配制一定浓度的溶液实验分析
■山东省北镇中学2015级17班 卢士杰(指导教师 刘树领)
配制一定浓度的溶液实验是典型的定量实验,也是学习与研究其他定量实验的基础,我们应予以重视。
一、配制一定浓度的溶液实验的基础知识
配制一定浓度的溶液实验的主要器材是量筒(或天平)、烧杯、玻璃棒、容量瓶、胶头滴管,主要过程有计算、称量(或量取)、溶解、冷却并转移、洗涤、定容、摇匀、保存并贴标签。其中量筒规格的选择是以所取液体体积为依据的,即液体体积等于或略少于量筒的容积,且量取后不能洗涤量筒,其目的就是为了减少量取误差;容量瓶上只有一条刻度线,因而其不能用来量取液体体积,只能用来配制溶液,同时也不能用来储存溶液,常见型号有100mL、250mL、500mL、1000mL,其型号就是容量瓶在室温20℃时的容积;计算是利用n=c·V(aq),V(aq)是容量瓶的容积,不一定是所要配制溶液的体积,溶质为固体时要换算成质量才能用天平称量,溶质为液体(或需要的是浓溶液)时要换算成体积才能用量筒量取;冷却是指冷却到室温,因为容量瓶的容积是室温下测得的,又因任何物质溶解时均伴随着放热或吸热的变化,故溶解后有的需要降温,有的需要升温,所以冷却是习惯、通俗的说法。
由于配制一定浓度的溶液实验是一个定量实验而不是一个定性实验,故溶液配制中必然有误差。误差的分析首先从基本原理或概念上分析,即其中n是指进入容量瓶中溶质的物质的量,所以分析n时应从计算是否准确,称量(或量取)、溶解、转移是否规范,洗涤是否遗漏等环节分析;V(aq)是指溶液的液面最低处与刻度线相平时的体积,因而应从定容时操作是否规范,溶液转移前是否遗漏冷却环节等角度分析。
二、常见问题例析
例题配制480mL0.5mol·L-1的NaOH溶液,试回答下列问题:
(1)选择仪器:完成本实验所必需的仪器有:托盘天平(精确到0.1g)、药匙、烧杯、玻璃棒、____、____等。
(2)计算:需要NaOH固体的质量为____。
(3)称量:①称量过程中NaOH固体应放于小烧杯中并放在天平的____(填“左盘”或“右盘”)。
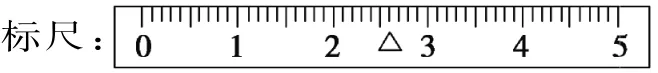
②某学生先用托盘天平称量一个小烧杯的质量,称量前把游码放在标尺的零刻度处,天平静止时发现指针在分度盘的偏右位置,说明此时左边质量____(填“大于”或“小于”)右边质量。假定最终称得小烧杯的质量为____(填“32.6g”或“32.61g”),请用“↓”表示在托盘上放上砝码,“↑”表示从托盘上取下砝码的称量过程,并在下图中标尺上画出游码的位置(画“△”表示)。_________________

_____砝码质量/g_______5_0____2_0____2_0___1__0____5___称量(取用砝码过程)
(4)溶解、冷却。该步实验中需要使用玻璃棒,作用是____。
(5)转移、洗涤。在转移时应使用____引流,洗涤烧杯2~3次是为了____。
(6)定容、摇匀。定容的操作是____。
解析:实验室不存在480mL的容量瓶,因而配制480mL0.5mol·L-1的NaOH溶液,实际上是配制500mL溶液,计算时要根据500mL溶液计算,由于托盘天平精确度为0.1g,故计算氢氧化钠固体质量时要精确到0.1g,即m(NaOH)=0.5mol·L-1×0.5L×40g·mol-1=10.0g。用托盘天平称量时,称量物放左盘,取砝码顺序是先大后小,然后移动游码。由于氢氧化钠具有强腐蚀性及吸水性,故称量时要放在玻璃器皿中称量。
答案:(1)胶头滴管 500mL容量瓶(2)10.0g (3)①左盘 ②小于 32.6g____

_____砝码质量/g_____________________________5 0 2 0 2 0 1 0 5_称量(取用砝码过程)↓↑_↓_↓↑_________↓↓↑
(4)搅拌,加速溶解 (5)玻璃棒 保证溶质全部转移至容量瓶中 (6)向容量瓶中加入蒸馏水至距刻度线1~2cm时,改用胶头滴管滴加蒸馏水至液体的凹液面最低处和刻度线在同一水平面上

