氧化还原反应考点分析
■浙江省杭州第二中学 曾应超
陌生氧化还原反应方程式的书写作为一种重要的创新题型,在近几年的高考中出现的频率越来越高。由于书写时需要对产物进行准确判断,因此,难度较大。
一、典例再现
例题一定条件下,金属钠可以与氧化铁发生反应,写出该反应的化学方程式:___。
答案:6Na+Fe2O3══3Na2O+2Fe
二、追根溯源
氧化还原反应的核心知识点即两条主线:其一,氧化剂得电子,化合价降低,发生还原反应,被还原,生成还原产物;其二,还原剂失电子,化合价升高,发生氧化反应,被氧化,生成氧化产物。具体可表示如下:
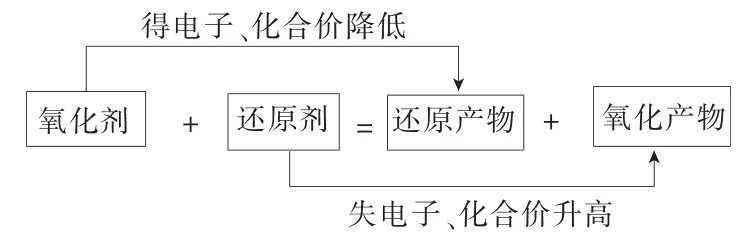
若要真正写好氧化还原反应方程式,对两对物质的书写显得尤为重要。若能对两对物质加以正确判断,问题便能迎刃而解。因此,在平时的学习中,对于常见氧化剂或还原剂对应的产物能够做到熟练掌握,是正确书写两对物质的必要基础。部分试剂及产物归纳如表1所示。

表1
三、解法探究
根据氧化还原反应的基本规律,在书写时,可采用“四步法”进行处理,具体方法如下。
1.写出两对物质。
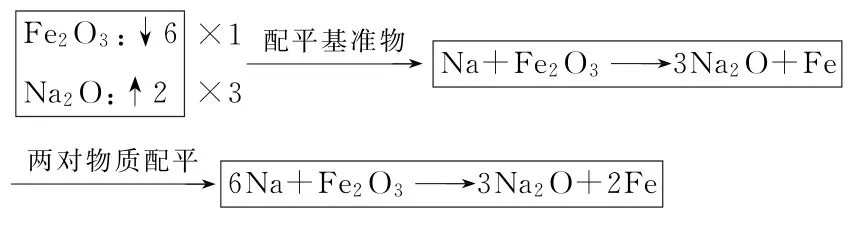
根据氧化还原反应的基本概念,准确推导出氧化产物和还原产物,从而写出氧化剂、氧化产物、还原剂以及还原产物。如果反应为电极方程式,则只需写出其中一对即可。推导时,充分利用氧化剂或还原剂的强弱以及元素金属性非金属性的强弱关系,重点把握两点:其一,哪种物质中的哪种元素化合价升高(或降低)。如“例题”中单质Na化合价只能升高,只能是还原剂,因此Fe2O3中必有元素化合价降低,不难发现只能是铁元素化合价降低。其二,升高(或降低)到何种程度。“例题”中钠元素的问题不大,而铁元素则可能降为+2或0价,由于单质Na具有很强的还原性,因此,将氧化剂还原的程度理应较大,故而铁元素降为0价更为合理,所以氧化产物为Na2O,还原产物为Fe。可写出四种物质
此外,还必须注意根据反应的氛围或环境,正确判断部分产物的合理性。如“例题”中可能出现将Na2O写成Na2O2的情况,那么Na2O写成Na2O2是否合理呢?如果能够熟悉氧化还原反应的“强制弱规律”,便不难判断。由于Fe2O3的氧化性弱于Na2O2,因而产物并不合理,同时,在强还原性的氛围中生成强氧化性的Na2O2也不合理。
【变式练习1】金属钠能在二氧化碳气体中燃烧,对于燃烧过程中生成的产物,有同学经过推理得出如下几种可能,你认为不合理的是( )。
A.氧化钠、单质碳
B.碳酸钠、单质碳
C.碳酸钠、一氧化碳
D.过氧化钠、单质碳
答案:D
解析:由于金属钠参加反应,只能发生化合价升高为+1价的过程,因此二氧化碳中必有元素化合物降低,只能由碳元素完成。由于金属钠还原性较强,因此可将其还原到单质碳,产物为氧化钠和单质碳。此外由于二氧化碳可与氧化钠反应生成碳酸钠,或与单质碳反应生成一氧化碳,故而A、B、C三项均合理。在D项中,过氧化钠的生成需氧元素化合价升高,同时过氧化钠为强氧化剂,如“例题”中分析所示在强还原剂氛围下,此过程的发生并不合理。
2.根据化合价升降守恒配平两对物质。
选择合适的配平基准物(首先配平的物质),根据化合价升高总值等于化合价降低总值加以配平。如果反应为电极方程式,则只需根据化合价变化总值配平电子即可。选择基准物时,必须选择核心元素化合价完全发生变化的物质,即完全起氧化作用、还原作用或者完全是氧化产物或还原产物的物质。如果反应物或产物均满足条件,则选择所含核心原子数最多的物质作为基准物,若两物质所含原子数相同则可同时选为基准物同时配平。然后,根据已配平基准物将其他核心元素化合价完全发生变化的物质加以配平。“例题”中配平时对基准物选择的分析过程如表2所示。

表2
根据表2分析结果,选择Fe2O3和Na2O为配平基准物,并进一步完成四种物质的配平结果如下所示。
【变式练习2】写出Cu2O与稀硝酸反应的氧化产物和还原产物,并选择合适的基准物配平两对物质。
答案:3Cu2O+14HNO3══6Cu(NO3)2+2NO+7H2O
解析:由于稀HNO3具有强氧化性,故而可将Cu2O氧化,根据Cu2O中元素化合价升高的可能性分析,只能+1价的Cu升高为+2价,稀硝酸的常规还原产物为NO。对配平基准物的选择分析过程如表3所示。
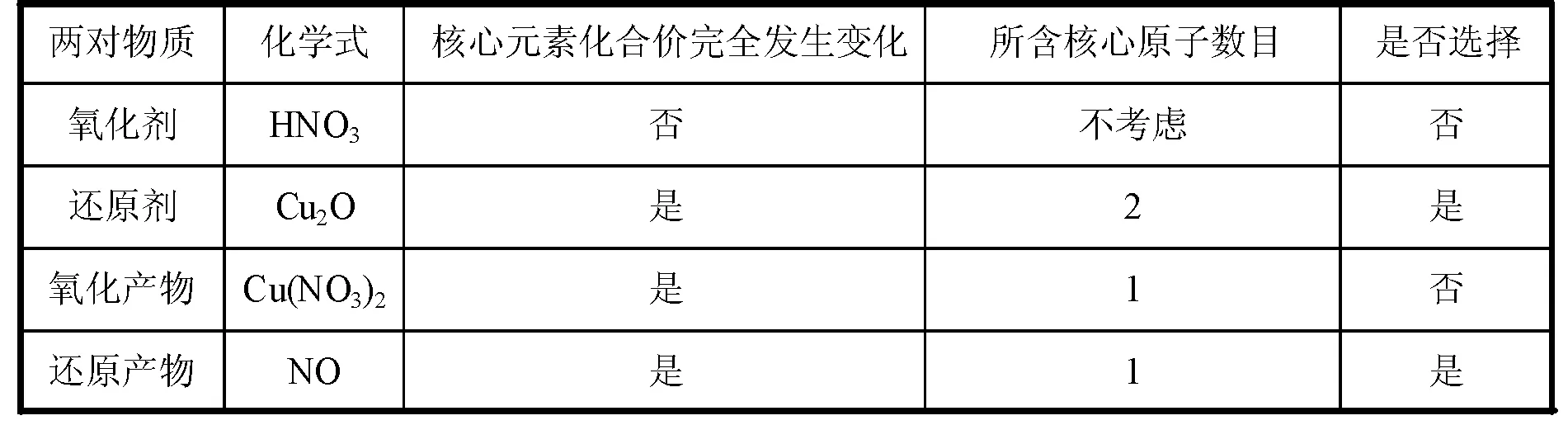
表3
根据表3分析过程可得,基准物为Cu2O和NO,两对物质配平过程如下所示,其中,由于HNO3核心元素化合价并未完全发生变化,不在配平物质要求之内。

3.根据元素守恒或电荷守恒添加H2O之外的物质。
如果反应式为化学方程式,可根据氢和氧之外的元素的守恒,添加必要物质。如果反应式为离子方程式,则需要配平电荷,一般根据溶液的酸碱性选择H+或OH-进行配平,若溶液显酸性则使用H+,否则使用OH-。判断溶液酸碱性可根据反应前的环境进行,也可根据产物进行。如果反应为电极方程式,还需关注电解质中导电的离子进行选择。“例题”中根据元素守恒无需添加其他物质,故而最后配平结果为6Na+Fe2O3══3Na2O+2Fe。“变式练习2”中根据元素守恒需补充HNO3,此步配平结果为
4.根据氢或氧元素守恒配平H2O。
由于反应中H2O是否作为反应物或生成物不一定被提及,因此,最后必须通过氢或氧元素的守恒,判断出反应式中是否需要配上H2O,“例题”中已无需要,“变式练习2”中根据氢或氧元素守恒配平H2O后,最终所得方程式为3Cu2O+14HNO3══6Cu(NO3)2+2NO+7H2O。
答案:
解析:由于中碳元素化合价由+3价升高到CO2中的+4价,因此中必有元素化合价降低,只能由锰元素完成,根据前述一般还原为Mn2+。对配平基准物的选择分析过程如表4所示。

表4
根据表4分析过程可得,基准物为MnO-4、Mn2+和,两对物质配平过程如下。

由于反应为离子方程式,需配平电荷,根据产物CO2可推断为酸性条件,否则产物应该为因此,配平离子为H+,此步配平结果为+10CO2↑,最后根据氢或氧元素守恒配平H2O,最终所得离子方程式为
四、跟踪练习
1.用NaHSO3可将废液中的还原成Cr3+,反应的离子方程式为____。
2.以石墨为电极,电解Pb(NO3)2与Cu(NO3)2的混合溶液可制取PbO2,阳极的电极反应式为____。
参考答案
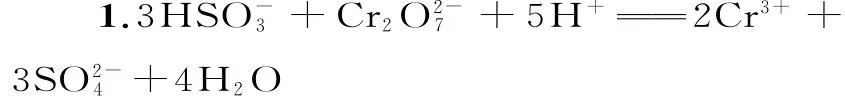
提示:由于还原成了Cr3+,NaHSO3中必有元素化合价升高,只能为具有强还原性的+4价硫升高到+6价。故两对物质为根据化合价升降守恒配平为;由于NaHSO3溶液显酸性,或者根据产物Cr3+不能在碱性溶液中生成,配平离子为H+,电荷守恒配平为最后根据氢或氧元素守恒配平H2O即可得出最终结果。
2.Pb2+-2e-+2H2O══PbO2+4H+。
提示:电极反应为氧化还原反应的半反应,需将上述方法中第一步的两对物质改为一对,且第二步化合价升降守恒配平基准物改为配平电子。本题中所需书写的阳极反应为氧化反应,化合价升高,只需找出化合价升高的一对物质即可。由于题中要求制备PbO2且原料Pb(NO3)2中铅元素为+2价,需升高到+4价才能实现PbO2的生成,故而可得Pb2+→PbO2;根据化合价升高总量配平电子得Pb2+-2e-→PbO2;由于溶液为酸性,配平离子为H+,根据电荷守恒配平得Pb2+-2e-→PbO2+4H+;最后根据氢或氧元素守恒配平H2O即可得出最终结果。

