在问题中感悟物质性质的转化规律
■浙江省杭州第四中学 王爱富
物质的性质只有在实际问题中能充分表现其变化的形式、变化的条件以及变化的类型等,学习物质的性质转化通过问题的解决才能更好地感悟物质性质的各种变化规律。下面以问题的解决为基础,从物质的转化形式、条件、量比关系、实验推理等角度阐述物质的转化规律。
一、从物质转化的条件与形式感悟物质性质的转化规律
物质往往在一定条件下才能转化,不同的物质,其转化的形式不同,可以从物质的分类角度看物质之间的转化关系。中学阶段的物质转化是基于“Na、Mg、Al、Fe、Cu五大金属及其重要化合物的性质转化”和“Cl、N、S、Si、C五大非金属及其重要化合物的性质转化”的核心知识体系。一般情况下,金属及其化合物之间的转化形式是:金属→金属氧化物→金属氧化物的水化物→盐。如金属钠及
非金属及其化合物之间的转化形式:

如氮及其化合物之间的转化关系:

在掌握物质之间转化的基本形式的同时,需要理解不同物质之间转化的条件。下面从一道高考题感受物质的转化形式及其转化条件。
例1(2017年江苏卷)在给定条件下,下列选项所示的物质间转化均能实现的是( )。
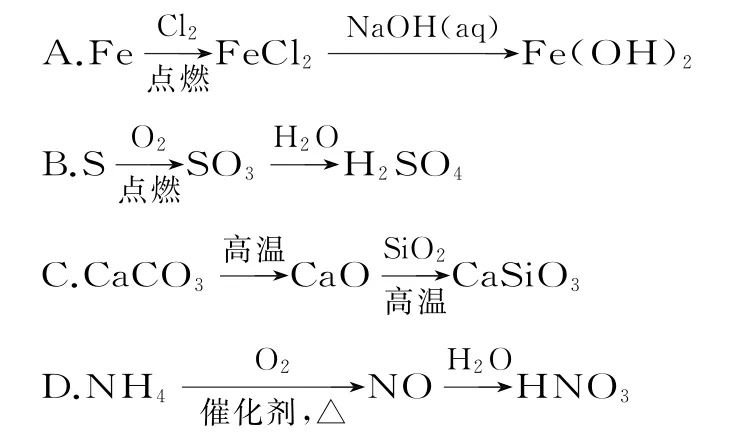
【考点定位】该试题考查铁及其化合物、硫及其化合物、氮及其化合物、碳和硅及其化合物各知识体系中物质的性质转化关系。
【考查意图】本题考查物质的性质及与转化关系,主要对硫、铁、氮、碳及其化合物性质转化的理解判断。
【名师点睛】本题难度不大,关键在于充分理解物质的转化形式与转化条件。
【错因分析】选项A错误的原因是因氯气具有强氧化性,则铁与氯气反应生成三氯化铁,而不是氯化亚铁;选项B的错误原因在于因硫与氧气反应生成二氧化硫,而不是三氧化硫;选项C,CaCO3高温分解生成碱性氧化物CaO,和酸性氧化物二氧化硅高温反应生成盐硅酸钙,故C正确;选项D中氨气催化氧化生成NO,NO和水不反应,不能生成硝酸,故D错误。
【同类题型】物质性质转化类型问题,首先要抓住中学阶段各大金属与非金属及其化合物之间转化关系的核心知识体系,然后理解实现转化过程所需要的条件,可以再看2015年福建理综试题中第9题:纯净物X、Y、Z转化关系如右所示,下列判断正确的是( )。
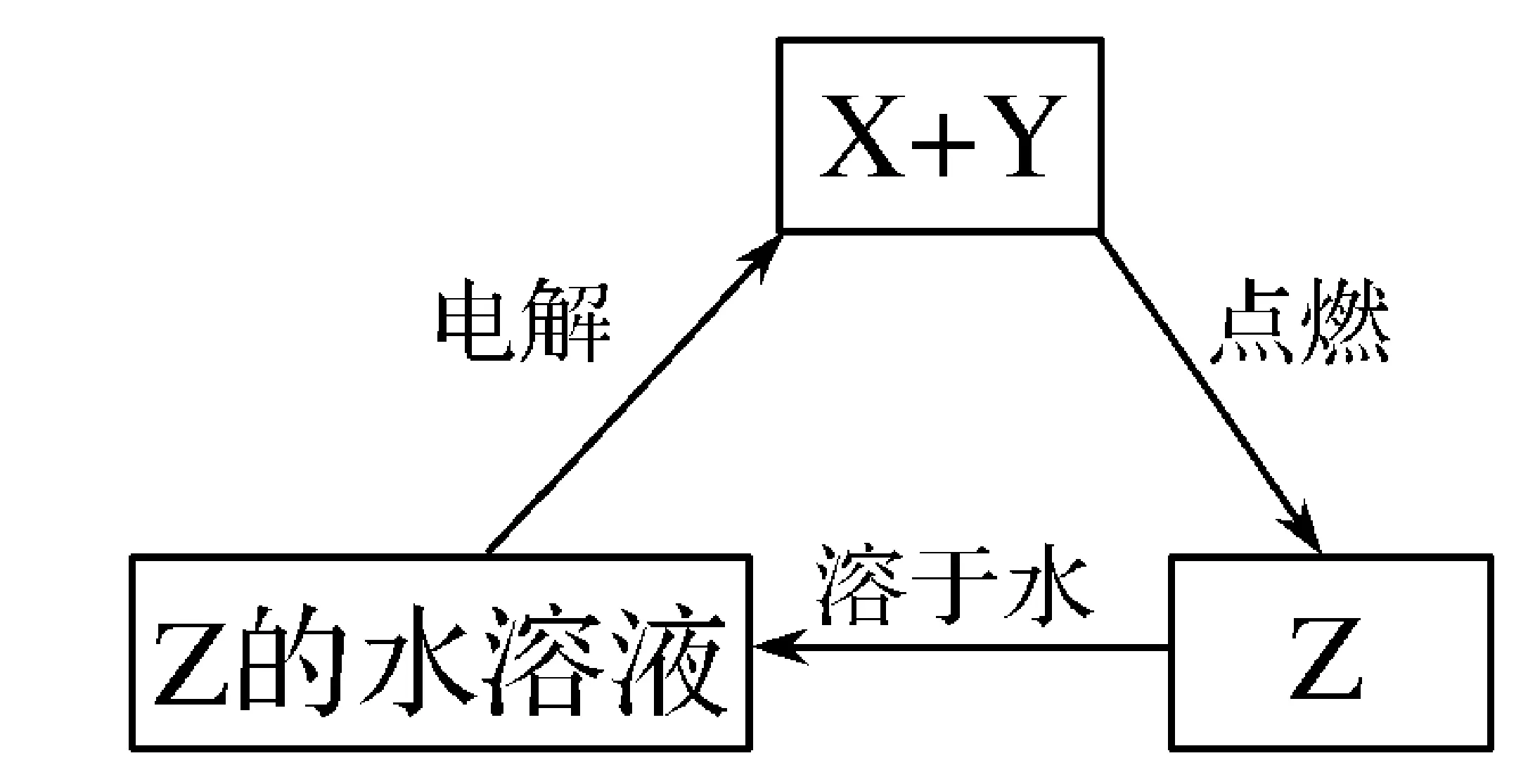
A.X可能是金属铜
B.Y不可能是氢气
C.Z可能是氯化钠
D.Z可能是三氧化硫
该试题是基于转化条件来实现物质性质转化的判断,从转化条件“点燃”分析,金属Na、Cu等以及非金属H2等均能在Cl2中燃烧,只有SO3是不可能通过燃烧得到的。从转化条件“电解”分析,电解氯化钠水溶液生成的是H2、Cl2、NaOH,不符合题中转化关系。不难分析该题的正确答案是A。
【复习建议】构建基于“Na、Mg、Al、Fe、Cu五大金属及其重要化合物的性质转化”和“Cl、N、S、Si、C五大非金属及其重要化合物的性质转化”的核心知识体系,并充分理解实现各转化关系所需要的转化条件。
二、从反应物的“量变”感悟物质性质的变化规律
物质的转化不但需要一定的条件,也要考虑物质反应的不同环境,因为不同的反应环境往往影响物质性质的不同反应结果,如溶液酸碱性环境、反应物的不同“量比”关系等。但从量的变化角度考虑物质性质的转化更能进一步揭示物质变化的本质与规律。从“量变”体现物质性质变化的规律,犹如我们在外出的路上,虽然对目的地充满了期待,但也能领略途中的优美风景。如何领略研究化学途中的“优美风景”,需要建立正确的认识方式。以“在一定量的NaOH溶液中慢慢通入CO2反应”为例,建立“量变”体现物质性质变化规律的一般模式:

例2已知还原性:向含有amolKI和amolK2SO3的混合液中通入bmolCl2充分反应(不考虑Cl2与I2之间的反应)。下列说法不正确的是( )。
A.当a≥b时,发生的离子反应为
B.当5a=4b时,发生的离子反应为
C.当a≤b≤1.5a时,反应中转移电子的物质的量n(e-)为amol≤n(e-)≤3amol
D.当a<b<1.5a时,溶液中与Cl-的物质的量之比为a∶(3a-2b)∶2b
【考点定位】基于“Cl2的氧化性,还原性的理论基础,用离子方程式表示反应物的不同“量比”关系时氧化还原反应的基本规律。
【考查意图】考查考生对氧化还原反应变化规律的理解与离子反应的书写。
【名师点睛】以Cl2的氧化性氧化不同还原性物质为背景,以量变为手段体现反应过程性,以离子反应方程式为表现形式来揭示氧化还原反应及其规律。本题属于中等偏上难度。
【错因分析】根据“量变”体现物质性质变化规律的一般模式分析:

【同类题型】在500mLFe2(SO4)3、CuSO4的混合液中,金属阳离子的浓度均为2.0mol·L-1。现加入amol铁粉,充分振荡反应后,下列说法不正确的是( )。
A.当a≤0.5时,发生的反应为2Fe3++Fe══3Fe2+
B.当a=1时,发生的反应为2Fe3++Cu2++2Fe══4Fe2++Cu
C.当0.5≤a<1.5时,溶液中Cu2+、的物质的量之比为(3-2a)∶(2+2a)∶5
D.当a≥1.5时,反应中电子转移数目大于3NA
该题从氧化性Fe3+>Cu2+出发,结合反应物的“量比”变化体现氧化还原反应的氧化性的相对强弱、得失电子守恒的基本规律,并用离子反应方程式表示其变化过程。混合溶液中n(Fe3+)=n(Cu2+)=1mol,当加入的铁粉a=0.5mol时,刚好与Fe3+完全反应;当a=1.5mol时,混合溶液中Fe3+和Cu2+均完全反应;当a≥1.5时,铁粉剩余,所以D选项反应中电子转移数目应为3NA。
【复习建议】学会从不同视角认识化学反应的多样性,运用定性、定量相结合的方式揭示化学变化的本质特征。归纳中学里有关“量变”体现物质性质变化的典型事例。如以钠的化合物转化为基础的二氧化碳与NaOH反应、碳酸钠与盐酸反应等;以Cl2的氧化性为基础的Cl2与FeBr2、FeI2、Na2SO3等反应;以铝的化合物两性转化为基础的Al3+与分别与强碱和强酸反应;以Fe、Cu及其化合物性质转化为基础的铁粉和铜粉与FeCl3溶液反应,铁粉和铜粉与CuCl2、FeCl3的混合溶液反应等。
三、从实验与推理中感悟物质性质的转化规律
不同物质的变化常伴随着一定的实验现象,如变化中常常伴随发光、放热、颜色变化、产生气体、生成沉淀等。一些物质的性质变化常常有其自身的变化特征,如将某气体通入含BaCl2的FeCl3溶液中,有白色沉淀生成,通入品红试液褪色,说明该气体为SO2;某溶液中滴入KSCN试剂,溶液变血红色,则可推得原溶液中有Fe3+。也可以从一些实验事实中推得物质性质的转化规律,如该转化正好体现离子反应的本质是向着离子浓度减小的方向进行。因此根据一定的实验现象与实验事实可以推理物质的转化规律。
推理过程不仅可以从实验现象的变化反映物质的性质转化,还可从随着反应物的量的变化反映出物质性质变化的规律。在推理过程中还需要分析反应的环境与条件,如溶液的酸碱性不同,一些金属阳离子沉淀的pH也不同等。
例3下列是某化学研究性学习小组对某无色水样成分的检验过程,已知该水样中只可能含有中的若干种离子。该小组同学取100mL水样进行实验:向样品中先滴加氯化钡溶液,再滴加1mol·L-1盐酸,实验过程中沉淀质量的变化如图1所示。回答下列问题:

图1
(1)水样中肯定不存在的离子是____,可能存在的离子是____。
(3)有同学认为溶液中肯定存在K+,且c(K+)≥0.6mol·L-1,该同学的观点____(填“正确”或“错误”)。
(4)写出bc段的离子方程式:___。
【考点定位】常见离子的检验方法、离子共存以及电荷守恒的应用等。
【考查意图】一定问题背景下离子组成的推断及离子反应与离子方程式的书写,考查学生灵活应用物质性质变化知识解释实验过程中物质的变化原因,从而考查考生分析问题、解决实际问题的能力。
【名师点睛】本题综合程度较高,但难度中等。能根据实验过程中的现象变化以及实验事实推理有关离子的性质变化,在平时学习中要求能将自己学过的化学反应理论知识与实际问题结合起来,加强理论联系实际问题,提高分析问题、解决问题的能力。
【错因分析】该水样为无色溶液,则Fe3+、Cu2+不存在,依据图像分析,加入氯化钡溶液生成沉淀,加入稀盐酸,沉淀部分溶解,证明水样中一定含有,因Ag+、Ca2+和发生反应生成沉淀不能大量共存,所以Ag+、Ca2+不存在。根据图像变化可知,m(BaSO4)=2.33g,m(BaCO3)=6.27g-2.33g=3.94g,所以
因Cl-不能确定,依据电解质溶液中电荷守恒,阳离子K+一定存在,且c(K+)≥0.1mol·L-1×2+0.2mol·L-1×2=0.6mol·L-1。
【同类题型】已知:Ag2SO4微溶于水,可溶于硝酸。溶液X中可能含有中的几种离子。为了确定其组成,某同学进行了如下实验:

下列说法正确的是( )。
A.溶液X中一定含有Na+、Cl-和
B.溶液X中一定不含Ca2+、Br-
D.在溶液X中依次滴入盐酸、双氧水和硫氰化钾溶液后,溶液将变成血红色
该试题难度不大,考查中学化学中常见离子的检验及离子共存问题。根据向溶液X中加入过量稀盐酸有气体放出,可以推断X中含有CO2-3,根据离子共存原则,没有Ca2+、Fe2+;根据电荷守恒,一定有Na+;根据沉淀,X中一定有根据向溶液1中加入过量AgNO3溶液产生的现象,X中一定没有Br-,因为没有产生淡黄色沉淀;根据实验过程分析,可能有
【复习建议】复习时多关注中学化学里重要物质的性质体现,如阳离子等,阴离子等,这些离子在实际问题中的相互转化及其检验方法。如从不同盐类与不同强弱的碱反应的变化规律归纳如下:
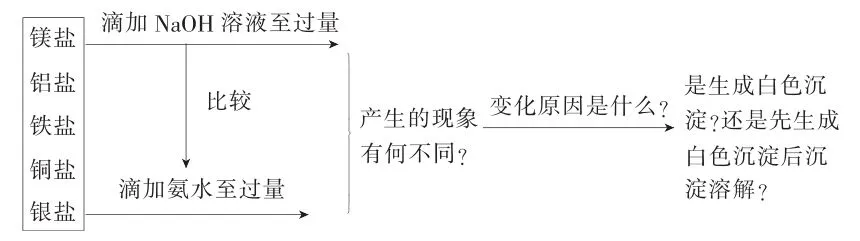
物质转化的多样性体现了物质性质的多样性,通过上述各种物质转化规律的讨论与分析,只有将这些规律应用于实际问题的解决中,才能更好地感悟物质的变化规律。
【问题解决】向1L含0.01molNaAlO2和0.02molNaOH的溶液中缓慢通入二氧化碳,随n(CO2)增大,先后发生三个不同的反应,当0.01mol<n(CO2)≤0.015mol时发生的反应是2NaAlO2+CO2+2H2O══2Al(OH)3↓+Na2CO3。下列对应关系正确的是( )。
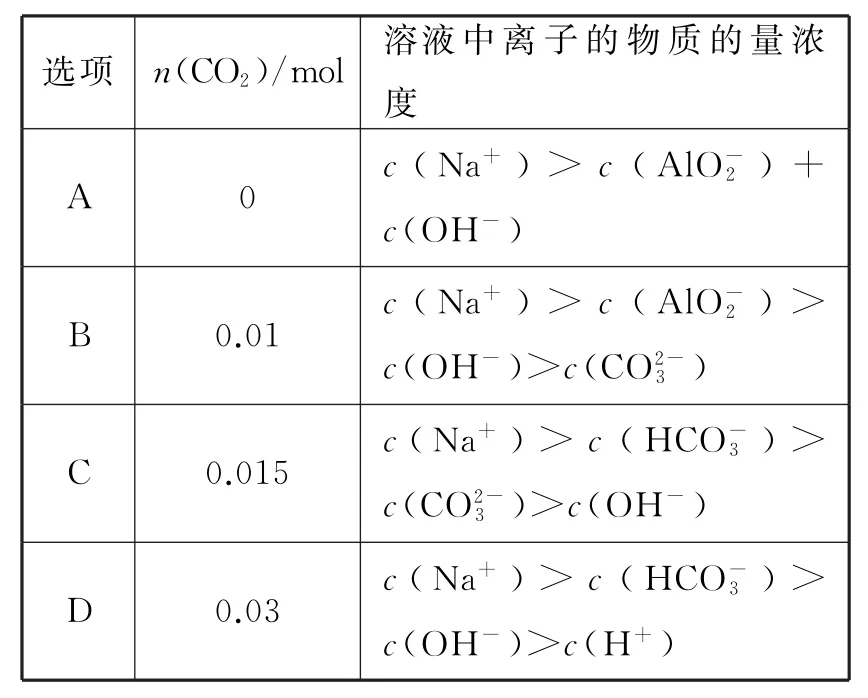
选项n(C O 2)/m o l溶液中离子的物质的量浓度_________________________A 0 c(N a+)>c(A l O-2)+___________________c(O H-)B 0.0 1 c(N a+)>c(A l O-2)>____________________c(O H-)>c(C O 2-3)C 0.0 1 5 c(N a+)>c(H C O-3)>___________________c(C O 2-3)>c(O H-)D 0.0 3 c(N a+)>c(H C O-3)>____________________c(O H-)>c(H+)
该题是根据反应物的一定“量变”体现混合体系中反应顺序的变化规律,根据“量变”体现物质性质变化的规律的一般模式进行分析,过程依然可用数轴显化方式表示:

然后根据不同阶段的反应结果,由反应所得的溶液成分分析溶液中各离子浓度的相对大小,显然选项D是正确的。如果向1L含0.01molNaAlO2和0.02molNaOH的溶液中逐滴滴入1.000mol·L-1的盐酸,随V(HCl)增大,先后又发生哪几个不同的反应呢?不同阶段所得溶液的成分又是什么呢?根据上述“量变”体现物质性质变化的规律的一般模式分析可知,反应经过了以下三个阶段:①V(HCl)≤20.00mL,NaOH+HCl══NaCl+H2O;②20.00mL<V(HCl)≤30.00mL,NaAlO2+HCl+H2O══NaCl+Al(OH)3↓;③30.00mL<V(HCl)≤60.00mL,Al(OH)3+3HCl══AlCl3+3H2O。

