元素化合物推断题解题方法与策略
■浙江省临安市天目高级中学 徐超成
纵观历年高考卷,元素化合物推断题是历年高考的热点,且难度大,易失分。在进行专题复习时,可以从离子反应型、框图型、化工流程型三种形式来进行复习。
一、离子反应型元素化合物推断题解题方法与策略
以离子反应为基础的推断题是高考的常考内容,考题的形式既有主观题也有客观题。这类试题侧重元素化合物知识的相互联系。
例1雾霾严重影响人们的生活与健康。某地区的雾霾中可能含有如下可溶性离子:某同学收集了该地区的雾霾,经必要的预处理后获得试样溶液,设计并完成了如下的实验:

根据以上的实验操作与现象,该同学得出的结论不正确的是( )。
B.试样中一定不含Al3+
C.试样中可能存在Na+、Cl-
D.该雾霾中可能存在NaNO3、NH4Cl和MgSO4
答案:B
解析:试样溶液中加入过量Ba(OH)2并加热,生成的气体1能使湿润的红色石蕊试纸变蓝色,说明气体1是NH3,则试样中含有向滤液中通入CO2,得到溶液2、沉淀2,溶液2中加入Al,生成气体2,该气体能使湿润的红色石蕊试纸变蓝色,说明含有气体2是NH3,根据已知条件知,溶液2中含有根据元素守恒知,原溶液中含有滤液1中通入CO2,得到沉淀2,向沉淀2中加入酸,沉淀溶解并放出气体,说明沉淀2是碳酸钡等难溶性碳酸盐;沉淀1加入酸后,沉淀部分溶解,硫酸钡不溶于酸,说明原来溶液中含有能和过量Ba(OH)2反应生成能溶于酸的沉淀,根据提供的离子可知,该沉淀为Mg(OH)2,所以溶液中含有Mg2+。通过以上分析知,试样中肯定存在和故A项正确;试样中不能确定是否含有Al3+,故B项错误;试样中可能存在Na+、Cl-,要检验是否含有钠离子或氯离子,可以采用焰色反应鉴定钠离子,用硝酸酸化的硝酸银检验氯离子,故C项正确;试样中肯定存在可能存在Na+、Cl-,所以该雾霾中可能存在NaNO3、NH4Cl和MgSO4,故D项正确。
【解题流程】

B.该混合溶液通过继续进行焰色反应可以间接确定是否含有I-
D.向该混合溶液中滴加酚酞试液后呈红色
答案:D
解析:①第一份加入足量盐酸,产生的气体在空气中变为红棕色,红棕色气体为NO2,则一定有被还原为NO,同时应有离子被氧化,所以一定含有Fe2+,Fe2+与易发生双水解,则一定不含在反应后的溶液中加入BaCl2溶液,有白色沉淀产生,沉淀为硫酸钡,则一定存在②第二份逐滴滴加NaOH溶液至过量,产生沉淀但不溶解,则一定不含Al3+,并有气体逸出,则气体为氨气,一定含加过量NaOH生成的沉淀为氢氧化亚铁,也可能有氢氧化铁,则可能含Fe3+,各离子的浓度均约为0.1mol·L-1,若含Fe3+不符合电荷守恒。综上所述,一定含Fe2+、可能含Na+、I-,一定不含根据以上分析,该混合溶液中一定不含有A项正确;因溶液中一定含遵循电荷守恒,若继续进行焰色反应确定Na+,可以间接确定含有I-,B项正确;该混合溶液中肯定含有,C项正确;当溶液中含时,为强酸弱碱盐,则溶液显酸性,该混合溶液中滴加酚酞试液后为无色,D项错误。
二、框图型元素化合物推断题解题方法与策略
以框图为基础的无机化学推断题主要考查钠、镁、铝、铁、铜、氯、硅、硫、氮等元素的单质及其化合物。从题型上看,主要以元素及其化合物的综合推断为主,联系基本概念、基本理论命题。从联系上看,可以从社会、科技、环境等角度联系元素化合物知识,还可以将实验、化学反应原理等结合起来进行综合考查。
例2下列框图中的字母分别代表一种常见的物质或其溶液,相互之间的转化关系如下所示(部分产物及反应条件已略去)。已知A、B为气态单质,F是地壳中含量最多的金属元素的单质,E、H、I均为氧化物,E为黑色固体,I为红棕色气体,M为红褐色沉淀。
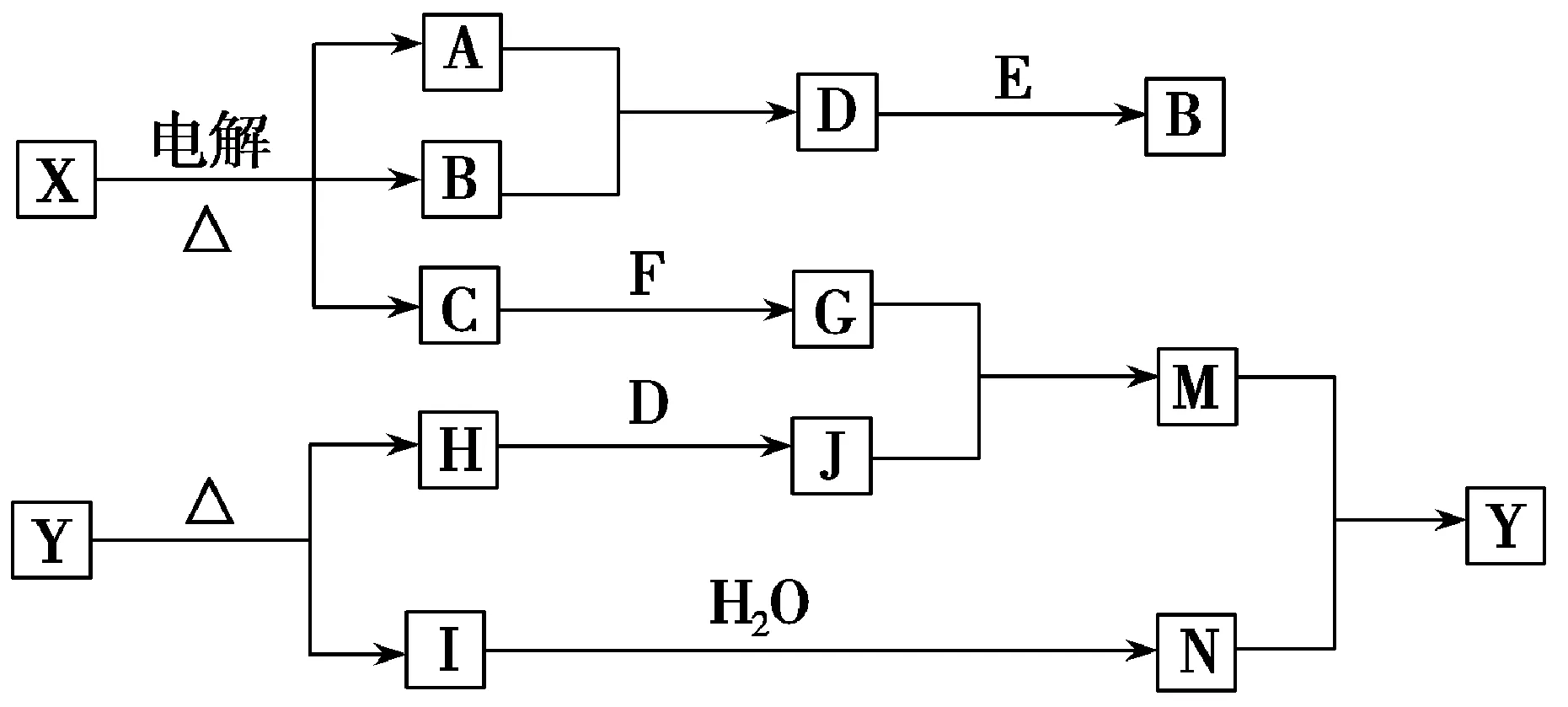
请回答下列问题:
(1)写出F在元素周期表中的位置:___。
(2)由J的饱和溶液可以制得胶体,其原理是____(用化学方程式表示)。
(3)电解X溶液的离子方程式为____。
(4)D+E→B的反应中,被氧化与被还原的物质的物质的量之比是____。
(5)G+J→M的离子方程式是____。
(6)Y受热分解的化学方程式是____。
(7)G中离子浓度由大到小的顺序为____,将G蒸干灼烧得到的物质为____(填化学式)。

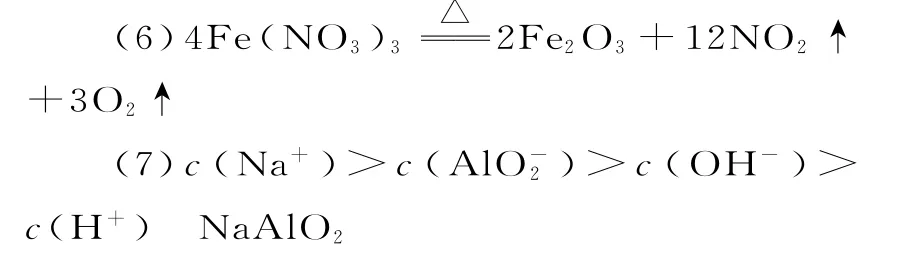
解析:F是地壳中含量最多的金属元素的单质,则F为Al;X电解生成A、B两种气态单质和能与Al反应的物质C,可知X为饱和NaCl溶液,C为NaOH溶液,A、B为H2、Cl2中的一种,则D为HCl,D与黑色固体E反应又生成B,可知E为MnO2,B为Cl2,故A为H2;G为NaAlO2溶液,M为红褐色沉淀Fe(OH)3,则J中含有Fe3+,应为FeCl3溶液,故氧化物H为Fe2O3;I为红棕色气体,且为氧化物,则I为NO2,从而可知N为HNO3溶液,故Y为Fe(NO3)3。(1)Al在元素周期表中位于第三周期ⅢA族。(2)实验室制备Fe(OH)3胶体的方法:将饱和FeCl3溶液逐滴加入沸水中,加热煮沸至液体呈红褐色时停止加热,反应的化学方程式为(3)电解饱和食盐水生成NaOH、H2和Cl2。氧化剂为MnO2,HCl既表现还原性又表现酸性,各占一半,氧化剂被还原,还原剂被氧化,故被氧化与被还原的物质的物质的量之比是2∶1。(5)Fe3+水解呈酸性,水解呈碱性,两者相互促进,完全水解生成Fe(OH)3和Al(OH)3沉淀受热分解生成Fe2O3、NO2,N的化合价降低,故必有一种元素的化合价升高,从化学式来看,只能是O,故产物中还有O2。根据化合价升降守恒和原子守恒可配平化学方程式。(7)NaAlO2溶液中发生水解故溶液中离子浓度大小关系为加热NaAlO2溶液时,水解平衡向右移动,c(OH-)逐渐增大,Al(OH)3将会溶解,重新生成NaAlO2,故蒸干灼烧该溶液得到的固体仍然是NaAlO2。
【解题流程】

【跟踪训练】根据下列转化关系,回答有关问题。

(1)浅绿色溶液D主要成分的化学式为____,试剂1是____。
(2)下列物质不能作为试剂2的是____(填序号)。
a.Cl2b.新制氯水 c.浓硫酸
d.硫 e.硝酸
(3)固体A溶于稀盐酸的化学方程式为____。
(4)溶液C到溶液F红色加深的原因是____。
(5)某同学在实验时向E中加入了一种过量的固体物质,发现淡黄色褪去,现对褪色原因进行探究。提出你的假设:____。为了对你所提出的假设进行验证,你设计的实验方案是____。
答案:(1)FeCl2KSCN溶液(或NH4SCN溶液) (2)d (3)Fe3O4+8HCl══2FeCl3+FeCl2+4H2O (4)溶液中的Fe2+被氧化剂氧化成Fe3+,使Fe3+浓度增大,从而生成更多的硫氰化铁,使红色加深(5)加入还原剂将Fe3+还原 用胶头滴管取少量淡黄色褪去后的溶液于试管中,滴加少量KSCN溶液,再加入几滴氯水。如果溶液开始不出现红色,加氯水后出现红色,则说明假设正确;若溶液不变红色,则假设不正确
解析:解答本题的关键是熟悉铁的不同价态离子的溶液的颜色及其转化条件。从框图可知,铁和稀盐酸反应生成FeCl2溶液,为浅绿色,即D的主要成分为FeCl2,加入试剂2后变为棕黄色溶液,联想最终变为深红色溶液F(硫氰化铁溶液),可以推断溶液E的主要成分为Fe3+,试剂2为强氧化剂,S不符合条件。铁和水蒸气反应生成固体Fe3O4,Fe3O4与盐酸反应的方程式为Fe3O4+8HCl══2FeCl3+FeCl2+4H2O,所以溶液B为FeCl3和FeCl2的混合溶液,加入试剂1(KSCN溶液)后,Fe3+变为硫氰化铁,加入试剂2(强氧化剂),Fe2+被氧化为Fe3+,并进一步转化为硫氰化铁,所以溶液颜色加深。
【解题策略】在无机推断中,主要是能找到题中的“题眼”,也就是一些特殊反应或特殊现象,或某些物质的特殊颜色等。只有抓住这些特征,我们才能够将各物质间的变化进行串联,进而推断出各物质的化学式以及它们之间发生的反应。
三、化工流程型元素化合物推断题解题方法与策略
无机化工流程题文字较少、涉及知识点较多,能较好地考查信息处理、推理等能力,是近年来高考命题的热点题型。化学工艺流程题以工业生产实际为载体,以元素化合物知识为基础,综合考查化学实验基本操作,物质的性质、制备和转化,环境保护等知识,它将实验、元素化合物和化学理论有机地结合在一起,综合性强,是化学卷考查的重头戏。
例3重铬酸钾是一种重要的化工原料,一般由铬铁矿制备,铬铁矿的主要成分为FeO·Cr2O3,还含有硅、铝等杂质。制备流程如下所示。
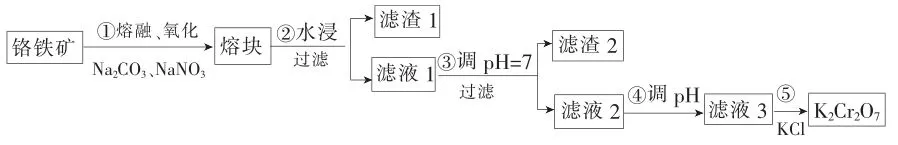
上述反应配平后FeO·Cr2O3与NaNO3的系数比为____。该步骤不能使用陶瓷容器,原因是____。
回答下列问题:
(2)滤渣1中含量最多的金属元素是____,滤渣2的主要成分是____及含硅杂质。
(3)步骤④调滤液2的pH使之变____(填“大”或“小”),原因是____(用离子方程式表示)。
答案:(1)2∶7 高温下Na2CO3能与SiO2反应生成硅酸钠和CO2
(2)铁 Al(OH)3
(3)小 增大溶液中H+,促进平衡正向移动
解析:(1)步骤①反应中,FeO·Cr2O3中Fe与Cr元素化合价升高,1molFeO·Cr2O3转移7mol电子,Na2CO3中N元素化合价降低,1molNaNO3转移2mol电子,依据反应中元素化合价升降相等,可得出FeO·Cr2O3与Na2CO3的系数比为2∶7;陶瓷容器的成分中含SiO2,高温下与Na2CO3能反应生成硅酸钠和CO2,所以不能用陶瓷容器。(2)由于氧化铁不溶于水,过滤后进入滤渣1,所以滤渣1中含量最多的金属元素是铁元素;滤液1中含最后转化为产品,所以滤渣2中含氢氧化铝和含硅杂质。(3)步骤④调滤液2的pH的目的是使转化为即发生反应为使平衡正向移动需使pH变小。
【解题流程】

【跟踪训练】水泥是重要的建筑材料。水泥熟料的主要成分为CaO、SiO2,并含有一定量的铁、铝和镁等金属的氧化物。实验室测定水泥样品中钙含量的过程如下所示。

回答下列问题:
(1)在分解水泥样品过程中,以盐酸为溶剂,氯化铵为助溶剂,还需加入几滴硝酸。加入硝酸的目的是____,还可使用____代替硝酸。
(2)沉淀A的主要成分是____,其不溶于强酸但可与一种弱酸反应,该反应的化学方程式为____。
(3)加氨水过程中加热的目的是____。沉淀B的主要成分为____、___(写化学式)。
答案:(1)将样品中可能存在的Fe2+氧化为Fe3+H2O2
(2)SiO2(或H2SiO3) SiO2+4HF══SiF4↑+2H2O(或H2SiO3+4HF══SiF4↑+3H2O)
(3)防止胶体生成,易沉淀分离Al(OH)3Fe(OH)3
解析:(1)水泥熟料中CaO以及铁、铝、镁的氧化物均与盐酸反应,硝酸能将水泥样品种含有的Fe2+氧化为Fe3+,便于水解除去;为了不引入新杂质,还可用H2O2代替硝酸。(2)由(1)中的分析可知,不溶于盐酸和硝酸的沉淀A为SiO2(或H2SiO3);SiO2(或H2SiO3)能溶于唯一的酸——氢氟酸,生成SiF4。(3)加入氨水调节溶解的pH为4~5,并加热,能防止胶体生成,使沉淀更加完全,易于分离;pH为4~5时,发生水解的离子主要是Fe3+、Al3+,故此步骤除去的是Al3+和Fe3+,所得沉淀B的主要成分是Al(OH)3和Fe(OH)3。
【解题策略】化学工艺流程题是高考的热点内容,每年都会涉及,体现了化学知识与生产实际的紧密联系;工艺流程题一般由多步连续的操作组成,每一步操作都有其具体的目标、任务;解答时要看框内,看框外,里外结合;边分析,边思考,易处着手;先局部,后全盘,逐步深入;而且还要看清问题,不能答非所问。要求用理论回答的试题应采用“四段论法”:本题改变了什么条件(或是什么条件)→根据什么理论→所以有什么变化→结论;化学工艺流程一般涉及氧化还原反应方程式的书写、化学反应原理知识的运用、化学计算、实验基本操作等知识,只要理解清楚每步的目的,加上扎实的基础知识,就能够很好地完成此类题目。

