用化学反应原理解决复杂的化学反应问题
■浙江省杭州学军中学 徐月明
高中阶段我们对化学反应的学习主要围绕着氧化还原反应、离子反应等展开,我们所遇到的反应虽然很多,但反应发生的原理基本离不开上述两方面,所以对氧化还原反应、酸碱反应等离子反应的深层次理解可以帮助我们解决许多看似复杂的问题。
一、氧化还原反应和复分解反应同时发生,结合反应中各物质的用量书写反应
例1将amolNa2O2粉末加入到含有bmolFeSO4的溶液中,下列说法不正确的是( )。
C.当a=b时,铁元素恰好转化成Fe(OH)3沉淀
D.当铁元素恰好转化成Fe(OH)3沉淀时,过氧化钠既体现氧化性又体现还原性,且被氧化和被还原的过氧化钠的物质的量之比是1∶1
分析:同学们在审题的时候很容易发现这是一个氧化还原反应的问题,部分同学在解答这个问题时预计会出现下面的想法,认为Na2O2先和水反应生成NaOH和O2,FeSO4再和NaOH反应生成Fe(OH)2,然后O2氧化Fe(OH)2生成Fe(OH)3,最后根据如上反应顺序结合Na2O2和FeSO4的物质的量整合出总反应。这样虽然可以解出此题,但整体解题过程比较复杂,也不利于理解每一种反应物在反应中真正所起的作用,所以我们可以试着从参加反应的各种物质在反应中所起作用的角度来思考这个问题。
Na2O2既具有强氧化性又可以在水溶液中发生歧化反应,所以当水溶液中有较强还原剂存在时可以认为Na2O2首先体现氧化性,过量的Na2O2再在水溶液中发生歧化反应,这样就可以结合氧化还原反应中电子转移守恒进行直接运算了,就解决了这个问题中氧化还原方面的问题。不过这里还有沉淀反应的问题,可以认为Na2O2中被还原成负二价的氧离子直接和水反应生成OH-,进而和Fe3+产生沉淀,根据两者的量来确定反应最终的产物。
同样,本题也可以把氧化剂Na2O2换成其他具有相同特征的物质,比如我们把Na2O2换成NaClO。两者的共同点是NaClO氧化了Fe2+后生成的OH-也会和Fe3+产生沉淀,同样需要判断恰好氧化时沉淀是否完全,如果沉淀不完全,过量的NaClO就会和Fe3+发生双水解反应。请看下面两个可能会出现的离子方程式。
1.将NaClO溶液加入FeSO4溶液至恰好将二价铁转化为三价铁:3ClO-+6Fe2++3H2O══3Cl-+2Fe(OH)3+4Fe3+。
2.将NaClO溶液加入FeSO4溶液至恰好将铁元素全部转化为Fe(OH)3沉淀:5ClO-+2Fe2++5H2O══Cl-+2Fe(OH)3+4HClO。
同学们可以试着完成下面两个练习:
练习1:分别写出用过量亚硫酸钠溶液吸收氯气的离子反应方程式和用次氯酸钠溶液吸收废气中氮氧化物(以NO2为例)的离子方程式。
练习2:写出向硝酸钡中通入过量SO2的离子方程式。
提示:根据反应物的化学性质,同学们能比较容易发现这几个反应都是典型的氧化还原反应,但是容易忽视氧化还原发生之后溶液的酸碱性环境变化或其他原因引起的复分解反应。练习1中的两个反应都涉及氧化还原反应后溶液酸性增强再和过量的弱酸盐反应的问题;练习2中涉及生成硫酸根离子和钡离子沉淀的问题,且要注意硫酸根离子和钡离子的量的问题。由于反应中控制SO2过量,反应以硝酸钡来配平书写,硫酸根离子过量。
答案:

延伸:同学们也可以自行练习当在硝酸钡溶液中通入少量SO2气体时的离子反应方程式。
二、氧化还原反应中氧化性、还原性强弱及反应物用量不同引起不同反应和原子守恒、电子转移守恒综合计算
例2将黄铁矿与焦炭充分混合(FeS2与C反应的质量比为5∶2),在空气不足时缓慢燃烧,可以得到两种氧化物(已知还原性Fe>C>S),请写出反应的化学方程式:___。
分析:本题显然还是氧化还原问题,涉及多种还原剂,同时也明确了反应物的用量,审题时要抓住两个要点,一个是空气不足和只得到了两种氧化物,另一个是反应物中各元素的还原性强弱。根据参加反应的FeS2与C的质量比求得其物质的量之比为1∶4,结合还原性容易判断出反应后S元素以单质存在,由于氧气量不足生成的氧化物宜写低价氧化物。反应的方程式可以写成以下形式:
2FeS2+8C+5O2══2FeO+8CO+4S或者3FeS2+12C+8O2══Fe3O4+12CO+6S。
同学们在书写化学反应方程式的过程中经常会碰到像上面这样的情况,请大家看下面这个例子:已知下列物质在酸性条件下的氧化性顺序为KBrO3>KIO3>Br2>I2,请写出向用硫酸酸化的KBrO3溶液中逐滴滴加KI溶液的分步反应的离子方程式。
这个问题显然也是溶液中各粒子氧化还原性差异引起的先后反应和产物形态控制问题,同学们在书写之前应先弄清楚第一阶段哪些粒子参加反应并根据各个粒子的性质和用量多少判断最初的产物形态。本题中开始时显然KBrO3过量,且其氧化性强于KIO3,所以最初的产物中I-应被氧化成而由于过量,其还原产物只能为Br2,第一步反应的方程式为随着KI溶液的不断滴入,此反应在溶液中KBrO3消耗完后结束。由于离子的氧化性强于Br2,第二步反应I-首先还原第三步反应再还原Br2单质,后两步反应的离子方程式依次为根据同样的思考方法,同学们还可以自行完成向用硫酸酸化的KI溶液中逐滴滴加KBrO3溶液的分步反应的离子方程式书写,再请同学们完成下面的练习。
练习3:硝酸与金属反应时往往产生氮氧化物,但是在某些特殊情况则不然。将稀硝酸(HNO3浓度低于2mol·L-1)与过量金属镁混合反应放出气体,反应完全后向剩余溶液中加入过量NaOH固体并加热,再次放出气体,将两次放出气体全部收集并混合,用碱石灰干燥后通过灼热氧化铜固体,观察到固体变红,将剩余气体用浓硫酸干燥,气体体积为原来的三分之一。已知反应产生的气体有两种成分,记为A、B。试问:
①两种气体的化学式:___。
②两种气体的比例A∶B=____。
③两种气体与氧化铜反应的方程式:___。
④镁与稀硝酸反应的离子方程式:___。
提示:本题也是氧化还原的概念和计算结合的问题,当硝酸用活泼金属还原时依据硝酸浓度不同被还原成不同价态,最后溶液加碱产生气体,证明还原产物中有铵根离子。混合气体都可以还原氧化铜,判断气体为氨气和氢气的混合物,根据和氧化铜反应后剩余N2为原混合气体的可知两种气体的体积比为2∶1。

练习4:复盐M[K3Fe(C2O4)3·3H2O]可用于摄影和蓝色印刷。某小组同学将纯净的化合物M在一定条件下加热分解,对所得气体产物和固体产物进行实验和探究。该小组同学查阅资料后推知,固体产物中,铁元素不可能以三价形式存在,而盐也只有K2CO3。为了进一步确定复盐M的分解反应方程式,小组同学对固体产物进行定量测量。

由以上实验数据的分析可知,加热后所得固体产物中除K2CO3外还含有什么物质?它们之间的物质的量之比为多少?请把你的结论填入表1中(可以不填满或补充空格)。

表1
通过以上结论,复盐M加热分解的反应方程式为____,当有0.2mol复盐M分解时,反应中转移的电子数为____mol。
提示:本题同样是氧化还原概念和利用原子守恒及电子转移守恒计算的综合问题,根据实验数据可知固体中含有0.01mol的单质Fe和0.01mol的FeO,计算时要注意原固体分两等分进行实验的细节。根据氧化还原规则,铁的化合价下降必然会有部分碳元素的化合价上升,根据电子转移守恒,假设有2mol的K3Fe(C2O4)3·3H2O分解,铁化合价下降转移了4mol电子,6molC2O24-分解产生4molCO和8mol+4价碳。
答案:
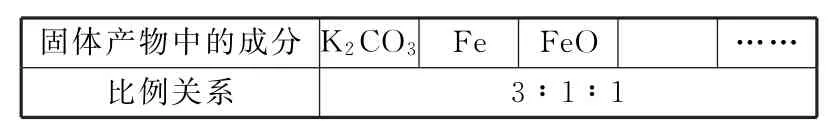
表2
2K3Fe(C2O4)3·3H2O══3K2CO3+Fe+FeO+4CO+5CO2+6H2O 0.8
三、非氧化还原离子反应中的反应方向
例3已知下列化学反应:前者均比后者更易发生。下列对反应事实现象的预测中,正确的是( )。
A.向氯化银沉淀中加入氨水,沉淀溶解
B.向银氨溶液中加入氯化钠生成白色沉淀
C.向银氨溶液中加入盐酸可生成AgCl沉淀
D.银氨溶液可以在酸性条件下稳定存在
分析:本题的关键是对溶液中非氧化还原反应进行条件的理解,根据离子反应的条件,离子反应总是容易向着某种离子浓度降低的方向进行,而经过高中阶段的学习,同学们已经掌握降低某种离子浓度的方法:生成沉淀、弱电解质、难电离配合离子或配合物分子等。本题中由于②Ag++2NH3══[Ag(NH3)2]+比反应③Ag++Cl-══AgCl更易进行,即NH3比Cl-更易结合Ag+,故选项A正确;同理,由于反应比反应②Ag++2NH3══[Ag(NH3)2]+更易进行,即NH3更易结合H+,故选项C正确。
练习5:书写向饱和碳酸钠溶液中逐滴滴加新制氯水的离子反应方程式:___。
提示:刚开始时碳酸钠大大过量且HClO的酸性强于反应为Cl2+H2O+反应完后,新制氯水中的HCl先和ClO-反应,然后再和反应,离子反应方程式依次为整个过程的总反应相当于氯水过量之后的反应:
练习6:工业上常用氟磷灰石[Ca5(PO4)3F]为原料,按图1所示制取磷酸、重过磷酸钙和氢氟酸。图1中反应1为氟磷灰石与另一种原料反应,生成A、B、C三种产物,其中产物C又与氟磷灰石发生反应2生成B和重过磷酸钙。写出反应1和反应2的方程式。

图1
提示:本题是很好的体现酸和盐反应的试题,从混盐氟磷灰石出发得到相应的弱酸和酸式盐,很容易发现反应1加入的反应物是一种强酸,结合磷肥的知识应该是加入硫酸。接下去关键是对产物C的分析,C物质能够继续和氟磷灰石反应得到B和D,按题意B和D一个为HF气体另一个为Ca(H2PO4)2,故物质C只有为H3PO4才合理。
反应1:Ca5(PO4)3F+5H2SO4══5CaSO4+3H3PO4+HF↑。
反应2:Ca5(PO4)3F+7H3PO4══5Ca(H2PO4)2+HF↑。

