鞘氨醇激酶1对人骨肉瘤U2OS细胞增殖、凋亡的影响及机制
张万贺,宝琪,杜春阳,郭义超
(1保定市莲池区妇幼保健院,河北保定071000;2保定市骨科医院;3河北医科大学)
·基础研究·
鞘氨醇激酶1对人骨肉瘤U2OS细胞增殖、凋亡的影响及机制
张万贺1,宝琪2,杜春阳3,郭义超2
(1保定市莲池区妇幼保健院,河北保定071000;2保定市骨科医院;3河北医科大学)
目的探讨鞘氨醇激酶1(SphK1)对人骨肉瘤U2OS细胞增殖和凋亡的影响及机制。方法将体外培养的人骨肉瘤U2OS细胞随机分为四组,转染组、Vector组分别转染SphK1 siRNA及对照siRNA,PF-543组在培养液中加入1 μmol/L SphK1特异性抑制剂PF-543,对照组常规培养。干预48 h时,采用Western blotting法检测SphK1蛋白表达,明确siRNA转染可在蛋白水平抑制骨肉瘤U2OS细胞SphK1高表达,且效果与其抑制剂PF-543相当。采用MTT法检测各组细胞存活率,采用TUNEL法和流式细胞术检测细胞凋亡率,采用Western blotting法检测增殖细胞核抗原(PCNA)、细胞周期蛋白D1(Cyclin D1)、Bax、Bcl-2、Caspase-3及活化的Caspase-3(cleaved Caspase-3)蛋白表达。结果与对照组、Vector组比较,转染组、PF-543组细胞存活率均下降,细胞凋亡率均增加,PCNA、Cyclin D1、Bcl-2蛋白表达均减低,Bax、Caspase-3及cleaved Caspase-3蛋白表达均增加,组间比较P均<0.05。结论SphK1基因可促进骨肉瘤细胞增殖、抑制细胞凋亡,调节凋亡及增殖相关因子表达可能是其作用机制。
骨肉瘤;鞘氨醇激酶1;细胞增殖;细胞凋亡;鞘氨醇激酶1特异性抑制剂
骨肉瘤是儿童及青少年常见的高度恶性骨组织原发肿瘤,年发病率为2/100万~5/100万,好发于血运丰富的长骨干骺端,具有早期肺转移、复发率高等特点,患者预后较差[1~3]。鞘氨醇激酶1(SphK1)可将具有促细胞凋亡功能的鞘氨醇(Sph)磷酸化为具有促细胞存活功能的鞘氨醇1-磷酸(S1P),进而调控细胞的生长发育[4]。Zhou等[5]研究发现,microRNA-124(miRNA-124)可通过下调人骨肉瘤细胞SphK1表达抑制细胞增殖及侵袭;苯妥帝尔和阿霉素联合应用能够抑制骨肉瘤组织SphK1高表达,同时抑制骨肉瘤U2OS细胞生长发育[6]。上述研究结果提示,SphK1可能参与骨肉瘤的发病及其病理生理过程,但其作用机制尚不明确。2016年3月~2017年3月我们进行本研究,探讨SphK1对人骨肉瘤U2OS细胞增殖、凋亡的影响及其机制。
1 材料与方法
1.1 材料 人骨肉瘤U2OS细胞购自南京凯基生物科技发展有限公司。SphK1 siRNA购自美国Santa Cruz公司。SphK1特异性抑制剂PF-543购自美国Selleck Chemicals公司。兔抗SphK1、Bcl-2、Caspase-3、活化的Caspase-3(cleaved Caspase-3)、增殖细胞核抗原(PCNA)、细胞周期蛋白D1(Cyclin D1)多克隆抗体及小鼠抗Bcl-2相关X蛋白(Bax)单克隆抗体均购自美国Promega公司。MTT购自Sigma公司。脂质体2000购自美国Invitrogen公司。辣根过氧化物酶标记羊抗兔IgG购自北京中杉金桥生物技术有限公司。聚偏二氟乙烯膜(PVDF)购自美国Milipore公司。TUNEL试剂盒购自美国Promega公司。
1.2 细胞培养 将U2OS细胞在DMEM完全培养基中37 ℃常规培养,当细胞融合75%~85%时,用无血清培养基培养24 h,进行以下研究。
1.3 细胞分组处理 将细胞随机分为四组,其中转染组、Vector组分别采用脂质体2000转染SphK1 siRNA及对照siRNA,PF-543组在培养液中加入1 μmol/L SphK1特异性抑制剂PF-543,对照组常规培养。
1.4 相关指标观察
1.4.1 细胞SphK1蛋白表达 采用Western blotting法检测。将四组转染48 h的细胞用冰冷PBS洗2遍,加入细胞裂解液200 μL,冰上放置1 h,4 ℃、12 000 r/min离心25 min,取上清液置于一干净的EP管中,Lowry法测定总蛋白浓度。取细胞裂解蛋白50 μg,行SDS-PAGE电泳,将产物电转移至PVDF膜;5%脱脂奶粉封闭PVDF膜2 h,加入SphK1抗体,4 ℃冰箱过夜;TBST液洗膜3次,加入辣根过氧化物酶标记的羊抗小鼠或兔抗体,37 ℃孵育1.5 h;TBST液洗膜后加ECL试剂,ODYSSEY远红外双色荧光成像系统显影(LLCOR Gene Company,USA)。LabWorks4.5软件(UVP Company,USA)对蛋白条带进行定量分析。
1.4.2 细胞增殖情况 采用MTT法检测。将细胞(5×103个/mL)接种于96孔板,每孔定容为200 μL,分别加入200 μL(5 g/L)MTT,37 ℃培养箱中继续培养4 h;弃培养液,每孔分别加入150 μL DMSO,待结晶完全溶解;采用酶标仪检测各孔在490 nm波长处的吸光度(A)值,计算细胞存活率。细胞存活率=(处理组A值/对照组A值)×100%。
1.4.3 细胞凋亡率 ①采用TUNEL法检测。将细胞(6×103个/mL)接种于8孔Leb-Tak腔室波片(美国Nalge Nunc公司)采用TUNEL法检测阳性细胞。步骤严格按试剂盒说明书操作。阳性细胞核呈棕黄色。每孔至少计数500个细胞,计算细胞凋亡率。细胞凋亡率=(凋亡细胞数/总细胞数)×100%。②采用流式细胞术检测。收集细胞培养液中的悬浮细胞及贴壁细胞,预冷PBS冲洗两次,采用体积分数为70%的冰冷乙醇固定24 h,置于4 ℃冰箱;取出后PBS冲洗两次,碘化丙啶4 ℃避光染色30 min,采用流式细胞仪检测凋亡细胞数,计算细胞凋亡率。
1.4.4 PCNA、Cyclin D1、Bax、Bcl-2、Caspase-3及cleaved Caspase-3蛋白表达 采用Western blotting法检测。具体步骤参照1.4.1。
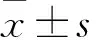
2 结果
2.1 各组SphK1蛋白表达比较 转染组、Vector组、PF-543组、对照组SphK1蛋白相对表达量分别为0.16±0.03、0.91±0.02、0.32±0.01、0.98±0.02。转染组、PF-543组SphK1蛋白相对表达量较对照组及Vector组明显降低(P均<0.05),其余组间比较差异均无统计学意义(P均>0.05)。
2.2 各组细胞存活率比较 转染组、Vector组、PF-543组、对照组细胞存活率分别为(45.17±0.21)%、(92.00±0.02)%、(53.05±0.26)%、(98.04±0.01)%。与对照组、Vector组比较,转染组、PF-543组细胞存活率均下降(P均<0.01);其余组间比较差异均无统计学意义(P均>0.05)。
2.3 各组细胞凋亡率比较 流式细胞结果显示,转染组、Vector组、PF-543组、对照组细胞凋亡率分别为(54.81±0.15)%、(8.20±0.03)%、(47.31±0.16)%、(2.57±0.02)%。与对照组及Vector组比较,转染组、PF-543组细胞凋亡率均升高(P均<0.01);其余组间比较差异均无统计学意义(P均>0.05)。
TUNEL结果显示,转染组、Vector组、PF-543组、对照组细胞凋亡率分别为(47.32±0.16)%、(4.35±0.05)%、(41.13±0.41)%、(4.82±0.06)%。与对照组和Vector组比较,转染组、PF-543组细胞凋亡率均升高(P均<0.01);其余组间比较差异均无统计学意义(P均>0.05)。
2.4 各组PCNA、Cyclin D1、Bax、Bcl-2、Caspase-3及cleaved Caspase-3蛋白表达比较 与对照组和Vector组比较,转染组、PF-543组PCNA、Cyclin D1、Bcl-2蛋白相对表达量均降低,Bax、Caspase-3及cleaved Caspase-3蛋白相对表达量均升高,组间比较P均<0.05。见表1。

表1 各组细胞PCNA、Cyclin D1、Bax、Bcl-2、Caspase-3及 cleaved Caspase-3蛋白相对表达量比较
注:与对照组比较,*P<0.01;与Vector组比较,*P<0.01。
3 讨论
80%的骨肉瘤患者在确诊时已经发生转移,手术及新辅助化疗后5年生存率仅20%~30%[7,8]。骨肉瘤临床治疗效果不佳的重要原因是缺少特异性的分子治疗靶点[9]。SphK1是维持细胞内鞘脂平衡的重要调节酶,具有SphK1和SphK2两个亚型,虽然二者在结构域上高度保守,但在亚细胞定位、酶催化特性和组织表达谱等方面均显著不同。SphK1是1-磷酸鞘氨醇(S1P)生成的限速酶,通过降低组织内神经酰胺和鞘氨醇含量,促进细胞增殖、抑制细胞凋亡[3]。研究发现,SphK1在肿瘤组织中表达明显高于正常组织,如结肠癌、乳腺癌、前列腺癌、头颈部鳞癌及甲状腺癌等[10,11]。Bonhoure等[12]报道,特异性敲除人类白血病细胞系SphK1基因能够抑制线粒体细胞色素C的释放,进而促进细胞凋亡。Heffernan-Stroud等[13]报道,敲除SphK1基因可以抑制p53基因敲除小鼠特征性胸腺淋巴瘤的发生、发展。SphK1表达水平与肿瘤恶性程度和患者预后等临床病理特征相关,因此SphK1被认为是生物体内重要的致癌因子。新近有报道称,SphK1参与骨肉瘤的发病及其病理生理过程。彭晶等[4]研究发现,mi-124通过下调人骨肉瘤细胞SphK1表达抑制细胞的增殖及侵袭。苯妥帝尔和阿霉素联合应用同样能够抑制骨肉瘤组织SphK1高表达,进而抑制骨肉瘤U2OS细胞的生长发育[5]。本研究采用短链microRNA和特异性抑制剂两种手段敲低人骨肉瘤U2OS细胞SphK1表达,结果显示,SphK1表达被抑制后U2OS细胞增殖受到明显抑制,提示SphK1基因可能是骨肉瘤的靶基因。
肿瘤防治的关键是抑制肿瘤细胞增殖、促进肿瘤细胞凋亡。细胞凋亡是细胞接受内外源死亡信号刺激后发生的自杀性死亡,在调节生物生长发育和自身稳定方面发挥重要作用。目前临床上大多数抗肿瘤药物的作用机制是诱导肿瘤细胞凋亡。研究发现,SphK1在许多哺乳动物肿瘤细胞中发挥抗细胞凋亡作用[14]。有研究以病毒为载体,将野生型和突变型SphK1基因导入人胃癌细胞,结果显示,过表达SphK1可抑制5-FU诱导的胃癌细胞凋亡[14];干扰乳腺癌MCF-7细胞SphK1基因表达可以抑制肿瘤细胞增殖和迁移能力,同时诱导细胞发生凋亡[15,16]。本研究发现,SphK1表达被抑制后骨肉瘤U2OS细胞凋亡率升高,凋亡细胞数明显增加;同时细胞内重要的凋亡抑制基因Bcl-2蛋白表达明显降低,促凋亡发生基因Caspase-3、cleaved Caspase-3、Bax蛋白表达明显升高。提示在骨肉瘤发病过程中,SphK1基因通过调节凋亡相关因子表达抑制肿瘤细胞凋亡。PCAN及Cyclin D1是细胞增殖状态的重要评价指标,其在肿瘤组织中的表达变化对疾病的发生、发展及患者预后具有关键性评估价值。本研究中SphK1表达被抑制后骨肉瘤U2OS细胞PCNA及Cyclin D1表达均受到明显抑制,提示SphK1基因可能通过调控细胞增殖因子表达促进骨肉瘤细胞增殖。
综上所述,SphK1基因具有促进骨肉瘤细胞增殖、抑制细胞凋亡的作用;调节凋亡及增殖相关因子表达可能是其作用机制。SphK1基因可能成为骨肉瘤的治疗靶点。
[1] 闫抗,夏斯龙,王业华.丙戊酸钠与顺铂联合应用对人骨肉瘤细胞株U-2OS 增殖、凋亡的影响及其作用机制[J].山东医药,2016,56(3):11-13.
[2] Ren X, Shen Y, Zheng S, et al. miR-21 predicts poor prognosis in patients with osteosarcoma[J]. Br J Biomed Sci, 2016,73(4):158-162.
[3] Brown HK, Tellez-Gabriel M, Heymann D. Cancer stem cells in osteosarcoma[J]. Cancer Lett, 2017(386):189-195.
[4] 彭晶,兰天,黄凯鹏,等.黄连素调节鞘氨醇激酶-1-磷酸鞘氨醇信号通路抗糖尿病小鼠肾损伤的研究[J].中国药理学通报,2011,27(11):1544-1549.
[5] Zhou Y, Han Y, Zhang Z, et al. MicroRNA-124 upregulation inhibits proliferation and invasion of osteosarcoma cells by targeting sphingosine kinase 1[J]. Hum Cell, 2017,30(1):30-40.
[6] Yao C, Wu S, Li D, et al. Co-administration phenoxodiol with doxorubicin synergistically inhibit the activity of sphingosine kinase-1(SphK1), a potential oncogene of osteosarcoma, to suppress osteosarcoma cell growth both in vivo and in vitro[J]. Mol Oncol, 2012,6(4):392-404.
[7] Zhang N, Xie T, Xian M, et al. SIRT1 promotes metastasis of human osteosarcoma cells[J]. Oncotarget, 2016,7(48):79654-79669.
[8] Heymann MF, Brown HK, Heymann D. Drugs in early clinical development for the treatment of osteosarcoma[J]. Expert Opin Investig Drugs, 2016,25(11):1265-1280.
[9] Lettieri CK, Appel N, Labban N, et al. Progress and opportunities for immune therapeutics in osteosarcoma[J]. Immunotherapy, 2016,8(10):1233-1244.
[10] Shida D, Inoue S, Yoshida Y, et al. Sphingosine kinase 1 is upregulated with lysophosphatidic acid receptor 2 in human colorectal cancer[J]. World J Gastroenterol, 2016,22(8):2503-2511.
[11] Li J, Song Z, Wang Y, et al. Overexpression of SphK1 enhances cell proliferation and invasion in triple-negative breast cancer via the PI3K/AKT signaling pathway[J]. Tumour Biol, 2016,37(8):10587-10593.
[12] Bonhoure E, Lauret A, Barnes DJ, et al. Sphingosine kinase-1 is a downstream regulator of imatinib-induced apoptosis in chronic myeloid leukemia cells[J]. Leukemia, 2008,22(5):971-979.
[13] Heffernan-Stroud LA, Helke KL, Jenkins RW, et al. Defining a role for sphingosine kinase 1 in p53-dependent tumors[J]. Oncogene, 2012,31(9):1166-1175.
[14] Li PH, Wu JX, Zheng JN, et al. A sphingosine kinase-1 inhibitor, SKI-Ⅱ, induces growth inhibition and apoptosis in human gastric cancer cells[J]. Asian Pac J Cancer Prev, 2014,15(23):10381-10385.
[15] Sarkar S, Maceyka M, Hait NC, et al. Sphingosine kinase 1 is required for migration, proliferation and survival of MCF-7 human breast cancer cells[J]. Asian Pac FEBS Lett, 2005,579(24):5313-5317.
[16] Mahajan-Thakur S, Bien-Möller S, Marx S, et al. Sphingosine 1-phosphate (S1P) signaling in glioblastoma multiforme-A systematic review[J]. Int J Mol Sci, 2017,18(11):pii: E2448.
河北省教育厅青年基金项目(QN2016018)。
宝琪(E-mail: 13731697766@163.com)
10.3969/j.issn.1002-266X.2017.48.008
R738.1
A
1002-266X(2017)48-0028-03
2017-06-26)

