丰富环境对血管性痴呆大鼠侧脑室室管膜下区神经再生的影响①
贺旭,刘英飞,罗明英,成绍武,葛金文
·基础研究·
丰富环境对血管性痴呆大鼠侧脑室室管膜下区神经再生的影响①
贺旭1,2,3,刘英飞4,罗明英5,成绍武2,3,葛金文2,3
目的探讨丰富环境(EE)对血管性痴呆大鼠侧脑室室管膜下区(SVZ)神经再生的影响。方法29只大鼠分成假手术组(n=5)、血管性痴呆组(VD组,n=12)和丰富环境组(EE组,n=12)。采用两血管阻断法(2-VO)制作血管性痴呆模型。VD组和假手术组常规饲养条件下饲养,EE组给予丰富环境干预。30 d后免疫组织化学染色观察SVZ微管相关蛋白Doublecortin(DCX)与外源性细胞增殖标记物BrdU的表达,免疫荧光双标观察SVZ DCX/Ki67、DCX/p-cAMP反应元件结合蛋白(CREB)的共表达情况。结果与假手术组相比,VD组BrdU+细胞数目(t=2.989,P=0.026)、DCX+细胞平均光密度值(t=3.069,P=0.005)增加;与VD组比较,EE组BrdU+细胞数目(t=3.067,P=0.027)、DCX+细胞平均光密度值(t=2.907,P=0.011)进一步增加。EE组DCX/Ki67(t=2.994,P=0.040)、DCX/p-CREB(t=4.707,P=0.009)共表达细胞高于VD组。结论丰富环境可通过CREB信号通路上调血管性痴呆大鼠SVZ神经再生水平。
血管性痴呆;丰富环境;室管膜下区;神经再生;大鼠
血管性痴呆(vascular dementia,VD)是指由一系列如脑缺血等血管因素导致脑组织损害引起的神经功能损害,同时伴有认知功能减退为特征的神经退行性疾病[1]。公共流行病学调查资料显示,VD发病率在所有痴呆类型中高居第二,仅次于阿尔茨海默病[2-4]。VD最显著的特征是神经元的丢失和伴有认知功能的损害[5]。临床实验表明,药物和免疫干预在降低轻度认知损害和痴呆等方面难以取得满意临床效果。侧脑室室管膜下区(subventricular zone,SVZ)作为一个神经发生区域之一,贯穿于动物终生。VD后SVZ内源性神经干细胞增殖和分化,出现神经再生,但产生的细胞难以完全替代凋亡的细胞。因此,我们亟需寻找一种新的方法或手段延缓VD的发病进程。
丰富环境(enriched environment,EE)是指动物所生活空间环境变大,成员扩大以及内置新颖物体数量增加,表现为可提供多感官刺激、主动性运动及相互间社会交往机会。研究发现丰富环境干预可增加智力,延缓衰老,有益于脑缺血后小鼠运动功能的恢复,提高其社交功能[6]。Doublecortin(DCX)作为一种微管相关蛋白,表达在迁移的成神经细胞和未成熟神经元中,代表神经再生的水平[7-8]。丰富环境可以通过上调海马突触可塑性和促进梨状皮质DCX的表达而改善痴呆大鼠的学习记忆[9-10]。但是关于丰富环境是否可促进VD大鼠SVZ神经再生鲜有报道。本研究通过二血管阻断法建立VD模型,观察丰富环境对VD大鼠SVZ的影响,探究丰富环境在VD大鼠中的作用机制。
1 材料与方法
1.1 实验材料
出生2个月左右、体质量(260±15)g的SPF级雄性Sprague-Dawley大鼠,由湖南斯莱克景达实验动物有限公司提供,许可证号SCXK(湘)2013-0004。动物房室温保持(23±1)℃,相对湿度50%~55%,通风条件好,饲养于光照/黑暗为12 h/12 h的环境,自由饮水,定期更换垫料,给予标准饮食。
1.2 实验仪器和试剂
冰冻切片机:英国Shan Don公司。Kopf脑立体定位仪:美国David KOPF Instruments公司。BX67荧光显微镜:日本OLYMPUS公司。鼠抗BrdU抗体,批号MCA2060:英国SEROTEC公司。羊抗DCX抗体,批号SC-8066:美国SANTA CRUZ BIOTECHNOLOGY公司。兔抗Ki67,批号:美国VECTOR公司。兔抗p-cAMP反应元件结合蛋白(cAMP-response element binding protein,CREB)抗体,批号9198:美国CELL SIGNALING公司。生物素化山羊抗大鼠:武汉博士德公司。广谱生物素化二抗:美国VECTOR公司。二氨基联苯胺(diaminobenzidine,DAB):美国SIGMA公司。Alexa Fluor 488与Alexa Fluor 594偶联驴抗兔及驴抗山羊IgG:美国INVITROGEN公司。
1.3 实验方法
1.3.1模型建立
采用两血管结扎法[10-11]永久性结扎大鼠双侧颈总动脉建立VD模型。所有大鼠腹腔注射1%戊巴比妥钠50 mg/kg麻醉,仰卧固定在Kopf脑立体定位仪上。去毛,碘伏消毒,从颈部一侧做手术切口,分离颈总动脉和迷走神经,用7号手术线永久性结扎。考虑到同时结扎双侧颈总动脉后,大鼠死亡率高,因此1周后,从颈部另一侧做一切口,分离颈总动脉和迷走神经,永久性结扎。模型制作过程中尽量减少大鼠的痛疼和动物的使用数量。
假手术组(n=5)大鼠分离颈总动脉和迷走神经,但不结扎,术后常规饲养。
1.3.2实验设计
对参与实验研究的大鼠进行编号,根据随机数字表法将大鼠随机分成假手术组、VD组和EE组。VD组(n=12)每笼4只,常规饲养30 d;EE组(n=12)每天放入1.5×1.5×1.5 m的木质旷场进行丰富环境刺激8 h(8:30 am~16:30 pm),共30 d。
丰富环境标准:提供标准鼠粮、水;放置各种颜色的管道及小球、塑料房子、小桶、滑轮及乒乓球等;旷场内的物品每天更换,同时用75%酒精擦洗;每天更换旷场内大鼠垫料和擦洗旷场内壁和地板,以消除大鼠留下来的气味。
三组大鼠处死前7 d腹腔注射BrdU 50 mg/kg(终浓度50 mg/ml),连续注射3次,每次间隔8 h。造模30 d后免疫组化观察三组大鼠SVZ DCX+细胞,BrdU+细胞;荧光双标观察DCX/Ki67与DCX/p-CREB共表达细胞。
1.3.3脑组织标本的制备
10%水合氯醛3.5 ml/kg麻醉成功后,穿刺针从大鼠心尖部位插入直到主动脉,生理盐水快速灌注冲洗血液,然后改用4%多聚甲醛磷酸盐缓冲液(polyformaldehyde phosphate buffer,PF)灌注;取出鼠脑,4%PF后固定过夜;梯度沉糖(15%和30%各一遍)以防止冰晶出现;包埋。采用冠状位切片,邻片法:恒温冰冻切片出现侧脑室解剖结构时,先切1套12张厚30 μm脑片放入组织培养板,然后切取1套12张厚6 μm切片,接着弃取12×30 μm+12×6 μm组织,再收集下一轮脑片。其中免疫组织化学染色选用30 μm脑片,而免疫荧光双标染色则采用6 μm脑片。
1.3.4ABC法免疫组织化学染色
0.01 mmol/L PBS(pH=7.3)漂洗脑片3次,每次10 min;3%H2O2处理30 min,漂洗3次,每次10 min;5%马血清+0.1%tritonX-100(0.01 mmol/L)孵育2 h;加入羊抗DCX(1∶1000)4℃孵育过夜;漂洗3次,每次10 min;加入生物素化马抗山羊IgG(1∶400)室温孵育2 h;抗生物素蛋白-生物素复合物(ABC Kit)(1∶400):A液与B液提前30 min混匀,室温孵育2 h。DAB显色,酒精脱水,二甲苯脱脂,中性树脂封片。
鼠抗BrdU的实验步骤:甲醇∶30%H2O2∶PB=7∶1∶2处理脑片15 min,消除内源性过氧化物酶;在65℃水浴锅中使用50%甲酰胺∶柠檬酸钠=1∶1进行抗原修复;2 N HCl处理组织30 min;0.01 mol/L Tris-HCl反应10 min;马血清孵育后加入大鼠抗BrdU(1∶1000)4℃孵育过夜;加入生物素化马抗大鼠IgG(1∶400)室温孵育2 h,其他实验步骤同前。
1.3.5免疫荧光组织化学染色
0.01 mol/L PBS洗涤3次,每次10 min;5%驴血清+0.1%tritonX-100磷酸盐缓冲液(0.01 mol/L)孵育2 h;加入山羊抗DCX(1∶1000)和兔抗Ki67(1∶1000)以及山羊抗 DCX(1∶1000)和兔抗p-CREB(1∶1000),4℃过夜;0.01 mmol/L PBS-T溶液漂洗3次,每次10 min;Alexa Fluor 488与Alexa Fluor 594偶联驴抗兔和驴抗山羊IgG(1∶400)孵育2 h;漂洗3次,每次10 min;双苯酰亚胺(1∶5000)染核10 min;漂洗;贴片;50%甘油封片。
1.4 图片分析
拍照时各组免疫组织化学和免疫荧光切片曝光度和像素保持一致。每套组化和荧光切片取相同的部位进行细胞计数。考虑到SVZ DCX+细胞密集,因此采用NIH Image J计算平均光密度值(average optical density,AOD)。
1.5 统计学分析
采用Prism GraphPad 5.0进行统计分析和处理。实验数据以(xˉ±s)表示,通过单因素或者配对Studentt检验比较组间差异。显著性水平α=0.05。
2 结果
2.1 BrdU+
与假手术组相比,VD组BrdU+细胞数目增加(P<0.05)。与VD组比较,EE组BrdU+细胞数目增加(P<0.05)。见图1、表1。
2.2 DCX+
DCX+细胞在大量聚集成团状。见图2。与假手术组相比,VD组DCX+细胞平均光密度值明显增加(P<0.01)。与VD组比较,EE组DCX+细胞平均光密度值进一步上升(P<0.05)。见表1。
2.3 DCX/ki67
VD组和EE组的DCX细胞可经过侧脑室下角迁移到纹状体,并与内源性细胞增殖标记物Ki67发生共表达。见图3。EE组DCX/ki67共表达细胞数高于VD组(P<0.05)。见表1。
2.4 DCX/p-CREB
VD组和EE组的DCX细胞与核转录因子p-CREB有共表达。见图4。EE组DCX/p-CREB共表达细胞数明显高于VD组(P<0.01)。见表1。
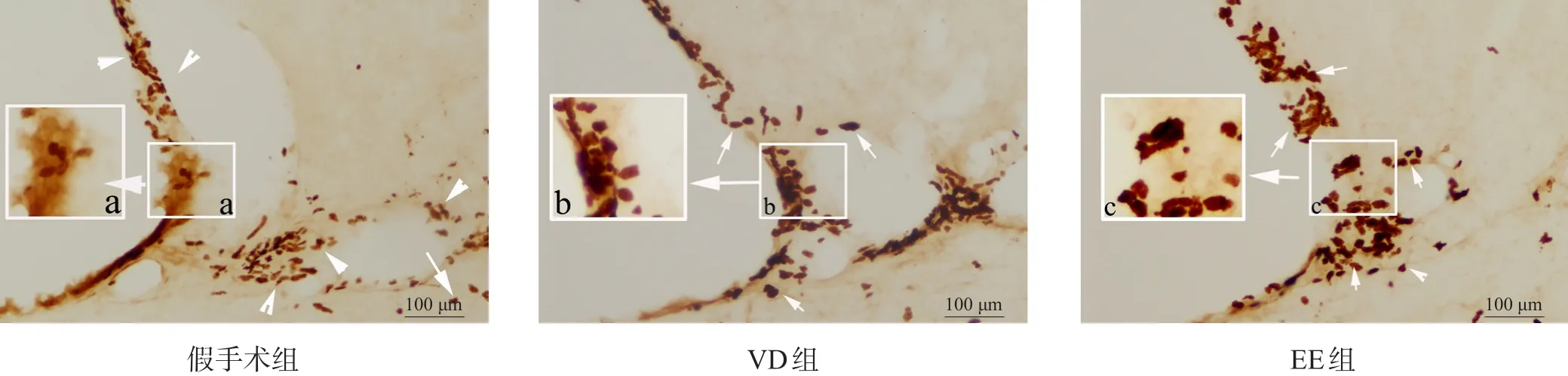
图1 三组SVZ BrdU+细胞表达(免疫组织化学染色,bar=100 μm)

图2 三组SVZ DCX+细胞表达(免疫组织化学染色,bar=100/50 μm)
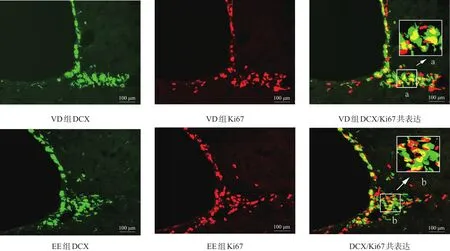
图3 VD组和EE组SVZ DCX/Ki67共表达(免疫荧光染色,bar=100 μm)
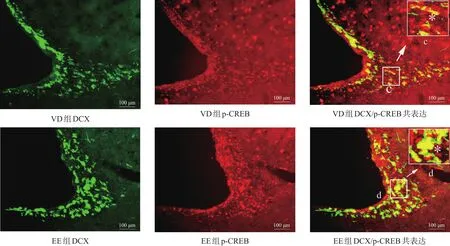
图4 VD组和EE组SVZ DCX/p-CREB共表达的影响(免疫荧光染色,bar=100μm)
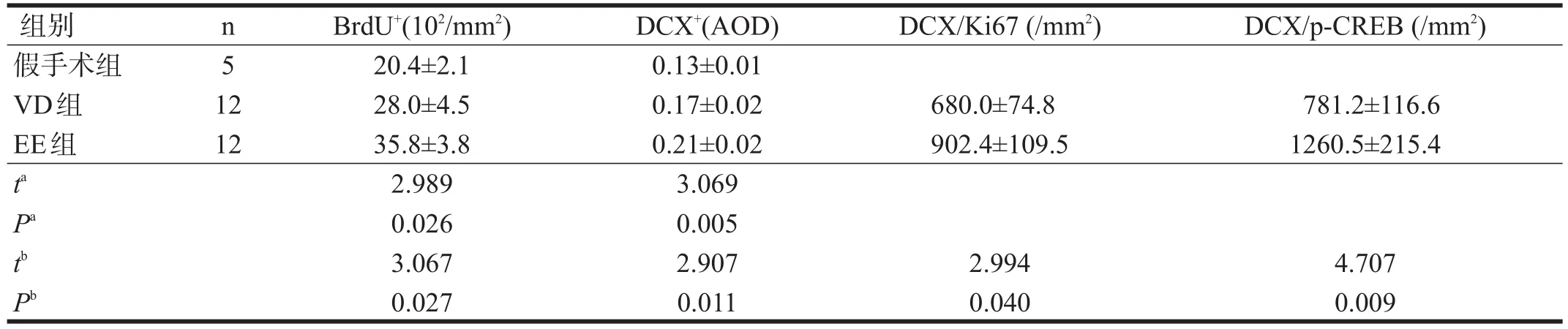
表1 三组SVZ BrdU+、DCX+表达及DCX与Ki67、DCX/p-CREB共表达情况
3 讨论
丰富环境是指在生存环境和社会交往两个方面相对于标准环境更加复杂的环境,具体表现为多感官刺激、自愿物理运动、社会性刺激及相互交往机会的增多。遭受物理损伤、化学伤害或者神经系统病变后,丰富环境均能上调啮齿类动物或其他哺乳动物海马的神经再生能力[12-15]。
VD发病机制涉及到脑血管因素引起脑组织缺血缺氧,进而造成神经元凋亡或丢失等病理改变[16]。我们之前的研究表明,丰富环境能通过促进梨状皮质未成熟神经元的表达与分化,从而改善VD大鼠的学习记忆[10]。本次研究我们进一步观察丰富环境对VD大鼠SVZ神经再生的影响。
DCX作为一种微管相关蛋白,起促进微管聚合的作用,表达在迁移的成熟神经细胞和未成熟神经元中,是成年神经再生的重要标记物,可以标记在有丝分裂后的神经前体细胞和未成熟神经元中,代表神经再生的水平[8,17],常受外界环境刺激[18]或者正常行为经验的调控[19]。BrdU作为胸腺嘧啶类似物,是外源性细胞增殖标记物,通常通过腹腔注射标记胚胎期和成年期分裂细胞的S期。
目前研究神经再生常联合运用这两种方法。本研究通过免疫组织化学染色观察三组大鼠SVZ DCX+细胞和BrdU+细胞的表达情况。实验结果显示,VD组SVZ DCX+细胞和BrdU+细胞的表达较假手术组增加。这可能是因为正常成年大鼠SVZ的神经前体细胞处于“静息”状态,而两侧颈总动脉夹闭产生脑缺血环境,从而刺激和加速SVZ内源性神经前体细胞的增殖。给予VD大鼠丰富环境干预后,DCX+细胞和BrdU+细胞进一步增加。这表明丰富环境使VD大鼠脑内内源性神经前体细胞激活的现象更加明显。
Ki67是一种核蛋白,是内源性细胞增殖标记物,可以发现于除了G0和早期G1阶段外细胞周期的所有时期,在静止期Ki67不表达[20]。免疫荧光双标结果显示,VD组和EE组均有DCX/Ki67细胞,且EE组共表达细胞高于VD组。这说明两血管阻断法制备的痴呆大鼠SVZ中有部分未成熟神经元处于细胞增殖阶段,并且给予丰富环境干预后可以加速神经前体细胞的增殖。
CREB是一种重要的核转录因子,CREB信号通路被激活后可参与神经发育与再生、突触可塑性及认知功能等多种生物学作用,体内外实验均表明CREB信号通路参与了嗅球[21]、海马[22-23]、SVZ[24]及吻侧迁移流[25]的神经再生。本研究使用免疫荧光双标技术观察SVZ DCX/p-CREB的共表达情况,结果显示EE组DCX/p-CREB细胞高于VD组。这表明丰富环境可通过CREB信号通路的磷酸化而调控VD大鼠SVZ神经再生。
综上所述,丰富环境可以促进VD大鼠SVZ神经再生,加速VD大鼠SVZ神经前体细胞的产生及增殖,且丰富环境通过CREB信号通路调控VD大鼠SVZ神经再生。
[1]Pase MP,Satizabal CL,Seshadri S.Role of improved vascular health in the declining incidence of dementia[J].Stroke,2017,48(7):2013-2020.
[2]Brookmeyer R,Johnson E,Ziegler-Graham K,et al.Forecasting the global burden of Alzheimer's disease[J].Alzheimers Dement,2007,3(3):186-191.
[3]Fotuhi M,Hachinski V,Whitehouse PJ.Changing perspectives regarding late-life dementia[J].Nat Rev Neurol,2009,5(12):649-658.
[4]O'Brien JT,Thomas A.Vascular dementia[J].Lancet,2015,386(10004):1698-1706.
[5]Smith EE,Cieslak A,Barber P,et al.Therapeutic strategies and drug development for vascular cognitive impairment[J].J Am Heart Assoc,2017,6(5):1-11.
[6]姜敏,王继先,余波,等.丰富环境对小鼠缺血性脑损伤后运动、社交功能的作用[J].中国康复理论与实践,2017,23(1):32-36.
[7]谭新杰,胡长林,蔡文琴.微管相关蛋白Doublecortin在成年大鼠神经元前体细胞发生中的表达[J].解剖学杂志,2006,29(5):601-603.
[8]Couillard-Despres S,Winner B,Schaubeck S,et al.Doublecortin expression levels in adult brain reflect neurogenesis[J].Eur J Neurosci,2005,21(1):1-14.
[9]赵晖,王少烽,张秋霞,等.丰富环境干预对慢性低灌注血管性痴呆大鼠学习记忆及突触素蛋白和微管相关蛋白的影响[J].中国康复医学杂志,2012,27(8):687-691.
[10]黄俊,吴帆帆,贺旭,等.丰富环境对血管性痴呆模型大鼠梨状皮质未成熟神经元表达的影响[J].中国组织工程研究,2016,20(27):4006-4012.
[11]Zhang N,Xing M,Wang Y,et al.Repetitive transcranial magnetic stimulation enhances spatial learning and synaptic plasticity via the VEGF and BDNF-NMDAR pathways in a rat model of vascular dementia[J].Neuroscience,2015,311:284-291.
[12]Ruitenberg MJ,Wells J,Bartlett PF,et al.Enrichment increases hippocampal neurogenesis independent of blood monocyte-derived microglia presence following high-dose total body irradiation[J].Brain Res Bull,2017,132:150-159.
[13]Zhang XM,Cai Y,Wang F,et al.Sp8 expression in putative neural progenitor cells in guinea pig and human cerebrum[J].Dev Neurobiol,2016,76(9):939-955.
[14]Hu YS,Xu P,Pigino G,et al.Complex environment experience rescues impaired neurogenesis,enhances synaptic plasticity,and attenuates neuropathology in familial Alzheimer's disease-linked APPswe/PS1DeltaE9 mice[J].FASEB J,2010,24(6):1667-1681.
[15]Bhagya VR,Srikumar BN,Veena J,et al.Short-term exposure to enriched environment rescues chronic stress-induced impaired hippocampal synaptic plasticity,anxiety,and memory deficits[J].J Neurosci Res,2017,95(8):1602-1610.
[16]高风超,陈翔,田新英.血管性痴呆危险因素及发病机制的研究进展[J].医学综述,2014,20(6):1068-1071.
[17]贺旭,葛金文,黄俊,等.三七总皂苷对全脑缺血成年大鼠侧脑室室管膜区神经再生的影响[J].中草药,2016,47(9):1535-1540.
[18]Xiong K,Luo DW,Patrylo PR,et al.Doublecortin-expressing cells are present in layer II across the adult guinea pig cerebral cortex:partial colocalization with mature interneuron markers[J].Exp Neurol,2008,211(1):271-282.
[19]He X,Zhang XM,Wu J,et al.Olfactory experience modulates immature neuron development in postnatal and adult guinea pig piriform cortex[J].Neuroscience,2014,259:101-112.
[20]Zacchetti A,van Garderen E,Teske E,et al.Validation of the use of proliferation markers in canine neoplastic and non-neoplastic tissues:comparison of KI-67 and proliferating cell nuclear antigen(PCNA)expression versus in vivo bromodeoxyuridine labelling by immunohistochemistry[J].APMIS,2003,111(3):430-438.
[21]He X,Deng FJ,Ge JW,et al.Effects of total saponins of Panax notoginseng on immature neuroblasts in the adult olfactory bulb following global cerebral ischemia/reperfusion[J].Neural Regen Res,2015,10(9):1450-1456.
[22]Kim JS,Yang M,Cho J,et al.Promotion of cAMP responsive element-binding protein activity ameliorates radiation-induced suppression of hippocampal neurogenesis in adult mice[J].Toxicol Res,2010,26(3):177-183.
[23]Ortega-Martinez S.A new perspective on the role of the CREB family of transcription factors in memory consolidation via adult hippocampal neurogenesis[J].Front Mol Neurosci,2015,8:46.
[24]Gampe K,Brill MS,Momma S,et al.EGF induces CREB and ERK activation at the wall of the mouse lateral ventricles[J].Brain Res,2011,1376:31-41.
[25]贺旭,严小新,潘爱华,等.成年大鼠吻侧迁移流的神经发生[J].中国组织化学与细胞化学杂志,2017,26(4):315-320.
Effect of Enriched Environment on Neuroregeneration in Subventricle Zone of Rats with Vascular Dementia
HE Xu1,2,3,LIU Ying-fei4,LUO Ming-ying5,CHENG Shao-wu2,3,GE Jin-wen2,3
1.Department of Anatomy,Yiyang Medical College,Yiyang,Hunan 413000,China;2.Department of Integrated Traditional and Western Medicine,Hunan University of Traditional Chinese Medicine,Changsha,Hunan 410208,China;3.Key Laboratory of Hunan Province for Integrated Traditional Chinese and Western Medicine on Prevention and Treatment of Cardio-Cerebral Disease,Changsha,Hunan 410208,China;4.Hospital Affiliated to Yiyang Medical College,Yiyang,Hunan 413000,China;5.Department of Human Anatomy,Kunming Medical College,Kunming,Yunnan 650500,China
GE Jin-wen.E-mail:40831556@qq.com
ObjectiveTo explore the effect of enriched environment on neuroregeneration in subventricle zone(SVZ)of rats with vascular dementia.MethodsAll rats were divided into sham group(n=5),vascular dementia group(VD group,n=12)and enriched environment group(EE group,n=12).Then,2-VO method was applied to make the vascular dementia model.The sham group and VD group
conventional breeding environment for 30 days,while EE group was subjected to enriched environment for 30 days.Immunohistochemistry was applied to detect the BrdU and Doublecortin(DCX)expression in SVZ,and DCX/Ki67,DCX/p-cAMP-response element binding protein(CREB)expression in SVZ was assessed by immunofluorescence double-labeling technique.ResultsCompared with the sham group,the number of DCX+cells(t=2.989,P=0.026)and BrdU+cells(t=3.069,P=0.005)increased in VD group,and increased more in EE group(t=3.067,P=0.027;t=2.907,P=0.011).Besides,the number of the DCX/Ki67(t=2.994,P=0.040)and DCX/p-CREB(t=4.707,P=0.009)cells was significantly higher in EE group than in VD group.ConclusionEnriched environment could up-regulate the neuroregeneration capacity in SVZ of rats with vascular dementia through CREB signal pathway.
vascular dementia;enriched environment;subventricle zone;neuroregeneration;rats
R749.1
A
1006-9771(2017)12-1384-06
[本文著录格式]贺旭,刘英飞,罗明英,等.丰富环境对血管性痴呆大鼠侧脑室室管膜下区神经再生的影响[J].中国康复理论与实践,2017,23(12):1384-1389.
1.国家自然科学基金项目(No.81500377);2.湖南省教育厅优秀青年课题(No.16B269);3.益阳医学高等专科学校引进高层次人才科研启动费项目(No.2016-001)。
1.益阳医学高等专科学校解剖教研室,湖南益阳市413000;2.湖南中医药大学中西医结合学院,湖南长沙市410208;3.中西医结合心脑疾病防治湖南省重点实验室,湖南长沙市410208;4.益阳医学高等专科学校附属医院内一科,湖南益阳市413000;5.昆明医科大学人体解剖教研室,云南昆明市650500。作者简介:贺旭(1984-),男,汉族,湖南邵阳市人,博士,讲师,主要研究方向:中药在心脑血管疾病神经发生与神经再生的作用。通讯作者:葛金文(1965-),男,汉族,湖南娄底市人,博士,教授,博士生导师,主要研究方向:脑血管病发病机制及中西医结合防治研究和中西医结合方法学研究。E-mail:40831556@qq.com。
10.3969/j.issn.1006-9771.2017.12.004
CITED AS:He X,Liu YF,Luo MY,et al.Effect of enriched environment on neuroregeneration in subventricle zone of rats with vascular dementia[J].Zhongguo Kangfu Lilun Yu Shijian,2017,23(12):1384-1389.
2017-06-30
2017-08-17)

