电针百会、四关穴对大鼠局灶性脑缺血再灌注大鼠大脑皮质中Tax1结合蛋白1表达的影响①
马宏梅,蒋锦,詹剑,李琼莉,张莹,秦文熠,罗勇
电针百会、四关穴对大鼠局灶性脑缺血再灌注大鼠大脑皮质中Tax1结合蛋白1表达的影响①
马宏梅1a,2,蒋锦1a,2,詹剑1a,2,李琼莉1a,2,张莹1a,2,秦文熠1b,罗勇1a,2
目的观察电针百会、四关穴对大鼠局灶性脑缺血再灌注大鼠大脑皮质中Tax1结合蛋白1(TAX1BP1)表达的影响,探讨电针抑制核因子-κB(NF-κB)信号通路的激活,发挥脑保护作用的可能机制。方法105只健康雄性Sprague-Dawley大鼠随机分为假手术组、模型组和电针组,每组再分为缺血2 h后再灌注6 h、12 h、24 h、48 h、72 h五个亚组。改良Longa线栓法制备右侧大脑中动脉梗死再灌注模型。电针组给予电针百会穴和病侧四关(合谷/太冲)穴。检测各组神经功能,缺血区大脑皮质中TAX1BP1蛋白的表达情况、TAX1BP1阳性细胞数、锌指蛋白A20和胞核NF-κB p65蛋白的表达情况。结果假手术组无神经功能缺损,与模型组相比,电针组在局灶性脑缺血2 h再灌注48 h、72 h时神经功能评分降低(P<0.05)。与假手术组相比,模型组在再灌注12 h、24 h、48 h时TAX1BP1蛋白表达增加(P<0.05);与模型组相比,电针组在再灌注12 h、24 h、48 h、72 h时TAX1BP1蛋白表达进一步增加(P<0.05),再灌注24 h为表达高峰。在再灌注24 h后,与假手术组相比,模型组A20表达、TAX1BP1阳性细胞数、胞核NF-κB p65表达增加(P<0.05);与模型组相比,电针组的A20表达、TAX1BP1阳性细胞数进一步增加(P<0.05),胞核NF-κB p65蛋白表达减少(P<0.05)。免疫荧光结果显示,TAX1BP1蛋白主要表达在胞浆,电针组TAX1BP1与A20共表达在胞浆。免疫组化结果显示,模型组NF-κB p65主要表达在胞核,电针组主要表达在胞浆。结论电针抑制大鼠局灶性脑缺血再灌注后NF-κB信号通路的激活,促进大鼠神经功能恢复,其机制可能是通过上调TAX1BP1蛋白的表达,从而发挥脑保护作用。
脑缺血再灌注;电针;Tax1结合蛋白1;锌指蛋白A20;核因子-κB p65;大鼠
脑卒中是目前导致人类死亡的第二位原因[1]。脑卒中包括缺血性脑卒中和出血性脑卒中,其中绝大多数是发生在大脑中动脉的缺血性脑卒中[2-3]。局灶性脑缺血再灌注后,有多种病理生理机制对脑组织造成损伤,其中炎症反应在局灶性脑缺血再灌注损伤中担当重 要 角 色[4]。 核 因 子 -κB(nuclear factor kappa B,NF-κB)信号通路的激活是神经性炎症的主要机制[5]。Tax1结合蛋白1(Tax1-binding protein 1,TAX1BP1,亦称TABP151或T6BP)最初因结合人嗜T淋巴细胞病毒1型(human T-lymphotropic virus type 1,HTLV-1)Tax1蛋白而被发现[6]。近年来研究发现,TAX1BP1是调控抑制NF-κB信号通路的抑制蛋白,目前已有研究证实TAX1BP1是终止NF-κB信号通路应答肿瘤坏死因子(tumor necrosis factor,TNF)、白细胞介素-1(interleukin-1,IL-1)和脂多糖(lipopolysaccharide,LPS)刺激的关键靶点,TAX1BP1通过招募结合锌指蛋白A20,又称肿瘤坏死因子诱导蛋白3(TNF-α induced protein 3,TNFAIP3)发挥抗炎作用,抑制NF-κB信号通路的激活[7]。Lim等[8]的系统评价和Meta分析结果亦显示,电针能够有效减轻脑卒中后肢体的痉挛状态。
本课题组前期研究发现,电针百会、四关穴能减轻大鼠局灶性脑缺血再灌注早期(6~72 h)脑组织的炎性损伤,上调A20表达,抑制NF-κB信号通路的激活[9-11]。故在局灶性脑缺血再灌注早期炎性损伤中,电针是否通过上调TAX1BP1蛋白的表达抑制局灶性脑缺血再灌注早期的炎性损伤,值得探讨。
本实验研究电针对局灶性脑缺血再灌注早期缺血区大脑皮质中TAX1BP1蛋白表达的影响,进一步探明电针对大鼠局灶性脑缺血再灌注早期炎性损伤的保护机制及TAX1BP1在其中的脑保护作用。
1 材料与方法
1.1 实验动物及分组
SPF级健康雄性Sprague-Dawley大鼠105只,体质量280~300 g,重庆医科大学实验动物中心提供,许可证号SCXK(渝)2012-0002。
按照随机数字表将75只大鼠分为假手术组(n=25)、模型组(n=25)和电针组(n=25)。每组大鼠再按照随机数字表法分为局灶性脑缺血2 h再灌注6 h、12 h、24 h、48 h、72 h亚组,每组5只,用于神经功能评分、Western blotting检测。
另30只大鼠按照随机数字表法分为假手术组、模型组和电针组,每组再按照随机数字表法随机各选取5只,在局灶性脑缺血2 h再灌注24 h时,分别进行免疫荧光染色及免疫组织化学染色。
大鼠禁食12 h后开始造模。动物处置按照重庆医科大学动物伦理委员会相关规定进行。
1.2 主要试剂与仪器
TAX1BP1兔单克隆抗体:英国ABCAM公司。NF-κB p65小鼠单克隆抗体:美国CELL SIGNALING TECHNOLOGY公司。A20兔多克隆抗体、β-actin兔多克隆抗体、山羊抗兔荧光二抗cy3、山羊抗小鼠荧光二抗488:武汉三鹰生物技术有限公司。A20小鼠单克隆抗体:美国SANTA CRUZ BIOTECHNOLOGY公司。核纤层蛋白B1(Lamin b1)兔多克隆抗体:武汉ABCLONAL公司。免疫组化试剂盒和DAB显色试剂盒:北京中杉金桥生物技术有限公司。细胞核蛋白和细胞浆蛋白提取试剂盒、一抗稀释液:上海碧云天生物技术有限公司。超敏ECL化学发光试剂盒:沈阳万类生物有限公司。
G6805-2型电针治疗仪:北京新胜公司。电泳、电转仪:美国BIO-RAD。lourmat fusion FX 7 Spectra显影仪:法国VILBER公司。Axio Observer ZI激光共聚焦荧光显微镜:德国CARL ZEISS MICROIMAGING公司。PM20自动显微镜:日本OLYMPUS公司。
1.3 动物模型与评价
根据Longa等[13]报道的方法,并结合本课题组秦文熠等[9]报道的经验方法,规范制备线栓法右侧大脑中动脉梗死再灌注模型。3.5%水合氯醛10 ml/kg腹腔注射麻醉,仰卧位手术,结扎大鼠的颈外动脉,插栓从颈外动脉至大脑中动脉,距颈动脉分叉处18~20 mm;2 h后,拔出线栓至颈外动脉,实现再灌注。造模后,采用Longa等[13]行为学评分进行评价:0分,无神经功能缺失症状;1分,轻度局灶神经功能缺失(不能完全伸展左侧前肢);2分,中度局灶神经功能缺失(向左侧转圈);3分,重度神经功能缺失(向左侧倾斜);4分,不能自发行走,意识水平降低。由于0分没有神经功能缺损,4分症状过重不利于后续实验,故1~3分为造模成功。
1.4 电针刺激
根据中国针灸学会实验针灸委员会制定的大鼠穴位图谱[12],选取百会穴和病侧四关(合谷/太冲)穴,利用直径0.38 mm、长1寸(≈3.33 cm)华佗牌不锈钢银针取百会穴斜刺入头皮1 mm,直刺四关穴2 mm,接电针治疗仪,频率100/2 Hz,疏密波,强度1 mA,刺激时间20 min。电针组拔栓后立即行电针刺激,每天1次,直至处死大鼠,即再灌注6 h、12 h分别刺激1次,再灌注24 h、48 h、72 h分别共刺激2次、3次、4次。
1.5 Western blotting
各组大鼠到各观察时间点时,3.5%水合氯醛10 ml/kg腹腔注射麻醉。断头后取右侧缺血区大脑皮质,迅速放入液氮极速冷冻后转入-80℃冰箱冻存备用。取缺血区大脑皮质,冰浴加入RIPA(Radio Immunoprecipitation Assay)裂解液、苯甲基磺酰氟化物(phenylmethyl sulfonyl fluoride,PMSF),匀浆器匀浆后静置5 min,4℃ 12000 g离心20 min。应用BCA蛋白定量法检测蛋白浓度,加入上样缓冲液,100℃沸水中煮15 min,-80℃冰箱冻存备用。取局灶性脑缺血2 h再灌注6 h、12 h、24 h、48 h、72 h时间点蛋白检测TAX1BP1蛋白的表达,取局灶性脑缺血2 h再灌注24 h时间点蛋白检测A20的表达情况;另取局灶性脑缺血2 h再灌注24 h时间点的缺血区大脑皮质,按照细胞核蛋白和细胞浆蛋白提取试剂盒说明书提取胞核蛋白检测NF-κB p65蛋白的表达情况。
配制8%SDS-PAGE凝胶,蛋白上样量为60 μg,恒压60~120 V电泳,电转250 mA 2 h,脱脂奶粉常温封闭2 h,孵育一抗4℃过夜,一抗为TAX1BP1(ab176572 1∶ 2000)、 A20(23456-1-AP 1∶ 200)、NF-κB p65(6956S 1∶1000)、β-actin(20536-1-AP 1∶2000)、Lamin B1(A2452 1∶800),TBST充分漂洗15 min,共3次,孵育抗兔二抗(1∶3000)或抗小鼠二抗(1∶3000)37℃1 h,TBST再次漂洗后显影仪显影,配套软件FUSION-CAPT分析条带灰度值,β-actin为TAX1BP1和A20的内参,Lamin B1为NF-κB p65的内参,目的条带灰度值与内参条带灰度值的比值为所得图像结果。
1.6 免疫荧光检测
各组局灶性脑缺血2 h再灌注24 h时,用3.5%水合氯醛10 ml/kg腹腔注射麻醉,“V”形剪开大鼠肋骨,充分暴露心脏,用生理盐水及4%多聚甲醛经心尖主动脉灌流固定。取大鼠脑组织,多聚甲醛浸泡24 h,30%蔗糖脱水、切片制备冰冻切片,晾干5 min,PBS冲洗10 min,共3次。3%triton破膜,PBS漂洗,山羊血清封闭37℃2 h,TAX1BP1荧光单标采用孵育TAX1BP1兔单克隆一抗(1∶50),TAX1BP1与A20共标采用孵育TAX1BP1兔单克隆抗体(1∶50)和A20小鼠单克隆一抗(1∶50),4℃过夜,37℃复温2 h,PBS冲洗15 min,共3次,山羊抗兔荧光二抗(避光1∶100)或山羊抗兔荧光二抗(避光1∶100)及山羊抗小鼠荧光二抗(1∶100)37℃孵育2 h,PBS冲洗10 min,共3次,DAPI染核(避光)后封片。盲法激光共聚焦荧光显微镜下观察缺血区大脑皮质。每个样本随机选取缺血区大脑皮质5个视野拍照,传入Photoshop CS5计数,阳性细胞计数为蛋白(红色荧光)和胞核(蓝色荧光)共同表达的细胞计数,参照Zhan等[11]阳性细胞计数方法。
1.7 免疫组织化学检测
各组大鼠局灶性脑缺血2 h再灌注24 h时,用3.5%水合氯醛10 ml/kg腹腔注射麻醉,“V”形剪开大鼠肋骨,充分暴露心脏,用生理盐水及4%多聚甲醛经心尖主动脉灌流固定。取大鼠脑组织,多聚甲醛充分固定后包埋、切片。切片脱蜡至水,抗原修复液37℃孵育2 h,3%H2O2去离子水常温孵育10 min,PBS冲洗3 min,共3次,加NF-κB p65一抗(1∶100)孵育4℃过夜,PBS冲洗3 min,共3次,滴加生物素化二抗工作液室温孵育15 min,PBS冲洗3 min,共3次,滴加残根酶标记链霉卵白素工作液室温孵育15 min,PBS冲洗3 min,共3次,DAB显色液显色,复染、脱水、透明、封片。盲法自动显微镜400倍下观察缺血区大脑皮质。
结果判定:细胞核表达为蓝色,阳性结果为棕色,棕色和蓝色重合为NF-κB p65表达在胞核,棕色表达在蓝色周围为NF-κB p65表达在胞浆。
1.8 统计学分析
采用SPSS 21.0统计软件进行数据分析。符合正态分布的计量资料采用(xˉ±s)表示。不同组别相同时间点比较采用单因素方差分析,LSD检验进行组间均数的两两比较。显著性水平α=0.05。
2 结果
2.1 神经功能评分
假手术组无神经功能缺损症状。与假手术组相比,模型组各时间点神经功能评分均升高(P<0.05);与模型组比较,电针组在再灌注48 h、72 h时,神经功能评分降低(P<0.05)。见表1。
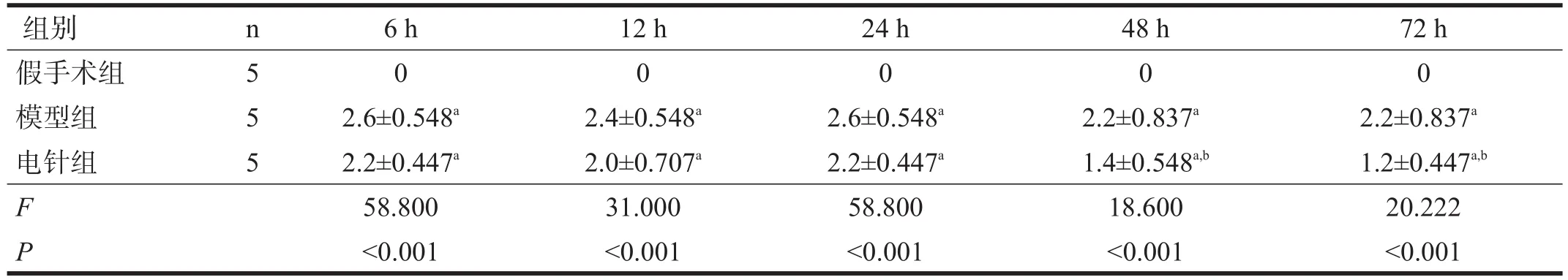
表1 各组大鼠不同时间点行为学评分
2.2 TAX1BP1蛋白
三组各时间点缺血区大脑皮质中TAX1BP1蛋白表达均有非常显著性差异(P<0.01)。与假手术组比较,模型组在再灌注12 h、24 h、48 h时,缺血区大脑皮质中TAX1BP1蛋白表达增加(P<0.05);与模型组比较,电针组在再灌注12 h、24 h、48 h、72 h时进一步增加(P<0.05),再灌注24 h为表达高峰。见表2、图1。
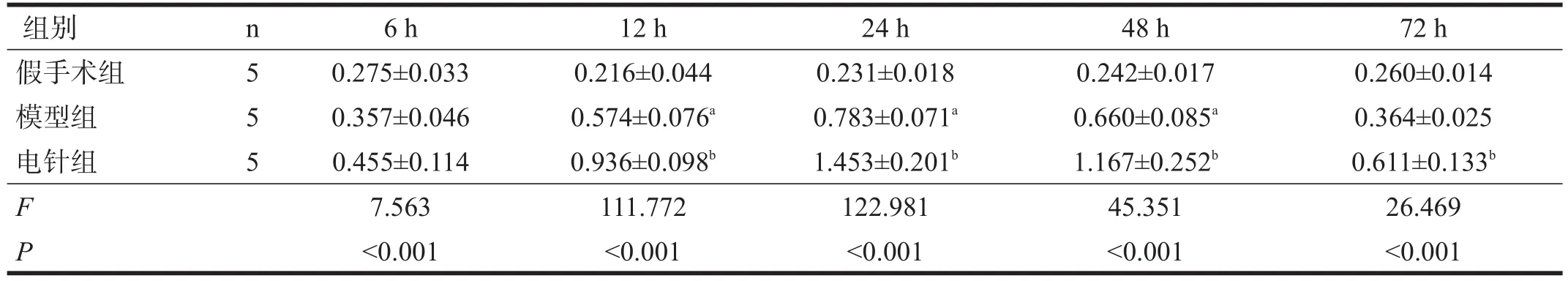
表2 各组不同时间点缺血区大脑皮质中TAX1BP1蛋白表达水平
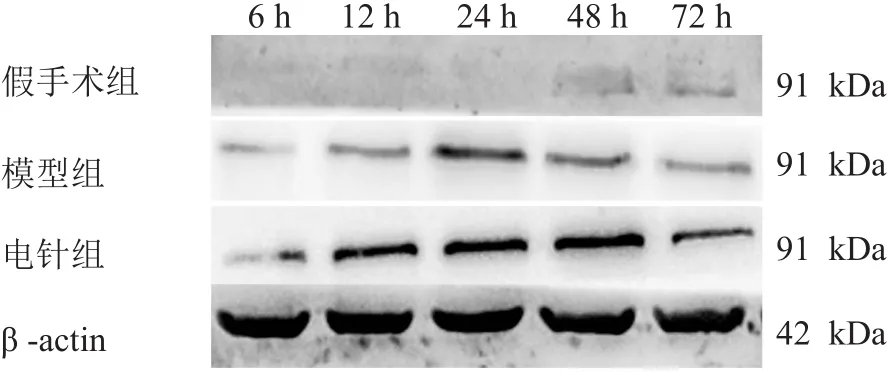
图1 Western blotting检测各组缺血区大脑皮质中TAX1BP1蛋白表达
2.3 A20、胞核NF-κB p65蛋白表达
局灶性脑缺血2 h再灌注24 h后,三组间A20、胞核NF-κB p65表达水平均有非常高度显著性差异(P<0.001)。与假手术组比较,模型组A20、胞核NF-κB p65表达增加(P<0.05);与模型组相比,电针组A20表达增加(P<0.05),胞核NF-κB p65表达减少(P<0.05)。见表3、图2。
2.4 TAX1BP1蛋白表达阳性细胞数
再灌注24 h后,三组TAX1BP1蛋白均主要表达在胞浆中,阳性细胞数组间均数比较有非常高度显著性差异(P<0.001)。与假手术组相比,模型组TAX1BP1阳性细胞数增加(P<0.05);与模型组相比,电针组相比表达进一步增加(P<0.05)。见表4、图3。
2.5 NF-κB p65蛋白的表达位置
局灶性脑缺血2 h再灌注24 h后,模型组NF-κB p65蛋白主要表达在胞核,电针组的NF-κB p65蛋白主要表达在胞浆。见图4。
2.6 TAX1BP1与A20共表达
局灶性脑缺血2 h再灌注24 h后,电针组TAX1BP1和A20共表达在胞浆。见图5。
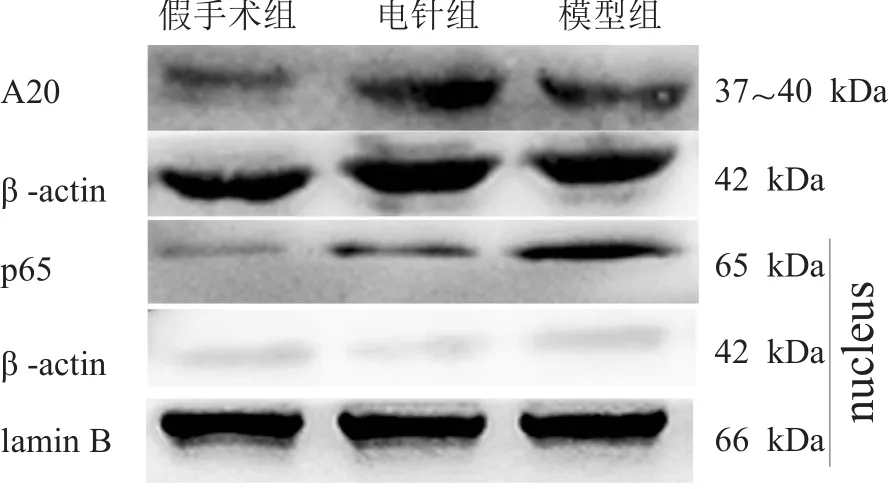
图2 Western blotting检测各组缺血区大脑皮质中A20、胞核NF-κB p65蛋白表达水平

图3 缺血区大脑皮质中TAX1BP1蛋白表达(免疫荧光染色,200×)

图4 各组缺血区大脑皮质中NF-κB p65蛋白的表达位置(免疫组织化学染色,400×)
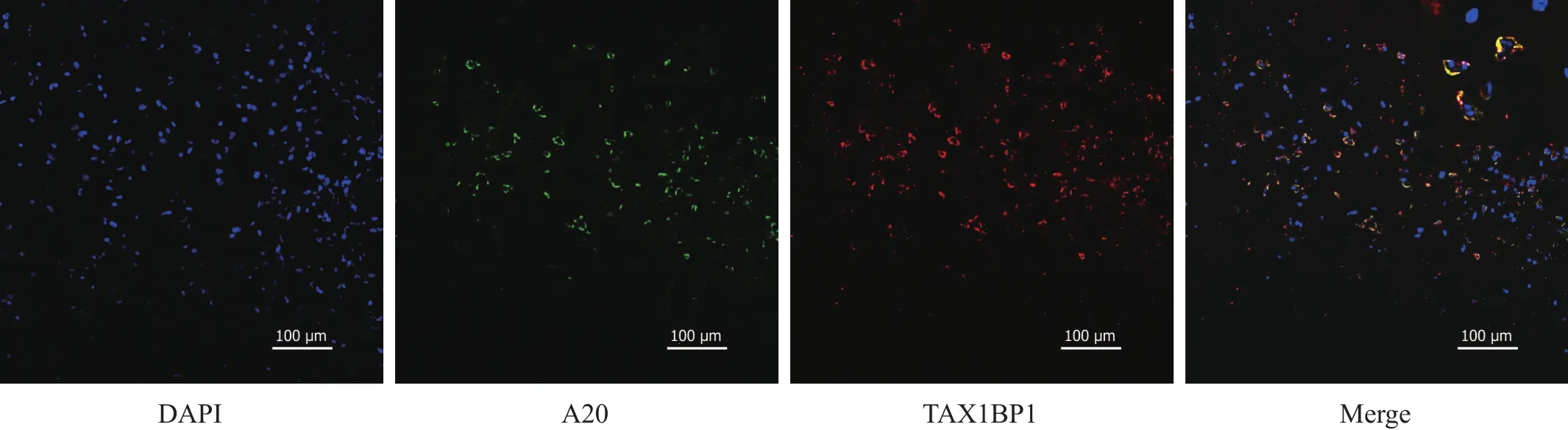
图5 电针组缺血区大脑皮质中TAX1BP1与A20共表达(免疫荧光染色,200×)
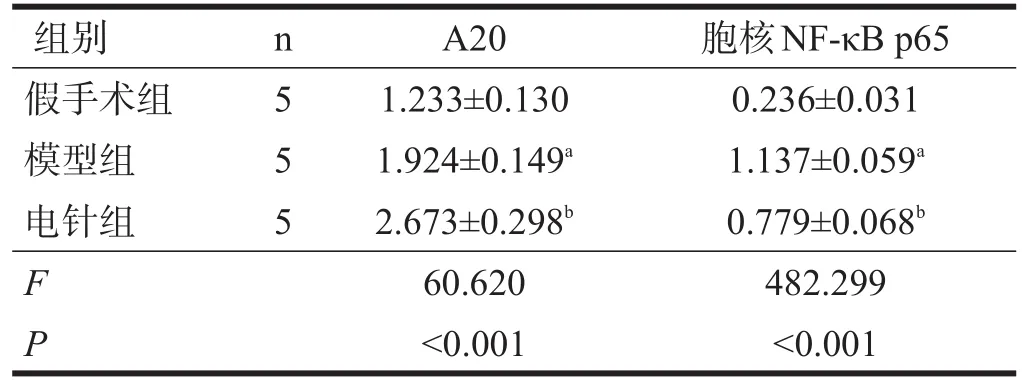
表3 各组大鼠缺血区大脑皮质中A20、胞核NF-κB p65蛋白表达水平
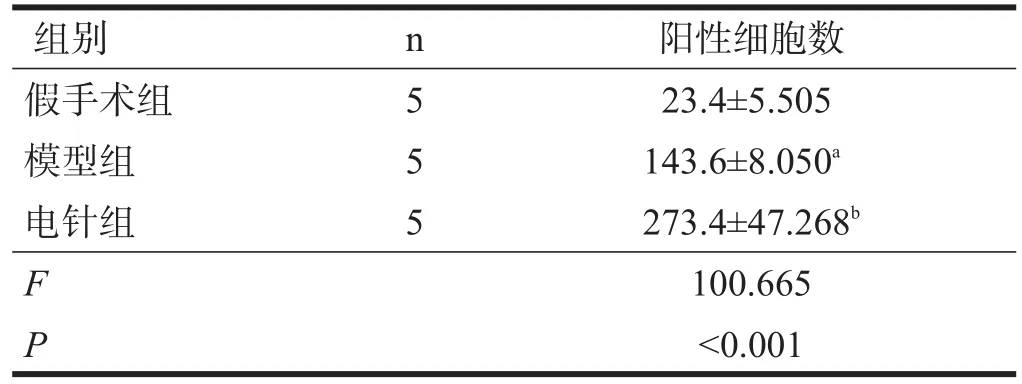
表4 各组大鼠缺血区大脑皮质中TAX1BP1蛋白阳性细胞数
3 讨论
脑卒中具有高发病率、高死亡率的特点,其中高达80%为缺血性脑卒中[14-15]。炎症反应贯穿脑缺血早期,主要发挥炎性损伤作用[15];而再灌注将会加重炎性损伤、氧化应激、脑水肿[16]。NF-κB信号通路是炎性损伤的主要信号通路[17]。静息状态下,NF-κB分子以二聚体形式(以p65/p50最广泛)存在于胞浆内,并与NF-κB的抑制蛋白(inhibitor of NF-κB,IκB)结合形成复合物。IκB能够遮蔽NF-κB的核定位信号,使其处于失活状态,不能进入胞核启动相关炎症因子的基因表达[18-19]。脑缺血再灌注后,多种表面受体激活,引起下游IκB激酶(IκB kinase.IKK)复合物磷酸化。磷酸化的IKK激活下游的IκB,引起IκB的磷酸化及泛素化,最终导致蛋白酶体的降解,从而释放NF-κB入核,转录多种炎性因子[20]。
本课题组前期研究发现,电针刺激大鼠百会穴和四关穴能促进大鼠局灶性脑缺血再灌注的神经功能恢复,并应用NF-κB信号通路阻滞剂NBD多肽证实电针通过下调IKK的表达,抑制NF-κB信号通路的激活,抑制局灶性脑缺血再灌注早期的炎性损伤[10]。本研究通过行为学评分证实,电针能够促局灶性脑缺血再灌注大鼠的神经功能恢复,并通过Western blotting和免疫组化证实电针能抑制NF-κB p65的核转位,支持电针能有效抑制脑缺血再灌注后NF-κB信号通路介导炎性损伤的观点,并与我们前期研究相符[9-11,21-22]。
电针对局灶性脑缺血再灌注后下游NF-κB信号通路的抑制作用已得到证实,但是电针的“真正调控靶点”,有待进一步研究。TAX1BP1能够有效抑制NF-κB炎症相关信号通路。TAX1能够同时激活IKK、诱导IκB蛋白的降解、直接作用于NF-κB的亚基,从而增强NF-κB信号通路的激活[23]。上调TAX1BP1蛋白表达,能有效抑制TAX1诱导的NF-κB激活,A20可能参与其中[7,24]。但也有研究表明,TAX1BP1能够与视神经蛋白结合增强TAX1诱导的NF-κB激活作用[25]。这可能与TAX1BP1结合的蛋白有关,有待进一步研究。肿瘤坏死因子受体相关因子6(TNF receptor-associated factor 6,TRAF6)是促炎因子激活NF-κB信号通路上游IKK的关键靶点,而TAX1BP1通过与TRAF6和A20相互作用,抑制TRAF6介导的NF-κB信号通路激活[26-27]。A20调节TRAF6需要TAX1BP1[28]。以上提示A20在TAX1BP1抑制NF-κB信号通路激活中发挥重要作用。A20具有泛素连接酶和去泛素化酶的双重泛素编辑酶作用,从而阻断各种炎症介质对IKK的激活,使NF-κB处于封闭状态[29-30]。
本课题组前期已经证实,电针通过上调局灶性脑缺血再灌注后A20的表达,抑制IKK的磷酸化,抑制NF-κB信号通路的激活,从而发挥减轻局灶性脑缺血再灌注后炎性损伤和促进大鼠神经功能恢复的作用[11]。而TAX1BP1能够招募、结合A20,减少IKK的磷酸化,有效抑制NF-κB信号通路的激活;当TAX1BP1沉默后,A20不能发挥其抗炎作用[7]。更有研究表明,TAX1BP1基因敲除的小鼠发生年龄依赖性的心瓣炎、皮炎,对低剂量的TNF-α、IL-1β高度敏感[31]。由此本研究在前期工作的基础上,继续探讨电针治疗局灶性脑缺血再灌注炎性损伤的作用靶点,探讨TAX1BP1在电针治疗局灶性脑缺血再灌注中的作用。
目前国内外未见TAX1BP1在动物实验机制方面的报道,所以本研究采用多个时间点(6~72 h)探讨TAX1BP1在局灶性脑缺血再灌注早期时间表达规律,结果显示,局灶性脑缺血再灌注后,内源性保护机制一定程度地提高TAX1BP1,而电针能进一步上调TAX1BP1的表达,并持续至再灌注后72 h,提示电针可能通过上调TAX1BP1的表达发挥脑保护作用。前期课题组研究发现,电针能够上调A20的表达,抑制局灶性脑缺血再灌注后NF-κB p65介导的炎性损伤,且在再灌注24 h时,电针上调A20表达,抑制NF-κB p65核转位的作用尤为明显[10-11]。本研究结果亦显示,电针上调TAX1BP1的表达在24 h时达到高峰,提示在再灌注24 h时,电针通过上调TAX1BP1的表达,招募、结合A20发挥抑制NF-κB信号通路激活的作用最为显著,故本研究再次选取再灌注24 h为观察时间点,定位观察各实验组大鼠缺血区大脑皮质中TAX1BP1、A20、胞核NF-κB p65的表达情况以及TAX1BP1与A20的共标情况。免疫荧光检测显示,TAX1BP1主要表达在胞浆中,电针干预后TAX1BP1仍主要表达在胞浆中,但是电针能够上调TAX1BP1阳性细胞数,再次提示电针可能通过上调TAX1BP1的表达,减轻局灶性脑缺血再灌注损伤。本研究通过Western blotting和免疫组化再次证实电针能够上调A20的表达,抑制NF-κB p65的核转位,且免疫荧光共标显示,电针干预后TAX1BP1与A20共同表达在胞浆中,提示电针通过上调TAX1BP1的表达,招募、结合A20发挥抗NF-κB p65介导的炎性损伤作用。由于实验条件所限,未应用免疫共沉淀的方法检测电针对TAX1BP1与A20结合量的影响。
综上所述,电针抑制NF-κB信号通路的激活,发挥脑保护作用,其机制可能通过上调TAX1BP1蛋白的表达,招募、结合A20,从而抑制NF-κB信号通路的激活,减轻局灶性脑缺血再灌注后的炎性损伤,促进大鼠的神经功能恢复。本研究首次在局灶性脑缺血再灌注损伤中研究TAX1BP1的可能作用机制。进一步研究TAX1BP1的抗炎性损伤作用,将为电针治疗提供新的理论依据。
[1]贾建平,陈生弟.神经病学[M].7版.北京:人民卫生出版社,2013:170.
[2]Abou-Chebl A.Management of acute ischemic stroke[J].Curr Cardiol Rep,2013,15(4):348.
[3]Liu L,Wang D,Wong KS,et al.Stroke and stroke care in China:huge burden,significant workload,and a national priority[J].Stroke,2011,42(12):3651-3654.
[4]Petrovic-Djergovic D,Goonewardena SN,Pinsky DJ.Inflam-matory disequilibrium in stroke[J].Circ Res,2016,119(1):142-158.
[5]Shih RH,Wang CY,Yang CM.NF-kappaB signaling pathways in neurological inflammation:a mini review[J].Front Mol Neurosci,2015,8:77.
[6]Chin KT,Chun AC,Ching YP,et al.Human T-cell leukemia virus oncoprotein tax represses nuclear receptor-dependent transcription by targeting coactivator TAX1BP1[J].Cancer Res,2007,67(3):1072-1081.
[7]Shembade N,Harhaj NS,Liebl DJ,et al.Essential role for TAX1BP1 in the termination of TNF-alpha-,IL-1-and LPS-mediated NF-kappaB and JNK signaling[J].EMBO J,2007,26(17):3910-3922.
[8]Lim SM,Yoo J,Lee E,et al.Acupuncture for spasticity after stroke:a systematic review and meta-analysis of randomized controlled trials[J].Evid Based Complement Alternat Med,2015,2015:870398.
[9]秦文熠,罗勇,余超.电针对局灶性脑缺血再灌注大鼠海马内白介素-1β及转录核因子κB抑制蛋白激酶的影响[J].针刺研究,2013,38(4):271-276.
[10]Qin WY,Luo Y,Chen L,et al.Electroacupuncture could regulate the NF-κB signaling pathway to ameliorate the inflammatory injury in focal cerebral ischemia/reperfusion model rats[J].Evid Based ComplementAlternat Med,2013,2013:924541.
[11]Zhan J,Qin W,Zhang Y,et al.Upregulation of neuronal zinc finger protein A20 expression is required for electroacupuncture to attenuate the cerebral inflammatory injury mediated by the nuclear factor-kB signaling pathway in cerebral ischemia/reperfusion rats[J].J Neuroinflammation,2016,13(1):258.
[12]华兴邦,周浩良.大鼠穴位图谱的研制[J].实验动物与动物实验,1991(1):1-5.
[13]Longa EZ,Weinstein PR,Carlson S,et al.Reversible middle cerebral artery occlusion without craniectomy in rats[J].Stroke,1989,20(1):84-91.
[14]Writing Group Members.Mozaffarian D,Benjamin EJ,Go AS,et al.Executive summary:heart disease and stroke statistics-2016 update:a report from the American Heart Association[J].Circulation,2016,133(4):447-454.
[15]Vidale S,Consoli A,Arnaboldi M,et al.Postischemic inflammation in acute stroke[J].J Clin Neurol,2017,13(1):1-9.
[16]Carden DL,Granger DN.Pathophysiology of ischaemia-reperfusion injury[J].J Pathol,2000,190(3):255-266.
[17]Mezzasoma L,Antognelli C,Talesa VN.A novel role for brain natriuretic peptide:Inhibition of IL-1β secretion via downregulation of NF-κB/Erk 1/2 and NALP3/ASC/caspase-1 activation in human THP-1 monocyte[J].Mediators Inflamm,2017,2017:5858315.
[18]Verma IM,Stevenson JK,Schwarz EM,et al.Rel/NF-kappa B/I kappa B family:intimate tales of association and dissociation[J].Genes Dev,1995,9(22):2723-2735.
[19]Baeuerle PA,Baltimore D.NF-kappa B:ten years after[J].Cell,1996,87(1):13-20.
[20]Miyamoto S.Nuclear initiated NF-κB signaling:NEMO and ATM take center stage[J].Cell Res,2011,21(1):116-130.
[21]Lan L,Tao J,Chen A,et al.Electroacupuncture exerts anti-inflammatory effects in cerebral ischemia-reperfusion injured rats via suppression of the TLR4/NF-κB pathway[J].Int J Mol Med,2013,31(1):75-80.
[22]Liu W,Wang X,Zheng Y,et al.Electroacupuncture inhibits inflammatory injury by targeting the miR-9-mediated NF-κB signaling pathway following ischemic stroke[J].Mol Med Rep,2016,13(2):1618-1626.
[23]Boxus M,Twizere JC,Legros S,et al.The HTLV-1 Tax interactome[J].Retrovirology,2008,5:76.
[24]Iha H,Kasai T,Kibler KV,et al.Pleiotropic effects of HTLV type 1 Tax protein on cellular metabolism:mitotic checkpoint abrogation and NF-kappaB activation[J].AIDS Res Hum Retroviruses,2000,16(16):1633-1638.
[25]Journo C,Filipe J,About F,et al.NRP/Optineurin Cooperates with TAX1BP1 to potentiate the activation of NF-kappaB by human T-lymphotropic virus type 1 tax protein[J].PLoS Pathog,2009,5(7):e1000521.
[26]Chen ZJ.Ubiquitination in signaling to and activation of IKK[J].Immunol Rev,2012,246(1):95-106.
[27]Morriswood B,Ryzhakov G,Puri C,et al.T6BP and NDP52 are myosin VI binding partners with potential roles in cytokine signalling and cell adhesion[J].J Cell Sci,2007,120(Pt 15):2574-2585.
[28]Bannon A,Zhang SD,Schock BC,et al.Cystic fibrosis from laboratory to bedside:the role of A20 in NF-κB-mediated inflammation[J].Med Princ Pract,2015,24(4):301-310.
[29]Wertz IE,O'Rourke KM,Zhou H,et al.De-ubiquitination and ubiquitin ligase domains of A20 downregulate NF-kappaB signaling[J].Nature,2004,430(7000):694-699.
[30]Skaug B,Chen J,Du F,et al.Direct,noncatalytic mechanism of IKK inhibition byA20[J].Mol Cell,2011,44(4):559-571.
[31]Iha H,Peloponese JM,Verstrepen L,et al.Inflammatory cardiac valvulitis in TAX1BP1-deficient mice through selective NF-kappaB activation[J].EMBO J,2008,27(4):629-641.
Effect of Electroacupuncture at Baihui and Siguan on Expression of Tax1-binding Protein 1 in Cerebral Cortex in Focal Cerebral Ischemia-Reperfusion Rats
MA Hong-mei1a,2,JIANG Jin1a,2,ZHAN Jian1a,2,LI Qiong-li1a,2,ZHANG Ying1a,2,QIN Wen-yi1b,LUO Yong1a,2
1.a.Department of Neurology,b.Department of Integrated Chinese and Western Medicine,the FirstAffiliated Hospital of Chonqing Medical University,Chongqing 400016,China;2.Chongqing Key laboratory of Neurology,Chongqing 400016,China
ObjectiveTo observe the effect of electroacupuncture(EA)at Baihui(GV20)and Siguan(Hegu/LI4 and Taichong/LR3)of affected side on expression of Tax1-binding protein 1(TAX1BP1)in cerebral cortex in focal cerebral ischemia-reperfusion rats,so as to investigate its protective mechanism in inhibiting nuclear factor kappa B(NF-κB)signaling pathway and promoting neurobehavioral recovery.MethodsA total of 105 Sprague-Dawley rats were randomly assigned into sham group,model group and EA group.Each group was randomly assigned into reperfusion six hours,twelve hours,24 hours,48 hours,72 hours groups after two hours of ischemia.The model was established by right middle cerebral artery occlusion and reperfusion.EA group
electroacupuncture at Baihui and left Siguan(Hegu and Taichong)acupoints.Neurobehavioral evaluation,TAX1BP1 protein expression,TAX1BP1 positive cell count,zink finger protein A20 expression,and nuclear NF-κB p65 protein expression were tested in each group.ResultsThere was no neurological deficit in the sham group.Compared with the model group,the neurological scores at 48 hours,72 hours after reperfusion decreased in EA group(P<0.05).Compared with the control group,the TAX1BP1 expression at twelve hours,24 hours and 48 hours after reperfusion increased in the model group(P<0.05),and further increased at twelve hours,24 hours,48 hours and 72 hours after reperfusion in EA group(P<0.05),and peakedat 24 hours after reperfusion.Compared with the sham group,the expression of A20 and NF-κB p65,and the number of TAX1BP1 positive cells increased in the model group(P<0.05),and the expression of A20 and the number of TAX1BP1 positive cells further increased,(P<0.05)and the expression of NF-κB p65 decreased in EA group(P<0.05)at 24 hours after reperfusion.Immunofluorescence labeling indicated that TAX1BP1 protein primarily expressed in the cytoplasm,TAX1BP1 protein and A20 protein co-expressed in the cytoplasm.Immunohistochemistry showed indicated that NF-κB p65 mainly expressed in the nucleus in the model groupr,and mainly expressed in the cytoplasm in the EA group.ConclusionElectroacupuncture could significantly inhibit neuronal NF-κB signaling pathway and promote neurobehavioral recovery in focal cerebral ischemia-reperfusion,which may related with up-regulating TAX1BP1 protein expression.
LUO Yong.E-mail:luoyong1998@163.com
cerebral ischemia-reperfusion;electroacupuncture;Tax1-binding protein 1;zink finger protein A20;nuclear factor kappa B p65;rats
R743.3
A
1006-9771(2017)12-1372-08
[本文著录格式]马宏梅,蒋锦,詹剑,等.电针百会、四关穴对大鼠局灶性脑缺血再灌注大鼠大脑皮质中Tax1结合蛋白1表达的影响[J].中国康复理论与实践,2017,23(12):1372-1379.
CITED AS:Ma HM,Jiang J,Zhan J,et al.Effect of electroacupuncture at Baihui and Siguan on expression of tax1-binding protein 1 in cerebral cortex in focal cerebral ischemia-reperfusion rats[J].Zhongguo Kangfu Lilun Yu Shijian,2017,23(12):1372-1379.
1.国家自然科学基金项目(No.30470606;No.81403243);2.重庆市渝中区科技计划项目(No.20160102);3.重庆市卫生局中医药科技项目(No.2012-2-128)。
1.重庆医科大学附属第一医院,a.神经内科,b.中西医结合科,重庆市400016;2.重庆市神经病学重点实验室,重庆市400016。作者简介:马宏梅(1990-),女,布依族,贵州龙里县人,硕士研究生,主要研究方向:针刺治疗脑血管病的保护机制。通讯作者:罗勇(1965-),男,汉族,重庆市人,博士,博士生导师,研究员,主要研究方向:脑血管病的损伤及保护机制。E-mail:luoyong1998@163.com。
10.3969/j.issn.1006-9771.2017.12.002
2017-07-18
2017-11-08)

