生态系统基于性状调节的物种间接作用:特征、成因及后果
朱 玉,王德利,*,钟志伟
1 东北师范大学环境学院,草地科学研究所,长春 130117 2 植被生态科学教育部重点实验室,吉林省生态恢复与生态系统管理重点实验室,长春 130024
生态系统基于性状调节的物种间接作用:特征、成因及后果
朱 玉1,2,王德利1,2,*,钟志伟1,2
1 东北师范大学环境学院,草地科学研究所,长春 130117 2 植被生态科学教育部重点实验室,吉林省生态恢复与生态系统管理重点实验室,长春 130024
物种之间的间接作用关系是维持生物群落结构以及生态系统功能的关键因素。目前的理论模型和实验性研究均认为,物种间接作用的传递主要是由物种的密度变化所引起。但大量的实验证据表明,生物个体在形态、生理、行为和生活史性状的适应性变化,是物种间形成间接互作关系的另一个重要机制。生态学家把这种基于物种性状调控的种间关系称为性状调节的间接作用。深入了解性状调节的间接作用类型,发生机制和作用途径,有助于阐释自然界中多物种种间关系的复杂性和多样性形成机制。对性状调节的概念和性状的分类进行系统的总结,指出性状可塑性和物种特异性是物种间性状调节关系形成的两个重要机制。与其他类型的种间互作一样,性状调节的种间作用是驱动物种进化的重要力量。此外,分析了性状调节在自然群落中传递的几个重要途径,并强调这些间接作用在影响和调节生态系统功能和过程中的重要作用。最后,就性状调节种间关系的研究对象、研究尺度、以及研究方法等问题提出若干建议,为今后对这一问题的研究提供相关参考。
性状调节;间接作用;可塑性;适应;种间关系
物种间接作用是指一个物种通过另一个物种(介导物种)而对第三个物种产生的影响[1]。间接作用可以发生在相同营养级的物种间,如竞争和互惠;也存在于不同营养级的物种间,如级联效应(cascading effect)。与物种间的直接作用相比,间接作用通常更为复杂而隐蔽,并容易受到物种特异性,时空异质性以及环境状况等因素的影响[2]。越来越多的理论与实验性研究表明,间接作用不但是生态系统复杂性的重要来源,还是影响物种分布格局、群落结构以及生态系统功能的重要因素[3- 5]。
早期的研究认为,间接作用主要是由介导物种数量的变化所调节的[6- 8],并将这种作用方式称为密度调节的间接作用[9-10]。经典的Lotka-Volterra种间竞争模型及其衍生模型便基于这个背景产生。自然系统中一些常见的种间关系,如资源利用竞争、似然竞争、关键种捕食者效应与营养级联效应等,也都被认为是由密度调节的间接作用[11]。在森林生态系统中,狼对鹿的捕食降低了鹿的种群数量,从而间接减轻了植物被后者的采食压力。这是密度调节的间接作用(营养级联效应)的一个典型案例(图1)。
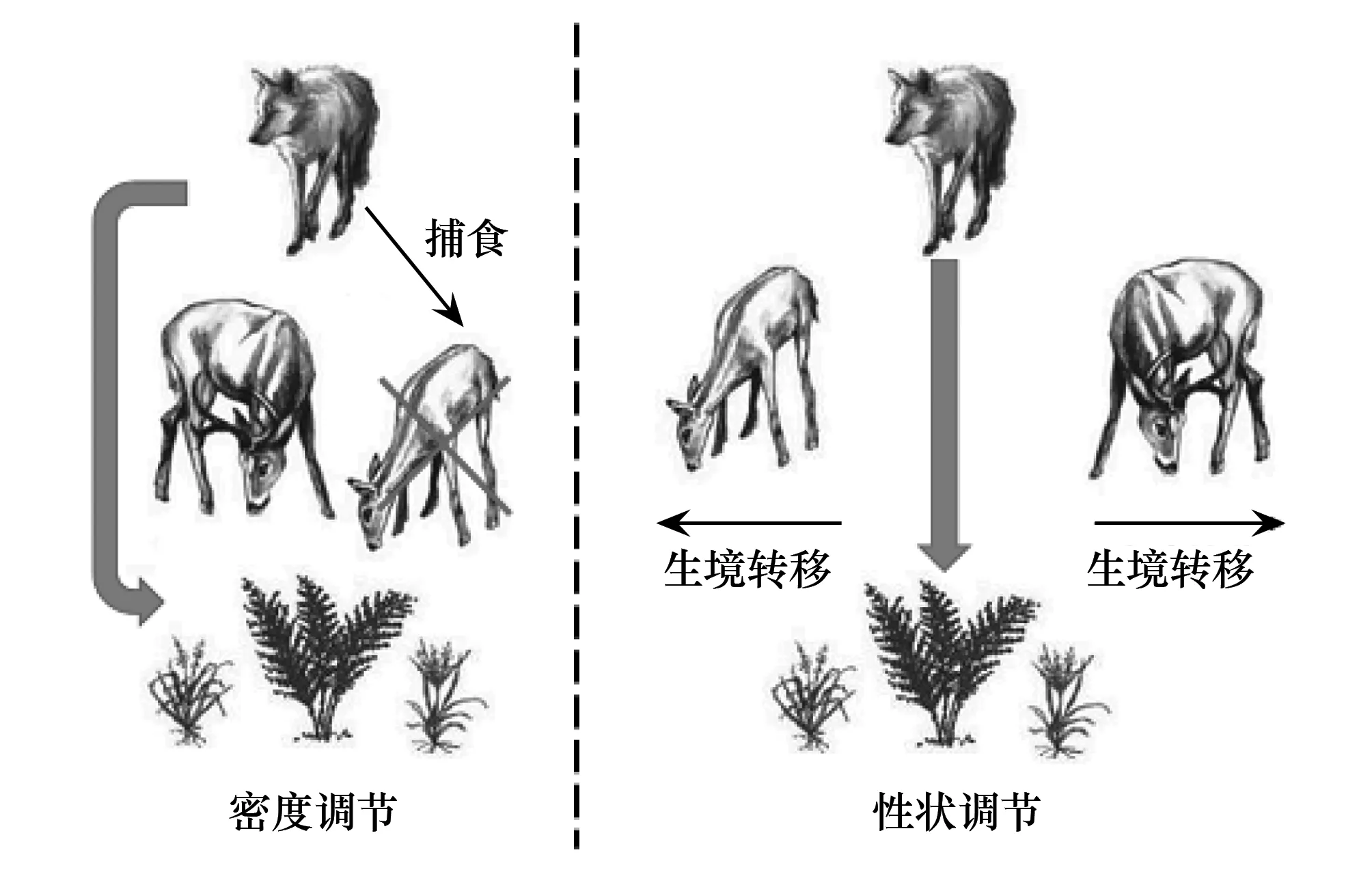
图1 密度调节和性状调节的间接关系的比较 Fig.1 Comparison between density-mediated and trait-mediated indirect effects
基于密度调节的间接作用的研究,极大地促进了研究者对群落中物种相互作用关系的认识[8, 11-12]。然而,越来越多的证据表明,基于密度调节的种间互作研究并不足以完整地刻画自然界中物种间复杂的间接相互作用[13- 15]。随着研究的深入,人们逐渐认识到,在物种互作过程中,即使介导物种的密度没有发生变化,但其个体性状的变化,也可以导致物种间产生显著的间接互作关系[16- 18]。生态学家将这种间接作用方式称为性状调节的间接作用[9-10]。性状调节的间接作用在自然界普遍存在,其在维持群落结构和生态系统功能方面的重要性,可以等同甚至超过密度调节的间接作用[19-20]。在上面的例子中,狼一方面可以通过捕食降低鹿的种群大小而减轻后者对植被的采食压力;同时,狼的捕食威胁也会迫使鹿转移生境,即导致其个体行为方式的改变,从而间接调节鹿对生境中植被的影响(图1)。
当前,性状调节间接关系的在自然系统中的普遍性和重要性已经得到生态学研究者的公认,相关研究在国外也已在不同生态系统中广泛开展[21- 24],但国内对该领域的关注尚少。本文将结合近年来有关性状调节在种间关系的研究,阐述性状调节的概念与分类,系统总结性状调节关系的发生机制及其传递途径。最后,本文对性状调节关系对生态系统功能的影响以及该领域未来的研究方向给以展望。
1 性状调节的概念与性状分类
1.1 性状调节概念
在物种间性状调节的关系中,物种的“性状”通常是指个体能够被直接观察或检测出的一系列属性,如:形态,结构,功能和生存对策等[3]。性状的形成是生物在长期进化历史中适应环境的结果。每个生物体可以抽象成众多性状组成的集合体,而每个性状的集合都是独一无二的,这与Hutchinson提出的“n-维生态位”的概念相类似。物种的性状可以强烈影响物种相互作用的方向和强度。例如,捕食者对猎物的作用既取决捕食者的性状(捕食者的体尺、捕猎速度、搜索效率),又取决猎物的性状(猎物的体尺、逃脱速度、防御策略)。物种的相互作用又会通过性状的改变,间接影响到与之关联的其他物种,即形成性状调节的间接作用。
Peacor和Werner较早地阐释了基于性状调节的间接作用,并将之定义为:一个物种(或种群)因其他物种的存在而改变自身的表型性状,这个产生变化的物种(或种群)中的每一个个体又会影响到和其他物种的互作关系[10]。人们最初在捕食者-猎物系统中发现性状调节的作用,即捕食者可以对猎物的行为产生影响,据此将性状调节称为行为介导的间接作用[10]。其后,性状调节的现象在植物-植食者系统研究中被广泛关注,即非行为介导的性状调节作用[2]。一般认为,植食者对植物的非致死作用以及植物较强的表型可塑性使得性状调节可以在该系统中普遍存在[25]。Ohgushi将引起植物性状变化的植食者称为发起者,将性状发生变化的植物称为传递者,将受到性状变化影响的另一个植食者称为接受者。他认为性状调节的间接作用指的是,发起者引起传递者一系列性状产生变化,传递者性状的改变进一步对接受者产生影响[2]。
物种间的性状调节具有两个鲜明特点:第一,性状调节关系是物种在长期进化过程中逐渐形成的共存方式,它体现了一个物种对特定生物胁迫(如竞争和捕食)的适应;第二,性状调节关系通常体现出依赖物种的特异性,在每对相互作用的物种中,其性状调节的方式、方向、和强度均随着物种属性的差异而不同。性状调节的种间关系是对传统物种共存理论的重要补充和拓展[10, 26]。事实上,物种的性状变化不仅存在于生物个体之间,也需要从物种或种群的遗传基础上分析,因为个体的表型性状是由遗传基因的表达和环境共同作用决定的。迄今,对性状调节现象的野外观察与实验都表明,性状调节的间接作用涉及从基因、个体、种群、群落,到生态系统的多个层次或水平[2, 27-28],这一问题已经成为生态学研究的各个领域的交点。
1.2 性状的分类
生物物种的性状,基于现有的研究认识通常分为几个类型:行为型、生理型、形态型,以及生活史型[3, 10]。
行为性状 行为性状又可分为采食和生境选择。处于食物链中间的物种在捕食风险和能量摄入两方面存在权衡(如面对捕食者时,要花费更多的时间躲避而减少进食量),因此其采食行为受到上下营养级物种关系的操控。在一项蜘蛛-蝗虫-植物关系的实验中,蜘蛛的口器被研究者用胶水封住,此时蜘蛛不能通过捕食蝗虫而降低蝗虫数量;但蜘蛛的存在可以使蝗虫的采食活动明显减少,因此对植物产生显著的影响[29]。还有研究发现,拟寄生蜂的幼虫可以通过刺激其宿主对植物的采食率而间接抑制植物种子产量[30]。生境选择是另一个易于被观察的行为性状。Schmitz等(2004)认为,在营养级联效应中50%的性状调节涉及到中间营养级物种生境选择的变化。生境利用的转变会对转移后生境中的物种产生不利影响[19]。Ripple等在美国的黄石公园中对杨树(Populusspp.)种群更新情况的调查发现,狼从公园中被去除后,麋鹿(Cervuselaphus)对生境的利用逐渐转移至河谷,麋鹿对河谷内杨树的采食使得该地区杨树的生长几乎停止[31-32]。
生理性状 生理性状的研究多集中在植物上,尤其是植物的诱导性防御反应[33-34],即植物在被采食后才产生或激活防御物质[35]。其实对于植物,诱导性防御仅是众多生理性状的一类。Ohgushi将植食者可改变的植物生理性状分为次级代谢物抵抗性或易感性、营养质量的提高或降低,以及补偿生长[3],并且认为它们之间可存在内在联系。例如,植物补偿生长往往伴随植物营养含量提高[36]。无论是大型哺乳动物,小型昆虫,还是植物病原体都可以通过对植物的生理性状的改变影响其他植食者,进而对其他营养级物种产生影响[37- 39]。
形态性状 形态性状常随生物生理性状同时改变。例如,蛀茎蛾(Archanarageminipuncta)对芦苇(Phragmitesaustralis)的损伤可以引发芦苇侧枝的补偿生长,增加芦苇叶片的氮含量和水分含量,有利于随后采食的昆虫以及更高营养级的捕食者[40]。植食者也常会影响植物的构型。例如,植物被动物采食后可以快速抽穗或分枝,以补偿营养和生殖部分损失的生物量。有研究表明,春天黑尾鹿和驼鹿的采食可以增加吉利花(Ipomopsisarizonica)的花序,从而增加以吉利花果实为食的夜蛾幼虫的数量[41]。在日本东部的森林生态系统,麋鹿的采食降低了树木枝条的复杂度,导致织网型蜘蛛无法找到足够的支撑物织网捕食而数量减少[42]。也有少数研究报道了动物形态性状的改变[43]。例如,植物可以改变蚜虫的体尺而影响初级拟寄生者的体尺,较小的初级拟寄生者可使次级拟寄生者转移目标,寻找更大的猎物[44]。
此外,草食动物的生态工程师作用可以为其他动物提供一系列新的栖息地或庇护所[45]。这种作用不是植物自身对植食者的直接响应,而是通过草食动物对植物结构的改变而影响植物的性状[2],进而对物种多样性和生物群落产生深远的影响[46]。
生活史性状 生活史性状调节的研究实例并不多,目前重点关注自身具有复杂生活周期的物种。例如,蚜虫会在生活史的不同阶段产生有翅型和无翅型两种,这是蚜虫在扩散和生长间权衡的表现。蚜虫的这种生活史性状既会随环境条件,也会在面对不同捕食压力下发生变化。对宿主-拟寄生者系统的研究中发现,存在专性拟寄生者时,蚜虫会从无翅型转变为有翅型,有翅型蚜虫的迁移会使当地种群数量下降;并且,蚜虫提高迁飞能力的同时其繁殖力也会下降,从而有利于当地的植物[47]。
2 物种间性状调节的发生机制
物种的性状可塑性(trait plasticity)和物种的特异性是性状调节种间关系形成重要机制;而性状调节关系的形成,可对互作物种的进化轨迹产生深远影响。
性状可塑性被认为是性状调节关系中最重要的内在机制[10, 48]。它不仅与物种自身的遗传结构有关,还与物种的发育分化以及环境的时空异质性有关[49];同时,在不同的环境条件以及生物个体的不同成长阶段,性状的变化也依赖于个体的生存对策。这意味着物种的某个性状的提高可以导致其他某个性状的降低(如采食和防御之间,生长和繁殖之间),生物个体性状间的权衡也是形成种间互作关系的重要方面[10, 12]。
物种的可塑性可分为行为可塑性和发育可塑性[9]。但两者的作用范围和发生尺度有明显差异。一般,行为可塑性在捕食者-猎物系统中较为普遍,反映的是物种性状的瞬时变化,如猎物出于对捕食者的恐惧会立即在取食和生境选择等行为上做出改变;而发育可塑性在植物-植食动物系统中较为常见,是指个体在一段时期内对自身内稳态的快速调整,涉及生理和形态等方面。Denno等发现,一种叶蝉(Prokelisiadolus)采食后的芦苇,其营养质量会显著降低,导致随后采食同株芦苇的另一种叶蝉(P.marginata)生产性能下降[50]。Denno和Kaplan的研究表明,植物的发育可塑性深刻影响植食性昆虫间的竞争关系,这种竞争结果通常体现不对称性[51]。除了植物,动物也具有发育可塑性。Raimondi等发现,一种肉食的海螺(Acanthinaangelica)对藤壶(Chthamalusanisopoma)的捕食可以引发藤壶形态从易于被捕食的圆锥形转变为不易被捕食的弯曲形,进而影响和它竞争同一空间的藻类(Ralfsiasp.)的分布[52]。在同一系统中,行为可塑性和发育可塑性常同时发挥作用。例如,Hawlena和Schmitz发现一种黑蝗属蝗虫(Melanoplusfemurrubrum)面对猎蛛(Pisuarinamira)时,不仅会产生行为的改变(转移生境避免被捕食),其新陈代谢率也会显著提高[53]。
物种特异性是性状调节关系的另一个重要机制。不同介导物种的性状对同一干扰的响应存在很大差异。例如,面对动物的采食,植物会采取不同的防御策略,性状会产生不同变化:有些植物会利用自身形态结构进行机械式的物理防御[54],有些则利用自身存在的或经诱导合成的代谢产物进行化学防御[35],还有些会通过加快光合速率,增加分蘖分枝而补偿伤害[36]。不同物种对介导物种性状的响应存在差异,其相互作用的结果会截然不同。例如,植食者采食引起植物次生代谢物的增加,对昆虫来说通常是不利的,但有时这却可成为某些昆虫抵御天敌的生化武器。有研究发现,一些专食性叶甲(Chrysomelaconfluens,Phyllotretaatra,P.undulata)喜欢采食富集次级代谢物的叶片,这一行为使其在抵御捕食者的攻击时获利[55-56]。一般认为,植物的营养含量升高对昆虫的影响是有利的。但Cease等研究中发现,在内蒙古草原,重度放牧可降低植物氮含量,但促进亚洲小车蝗(Oedaleusasiaticus)种群数量的爆发,控制实验进一步表明,增加草地氮含量,可显著降低该种蝗虫的生产性能[57]。本研究团队在东北松嫩平原的实验显示,牛的适度采食会导致羊草(Leymuschinensis)营养含量增加(氮含量增加,碳氮比降低),这对本地的主要采食羊草的素色异爪蝗(Euchorthippusunicolor)产生了负面影响,不仅降低了蝗虫的生产性能,也抑制了蝗虫种群的密度。因此性状调节的种间作用既取决于影响性状的变化又取决于响应性状的反馈。
性状调节的种间关系可在影响性状和响应性状之间进行不断反馈,从而在较长的时间尺度上对互作物种的进化轨迹产生深刻影响。Craig等研究发现,黑头山雀的存在迫使造瘿蝇类进化出直径较小的虫瘿,使得产卵在虫瘿上的拟寄生蜂进化出更短的产卵器;而当黑头山雀缺失时,拟寄生蜂的产卵器和虫瘿直径存在正反馈,拟寄生蜂进化出更长的产卵器[58]。目前关于进化的间接关系的研究还十分有限,因为物种的进化特征都是经过若干年的适应而产生的遗传结构不可逆变化的结果,其过程一般都十分漫长,短期的控制实验难以进行检验[48]。尽管如此,生态学家们对各物种以进化形式表现的互作关系仍展示出极大的兴趣,通过对自然进化过程中物种行为和生理的适应性研究,以期更好地理解种间共存机制和群落进化进程。
3 性状调节在自然群落中的传递路径

图2 几种性状调节的间接关系的传递路径(仿自Werner and Peacor[10])Fig.2 Several kinds of transfer paths of trait-mediated indirect effects (Simulated from Werner and Peacor[10])
相对于仅描述营养级关系的传统食物网模型,物种性状调节的种间相互作用可以把自然群落中同一营养级和不同营养级中的物种“粘合”在一起,形成复杂的物种互作网络[2]。性状调节关系在物种互作网络中的传递途径复杂而多样,一些生态学家对其传播路径做出总结[3, 10]。图2为几种常见的性状调节间接作用的传递路径。按照物种的数量和互作的方式,性状调节关系可以分为:级联效应(图2a, b, c)、资源利用竞争(图2d)和似然竞争(图2e)、非营养的三物种互作关系(图2f, g, h),以及多物种互作关系(图2i, j, k, l)。图中实心圆表示性状发生变化的物种。实线箭头指向能量传递的方向,而弧形的虚线表示物种之间的性状调节(箭头从引起性状改变的物种指向性状产生响应的物种)。
3.1 级联效应
在性状调节关系的研究中,营养级联效应是目前研究最多、也是分布最广泛的物种间接关系[5, 10, 19]。级联效应一般涉及3个营养级内的3个物种:顶层物种采食中间物种,中间物种采食底层物种,因此处于中间物种的性状即可能受到来自顶层,也可能受到来自底层物种的影响,这就分别构成了营养级联的下行效应(图2a)或上行效应(图2b)。在级联效应中,同时也存在物种的跨级影响(底层物种直接影响上层物种),诸如,植物可以影响捕食者的采食行为,进而影响草食者(图2c)。Holt等发现,狮子在植物繁茂的条件下,对野牛的捕食效率更高,导致野牛种群数量下降,从而形成一个性状调节的正反馈环[59]。
3.2 资源利用竞争和似然竞争
资源利用竞争和似然竞争都涉及到2个营养级的3个物种。对于资源利用竞争,其性状调节间接作用的结果很难预测,既与互作物种的特异性又与互作物种所处的环境条件相关(图2d)。在植物-植食者系统中,植食者对植物的采食会改变植物的性状(改变其营养含量或防御物质),然后对共享该植物的其他植食者产生正向或负向影响[46]。在捕食者-猎物系统中,有研究发现当叶片上和地面上捕食者都存在时,它们对蚜虫(Acyrthosiphonpisum)的捕食率会产生累加效应。叶片上的捕食者会使蚜虫掉落到地面,增加地面捕食者的捕食率[60];也有研究发现当几种非致命(被关在笼子里而不能进行捕食)的水虿(Anaxjunius和A.longipes)出现时,青铜蛙(Ranaclamitans)的蝌蚪的活动性减弱,导致另一种水虿(Tramealacerata)的捕食率下降[61]。对于似然竞争中的性状调节关系,报道相对较少(图2e)。但Harmon等发现,瓢虫(Coleomegillamaculata)既可以采食蒲公英花蜜又可以采食在蒲公英上活动的豌豆蚜虫,瓢虫在蒲公英上驻留的时间越长,对蚜虫的捕食率就越大[62]。
3.3 非营养的三物种互作关系
非营养联系的种间作用开始受到越来越多的关注,常常以干扰竞争的形式体现,诸如植物间的化感作用与动物的保护领域行为。性状调节的干扰竞争是指一个猎物可以影响另一个猎物的性状,进而影响它们的捕食者(图2f);或者两个猎物之间彼此干扰,进而影响它们共享的资源(图2g)。具体表现为一种竞争优势者可以将另一种竞争者驱逐出庇护地,从而增加捕食者对后者的捕食或减少后者对资源的消耗[63-64]。在美国密歇根的一个溪流生态系统中,研究者发现,蓝镖鲈(Etheostomacaeruleum)的存在降低了淡水鳌虾(Orconectespropinquus)对底栖的大型无脊椎动物的捕食[65]。另外捕食者对一种猎物的影响,会影响该猎物和其他竞争者的关系,猎物之间的竞争关系也是一种非营养级链接[52, 61](图2h)。
3.4 多物种互作关系
线性的级联效应是最常见的多物种关系(图2i)。例如,成年鲈鱼的去除可使种群内幼年鲈鱼的数量剧增,迫使体型更小的鲦鱼转移到更浅的水域,使原生境内的浮游动物免于被捕食,从而降低了原生境的藻类数量[66]。线性的级联效应中也可存在非营养关系,在植物-共生菌关系中有相关报道(图2j)。植物共生菌和植物并无直接的营养关系,植物共生菌可提高植物的质量进而有利于植食昆虫及它们的捕食者。
四物种组成的菱形关系网也很常见,包括一个捕食者,两个植食者和资源(图2k)。具体表现为当两个植食者面对捕食者时,两者的性状响应不同,其竞争关系也会发生改变,竞争优胜者可以占据更多的资源。在内盖夫沙漠,研究者利用训练好的仓鸮对两种沙鼠(Gerbillusallenbyi和G.pyramidum)产生可控的捕食威胁。仓鸮的出现会明显改变后者的行为性状进而改变它们对资源的影响[67]。在淡水生态系统中,水虿(Anaxjunius)的出现改变美国牛蛙(Ranacatesbeiana)蝌蚪和青铜蛙(Ranaclamitans)蝌蚪的竞争关系[61]。如果在这个4物种组成的关系网中,再加入一个顶级捕食者,形成5个物种组成的间接关系网,则物种间的关系会变得更加复杂(图2l)。猎物对来自2个不同营养级的捕食者的响应会进一步影响彼此间的竞争关系[10]。
4 性状调节与生态系统功能
物种的性状既是构建种间关系和群落结构的基础,又可以通过食物网的能量流动和物质循环对维持生态系统功能产生重要影响[68-69]。据统计,对于陆地植物来说,仅有10%的生物量被草食动物直接采食,剩余90%的植物虽然没被采食,但它们的功能性状都能受到草食动物的调节,并间接地对植物群落的结构和生态系统功能产生影响[70-71]。草食动物可改变植物的众多性状,如采食或践踏引起的植物功能群、植物枯落物质量、植物根系分泌物和植物营养重吸收等发生改变[72- 77]。同时,植物性状(质量)的改变常伴随植物密度(数量)的变化一起作用于生态系统功能[78- 81]。
植物性状调节的动物-植物关系极大的影响了植物群落的演替和外来物种的入侵。一种本地的植食者可以和外来入侵的红藻(red alga)形成兼性互利关系,进而增大对其他本地水藻的采食,而增加了外来红藻的入侵机会[82]。植物性状调节的动物-植物关系也可影响植物多样性和生产力,同时对养分循环产生影响[72, 78]。Schmitz研究发现,捕食者蜘蛛不同的捕猎模式对植食者蝗虫的行为会产生不同的影响,进一步作用于草地生态系统功能。主动出击型的蜘蛛最终可以降低植物物种多样性,提高地上净初级生产力和氮矿化速率;而埋伏型的蜘蛛有相反的作用[5]。在地下的碎屑食物网中,当具有关键生态功能的土壤动物的性状发生改变,也会对生态系统造成深远的影响。在青藏高原高寒草甸的研究表明,蚯蚓(Pheretimaaspergillum)在捕食型步甲(Agonumimpress)存在的情况下被迫向下层土壤移动,由此降低下层土壤的容重,增加土壤水分与氮可利用率,最终提高植物地上生物量[83]。在非营养联系的种间作用研究中,物种间性状调节对土壤养分循环,植物多样性和生产力的影响的研究也屡有报道。在珊瑚礁中活动的黄眼雀鲷(Stegastesfasciolatus)会在自己的领地内攻击其他植食性鱼类(如鹦嘴鱼属Scarusspp.和刺尾鱼属Acanthurusspp.),导致领地内水藻的多样性显著增加[84]。一种领地性的社会性昆虫-弓背蚁(Camponotusherculeanus),会攻击领地内的不同体型的粪食性甲虫(Onthophagusyubarinus和O.tabidus),使其数量显著降低,进而降低了牛粪分解速率和土壤中营养的可利用性,最终降低了植物的地上生物量[63]。
5 展望
物种的间接作用是构建生物群落和影响生态系统的关键因素。而对于间接作用的产生机制和传递方式,早期的研究工作多集中在密度调节介导的种间关系。随研究的不断拓展,生态学家开始以进化的角度去思考物种的适应性性状,并且意识到物种性状的可塑性和特异性对于种间关系的传递,生物群落的构建以及生态系统的维持具有重要生态学意义。
有关性状调节的间接关系虽已积累了相当多的理论认识和实验证据,但还存在着很大的局限性。第一,迄今的研究主要关注的是物种的行为和生理性状,关于物种形态、生活史等方面的性状尚缺少足够的研究;第二,性状可塑性的反馈相对物种的密度变化,有较大的时间差异:物种的行为性状可以快速响应,而生理和形态性状的响应则相对漫长,甚至要经过世代选择。如何在恰当的时间尺度内解析物种密度和性状对种间关系的作用有待于深入探讨。第三,现有的研究很少关注性状调节对种群动态和生态系统的长期影响,更多关注性状调节对个体适合度的作用(如生存和生长率等)。
尽管性状调节的间接关系已被广泛承认是由物种表型可塑性引起的功能变异,但关于这些性状变化背后的遗传基础还所知甚少。了解个体的性状的遗传背景,特别是其表型和基因型的关系,必将为解释种间性状调节的机制提供深层次的依据。有关物种性状调节的机理,需要在更复杂的群落中进行深入探索,以期更好地反映自然群落中物种间真实的互作过程。但是,研究的群落越复杂,物种连接的途径越繁多,检验性状调节的作用就越困难。目前种间关系的研究多局限在3个物种,对4个物种及以上的系统还鲜有报道;因此,如何利用现代生态学理论去预测种间关系作用结果以及关系网络拓扑结构显得尤为重要。研究者应多关注理论中函数关系的构建,而不仅限于描述一个实验现象。如果可以从机制的角度量化系统内的种间关系,将有益于了解整个系统的构建和运行,也可以更好地将理论模型与实际生态过程进行有机结合。
[1] Kerfoot W C, Sih A. Predation: Direct and Indirect Impacts on Aquatic Communities. New Hampshire: University Press of New England, 1987.
[2] Ohgushi T. Indirect interaction webs: herbivore-induced effects through trait change in plants. Annual Review of Ecology, Evolution, and Systematics, 2005, 36(1): 81- 105.
[3] Ohgushi T, Schmitz O, Holt R D. Trait-Mediated Indirect Interactions: Ecological and Evolutionary Perspectives. Cambridge: Cambridge University Press, 2012.
[4] Pagès J F, Farina S, Gera A, Arthur R, Romero J, Alcoverro T. Indirect interactions in seagrasses: fish herbivores increase predation risk to sea urchins by modifying plant traits. Functional Ecology, 2012, 26(5): 1015- 1023.
[5] Schmitz O J. Effects of predator hunting mode on grassland ecosystem function. Science, 2008, 319(5865): 952- 954.
[6] Hairston N G, Smith F E, Slobodkin L B. Community structure, population control, and competition. The American Naturalist, 1960, 94(879): 421- 425.
[7] May R, McLean A. Theoretical Ecology: Principles and Applications. 3rd ed. Oxford, UK: Oxford University Press, 2007.
[8] Paine R T. Food web complexity and species diversity. The American Naturalist, 1966, 100(910): 65- 75.
[9] Abrams P A. Implications of dynamically variable traits for identifying, classifying, and measuring direct and indirect effects in ecological communities. The American Naturalist, 1995, 146(1): 112- 134.
[10] Werner E E, Peacor S D. A review of trait-mediated indirect interactions in ecological communities. Ecology, 2003, 84(5): 1083- 1100.
[11] Oksanen L, Fretwell S D, Arruda J, Niemela P. Exploitation ecosystems in gradients of primary productivity. The American Naturalist, 1981, 118(2): 240- 261.
[12] Tilman D. Constraints and tradeoffs: toward a predictive theory of competition and succession. Oikos, 1990, 58(1): 3- 15.
[13] Beckerman A, Petchey O L, Morin P J. Adaptive foragers and community ecology: linking individuals to communities and ecosystems. Functional Ecology, 2010, 24(1): 1- 6.
[14] Pearson D E. Trait- and density-mediated indirect interactions initiated by an exotic invasive plant autogenic ecosystem engineer. The American Naturalist, 2010, 176(4): 394- 403.
[15] Bolker B, Holyoak M, Krivan V, Rowe L, Schmitz O. Connecting theoretical and empirical studies of trait-mediated interactions. Ecology, 2003, 84(5): 1101- 1114.
[16] Lima S L. Predators and the breeding bird: behavioral and reproductive flexibility under the risk of predation. Biological Reviews, 2009, 84(3): 485- 513.
[17] Callaway R M, Pennings S C, Richards C L. Phenotypic plasticity and interactions among plants. Ecology, 2003, 84(5): 1115- 1128.
[18] Creel S, Christianson D. Relationships between direct predation and risk effects. Trends in Ecology & Evolution, 2008, 23(4): 194- 201.
[19] Schmitz O J, Krivan V, Ovadia O. Trophic cascades: the primacy of trait-mediated indirect interactions. Ecology Letters, 2004, 7(2): 153- 163.
[20] Trussell G C, Ewanchuk P J, Matassa C M. Resource identity modifies the influence of predation risk on ecosystem function. Ecology, 2008, 89(10): 2798- 2807.
[21] Ohgushi T, Hambäck P A. Toward a spatial perspective of plant-based indirect interaction webs: Scaling up trait-mediated indirect interactions. Perspectives in Plant Ecology, Evolution and Systematics, 2015, 17(6): 500- 509.
[22] Uriarte M, Lasky J R, Boukili V K, Chazdon R L. A trait-mediated, neighbourhood approach to quantify climate impacts on successional dynamics of tropical rainforests. Functional Ecology, 2016, 30(2): 157- 167.
[23] Burdon F J, Reyes M, Alder A C, Joss A, Ort C, Räsänen K, Jokela J, Eggen R I L, Stamm C. Environmental context and magnitude of disturbance influence trait-mediated community responses to wastewater in streams. Ecology and Evolution, 2016, 6(12): 3923- 3939.
[24] Buchkowski R W. Top-down consumptive and trait-mediated control do affect soil food webs: It′s time for a new model. Soil Biology and Biochemistry, 2016, 102: 29- 32.
[25] Gómez J M, Megías A G. Trait-mediated indirect interactions, density-mediated indirect interactions, and direct interactions between mammalian and insect herbivores // Ohgushi T, Craig T P, Price P W, eds. Ecological Communities: Plant Mediation in Indirect Interaction Webs. Cambridge: Cambridge University Press, 2007: 104- 121.
[26] Golubski A J, Westlund E E, Vandermeer J, Pascual M. Ecological networks over the edge: hypergraph trait-mediated indirect interaction (TMII) structure. Trends in Ecology & Evolution, 2016, 31(5): 344- 354.
[27] Schmitz O J. Herbivory from individuals to ecosystems. Annual Review of Ecology, Evolution, and Systematics, 2008, 39(1): 133- 152.
[28] Abdala-Roberts L, Pratt J D, Pratt R, Schreck T K, Hanna V, Mooney K A. Multi-trophic consequences of plant genetic variation in sex and growth. Ecology, 2016, 97(3): 743- 753.
[29] Beckerman A P, Uriarte M, Schmitz O J. Experimental evidence for a behavior-mediated trophic cascade in a terrestrial food chain. Proceedings of the National Academy of Sciences of the United States of America, 1997, 94(20): 10735- 10738.
[30] Xi X Q, Eisenhauer N, Sun S C. Parasitoid wasps indirectly suppress seed production by stimulating consumption rates of their seed-feeding hosts. Journal of Animal Ecology, 2015, 84(4): 1103- 1111.
[31] Ripple W J, Beschta R L. Restoring Yellowstone′s aspen with wolves. Biological Conservation, 2007, 138(3- 4): 514- 519.
[32] Ripple W J, Beschta R L. Trophic cascades in Yellowstone: The first 15 years after wolf reintroduction. Biological Conservation, 2012, 145(1): 205- 213.
[33] Jackrel S L, Wootton J T. Cascading effects of induced terrestrial plant defences on aquatic and terrestrial ecosystem function. Proceedings of the Royal Society of London B: Biological Sciences, 2015, 282(1805): 20142522.
[34] Poelman E H, Kessler A. Keystone herbivores and the evolution of plant defenses. Trends in Plant Science, 2016, 21(6): 477- 485.
[35] Mithöfer A, Boland W. Plant defense against herbivores: chemical aspects. Annual Review of Plant Biology, 2012, 63(1): 431- 450.
[36] Price P W. The plant vigor hypothesis and herbivore attack. Oikos, 1991, 62(2): 244- 251.
[37] Zhu H, Wang D L, Wang L, Bai Y G, Fang J, Liu J. The effects of large herbivore grazing on meadow steppe plant and insect diversity. Journal of Applied Ecology, 2012, 49(5): 1075- 1083.
[38] Zhong Z W, Wang D L, Zhu H, Wang L, Feng C, Wang Z N. Positive interactions between large herbivores and grasshoppers, and their consequences for grassland plant diversity. Ecology, 2014, 95(4): 1055- 1064.
[39] Stam J M, Kroes A, Li Y H, Gols R, Van Loon J J, Poelman E H, Dicke M. Plant interactions with multiple insect herbivores: from community to genes. Annual Review of Plant Biology, 2014, 65(1): 689- 713.
[40] Tscharntke T. Insects on common reed (Phragmitesaustralis): community structure and the impact of herbivory on shoot growth. Aquatic Botany, 1999, 64(3- 4): 399- 410.
[41] Mopper S, Maschinski J, Cobb N, Whitham T G. A new look at habitat structure: consequences of herbivore-modified plant architecture// Bell S S, McCoy E D, Mushinsky H R, eds. Habitat Structure: The Physical Arrangement of Objects in Space. Netherlands: Springer, 1991: 260- 280.
[42] Miyashita T, Takada M, Shimazaki A. Indirect effects of herbivory by deer reduce abundance and species richness of web spiders. Ecoscience, 2004, 11(1): 74- 79.
[43] Xi X Q, Wu X W, Nylin S, Sun S C. Body size response to warming: time of the season matters in a tephritid fly. Oikos, 2016, 125(3): 386- 394.
[44] Bukovinszky T, Van Veen F J F, Jongema Y, Dicke M. Direct and indirect effects of resource quality on food web structure. Science, 2008, 319(5864): 804- 807.
[45] Lawton J H, Jones C G. Linking species and ecosystems: organisms as ecosystem engineers// Jones C G, Lawton J H, eds. Linking Species & Ecosystems. Boston, MA: Springer US, 1995: 141- 150.
[46] Ohgushi T, Craig T P, Price P W. Ecological communities: plant mediation in indirect interaction webs. Cambridge: Cambridge University Press, 2007.
[47] van Veen F J F, Godfray H C. Consequences of trait changes in host-parasitoid interactions in insect communities // Ohgushi T, Schmitz O, Holt R D, eds. Trait-Mediated Indirect Interactions: Ecological and Evolutionary Perspectives. Cambridge: Cambridge University Press, 2013: 28- 46.
[48] 王德利. 植物与草食动物之间的协同适应及进化. 生态学报, 2003, 24(11): 2641- 2648.
[49] Agrawal A A. Phenotypic plasticity in the interactions and evolution of species. Science, 2001, 294(5541): 321- 326.
[50] Denno R F, Peterson M A, Gratton C, Cheng J A, Langellotto G A, Huberty A F, Finke D L. Feeding-induced changes in plant quality mediate interspecific competition between sap-feeding herbivores. Ecology, 2000, 81(7): 1814- 1827.
[51] Denno R F, Kaplan I. Plant-mediated interactions in herbivorous insects: mechanisms, symmetry, and challenging the paradigms of competition past // Ohgushi T, Craig T P, Price P W, eds. Ecological Communities: Plant Mediation in Indirect Interaction Webs. Cambridge: Cambridge University Press, 2007: 19- 50.
[52] Raimondi P T, Forde S E, Delph L F, Lively C M. Processes structuring communities: evidence for trait-mediated indirect effects through induced polymorphisms. Oikos, 2000, 91(2): 353- 361.
[53] Hawlena D, Schmitz O J. Herbivore physiological response to predation risk and implications for ecosystem nutrient dynamics. Proceedings of the National Academy of Sciences of the United States of America, 2010, 107(35): 15503- 15507.
[54] Palmer T M, Stanton M L, Young T P, Goheen J R, Pringle R M, Karban R. Breakdown of an ant-plant mutualism follows the loss of large herbivores from an African Savanna. Science, 2008, 319(5860): 192- 195.
[55] Martinsen G D, Driebe E M, Whitham T G. Indirect interactions mediated by changing plant chemistry: beaver browsing benefits beetles. Ecology, 1998, 79(1): 192- 200.
[56] Poelman E H, Van Loon J J A, Van Dam N M, Vet L E, Dicke M. Herbivore-induced plant responses inBrassicaoleraceaprevail over effects of constitutive resistance and result in enhanced herbivore attack. Ecological Entomology, 2010, 35(2): 240- 247.
[57] Cease A J, Elser J J, Ford C F, Hao S G, Kang L, Harrison J F. Heavy livestock grazing promotes locust outbreaks by lowering plant nitrogen content. Science, 2012, 335(6067): 467- 469.
[58] Craig T P, Itami J K. Divergence ofEurostasolidaginisin response to host plant variation and natural enemies. Evolution, 2011, 65(3): 802- 817.
[59] Holt R D, Holdo R M, Van Veen F J. Theoretical perspectives on trophic cascades: Current trends and future directions // Terborgh J, Estes J A, eds. Trophic Cascades: Predators, Prey, and the Changing Dynamics of Nature. 2nd ed. Washington DC: Islands Press, 2010: 301- 318.
[60] Losey J E, Denno R F. Positive predator-predator interactions: enhanced predation rates and synergistic suppression of aphid populations. Ecology, 1998, 79(6): 2143- 2152.
[61] Peacor S D, Werner E E. Trait-mediated indirect interactions in a simple aquatic food web. Ecology, 1997, 78(4): 1146- 1156.
[62] Harmon J P, Ives A R, Losey J E, Olson A C, Rauwald K S.Coleomegillamaculata(Coleoptera: Coccinellidae) predation on pea aphids promoted by proximity to dandelions. Oecologia, 2000, 125(4): 543- 548.
[63] Zhao C, Wu X W, Griffin J N, Xi X Q, Sun S C. Territorial ants depress plant growth through cascading non-trophic effects in an alpine meadow. Oikos, 2014, 123(4): 481- 487.
[64] Xi X Q, Griffin J N, Sun S C. Grasshoppers amensalistically suppress caterpillar performance and enhance plant biomass in an alpine meadow. Oikos, 2013, 122(7): 1049- 1057.
[65] Stelzer R S, Lamberti G A. Independent and interactive effects of crayfish and darters on a stream benthic community. Journal of the North American Benthological Society, 1999, 18(4): 524- 532.
[66] Carpenter S R, Kitchell J F, Hodgson J R, Cochran P A, Elser J J, Elser M M, Lodge D M, Kretchmer D, He X, Von Ende C N. Regulation of lake primary productivity by food web structure. Ecology, 1987, 68(6): 1863- 1876.
[67] Abramsky Z, Rosenweig M L, Subach A. Do gerbils care more about competition or predation? Oikos, 1998, 83(1): 75- 84.
[68] 刘晓娟, 马克平. 植物功能性状研究进展. 中国科学: 生命科学, 2015, 45(4): 325- 339.
[69] Miner B G, Sultan S E, Morgan S G, Padilla D K, Relyea R A. Ecological consequences of phenotypic plasticity. Trends in Ecology & Evolution, 2005, 20(12): 685- 692.
[70] Cebrian J. Role of first-order consumers in ecosystem carbon flow. Ecology Letters, 2004, 7(3): 232- 240.
[71] Hunter M D. Insect population dynamics meets ecosystem ecology: effects of herbivory on soil nutrient dynamics. Agricultural and Forest Entomology, 2001, 3(2): 77- 84.
[72] Liu J, Feng C, Wang D L, Wang L, Wilsey B J, Zhong Z W. Impacts of grazing by different large herbivores in grassland depend on plant species diversity. Journal of Applied Ecology, 2015, 52(4): 1053- 1062.
[73] Li X F, Liu J S, Fan J, Ma Y, Ding S, Zhong Z W, Wang D L. Combined effects of nitrogen addition and litter manipulation on nutrient resorption ofLeymuschinensisin a semi-arid grassland of northern China. Plant Biology, 2015, 17(1): 9- 15.
[74] Wardle D A, Bardgett R D, Klironomos J N, Setälä H, Van Der Putten W H, Wall D H. Ecological linkages between aboveground and belowground biota. Science, 2004, 304(5677): 1629- 1633.
[75] Bakker E S, Ritchie M E, Olff H, Milchunas D G, Knops J M H. Herbivore impact on grassland plant diversity depends on habitat productivity and herbivore size. Ecology Letters, 2006, 9(7): 780- 788.
[76] Ritchie M E, Tilman D, Knops J M H. Herbivore effects on plant and nitrogen dynamics in oak savanna. Ecology, 1998, 79(1): 165- 177.
[77] Olff H, Ritchie M E. Effects of herbivores on grassland plant diversity. Trends in Ecology & Evolution, 1998, 13(7): 261- 265.
[78] Bardgett R D, Wardle D A. Herbivore-mediated linkages between aboveground and belowground communities. Ecology, 2003, 84(9): 2258- 2268.
[79] Augustine D J, McNaughton S J. Ungulate effects on the functional species composition of plant communities: herbivore selectivity and plant tolerance. The Journal of Wildlife Management, 1998, 62(4): 1165- 1183.
[80] Augustine D J, McNaughton S J. Regulation of shrub dynamics by native browsing ungulates on east African rangeland. Journal of Applied Ecology, 2004, 41(1): 45- 58.
[81] Pastor J, Naiman R J. Selective foraging and ecosystem processes in boreal forests. The American Naturalist, 1992, 139(4): 690- 705.
[82] Enge S, Nylund G M, Pavia H. Native generalist herbivores promote invasion of a chemically defended seaweed via refuge-mediated apparent competition. Ecology Letters, 2013, 16(4): 487- 492.
[83] Zhao C, Griffin J N, Wu X W, Sun S C. Predatory beetles facilitate plant growth by driving earthworms to lower soil layers. Journal of Animal Ecology, 2013, 82(4): 749- 758.
[84] Hixon M A, Brostoff W N. Damselfish as keystone species in reverse: intermediate disturbance and diversity of reef algae. Science, 1983, 220(4596): 511- 513.
Characteristics,causes,andconsequencesoftrait-mediatedindirectinteractionsinecosystems
ZHU Yu1,2,WANG Deli1,2,*,ZHONG Zhiwei1,2
1SchoolofEnvironment,InstituteofGrasslandScience,NortheastNormalUniversity,Changchun130117,China2KeyLaboratoryofVegetationEcology,MinistryofEducation,JilinKeyLaboratoryofEcologicalRestorationandEcosystemManagement,Changchun130024,China
Indirect species interactions play a critical role in shaping community structure and the functioning of ecosystems. Previous empirical and theoretical studies commonly assumed that indirect interactions were caused in general by changes in population density of interacting species, which is referred to as ‘density-mediated indirect interactions.’ However, there is growing evidence that changes in traits of the individual intermediate species can also be an important mechanism that regulates indirect interactions among species, and ecologists term these species interactions ‘trait-mediated indirect interactions′ (TMIIs). TMIIs are prevalent in both aquatic and terrestrial systems, and their effects are often as strong as, or stronger than, those of density-mediated indirect effects. Studies on the characteristics, causes, and consequences of TMIIs are essential to understand the complexity and diversity of multispecies interactions in natural ecosystems fully. In this paper, we summarize the concept and classification of TMIIs, and suggest that trait plasticity and species specificity are the two intrinsic mechanisms for the occurrence of TMIIs. We also review the direct evidence for TMIIs in various permutations of interaction webs that can have both trophic and non-trophic links, and then highlight the profound effects of TMIIs on regulation of ecological functions and processes in a wide range of ecological systems. Finally, we propose future developments regarding the effects of TMIIs to provide a reference framework for related research.
trait-mediated indirect interactions;indirect effects;plasticity;adaption;species interactions
国家自然科学基金项目(31230012);国家科技基础性工作专项(2012FY111900);教育部创新团队发展计划(IRT- 16R11);中国博士后面上基金(2016M590246)
2016- 10- 01; < class="emphasis_bold">网络出版日期
日期:2017- 08- 14
*通讯作者Corresponding author.E-mail: wangd@nenu.edu.cn
10.5846/stxb201610011986
朱玉,王德利,钟志伟.生态系统基于性状调节的物种间接作用:特征、成因及后果.生态学报,2017,37(23):7781- 7790.
Zhu Y,Whang D L,Zhong Z W.Characteristics, causes, and consequences of trait-mediated indirect interactions in ecosystems.Acta Ecologica Sinica,2017,37(23):7781- 7790.

