扎龙湿地保护区异质生境芦苇种群分株构件的数量特征
焦德志,荣 子,曹 瑞,闫秋月,姜秋旭,杨允菲
1 齐齐哈尔大学生命科学与农林学院,齐齐哈尔 161006 2 东北师范大学草地科学研究所,植被生态科学教育部重点实验室,长春 130024
扎龙湿地保护区异质生境芦苇种群分株构件的数量特征
焦德志1,2,荣 子1,曹 瑞1,闫秋月1,姜秋旭1,杨允菲2,*
1 齐齐哈尔大学生命科学与农林学院,齐齐哈尔 161006 2 东北师范大学草地科学研究所,植被生态科学教育部重点实验室,长春 130024
采用单位面积取样,计数和测量的调查与统计方法,对扎龙湿地保护区4个生境单优群落芦苇种群分株构件数量特征进行比较分析。结果表明,4个生境芦苇种群从5月10日左右返青后进入营养生长期,分株高度和分株密度均持续增加到生殖生长初期的8月份,其中6—8月份差异均达到显著水平(P<0.05),8—10月份差异均未达到显著水平(P>0.05),芦苇进入生殖生长期后,分株便停止高度生长,地下芽的输出也不再形成分株补充现实种群;分株生物量和种群生物量均持续增加到生殖生长旺盛期的9月份,至休眠期的10月份均有所降低,各月份间的差异均达到显著水平,芦苇种群在生长季末期,具有将生产的物质分配转移到地下储藏与营养繁殖器官的形成与生长上的特性。芦苇种群分株数量特征与返青后实际生长时间之间均较好地符合对数函数关系,R2在0.818—0.994之间,拟合方程均达到了P<0.05的显著水平。4个生境芦苇种群分株密度以湿生生境最大,依次为水生生境、旱生生境,盐碱生境最小,分株高度、分株生物量和种群生物量均以水生生境最大,依次为湿生生境、旱生生境,盐碱生境最小。因此,4个生境芦苇种群分株构件数量特征均表现出基本一致的生育期节律性,同时,芦苇种群的个体生长和种群动态存在明显的环境效应,土壤含水量、pH是影响该地区芦苇分株数量特征的主要因子。
扎龙湿地;芦苇种群;构件;异质生境;数量特征
1977年Harper和Caltwarlthy提出植物种群构件理论[1],标志植物构件生态学研究的新篇章,把植物种群划分群落水平和个体水平既相关联又截然不同的层次,构件生态学的产生和建立,为植物种群生态学的深入研究开拓了新途径[2]。
对植物种群构件研究集中表现在植物对环境的适应上。在异质生境中,分株构件大小具有较大的可塑性,均可在种群和分株等水平上进行检测[3],植物对异质环境的适应变化,不仅能够反映出植物分株及种群对环境的适应能力和生长发育节律,也能够反映出环境条件对植物分株及种群影响和饰变程度[4]。新疆阜康荒漠红砂种群对环境因子的反应通过其主要构件,如植株冠幅和高度以及分枝构件系统来表现[5],欧洲水青冈构件的数目和构件大小可以随环境条件发生变化,增加枝条的生物量投入是更好地适应恶劣环境的有利选择[6],羊草草地主要植物通过植株高度的变化影响其截取光能的有效性,植物个体形态的变化具有重要的生态学意义[7],当种群密度增加时,植物采取变化结构是最易采取的、最经济的对策,随着红葱种群密度的增大,其个体高度增加,平均蘖重减小,这是种群密度对不同构件调节的结果,具有相同环境最大容纳量的植物种群,随着种群密度的增加必然存在着空间和资源供给矛盾,个体生长必然受到空间和资源的限制[8]。因此,开展构件水平种群与环境因子关系的研究,不仅可以获得种群对环境因子反应以及对某些环境因子适应性等重要信息,并且在一定程度上,对揭示无性系植物群落结构的形成及群落相对稳定均具有重要意义。
芦苇在扎龙湿地保护区内广泛分布,芦苇群落也是保护区内面积最大的群落类型。芦苇为典型的长根茎型无性系植物,天然种群主要依靠营养繁殖补充和更新种群[9]。分株为芦苇种群的主要构件,其中分株密度、高度及其生物量是其基本的数量特征指标,也是种群的重要参数,在一定程度上可以反映芦苇种群生产力及生长环境条件的优劣。因此,开展保护区内异质生境芦苇种群的大小,分株高度及其生物量等数量特征的空间变化和季节性变化规律,以及土壤环境因子与分株数量特征间相关性分析,探讨芦苇种群在分株构件数量特征上表现的生物学特性以及土壤理化因子的环境效应,既可为进一步揭示芦苇的表型可塑性和趋异适应机理提供基础,也可为扎龙湿地保护区芦苇资源管理和湿地的生态恢复和重建提供理论支持。
1 研究地区和研究方法
1.1 研究区概况
本项研究是在松嫩平原北部,黑龙江省齐齐哈尔市,扎龙国家级自然保护区(齐齐哈尔东南23 km)。其位于46°52′—47°32′N,123°47′—124°37′E,该地区属于中温带大陆性季风气候,冬寒漫长,春干风大,夏热多雨,秋凉霜早,年平均气温为3.2℃,最冷月平均气温-19.4℃,最热月平均气温22.9℃,年日照时数2700—3000 h,年辐射总量是2052—2140 s/cm2,积温2600—3000℃,平均地温4.9℃,无霜期128 d[10- 11]。
1.2 样地设置
在扎龙国家级自然保护区核心区,以土壤水分条件,从旱生、湿生、水生及盐碱化土壤,共设置4个生境样地:
1)旱生生境(H1):土壤为草甸土,全年无积水或7—8月份雨季短时积水,经常形成羊草+芦苇群落,微地形中心也可形成面积不等的单优种芦苇群落斑块,群落下层伴生西伯利亚蓼(Polygonumsibiricum)、针蔺(Eleochariscongesta)、朝鲜碱茅(Puccinelliachinampoensis)、扁秆藨草(Scirpusplaniculmis),委陵菜(Potentillaaiscolor)等[12]。
2)湿生生境(H2):土壤为沼泽土,平时无积水或少量积水,7—8月雨季来临以后逐渐积水,积水深度一般情况低于30 cm,群落下层伴生西伯利亚蓼(Polygonumsibiricum)、针蔺、翻白委陵菜(Potentillaaiscolor)、海乳草(Glauxmaritima)等[13]。
3)水生生境(H3):土壤为腐殖沼泽土,形成湿地内面积最大的芦苇群落,常年积水,水深变化为10—100 cm,群落下层伴生狸藻(Utriculariavulgaris)、眼子菜(Potamogetonoctandrus)、甜茅(Glyceriaacutiflora)、小叶樟(Calamagrostisangustifolia)等[13]。
4)盐碱生境(H4):土壤为盐碱土,全年无积水,土壤表层已完全丧失,具有明显盐碱斑,有的碱斑可形成单优势种芦苇居群,群落下层伴角碱蓬(Suaedacorniculata)、碱地肤(Kochiasieveriana)、野大麦(Hordeumbrevisubulatum) 、朝鲜碱茅[12]等。
样地多年来一直冬季收割,造纸或民用。另外,4个生境样地间距离均在5 km内,光照和温度等环境条件可视为一致。
1.3 研究方法
按照芦苇的生育期特性确定取样时间,于6月10日(营养生长初期),7月10日(营养生长旺盛期),8月10日(生殖生长初期),9月19日(生殖生长旺盛期),10月17日(休眠期),分别在上述4个样地内做50 cm×50 cm刈割取样,5次重复。逐样方计数芦苇分株数量,各样地随机抽取30个分株测量其高度,将所有样品置通风处风干,分别称重。芦苇根茎集中分布在100 cm以内土层,用土钻对每一样点土壤取样,深度为100 cm,混匀后带回实验室。采用烘干称重法测定土壤含水量,采用电位法测定pH值,采用重铬酸钾加热法测定有机质含量,采用碱解扩散法测定速效氮含量,采用钼锑抗比色法测定速效磷含量[14-15]。
1.4 数据处理
将分株数量特征取样面积50 cm×50 cm的数值换算成1 m×1 m的单位面积数值。密度、高度、生物量以实际观测统计值表示,用M 反映样本的平均数量,SD 反应样本的绝对变异程度。用Excel 2007绘制图表,SPSS 19.0 软件对数据进行分析处理。对不同月份和不同生境间差异进行单因素方差分析(One-way ANOVA,ɑ=0.05)。利用重复取样获得的分株数据和土壤因子间进行Pearson相关分析。对分株密度、高度、生物量与返青后的实际生长时间(以5月10日返青计)分别用线性、指数、对数函数进行回归,选取相关性最高的拟合方程作为定量刻画模型,方程的拟合优度以R2检验,方程显著性采用F检验。文中图表数据均为(M±SD)。
2 结果分析
2.1 芦苇种群分株的空间动态
2.1.1 不同生境分株高度空间动态
分株高度是分株生长的重要量度之一。经方差分析和多重比较(图1),4个生境芦苇种群分株高度在6月份以湿生生境(H2)和水生生境(H3)显著(P<0.05)高于旱生生境(H1)和盐碱生境(H4),在7月份,4个生境之间的差异均达到了显著水平,8—10月份的空间变化趋势大体相同,即H1和H2之间的差异未达到显著水平(P>0.05),H3在233.7—240.2 cm之间,H1在189.6—199.3 cm之间,H2在186.1—201.1 cm之间,H4在99.9—107.6 cm之间。由此反映出4个异质生境芦苇种群分株高度在生长季后期生境间差异及差异序位均相对稳定。
2.1.2 不同生境分株生物量空间动态
分株生物量也是分株生长的重要量度之一。经方差分析和多重比较(图2),4个生境芦苇种群分株生物量在6月份以H3显著(P<0.05)高于H1、H2和H4,在7—10月份,4个生境之间的差异均达到了显著水平,且空间变化趋势基本相同,其中H3在9.3—14.5 g/株之间,依次是H2在6.6—12.2 g/株之间,H1在3.9—7.8 g/株之间,H4在2.3—2.9 g/株之间。由此反映出4个异质生境芦苇种群分株生物量在生长季中后期生境间差异及差异序位均相对稳定。
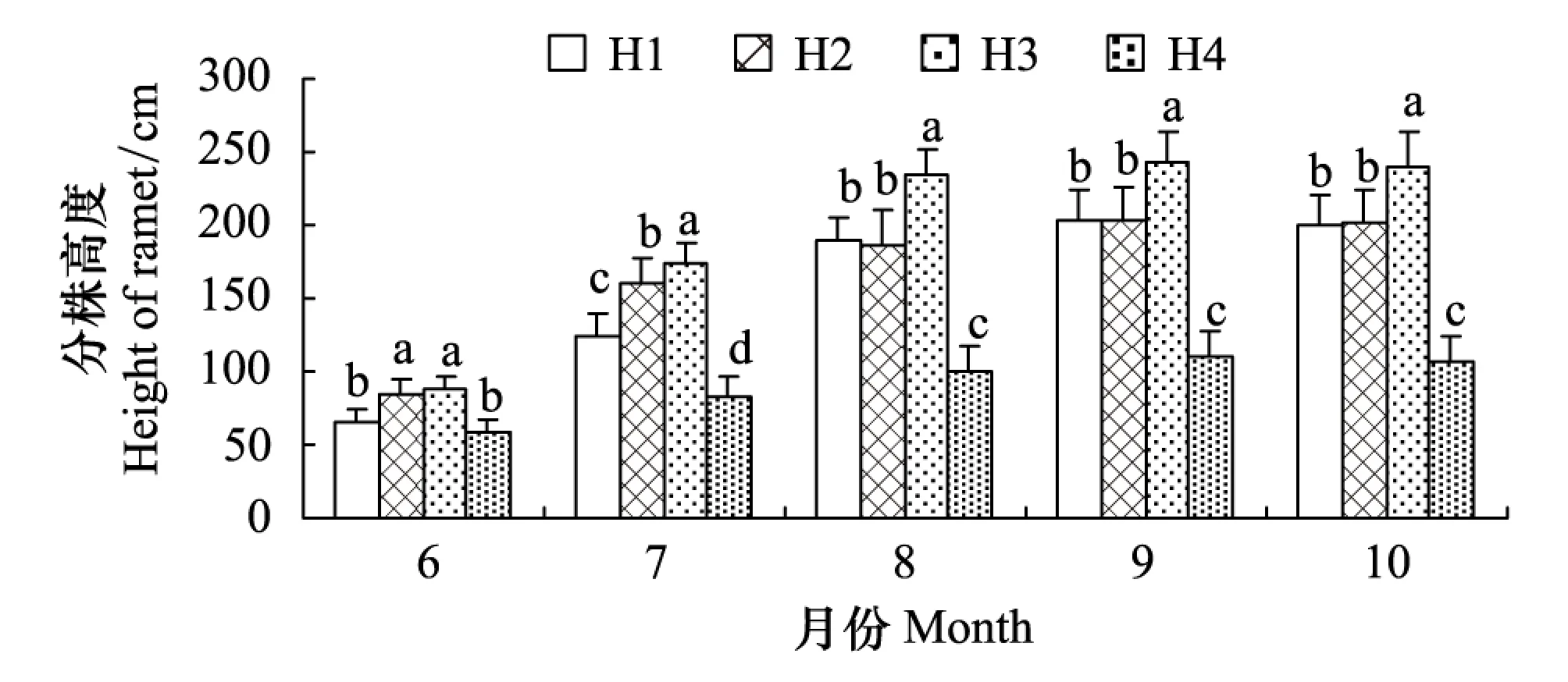
图1 不同生长期异质生境芦苇种群分株高度比较 Fig.1 Comparison of height of ramets in different growing period of Phragmites australis populations in heterogeneous habitats H1:旱生生境 Xeric habitats; H2:湿生生境 Wet habitats; H3:水生生境 Aquatic habitats; H4:盐碱生境 Saline-alkali habitats;不同小写字母表示生境间差异显著(P<0.05)

图2 不同生长期异质生境芦苇种群分株生物量比较 Fig.2 Comparison of biomass of ramets in different growing period of Phragmites australis populations in heterogeneous habitats
2.1.3 不同生境分株密度空间动态

图3 不同生长期异质生境芦苇种群分株密度比较 Fig.3 Comparison of density of ramets in different growing period of Phragmites australis populations in heterogeneous habitats
经方差分析和多重比较(图3),4个生境芦苇种群分株密度各月份均以H2最大,均以H4最小。其中,在6月份,4个生境之间的差异均达到了显著水平(P<0.05),H2为287 株/m2,依次H3为214 株/m2,H1为165 株/m2,H4为128 株/m2;在7月份,H1和H3间的差异没达到显著水平(P>0.05);在8—10月份,4个生境之间的差异又均达到了显著水平,且保持相对稳定,H2为443—455 株/m2之间,依次H3为400—405 株/m2之间,H1为332—340 株/m2之间,H4为296—305 株/m2之间。 由此反映出4个异质生境芦苇种群分株密度在整个生长期内生境间差异及差异序位均相对稳定。
2.1.4 不同生境种群生物量空间动态
经方差分析和多重比较(图4),4个生境芦苇种群生物量各月份均以H3最大,均以H4最小,H3为H4的3.3—6.6倍。6—10月份,H3在644.7—5818.9 g/m2之间,依次H2在513.5—5456.0 g/m2之间,H1在286.5—2665.3 g/m2之间,H4在194.4—874.8 g/m2之间,4个生境之间的差异均达到显著水平(P<0.05)。由此反映出4个异质生境芦苇种群生物量在整个生长期内生境间差异及其差异序位均相对稳定。

图4 不同生长期异质生境芦苇种群生物量比较 Fig.4 Comparison of biomass in different growing period of Phragmites australis populations in heterogeneous habitats
2.2 芦苇种群分株的季节动态
2.2.1 不同生境分株高度季节动态
在扎龙湿地保护区,芦苇一般5月10日左右返青,然后进入营养生长期,从营养生长初期的6月份到生殖生长初期的8月份,分株高度迅速增加,至生殖生长旺盛期的9月份最高,休眠期的10月份均又有不同程度下降(图5)。经统计分析和多重比较,4个生境芦苇分株高度在6、7、8月份之间的差异均达到显著水平(P<0.05),8、9、10月份之间的差异均未达到显著水平(P>0.05)。由此反映了各生境芦苇种群从营养生长初期到生殖生长初期,是芦苇分株的主要增高期,表明抽穗期以后芦苇分株便停止高度生长的生物学特征。
经回归分析,4个生境芦苇种群分株高度与返青后的实际生长时间(5月10日返青计)之间均较好地符合对数函数关系(图5),方程的拟合优度(R2)在0.935—0.994之间,并均达到了P<0.01的极显著水平。

图5 异质生境芦苇种群分株高度季节动态Fig.5 Seasonal changes of height of ramets of Phragmites australis populations in heterogeneous habitats不同小写字母表示月份间差异显著(P<0.05); * P<0.05;** P<0.01
2.2.2 不同生境分株生物量季节动态
经大样本取样测定,从营养生长初期的6月份到生殖生长旺盛期的9月份,芦苇分株生物量逐渐增加,并在 9月份达到最大,休眠期的10月份又有不同程度下降(图6)。经统计分析和多重比较,4个生境芦苇分株生物量在6—10月份之间的差异均达到显著水平(P<0.05)。由此反映了各生境芦苇种群从营养生长初期到生殖生长旺盛期,是芦苇分株生物量的主要增长期,并具有在生长季末期均显著降低的共同特征。这主要与无性系植物在生长季末期,将生产的物质主要分配转移到地下储藏与营养繁殖器官的形成与生长上。此外,10月份取样时植株下部叶片的少量脱落,也会造成分株生物量的损失。
经回归分析,4个生境芦苇种群分株生物量与返青后的实际生长时间(5月10日返青计)之间均较好地符合对数函数关系(图6),方程的拟合优度(R2)在0.912—0.945之间,并均达到了P<0.05的显著水平。
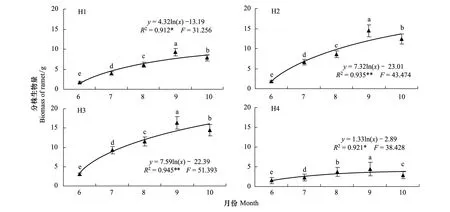
图6 异质生境芦苇种群分株生物量季节动态Fig.6 Seasonal changes of biomass of ramets of Phragmites australis populations in heterogeneous habitats
2.2.3 不同生境分株密度季节动态
在扎龙湿地保护区,天然的芦苇种群依靠营养繁殖来维持和更新种群,分株均由地下芽萌发形成。经统计分析和多重比较, 4个生境芦苇种群分株密度均以6月份最低,7、8月份均显著增加,8月份之后分株密度基本稳定(图7)。4个生境芦苇种群分株密度在6、7、8月份之间的差异均达到显著水平(P<0.05),8、9、10月份之间的差异均未达到显著水平(P>0.05)。由此反映了各生境芦苇种群从营养生长初期到生殖生长初期,一直有芽输出形成分株补充现实种群,而进入生殖生长期以后根茎芽的输出以形成新根茎补充潜在种群的共同特征。
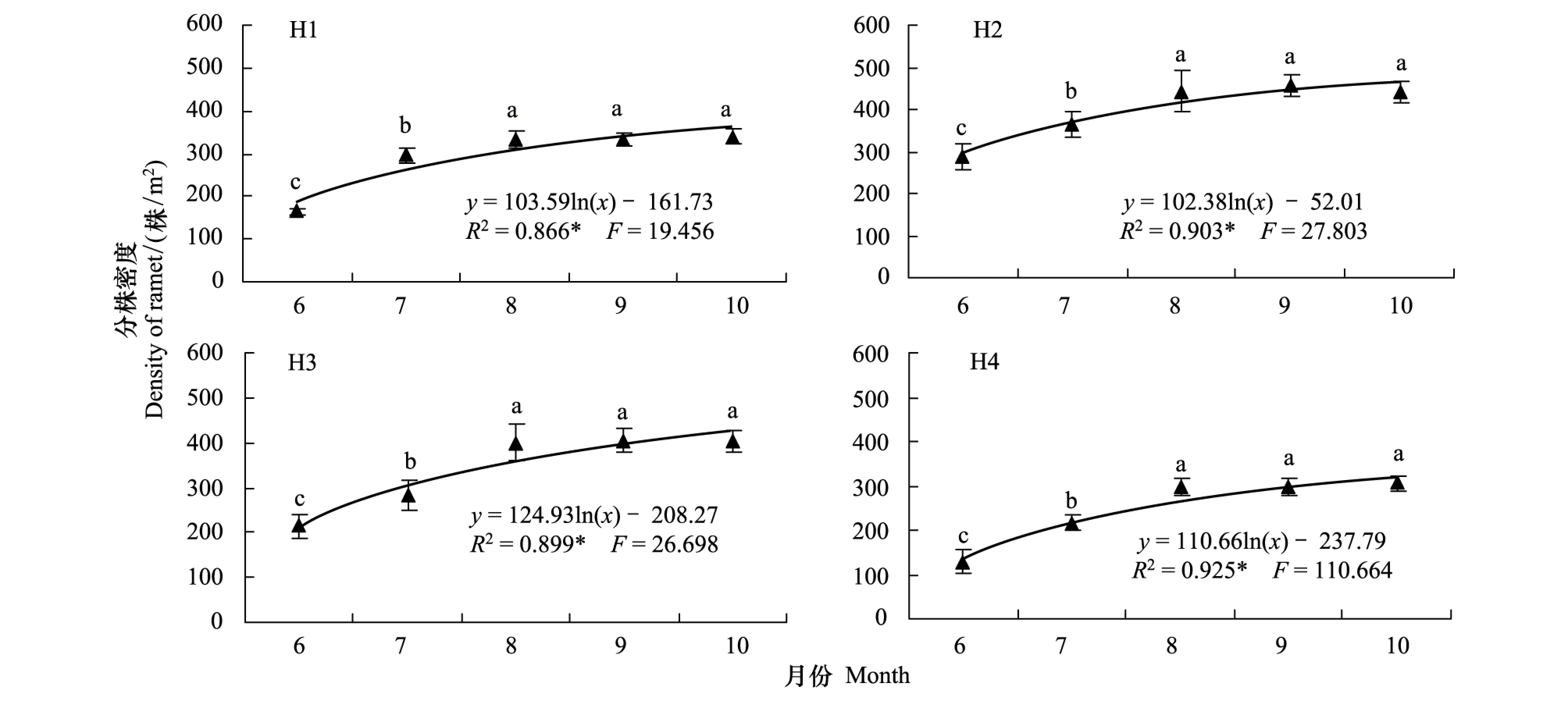
图7 异质生境芦苇种群分株密度季节动态Fig.7 Seasonal changes of density of ramets of Phragmites australis populations in heterogeneous habitats
经回归分析,4个生境芦苇种群分株密度与返青后的实际生长时间(5月10日返青计)之间均较好地符合对数函数关系(图7),方程的拟合优度(R2)在0.866—0.925之间,并均达到了P<0.05的显著水平。
2.2.4 不同生境种群生物量季节动态
在扎龙湿地保护区,芦苇种群的萌发生长开始于5月份返青后,从营养生长初期的6月份到生殖生长旺盛期的9月份,种群生物量逐渐增加,休眠期的10月份又有不同程度下降(图8)。经统计分析和多重比较,4个生境芦苇种群生物量在6—10月份之间的差异均达到显著水平(P<0.05)。各生境芦苇种群生物量的生长动态均为单峰型,峰值均出现在生殖生长旺盛期的9月份。由此反映了各生境芦苇种群从营养生长初期到生殖生长旺盛期,是种群生物量的主要增长期,并具有生长季末期均显著降低的共同特征。
经回归分析,4个生境芦苇种群生物量与返青后的实际生长时间(5月10日返青计)之间均较好地符合对数函数关系(图8),方程的拟合优度(R2)在0.818—0.944之间,并均达到了P<0.05的显著水平。
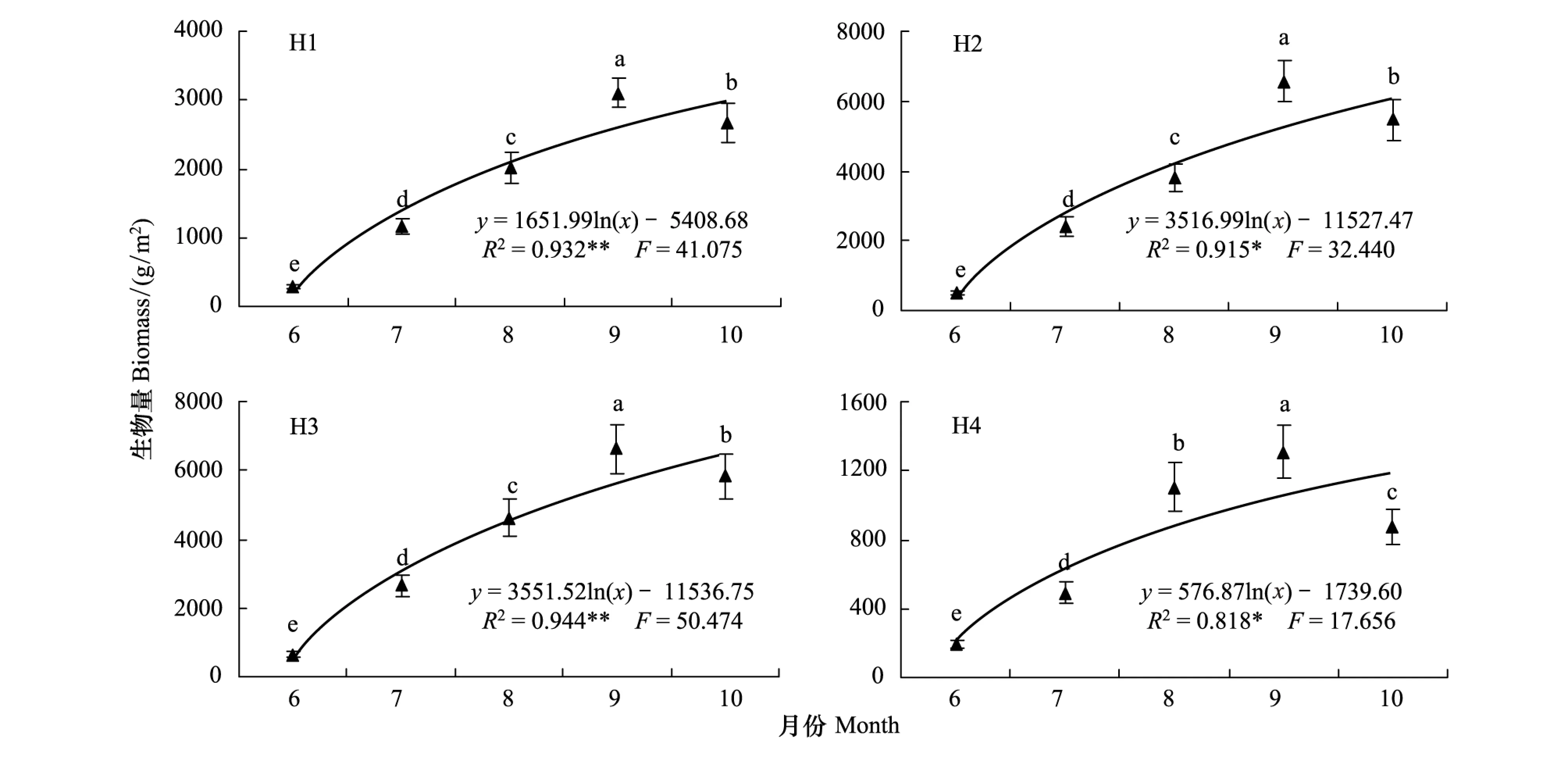
图8 异质生境芦苇种群生物量季节动态Fig.8 Seasonal changes of biomass of Phragmites australis populations in heterogeneous habitats
2.3 土壤因子对种群分株数量特征的影响
松嫩平原“一步三换土”的土壤格局,扎龙湿地保护区内芦苇群落的生境异质性普遍存在。经统计分析和多重比较,4个生境5个土壤因子存在较大差异(表1)。H3因常年积水,土壤含水量处于饱和状态,只表现出水深变化,其他3个生境各月份土壤含水量均以H2最高,均以H4最低,各生境间差异均达到显著水平(P<0.05),H1、H2和H4土壤含水量因季节性降雨波动较大,6月份最低,9月份最高;各月份土壤pH值均以H4最高,均显著地高于其他3个生境,H3最低,7、8月份与H1和H2差异未达到显著水平(P>0.05),各生境均以9月份最低,10月份最高;各月份土壤有机质、速效氮含量均以H2最高,H4最低,9、10月份H1和H2有机质含量差异未达到显著水平;各月份土壤速效磷含量均以H4最高,H1最低,各生境间差异均达到显著水平。生长期内土壤有机质、速效氮、速效磷含量呈逐渐降低的趋势。因此,4个异质生境5个土壤因子既存在季节波动性,同时,又表现出比较稳定的空间差异。
对4个生境土壤因子与芦苇种群数量特征进行相关性分析(表2)。结果表明,土壤含水量与种群数量特征呈极显著(P<0.01)的正相关,土壤pH与种群数量特征呈显著(P<0.05)或极显著的负相关,土壤有机质和速效氮含量与种群数量特征呈正相关,但均未达到显著水平(P>0.05),土壤速效磷含量与种群数量特征呈负相关,其中与分株生物量和种群生物量未达到显著水平。由此表明土壤含水量、pH是影响扎龙湿地保护区芦苇种群数量特征的主要土壤因子。
3 讨论
3.1 植物生长发育的生物节律性
生物节律在植物生命过程中扮演着非常重要的角色,是植物在与环境长期生存斗争中进化出来的一种适应性机制[16]。生物节律对环境周期性改变具相对稳定性,即使在实验室恒定条件下,排除一切环境因子的影响,生命活动仍表现出节律性变化[17]。生物节律性是由植物遗传因素控制的,一般较难改变,在一个完整的生育期内表现出稳定的时间顺序。
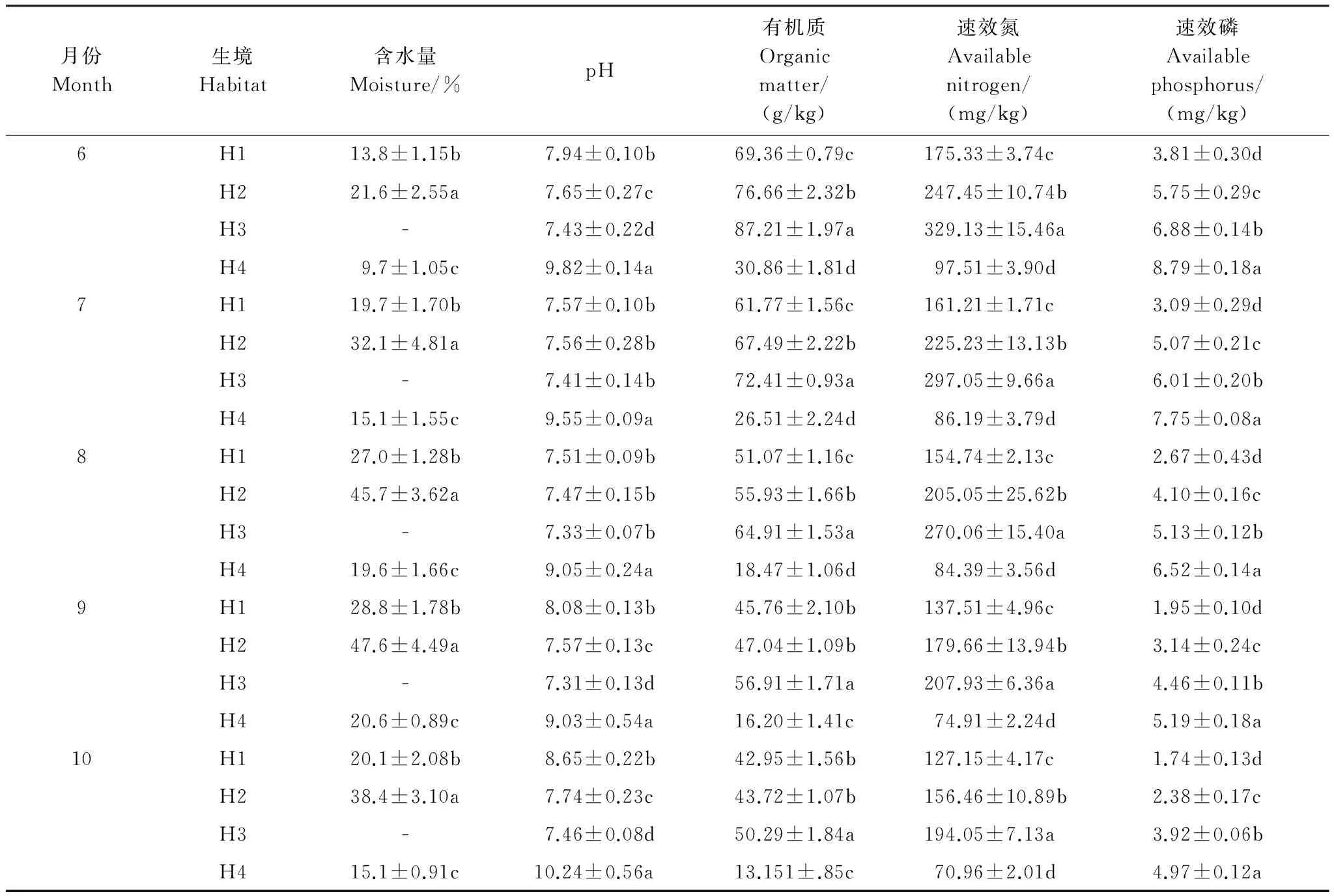
表1 4个生境土壤理化特性
H1:旱生生境 Xeric habitats; H2:湿生生境 Wet habitats; H3:水生生境 Aquatic habitats; H4:盐碱生境 Saline-alkali habitats; 不同小写字母表示生境间差异显著(P<0.05)

表2 芦苇种群数量特征与土壤因子之间的相关系数(n=20)
*P<0.05; **P<0.01; 种群数量特征与土壤含水量相关分析中n=15,不包含水生生境(H3)
在扎龙湿地保护区,4个生境芦苇在5月10左右返青后,进入营养生长期,分株高度和密度可持续增加到生殖生长初期的8月份,芦苇一旦开始抽穗后,分株便停止高度生长,芽的输出也不再形成分株补充现实种群。分株和种群生物量从返青后持续增加到生殖生长旺盛期的9月份,至休眠期的10月份又有所降低,生物量呈“单峰型”变化,在生长季后期,芦苇种群将生产的物质主要分配转移到地下储藏与营养繁殖器官的形成与生长上。因此,4个生境芦苇种群分株在生长及物质生产上表现出共同的生物学特性和一致的时间节律性。
对不同分布区芦苇的研究也表明,在株高、密度、生物量均具有明显的时间节律性。在盘锦湿地,4—7月份芦苇平均生长速率为92.67 cm,7月份之后营养生长缓慢[18],鄱阳湖洲滩,4—6月份芦苇平均生长速度最快,7月份以后植株增高缓慢[19],银川平原湿地,6—7月份芦苇生长最快[20],莫莫格湿地,5—6月份高度变化较大[21],闽江河口湿地,芦苇7月份增高最快[22],Clevering等[23]和Karunaratne等[24]研究也表明4—5月份芦苇生长速度最快,6—8月份生长缓慢。
在松嫩平原[21],三江平原[25],还是长江流域[22],黄河流域[26]芦苇分株密度在生长季初期5、6月份最低,到7、8月份达到最大值,生长季后期并有一定程度的减少。芦苇分株密度峰值在月份上差异,主要受分布区的地理位置以及气候等因素的影响[18,27]。由于受资源竞争的限制,使植株间对光、水分、营养物的竞争增大,导致植株死亡率上升[28]。对乌梁素海[29]、银川平原湿地[20,30]和天津典型湿地[31]芦苇种群密度的研究显示,当芦苇密度超过200 株/m2时,自疏作用开始呈现。我们研究的4个样地中,芦苇分株密度(最高值)稳定期达到了400—450 株/m2,取样观测未发现死株以及分株密度可持续增加到8月份,表明芦苇种群尚未达到环境最大容纳量,也未表现出自疏死亡现象,至于该区域芦苇是否存在自疏作用及其自疏作用的分株密度需要进一步研究。
对于芦苇种群生物量以及生产力的研究报道也较多[32- 33],研究区域几乎涵盖了我国芦苇分布的所有地区[22,25,31],研究显示,芦苇在生长季初期开始萌发生长,地上生物量逐渐积累,一般在7—9月份出现峰值,到生长季末期生物量有下降的趋势[34]。芦苇生物量下降的原因主要为:一是芦苇典型的营养繁殖特性决定,生长季末期芦苇将地上光合产物向地下根茎转运,可以使根茎储存更多的营养物质,为竖年根茎芽的萌发提供物质保证,也是典型根茎型植物芦苇能够“生生不息,相对长寿”的有力证据;二是气候原因引起的芦苇生长节律的变化,叶片脱落对生物量的损失所造成的。另外,研究还发现,盐碱生境10月份种群生物量与9月份比降低的比率最大达到了33%,原因可能是在生境比较恶劣或者干扰强度增大的情况下,依靠种子进行的有性繁殖方式会受到一定程度的限制,甚至会停止,为了保证种群的延续,植物会改变其繁殖策略[9],在生长季末期种群会将更多的营养物质向地下根茎转运,增大对营养繁殖的投入。取样调查时也发现,盐碱生境中的芦苇很少抽穗进行有性繁殖,绝大多数只进行营养生长,样地内形成较多的 “哑巴苇子”。这种现象是取样的人为误差还是适应环境的反应有待进一步研究证实。
3.2 植物生长和物质积累规律的定量刻画
植物的生长和物质积累总是遵循着某种规律,对于其过程具体化和定量刻画,一直是生态学研究的热点问题[35],生态学家们也一直在探索用拟合方程或回归曲线反映生物学与生态学现象和生长规律,赋予方程参数更多的生态学意义[36]。以相关系数最大值为定量刻画标准,不仅可以发现物种之间的差异,也许同种在不同环境下也会有差异,由此体现出植物在分株、无性系或种群间的不同调节等问题[37]。
本研究发现,4个生境芦苇种群的数量特征与返青后的实际生长时间(5月10返青计)之间均可以用拟合方程进行定量描述。其中分株高度、生物量、密度和种群生物量与生长时间之间均较好地符合对数函数关系,分株高度的拟合优度(R2)在0.935—0.994之间,分株生物量在0.912—0.945之间,分株密度在0.866—0.925之间,种群生物量在0.818—0.944之间,拟合方程均达到了P<0.05的显著水平。由此反映了4个异质生境芦苇种群分株的数量特征具有比较稳定的时间变化规律。只是,拟合方程的数据是一个生长季的信息,能否真实的反映芦苇种群分株的变化规律有待进一步证实。
3.3 植物(分株)数量特征对土壤驱动因子的响应
无性系种群对环境因子的反应首先表现在个体的构件组织上,如植株高度、枝条数量、分枝径粗以及生物量等等[5],其构件大小与种间竞争、分株间竞争、密度制约,以及环境条件有着密切的关系。
在扎龙湿地保护区分别设置4个生境芦苇样地,旱生生境(H1)、湿生生境(H2)、水生生境(H3)和盐碱生境(H4)。研究结果表明,4个生境芦苇种群数量特征在生境间的差异及其差异序位均比较稳定。其中分株密度以H2最大,依次是H3,H1,H4最小,H2为H4的1.4—2.2倍,分株高度、生物量以及种群生物量以H3最大,依次是H2,H1,H4最小,H3为H4的1.2—1.6倍、2.0—5.1倍、3.3—6.6倍,共同特征是以常年积水或季节性积水的水生和湿生环境最高,以既无临时积水,土壤条件又恶劣的碱斑生境最低。芦苇种群各数量特征与土壤含水量呈极显著(P<0.01)的正相关,与土壤pH呈显著或极显著的负相关,与土壤有机质含量和速效氮含量呈正相关,但均未达到显著水平,与土壤速效磷含量呈负相关,其中分株密度、高度达到显著水平,表明芦苇种群的个体生长和种群动态存在明显的环境效应,其中土壤含水量、pH对该地区芦苇种群数量特征的影响作用更明显。
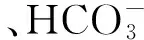
[1] Harper J L. Population Biology of Plant. London: Academic Press, 1977.
[2] 钟章成, 曾波. 植物种群生态研究进展. 西南师范大学学报: 自然科学版, 2001, 26(2): 230- 236.
[3] Harper J L. The concept of population in modular organisms//May R M, ed. Theoretical ecology principles and applications. London: Blackwell Scientific Publications, 1981: 53- 77.
[4] Arenas F, Viejo R M, Fernández C. Density-dependent regulation in an invasive seaweed: responses at plant and modular levels. Journal of Ecology, 2002, 90(5): 820- 829.
[5] 徐莉, 王丽, 岳明, 赵桂仿, 王祎玲. 新疆阜康荒漠红砂种群构件结构与环境因子的灰色关联度分析. 植物生态学报, 2003, 27(6): 742- 748.
[6] 李俊清, 臧润国, 蒋有绪. 欧洲水青冈(FagussylvaticalL.)构筑型与形态多样性研究. 生态学报, 2001, 21(1): 151- 155.
[7] 巴雷, 王德利. 羊草草地主要植物邻体干扰条件下构件形态特性比较. 东北师大学报: 自然科学版, 2003, 35(1): 110- 116.
[8] 黎磊, 周道玮. 红葱种群地上和地下构件的密度制约调节. 植物生态学报, 2011, 35(3): 284- 293.
[9] 焦德志, 么璐, 黄曌月, 杨允菲. 东北草地异质生境芦苇种群根茎芽年龄结构及输出规律. 生态学报, 2015, 35(2): 370- 377.
[10] 中华人民共和国林业部. 扎龙国家级自然保护区管理计划. 北京: 中国林业出版社, 1997: 1- 5.
[11] 赵魁义. 中国沼泽志. 北京: 科学出版社, 1999: 231- 239.
[12] 焦德志, 么璐, 黄曌月, 杨允菲. 东北草地异质生境芦苇芽种群动态. 应用生态学报, 2015, 26(2): 404- 410.
[13] 焦德志, 黄曌月, 周婵, 杨允菲. 扎龙湿地异质生境芦苇种群根茎动态及年龄结构. 生态学杂志, 2016, 35(4): 888- 895.
[14] 鲁如坤. 土壤农业化学分析方法. 北京: 中国农业科技出版社, 2000.
[15] 骆东奇, 白洁, 谢德体. 论土壤肥力评价指标和方法. 土壤与环境, 2002, 11(2): 202- 205.
[16] 门中华, 李生秀. 植物生物节律性研究进展. 生物学杂志, 2009, 26(5): 53- 55.
[17] Ueda M, Nakamura Y. Chemical basis of plant leaf movement. Plant and Cell Physiology, 2007, 48(7): 900- 907.
[18] 贾庆宇, 周莉, 谢艳兵, 周广胜. 盘锦湿地芦苇群落生物量动态特征研究. 气象与环境学报, 2006, 22(4): 25- 29.
[19] 许秀丽, 张奇, 李云良, 谭志强, 王晓龙. 鄱阳湖洲滩芦苇种群特征及其与淹水深度和地下水埋深的关系. 湿地科学, 2014, 12(6): 714- 722.
[20] 夏贵菊, 何彤慧, 赵永全, 翟昊. 银川平原芦苇生态特征与土壤因子的关系. 土壤通报, 2015, 46(1): 99- 104.
[21] 王雪宏, 佟守正, 吕宪国. 半干旱区湿地芦苇种群生态特征动态变化研究——以莫莫格湿地为例. 湿地科学, 2008, 6(3): 386- 391.
[22] 张林海, 曾从盛, 仝川. 闽江河口湿地芦苇和互花米草生物量季节动态研究. 亚热带资源与环境学报, 2008, 3(2): 25- 33.
[23] Clevering O A, Brix H, Lukavská J. Geographic variation in growth responses inPhragmitesaustralis. Aquatic Botany, 2001, 69(2- 4): 89- 108.
[24] Karunaratne S, Asaeda T, Yutani K. Growth performance ofPhragmitesaustralisin Japan: influence of geographic gradient. Environmental and Experimental Botany, 2003, 50(1): 51- 66.
[25] 张友民, 杨允菲, 王立军. 三江平原沼泽湿地芦苇种群生产与分配的季节动态. 中国草地学报, 2006, 28(4): 1- 5.
[26] 赵文智, 常学礼, 李启森, 何志斌. 荒漠绿洲区芦苇种群构件生物量与地下水埋深关系. 生态学报, 2003, 23(6): 1138- 1146.
[27] 张宏斌, 孟好军, 刘贤德, 张芬琴, 赵维俊. 黑河流域中游水陆交错带湿地芦苇种群动态变化特征. 生态科学, 2012, 31(5): 500- 506.
[28] 昝肖肖, 徐宾铎, 任一平, 王小林, 蔡星媛. 青岛大沽河河口湿地芦苇的生长及生物量动态研究. 中国海洋大学学报, 2011, 41(11): 27- 33.
[29] 段晓男, 王效科, 欧阳志云, 苗鸿, 郭然. 乌梁素海野生芦苇群落生物量及影响因子分析. 植物生态学报, 2004, 28(2): 246- 251.
[30] 吴春燕, 何彤慧, 夏贵菊, 于骥. 银川平原湿地芦苇群落的密度效应研究. 西北林学院学报, 2016, 31(2): 98- 102.
[31] 陈清, 刘丹, 马成仓, 王中良. 天津典型湿地芦苇种群生产力和氮磷营养结构与环境因子的关系. 生态与农村环境学报, 2016, 32(1): 60- 67.
[32] 崔保山, 赵欣胜, 杨志峰, 唐娜, 谭学界. 黄河三角洲芦苇种群特征对水深环境梯度的响应. 生态学报, 2006, 26(5): 1533- 1541.
[33] 马金妍, 石冰, 王开运, 巩晋楠, 侯颖. 崇明东滩湿地围垦区芦苇生物量影响因素初探. 生态与农村环境学报, 2009, 25(4): 100- 102.
[34] Asaeda T, Manatunge J, Roberts J, Hai D N. Seasonal dynamics of resource translocation between the aboveground organs and age-specific rhizome segments ofPhragmitesaustralis. Environmental and Experimental Botany, 2006, 57(1): 9- 18.
[35] 邓正苗, 陈心胜, 谢永宏. 植物芽库的研究进展. 生态学杂志, 2010, 29(9): 1812- 1819.
[36] 杨东方, 苗振清. 数学模型在生态学的应用及研究. 北京: 海洋出版社, 2010: 1- 2.
[37] 杨允菲, 张宝田. 松嫩平原草甸生境甘草种群生殖构件表型可塑性及变化规律. 草业学报, 2006, 15(2): 14- 20.
[38] 盖平, 鲍智娟, 张结军, 秦永发. 环境因素对芦苇地上部生物量影响的灰色分析. 东北师大学报: 自然科学版, 2002, 34(3): 87- 91.
[39] 邓春暖, 章光新, 李红艳, 李然然. 莫莫格湿地芦苇对水盐变化的生理生态响应. 生态学报, 2012, 32(13): 4146- 4153.
[40] 邓春暖, 章光新, 潘响亮. 莫莫格湿地芦苇生理生态特征对水深梯度的响应. 生态科学, 2012, 31(4): 352- 356.
[41] Vretare V, Weisner S E B, Strand J A, Granéli W. Phenotypic plasticity inPhragmitesaustralisas a functional response to water depth. Aquatic Botany, 2001, 69(2- 4): 127- 145.
[42] Engloner A I. Annual growth dynamics and morphological differences of reed (Phragmitesaustralis[Cav.] Trin. ex Steudel) in relation to water supply. Flora—Morphology, Distribution, Functional Ecology of Plants, 2004, 199(3): 256- 262.
[43] 冯忠江, 赵欣胜. 黄河三角洲芦苇生物量空间变化环境解释. 水土保持研究, 2008, 15(3): 170- 174.
[44] Pagter M, Bragato C, Brix H. Tolerance and physiological responses ofPhragmitesaustralisto water deficit. Aquatic Botany, 2005, 81(4): 285- 299.
QuantitativecharacteristicsoftherametmoduleofPhragmitesaustralispopulationsinheterogeneoushabitatsintheZhalongWetlandNationalReserve
JIAO Dezhi1,2, RONG Zi1, CAO Rui1, YAN Qiuyue1, JIANG Qiuxu1, YANG Yunfei2,*
1CollegeofLifeScienceandAgriculture,Forestry,QiqiharUniversity,Qiqihar161006,China2KeyLaboratoryofVegetationofEducationMinistry,InstituteofGrasslandScience,NortheastNormalUniversity,Changchun130024,China
By sampling a unit area and using methods such as counting and measuring, a comparative study was performed on the quantitative characteristics of the ramet module ofPhragmitesaustralispopulations in four habitats in the Zhalong Wetland National Reserve. The results showed that theP.australispopulations in the four habitats turned green around May 10 and began to enter the vegetative growth period. The height and density of the ramets continued to increase until the beginning of the reproductive growth period in August, and a significant difference was observed between June and August (P< 0.05). The difference was not significant from August to October (P> 0.05). When theP.australispopulations entered the reproductive growth period, the ramets stopped growing in height, and at the same time, the output of the underground bud no longer formed ramets to increase realistic population. The biomass of the ramets and population continued to increase until the beginning of the exuberant reproductive growth period in September, and it decreased when entering the dormant period in October. The difference between each month was significant. At the end of the growing season,P.australispopulations showed characteristics such as distributing and transferring the material produced underground for storage as well as contributing to the formation and growth of vegetative reproductive organs. There was a significant logarithmic correlation between the quantitative characteristics ofP.australisand the actual growth time after returning green. The goodness of fit of equation was 0.818—0.994, and the fitting equation reached a significant level ofP< 0.05. The density of ramets was the highest in the wet habitat, followed by the aquatic habitat and xeric habitat; it was the lowest in the saline-alkali habitat. The height and biomass of the ramets and population were the highest in the aquatic habitat, followed by the wet habitat and xeric habitat; it was the lowest in the saline-alkali habitat. Therefore, the quantitative characteristics of the ramets of theP.australispopulations in the four habitats showed a basically consistent rhythm in the growth period. Individual growth and population dynamics of theP.australispopulations showed obvious environmental effects, and moisture and pH were the main factors that affected the quantitative characteristics of the ramets of theP.australispopulations in the Zhalong Wetland National Reserve.
Zhalong Wetland;Phragmitesaustralispopulation; module; heterogeneous habitats; quantitative characteristics
国家自然科学基金项目(31472134,31672471);黑龙江省教育厅科学技术研究项目(12541887)
2016- 10- 27; < class="emphasis_bold">网络出版日期
日期:2017- 08- 14
*通讯作者Corresponding author.E-mail: yangyf@nenu.edu.cn
10.5846/stxb201610272187
焦德志,荣子,曹瑞,闫秋月,姜秋旭,杨允菲.扎龙湿地保护区异质生境芦苇种群分株构件的数量特征.生态学报,2017,37(23):7843- 7853.
Jiao D Z, Rong Z, Cao R, Yan Q Y, Jiang Q X, Yang Y F.Quantitative characteristics of the ramet module ofPhragmitesaustralispopulations in heterogeneous habitats in the Zhalong Wetland National Reserve.Acta Ecologica Sinica,2017,37(23):7843- 7853.

