肝动脉化疗栓塞术对原发性肝癌合并HIV/AIDS患者T淋巴细胞亚群的影响
赵 勇, 魏 国, 胡礼冲,华 欣,何 永,蔡 琳,何盛华
1.成都市公共卫生临床医疗中心 普通外科(成都 610061);2.成都市公共卫生临床医疗中心 放射介入科(成都 610061);3.成都市公共卫生临床医疗中心 感染科(成都 610061)
·论著·
肝动脉化疗栓塞术对原发性肝癌合并HIV/AIDS患者T淋巴细胞亚群的影响
赵 勇1, 魏 国1, 胡礼冲2,华 欣1,何 永1,蔡 琳3,何盛华3
1.成都市公共卫生临床医疗中心 普通外科(成都 610061);2.成都市公共卫生临床医疗中心 放射介入科(成都 610061);3.成都市公共卫生临床医疗中心 感染科(成都 610061)
目的探讨原发性肝癌(primary hepatic carcinoma,PHC)合并人类免疫缺陷病毒(human immunodeficiency virus,HIV)/获得性免疫缺陷综合征(acquired immune deficiency syndrome,AIDS)患者肝动脉化疗栓塞术(transcatheter arterial chemoembolization,TACE)前后T细胞亚群的变化。方法采用回顾性病例对照研究,选取2014年7月至2016年6月在成都市公共卫生临床医疗中心就诊的17例PHC合并HIV/AIDS患者为试验组,同期HIV阴性的PHC患者32例为对照组。采用流式细胞术(FCM)检测两组患者术前1 d及试验组患者术后1、4周外周血 CD3、CD4、CD8 T细胞及CD4/CD8的比值,比较两组患者术前1 d及试验组术后1、4周外周血T细胞亚群各指标的动态变化 。结果试验组术前外周血T细胞亚群CD3、CD4 、 CD4/CD8比值明显低于对照组,而CD8明显高于对照组(P<0.05 );试验组治疗1周后,外周血T细胞亚群 CD3、CD4 、 CD4/CD8比值明显较治疗前下降,CD8明显增高(P<0.05), 而4周后外周血T细胞亚群CD3、CD4及 CD4/CD8 比值较治疗1周后明显增高, CD8明显下降(P<0.05)。结论TACE对PHC合并HIV/AIDS患者是安全、有效的治疗方法。PHC合并HIV/AIDS患者细胞免疫较HIV阴性的PHC患者明显低下,TACE治疗PHC合并HIV/AIDS患者,细胞免疫状态呈现先抑制后恢复的趋势。
获得性免疫缺陷综合征;原发性肝癌;肝动脉化疗栓塞术;T淋巴细胞亚群
艾滋病,即获得性免疫缺陷综合征(acquired immune deficiency syndrome,AIDS),是因人类免疫缺陷病毒(human immunodeficiency virus,HIV)感染所导致的机体免疫功能部分或完全丧失,从而继发各种机会性感染或机会性肿瘤。原发性肝癌(primary hepatic carcinoma,PHC)是我国常见的恶性肿瘤之一,其中,80%以上的PHC病人合并肝硬化,主要与丙型肝炎病毒(hepatitis C virus,HCV)/乙型肝炎病毒(hepatitis B virus,HBV)的慢性感染有关。在我国,80%~90%的PHC与HBV、HCV有关。HIV病毒与HCV/HBV病毒的传播途径相似,故在我国HIV与HCV/HBV共同感染的患者比例也在逐年增加[1]。同时,随着高效抗逆转录疗法(highly active antiretroviral therapy,HAART)在AIDS患者中越来越多的使用,HIV患者生存期的延长,PHC发生在HIV感染患者中的比例也在逐渐增高[1-3]。据相关报道[3],HIV与HBV重叠感染的患者中,肝脏相关疾病是导致HIV感染患者死亡的重要原因,其中,约15%的患者是死于HBV感染的相关肝癌。据报道[4-5],在我国高达60%~70%的PHC患者在首次诊断时已为肿瘤中晚期,无法行根治性手术治疗,尤其是合并HIV病毒感染的患者, 由于其自身免疫缺陷,疾病进展尤为迅速。目前,对PHC晚期不能行根治性治疗的患者,只能用局部疗法或全身综合治疗[6]。肝动脉化疗栓塞术(transcatheter arterial chemoembolization,TACE)、放疗、中医中药等多种方法综合治疗仍是目前最常用及最有效的治疗方法。姑息治疗方法中,仅有TACE术可以提高PHC患者的生存率。PHC合并HIV/AIDS患者的T细胞亚群是否不同于非HIV感染的PHC患者,TACE治疗的PHC合并HIV/AIDS患者T细胞亚群动态变化如何,目前尚不清楚。因此,本研究选取2014年7月至2016年6月在成都市公共卫生临床医疗中心就诊的17例PHC合并HIV / AIDS病人及同期HIV阴性PHC患者32例病人进行回顾性分析,对比PHC合并HIV / AIDS病人TACE治疗前及治疗后1、4周T细胞亚群各指标的动态变化。现报道如下。
1 资料与方法
1.1 临床资料
选取2014年7月至2016年6月我中心行TACE介入治疗的49例PHC患者,所有病例均符合卫生部《原发性肝癌诊疗规范(2011年版)》诊断标准,巴塞罗那分期(BCLC)为A、B期,体力状况(performance status, PS)评分0分,肝功能Child-Pugh评分:A级或B级,无C级,相关影像学检查提示无明显肝动脉-门静脉/肝静脉瘘、无门静脉癌栓、无远处转移病灶。其中,合并HIV感染的PHC患者共17例为试验组,男12例, 女5例, 年龄28~53(34.6±5.6)岁。试验组所有病例术前HIV 抗体初筛阳性,并经四川省成都市疾病预防控制中心(CDC)用蛋白印迹法(Western blot, WB)确证,符合《艾滋病诊疗指南》而确诊[7]。非HIV感染者共32例为对照组,经 ELISA 法初筛 HIV (-),其中,男18例,女14例,年龄42~56(50.2±12.3)岁。两组病例一般状况比较,差异无统计意义(P>0.05),具有可比性。两组PHC患者本次TACE治疗均为首次,TACE治疗前60 d均未接受过放化疗,且试验组患者TACE治疗前均正接受或已经行HAART治疗,没有明确机会性感染。
1.2 方法
1.2.1 TACE治疗方法 所有患者均采用常规Seldinger法行右侧或左侧股动脉穿刺插管,置导管于腹腔动脉或肝总动脉行造影,根据术中造影情况,将导管超选至肝脏的肿瘤供血动脉,必要时可行2.8F微导管超选择插管,以减少对正常肝脏组织的损害。经导管注入碘油与化疗药物充分乳化后的混悬液,行肝动脉内化疗栓塞。治疗方案:5-氟尿嘧啶750~1 000 mg,丝裂霉素20 mg,顺铂40~80 mg,联合超液化碘油5~15 mL,充分乳化后,行介入栓塞化疗术。试验组患者予以常规HARRT等治疗,术后两组均给予常规保肝、水化和止吐、止痛等对症支持治疗。试验组术中,术者穿双层手术衣、双层手套、面罩、鞋套等,避免职业暴露。
1.2.2 实验室检测方法 HIV抗体初筛实验采用ELISA法, 若初筛实验阳性,则行WB确证。两组患者除诊疗指南要求的常规项目外, 分别于术前1 d和术后1 、4周抽取外周静脉血, 检测肝功能指标:天冬氨酸氨基转移酶(alanine aminotransferase,ALT)、门冬氨酸氨基转移酶(aspartate aminotransferase,AST)和总胆红素(total bilimin,TBIL)。采用Beckman Coulter Epics XL流式细胞仪,检测外周血T淋巴细胞亚群:CD3、CD4、CD8以及CD4/CD8比值。
1.3 统计学方法
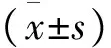
2 结果
2.1 两组患者TACE治疗效果、并发症及预后情况
两组患者在行TACE治疗术后,均予常规保肝、水化和止吐、止痛等对症支持治疗,对照组患者术中、术后均未出现严重并发症,试验组患者术后出现2例机会性感染,均予以对症治疗后好转。两组患者肝功能指标:ALT、AST、TBIL在术后1周复查,均较术前明显升高(P<0.05),经过护肝等综合治疗,术后4周复查,基本恢复到术前水平。两组患者行TACE治疗后,均不同程度出现栓塞后综合症(恶心、呕吐、疼痛、发热、肝区隐痛、纳差等)反应,经及时对症治疗后,逐渐缓解。
2.2 两组患者TACE治疗前T细胞亚群分布比较
试验组患者CD3细胞(801±51)/μL,低于对照组(835±47)/μL,差异有统计学意义(t=2.318,P<0.05)。试验组CD4细胞数量低, 平均(231±19)/μL, 且下降幅度大, CD4<500/μL的占82.35%(14/17),其中,<200/μL的占52.94%(9/17);对照组患者CD4细胞数量为(445±28)/μL, CD4<500/μL的占68.75%(22/32), 其中,<200/μL的占18.75%(6/32) ;两组CD4比较,差异有统计学意义 (t= 31.374,P<0.05) 。试验组CD8细胞(578±33)/μL, 高于对照组( 392±25)/μL,差异有统计学意义 (t=20.268,P<0.05)。由于试验组CD4淋巴细胞数量低, CD8淋巴细胞数量较高, 导致CD4/CD8的比值明显低于对照组(t= 15.121,P<0.05)(表1) 。

表1 术前两组外周血T淋巴细胞亚群分布及比较
2.3 两组TACE治疗前后外周血T细胞亚群的变化
术后1周复查外周血T淋巴细胞亚群:CD3、CD4 及CD4/CD8 较TACE术前明显下降(P<0.05),CD8 较术前明显升高(P<0.05);术后4周外周血T淋巴细胞亚群:CD3、CD4 及CD4/CD8较术后1周升高(P<0.05),CD8 较术后1周下降(P<0.05)(表2~5)。

表2 两组手术前后外周血CD3计数
注:与术前比较,﹡P<0.05;与术后1周比较,△P<0.05

表3 两组手术前后外周血CD4计数
注:与术前比较,﹡P<0.05;与术后1周比较,△P<0.05

表4 两组手术前后外周血CD8计数
注:与术前比较,﹡P<0.05;与术后1周比较,△P<0.05

表5 两组手术前后外周血CD4/CD8比值
注:与术前比较,﹡P<0.05;与术后1周比较,△P<0.05
3 讨论
相关研究[8]表明,TACE术不仅阻断了PHC患者肿瘤供血动脉,而且化疗药物同时也杀伤肿瘤细胞,两者结合促进了肝脏肿瘤细胞的凋亡、坏死。TACE术对人体正常的肝脏组织细胞也会造成一定程度的缺血再灌注损伤及化疗药物的细胞毒性反应,导致TACE治疗术后1周主要肝功指标(ALT、AST、TBIL)较术前明显升高,术后予以护肝、水化等综合治疗,经过4周修复,肝功能逐渐恢复[9]。本研究试验组17例患者行TACE治疗,术后1周复查肝功能指标:ALT、AST、TBIL均出现不同程度损害,术后予以护肝、水化等综合治疗,术后4周复查,逐渐恢复正常,期间无肝功能衰竭,这与对照组肝功能变化相同。有研究[1]表明,HIV患者中,PHC发生的主要原因是由于其机体共同感染HCV/HBV病毒所致。虽然,HIV病毒感染的特殊性,导致机体免疫力缺陷,致使机体对抗肿瘤的免疫应答减弱,促进癌细胞增殖,但目前并无确切的证据表明HIV感染与PHC的发生有相关性[1],因此,TACE术对PHC合并HIV/AIDS患者的肝功能影响,与普通患者相同。
人体内CD3淋巴细胞代表成熟的T淋巴细胞,是机体内最主要的细胞免疫活性细胞。CD4细胞被称作辅助性T细胞(helper T cells, Th),具有协助体液免疫和细胞免疫的功能。CD8细胞被称作细胞毒性T细胞。临床上,通过抽取外周静脉血,检测CD4、CD8细胞计数以及CD4/CD8淋巴细胞比值,来评价机体免疫系统的平衡状态。正常患者体内, CD4、CD8细胞计数及两者相对比处于相对稳定、平衡的状态,予以维持患者细胞免疫功能的平衡。但在肿瘤患者,尤其是恶性癌症患者中,免疫系统常受到不同程度破坏,表现为外周血CD4细胞的计数降低,CD8细胞的计数增加,CD4/CD8淋巴细胞比值降低[10],说明肿瘤患者的细胞免疫功能处于抑制状态,对识别和杀伤突变细胞的能力下降,从而导致了肿瘤生长和转移。在HIV/AIDS患者中,HIV病毒感染人体后,导致体内CD4细胞计数明显减少,CD8细胞计数明显增加,加速细胞免疫功能的损害,最后导致各种机会性感染及肿瘤。 本研究结果显示,普通肝癌患者外周血CD3、CD4、CD4/CD8比值较正常值降低,CD8淋巴细胞计数升高,提示PHC患者的免疫功能处于明显抑制状态。PHC合并HIV/AIDS患者相对于PHC患者,外周血CD3、CD4、CD4/CD8比值更低(P<0.05),CD8细胞计数明显增加(P<0.05),可能与HIV的免疫原性相关, 即AIDS比肿瘤细胞更能引起机体强烈的免疫效应。本研究中,试验组患者TACE治疗前后无死亡病例,但存在2例机会性感染,可能是HIV患者TACE术后,免疫力较术前明显降低,增加机会性感染概率,予以及时治疗后好转。因此,对PHC合并HIV/AIDS患者行T淋巴细胞的研究成为监测其免疫系统平衡的一个重要内容。
TACE术在治疗PHC患者时,对患者免疫功能的影响,业内观点不同,一部分学者认为:TACE术使PHC患者原本脆弱的免疫系统进一步遭受打击,导致其免疫力进一步降低[11-12];另一部分学者持截然相反的观点:PHC患者虽然免疫力因为肿瘤细胞的影响而受到抑制,但行TACE治疗后,肿瘤细胞凋亡、坏死,使患者体内肿瘤负荷减少,肿瘤细胞所分泌的免疫抑制因子减少,所以,机体的免疫力可以得到恢复[13-14]。本研究中,两组患者行TACE介入治疗后1周,复查外周血CD3、CD4、CD4/CD8比值均较术前明显降低,CD8细胞计数较术前升高,说明PHC患者在行TACE治疗后,短时期内其免疫抑制状态较术前加重。这可能是由于PHC患者行TACE介入治疗时,所用的碘化油与化疗药物不仅对肿瘤细胞产生损害,同时,对肝脏正常组织也产生了一定毒副作用,使PHC患者原本相对低下的免疫力更加受到抑制。但TACE术后,两组患者均予以护肝、水化等综合治疗,未使用免疫增强剂情况下,经过4周恢复,患者免疫状态较介入治疗1周后好转,甚至部分患者免疫力恢复至介入治疗前,这可能是由于患者的肿瘤细胞直接受到化疗药物及缺血灌注损伤,导致肿瘤细胞坏死,从而减轻了患者的肿瘤负荷,体内免疫抑制因子降低,故机体的免疫系统得到逐渐恢复。可见,TACE治疗对PHC患者的细胞免疫功能呈现先抑制后逐渐恢复的趋势,提示在临床工作中,PHC患者在行TACE治疗期间,术前、术后应该动态检测患者外周血T淋巴细胞亚群的变化,了解患者免疫状况,有利于评价下次介入治疗的时机,为下次TACE治疗提供一定的免疫学证据。尤其是PHC合并HIV/AIDS患者,自身免疫力严重缺陷,动态监测T淋巴细胞亚群的变化,有利于评价患者免疫状态的恢复情况,从而选择恰当的治疗时机。
CD4细胞是HIV病毒感染的主要靶细胞,故CD4淋巴细胞的变化提示机体感染HIV病毒后,免疫力受到损害的程度[14]。有研究[14-15]表明,当HIV感染患者外周静脉血CD4淋巴细胞计数<200/μL时,HIV感染患者在进行手术时需高度谨慎,因为此时患者免疫力处于重度低下水平,导致机会性感染的发生率明显增加,但在挽救生命的时候,应根据患者病情的详细情况,向病人及病人委托人充分阐明手术的必要性及可能的风险和预后,再决定是否手术。PHC患者的TACE治疗属于微创手术治疗,创伤相对较小。有研究[16-17]表明,PHC患者在行TACE手术治疗时,选择合适剂量的栓塞及化疗药物,对于肿瘤患者的预后影响不大。本研究中,17例PHC合并HIV/AIDS患者在TACE介入术前,均正在接受或已接受HARRT的治疗,其中,有2例CD4细胞计数<200/μL患者,在行TACE治疗后出现机会性感染,并予以积极对症治疗,好转恢复出院。PHC合并HIV/AIDS患者在行TACE介入治疗后4周,复查外周静脉血CD3、CD4、CD8细胞计数及CD4/CD8比值较术后1周明显恢复,基本达到介入治疗前水平,这与普通PHC患者相仿,说明PHC合并HIV/AIDS患者在行介入治疗期间,免疫状态的变化与HIV阴性的PHC患者基本一致,免疫功能呈现先抑制后逐渐恢复的趋势。因此,笔者认为对PHC合并HIV/AIDS的患者,在TACE治疗术前,应充分评估患者肝功能、细胞免疫状态,且行正规HARRT治疗,严格掌握手术适应证、手术时机及手术禁忌症。治疗期间,动态监测患者的T淋巴细胞亚群,评价适当的治疗时机。但由于HIV/AIDS患者自身免疫缺陷,警惕机会性感染发生,以便提高治疗的有效性及安全性。
综上所述,TACE对PHC合并HIV/AIDS患者是安全、有效的治疗方法。PHC合并HIV/AIDS患者细胞免疫较HIV阴性的PHC患者明显低下,TACE治疗PHC合并HIV/AIDS患者细胞免疫状态呈现先抑制后恢复的趋势。
[1]刘丽杰, 罗治文, 朱樑. 合并感染人类免疫缺陷病毒的肝癌患者的治疗[J]. 胃肠病学和肝病学杂志, 2006, 15(6): 630-633.
[2]张永喜, 桂希恩, 钟亚华, 等. 艾滋病病毒感染人群中恶性肿瘤的常见类型及其生存分析[J]. 肿瘤研究与临床, 2010, 22(11): 764-766.
[3]Salmon-Ceron D, Lewden C, Morlat P,etal. Liver disease as a major cause of death among HIV infected patients: role of hepatitis C and B viruses and alcohol[J]. J Hepatol, 2005, 42(6): 799-805.
[4]Bruix J, Sherman M, Llovet J M,etal. Clinical management of hepatocellular carcinoma. Conclusions of the Barcelona-2000 EASL conference. European Association for the Study of the Liver[J]. J Hepatol, 2001, 35(3): 421-430.
[5]Hoofnagle J H. Hepatocellular carcinoma: summary and recommendations[J]. Gastroenterology, 2004, 127(5 Suppl 1): S319-S323.
[6]廖娟, 王春晖, 李肖, 等. 经导管肝动脉化疗栓塞术对原发性肝癌患者细胞免疫及调节T细胞的影响[J]. 肝脏, 2011, 16(3): 198-201.
[7]中华医学会感染病学分会艾滋病学组. 艾滋病诊疗指南[J]. 中华传染病杂志, 2006, 24(2): 133-144.
[8]肖恩华, 胡国栋, 李锦清, 等. 化疗栓塞后肝细胞癌细胞凋亡和耐药基因表达的改变[J]. 放射学实践, 2000, 15(6): 387-389.
[9]黄得校, 陈勇, 曾庆乐, 等. 大剂量干扰素联合化疗药物经导管动脉化疗栓塞术对肝癌患者T细胞亚群的影响[J]. 广东医学, 2013, 34(20): 3185-3188.
[10] Cho Y, Miyamoto M, Kato K,etal. CD4+ and CD8+ T cells cooperate to improve prognosis of patients with esophageal squamous cell carcinoma[J]. Cancer Res, 2003, 63(7): 1555-1559.
[11] 李彩霞, 李传福, 曹驰. 肝癌患者TACE前后细胞免疫状态变化[J]. 山东大学学报(医学版), 2003, 41(5): 553-555.
[12] 卢伟, 李彦豪, 何晓峰, 等. 经导管动脉化疗栓塞术中化疗药物剂量对肝癌患者T细胞亚群的影响[J]. 第一军医大学学报, 2002, 22(6): 524-526.
[13] 侯恩存, 王新, 练祖平, 等. 肝动脉化疗栓塞术对原发性肝癌患者T淋巴细胞亚群的影响[J]. 临床外科杂志, 2006, 14(11): 725-726.
[14] 夏咸军, 陈辉, 刘永福, 等. 艾滋病合并恶性肿瘤的临床特征及外科治疗分析[J]. 中华普通外科杂志, 2012, 27(9): 763-765.
[15] Xia X J, Liu B C, Su J S,etal. Preoperative CD4 count or CD4/CD8 ratio as a useful indicator for postoperative sepsis in HIV-infected patients undergoing abdominal operations[J]. J Surg Res, 2012, 174(1): e25-e30.

[17] 卢伟, 李彦豪, 李祖国, 等. 小剂量和常规剂量化疗药物经导管动脉内化疗栓塞后肝癌细胞坏死及凋亡的比较研究[J]. 中华放射学杂志, 2003, 37(3): 232-237.
TheEffectofTranscatheterArterialChemoembolizationonTlymphocyteSubsetsinPatientswithPrimaryHepaticCarcinomaComplicatedwithHIV/AIDS
ZhaoYong1,WeiGuo1,HuLichong2,HuaXin1,HeYong1,CaiLin3,HeShenghua3.
1.DepartmentofGeneralSurgery,PublicHealthClinicalCenterofChengdu,Chengdu610061,China; 2.DepartmentofRadiationIntervention,PublicHealthClinicalCenterofChengdu,Chengdu610061,China; 3.DepartmentofInfection,PublicHealthClinicalCenterofChengdu,Chengdu610061,China
ObjectiveTo investigate the changes of T lymphocyte subsets in patients with primary hepatocellular carcinoma (PHC) complicated with acquired immune deficiency syndrome (AIDS) before and after transcatheter arterial chemoembolization (TACE).MethodsThe retrospective case control study was adopted. 17 patients of PHC complicated with AIDS treated in Public Health Clinical Center of Chengdu from July of 2014 to June of 2016 were selected into the experiment group, while the other 32 PHC cases without HIV infection over the corresponding period were selected into the control group. The flow cytometry (FCM) was adopted to measure the Counts of CD3, CD4, CD8 T lymphocyte and the ratio of CD4 to CD8 in peripheral blood 1 day before TACE in both groups and 1 and 4 weeks after TACE in the experiment group respectively. The differences of T lymphocyte subsets in peripheral blood before TACE between the two groups were compared, and the dynamic changes of T lymphocyte subsets in peripheral blood of the experiment group 1 and 4 weeks after TACE were compared.ResultsThe counts of CD3 and CD4 and the ratio of CD4 to CD8 in peripheral blood in the experiment group were significantly lower than those in the control group before TACE (P<0.05), while the count of CD8 in the experiment group was significantly higher than that in the control group (P<0.05). The counts of CD3 and CD4 and the ratio of CD4 to CD8 in peripheral blood were significantly reduced (P<0.05) and the count of CD8 was significantly increased (t=8.433) (P<0.05) 1 week after TACE than 1 day before TACE. The counts of CD3 and CD4 and the ratio of CD4 to CD8 in peripheral blood were significantly increased (P<0.05) and the count of CD8 was significantly reduced (P<0.05) 4 weeks after TACE than 1 week after TACE.ConclusionTACE is a safe and effective treatment for the patients with PHC complicated with HIV/AIDS. The cellular immune function of the patients with PHC complicated with HIV/AIDS is significantly lower than that of the PHC patients without HIV infection and TACE could significantly improve the cellular immunity of the patients with PHC complicated with HIV/AIDS by inhibiting it at first.
Acquired immune deficiency syndrome; Primary hepatic carcinoma; Transcatheter arterial chemoembolization; T lymphocyte subsets
10.3969/j.issn.1674-2257.2017.06.017
R735.7
A

