柚皮素对3T3-L1和HepG2细胞胰岛素抵抗模型葡萄糖摄取能力和胰岛素敏感性的影响*
王 元,曾凯宏,Δ,邓 波,余雪梅,宋 怡,黄璐娇,周 雪
1. 电子科技大学医学院(成都 610054);2. 四川省医学科学院·四川省人民医院 临床营养科(成都 610072)
·论著·
柚皮素对3T3-L1和HepG2细胞胰岛素抵抗模型葡萄糖摄取能力和胰岛素敏感性的影响*
王 元1,曾凯宏1,2Δ,邓 波2,余雪梅2,宋 怡2,黄璐娇2,周 雪2
1. 电子科技大学医学院(成都 610054);2. 四川省医学科学院·四川省人民医院 临床营养科(成都 610072)
目的探讨柚皮素(Naringenin,Nar)对3T3-L1和HepG2 细胞胰岛素抵抗(Insulin Resistance,IR)模型葡萄糖摄取能力和胰岛素敏感性的影响。方法采用含0.5 mM IBMX 、1 μM 地塞米松、10 mg/L 胰岛素的诱导液将3T3-L1细胞诱导分化为成熟脂肪细胞,采用高糖/高胰岛素诱导建立3T3-L1和HepG2 细胞IR模型;按照空白组、正常组、IR模型组、对照药物IR组以及不同浓度Nar干预IR组;以MTT法检测细胞增殖;以葡萄糖氧化酶法(GOD)检测细胞对葡萄糖的摄取量。结果与正常组细胞相比,3T3-L1和HepG2 IR模型组细胞增殖受到抑制、葡萄糖摄取量减少以及对胰岛素敏感性减弱(P<0.001);Nar干预IR模型组能明显促进IR细胞的增殖,增加IR细胞的葡萄糖摄取和增强对胰岛素的敏感性(P<0.001)。结论Nar对3T3-L1和HepG2 细胞IR模型葡萄糖摄取能力降低和胰岛素敏感性改变有改善作用,可以作为防治IR的一种手段。
柚皮素;胰岛素抵抗;细胞增殖;葡萄糖摄取;胰岛素敏感性
糖尿病(Diabetes mellitus,DM)的发病率呈逐年现上升趋势,DM分为Ⅰ型DM(T1DM)和Ⅱ型DM(T2DM),其中T2DM 占90%~ 95%[1]。胰岛素抵抗(Insulin Resistance,IR)和胰岛β细胞功能障碍是T2DM的两大病理生理特征,机体组织(脂肪、肝脏、肌肉组织等)产生IR时靶细胞摄取和利用葡萄糖能力及对胰岛素的敏感性降低[2]。柚皮素(Naringenin,Nar)是柚皮苷的苷元,属于二氢黄酮类化合物,主要存在于芸香科植物葡萄柚及柑橘类水果中,现已证实, Nar具有抗氧化、免疫调节、调节血糖及升高血浆胰岛素浓度等作用[3]。但Nar对IR引起的细胞葡萄糖摄取和利用能力降低及对胰岛素的敏感性改变的效用,目前在国内外尚无研究报道。本实验以高糖/高胰岛素诱导的小鼠前脂肪细胞(3T3-L1)和人肝癌细胞(HepG2)IR模型为研究对象,检测Nar对两种细胞IR模型细胞增殖、葡萄糖摄取能力和胰岛素敏感性的影响。
1 材料与方法
1.1 材料
1.1.1 细胞 小鼠前脂肪细胞(3T3-L1)和人肝癌细胞(HepG2)购自ATCC公司。
1.1.2 主要试剂和仪器 Nar、罗格列酮购自BBI Life Science公司。3-异丁基-1-甲基黄嘌呤 (IBMX)、地塞米松、胰岛素均购自Sigma 公司, DMEM 培养基、胎牛血清(FBS) 购自 Gibco 公司,葡萄糖氧化酶法测定试剂盒(GOD)购于北京普利莱公司,噻唑蓝(MTT)购于碧云天公司,油红O染色试剂盒购于上海歌凡生物公司,其他试剂均为分析纯级别,酶标仪型号为Thermo Fisher Multiskan FC酶标仪。
1.2 方法
1.2.1 3T3-L1和HepG2细胞培养及3T3-L1细胞诱导分化 3T3-L1 和HepG2细胞在37 ℃、5% CO2恒湿的孵箱中培养,使用含10% FBS的高糖DMEM培养基,每 48 h 换培养液1次。将3T3-L1细胞诱导分化为成熟脂肪细胞的步骤如下:待细胞融合2 d后,加入含0.5 mM IBMX 、1 μM地塞米松、10 mg/L胰岛素和10% FBS的高糖DMEM培养基培养48 h,换含10 mg/L胰岛素和10% FBS的高糖 DMEM培养基培养48 h,换含10% FBS的高糖 DMEM培养基继续培养,每48 h换1次培养液,诱导分化至8~14 d[4]。
1.2.2 3T3-L1成熟脂肪细胞的鉴定 将分化成熟的3T3-L1脂肪细胞去掉培养液,用 PBS洗3次,用10%多聚甲醛固定液固定15 min,再用PBS洗3次,以油红O染色30 min,倒置显微镜下观察染色结果,并拍摄图片,若发现85%以上的细胞呈含脂滴状态即诱导成功[4-5]。
1.2.3 建立3T3-L1和HepG2细胞IR模型 将生长状态良好的细胞均匀接种在 96 孔板中。3T3-L1前脂肪细胞按照“1.2.1”的方法诱导分化为成熟的脂肪细胞,换含10% FBS的低糖DMEM培养基培养48 h,换入无血清的低糖DMEM培养基培养12 h,换入含100 nM胰岛素、10% FBS的高糖DMEM培养基干预30 min,建立3T3-L1脂肪细胞IR模型[5]。待HepG2细胞生长稳定,换2% FBS低糖DMEM培养基培养12 h,换含100 nM胰岛素、2% FBS的低糖DMEM培养基培养24 h,建立HepG2细胞IR模型[6]。
1.2.4 实验分组 将两种细胞均分为空白组(无细胞,只含DMEM培养基)、正常组(正常细胞,不加任何药物,简称Nor组)、IR模型组(IR模型细胞,不加任何药物,简称IR组)、对照药物IR组(IR模型细胞,20 μg/mL罗格列酮,简称Con组)和不同浓度(12.5、25、50、75、100、150 μg/mL)Nar干预IR组,共6组,每组设6个复孔。各组做相应处理后,于培养箱内培养24 h。
1.2.5 检测Nar对3T3-L1和HepG2细胞各组细胞增殖的影响 按照“1.2.4”所述方法进行干预后,每孔加MTT溶液10 μL,培养箱内孵育4 h,吸弃上清培养液,加DMSO 150 μL,振荡30 min,用酶标仪于490 nm波长处测量OD值,以每孔OD值减去空白组OD值计算细胞增殖,实验重复3次。
1.2.6 检测Nar对 3T3-L1和 HepG2各组细胞葡萄糖摄取的影响 按照“1.2.4”所述方法进行干预后,吸弃上清培养液,每孔加100 μL含10% FBS低糖DMEM培养基培养1 h,用GOD法测定每孔内剩余葡萄糖含量,于酶标仪570 nm波长处测定 OD值,葡萄糖摄取量=空白组葡萄糖含量-每孔剩余葡萄糖含量,实验重复3次。
1.2.7 检测Nar对 3T3-L1和HepG2各组细胞胰岛素敏感性的影响 按照“1.2.4”所述方法进行干预后,吸弃上清培养液,每孔加100 μL含100 nM胰岛素、10% FBS低糖DMEM培养基培养1 h,按“1.2.6”所述方法测葡萄糖摄取量,实验重复3次。
1.3 统计学方法
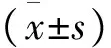
2 结果
2.1 3T3-L1成熟脂肪细胞的鉴定
3T3-L1细胞为贴壁细胞,呈长梭形,不聚团生长。诱导3T3-L1细胞8 d后,每孔中细胞均呈现典型的脂肪细胞表型,细胞中富含脂滴>85%,脂滴可被油红染色。大部分3T3-L1细胞已被诱导为脂肪细胞,可用于进一步实验(图1)。

图1 3T3-L1细胞光学显微镜图片(×100)注:A:诱导前细胞形态;B:诱导后细胞形态;C:诱导后细胞油红O染色
2.2 Nar 干预对 3T3-L1和HepG2细胞IR模型细胞增殖的影响
光学显微镜下,与正常3T3-L1脂肪细胞相比,3T3-L1 IR组细胞增殖降低,脂滴量减少,Nar干预能使IR细胞增殖,脂滴量增加。HepG2细胞呈多角形,并聚团生长,与正常HepG2细胞相比,HepG2 IR细胞团之间透亮的死亡细胞增多,细胞增殖减少,Nar干预能使IR组细胞团之间细胞死亡减少,细胞增殖明显增加。
与正常组比较,3T3-L1 IR模型细胞的增殖受到明显抑制(P<0.001);与IR模型组比较,不同浓度Nar干预均促进3T3-L1 IR 模型细胞的增殖(P<0.001),50 μg/mL和75 μg/mL Nar对3T3-L1 IR模型细胞的增殖效果最明显。与正常组比较,HepG2细胞IR模型细胞增殖受到明显抑制(P<0.001);与IR模型组比较,不同浓度Nar干预均促进HepG2细胞IR模型细胞的增殖(P<0.001),不同浓度Nar干预组之间对HepG2细胞IR模型细胞的增殖进行比较,差异无统计学意义(P>0.05)(图2~4)。
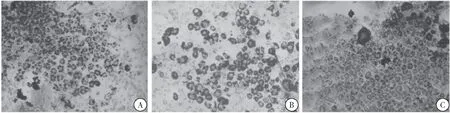
图2 3T3-L1细胞油红O染色光学显微镜图片(×100)注:A:正常脂肪细胞;B:IR模型细胞;C:IR模型Nar干预细胞

图3 HepG2细胞光学显微镜图片(×100)注:A:正常细胞;B:IR模型细胞;C:IR模型Nar干预细胞

图4 Nar 对3T3-L1和HepG2 IR模型细胞增殖的影响
注:A: Nar干预对3T3-L1 IR模型细胞增殖的影响;B:Nar干预对HepG2 IR模型细胞增殖的影响;与正常组比较,***P<0.001;与模型组比较,###P<0.001
2.3 Nar 干预对 3T3-L1细胞IR模型细胞葡萄糖摄取和胰岛素敏感性的影响
通过未加胰岛素的培养基里的葡萄糖摄取量来检测Nar 干预对 3T3-L1脂肪细胞葡萄糖摄取的影响,而加胰岛素的培养基里的葡萄糖摄取量来检测Nar 干预对 3T3-L1脂肪细胞的胰岛素敏感性的影响。未加胰岛素组中,与3T3-L1细胞正常组相比,IR模型组细胞葡萄糖摄取明显降低(P<0.001),Nar干预能使IR细胞葡萄糖摄取明显增加(P<0.001),其中75 μg/mL Nar干预组葡萄糖摄取增加最为明显,且略高于对照组细胞葡萄糖摄取。加胰岛素组中,与3T3-L1细胞正常组对比,IR模型组细胞对葡萄糖摄取明显降低(P<0.001);Nar干预能使IR细胞葡萄糖摄取明显增加,其中25、50、75 μg/mL Nar干预组葡萄糖摄取增加最明显(P<0.001)(图5)。

图5 Nar 对 3T3-L1 脂肪细胞葡萄糖摄取能力和胰岛素敏感性改变的影响
注:A:培养基中未加胰岛素,测定葡萄糖摄取值,检测不同浓度Nar 干预对 3T3-L1 IR模型葡萄糖摄取能力的影响;B:培养基中加胰岛素,测定葡萄糖摄取值,检测不同浓度Nar干预对 3T3-L1 IR模型胰岛素敏感性改变的影响结果; 与正常组比较,***P<0.001;与模型组比较,###P<0.001
2.4 Nar 干预对HepG2细胞IR细胞模型细胞葡萄糖摄取和胰岛素敏感性的影响
通过未加胰岛素的培养基里的葡萄糖摄取量来检测Nar 干预对HepG2细胞葡萄糖摄取的影响,而加胰岛素的培养基里的葡萄糖摄取量来检测Nar 干预对HepG2细胞的胰岛素敏感性的影响。未加胰岛素组中,与HepG2细胞正常组相比,IR模型组细胞葡萄糖摄取明显降低(P<0.001),Nar干预能使IR细胞葡萄糖摄取明显增加(P<0.001),其中25、50 μg/mL Nar干预组葡萄糖摄取增加最明显,且略高于对照组细胞葡萄糖摄取。加胰岛素组中,与HepG2细胞正常组对比,IR模型组细胞对葡萄糖摄取明显降低(P<0.001);Nar干预能使IR细胞葡萄糖摄取明显增加,其中50 μg/mL Nar干预组葡萄糖摄取增加最明显(P<0.001)(图6)。

图6 Nar 对HepG2细胞葡萄糖摄取能力和胰岛素敏感性改变的影响
注:A:在培养基中未加胰岛素,测定葡萄糖摄取值,检测不同浓度Nar干预对HepG2 IR模型葡萄糖摄取能力的影响;B:在培养基中加胰岛素,测定葡萄糖摄取值,检测不同浓度Nar干预对HepG2 IR模型胰岛素敏感性的影响;与正常组比较,***P<0.001;与模型组比较,###P<0.001
3 讨论
据文献[7]报道,近年全球T2DM的发病率呈逐渐上升趋势,并且由T2DM诱发的并发症患者人数也在逐年增加,因此,探索防护T2DM的方法已成为临床关注的热点问题之一。Nar是一种广泛存在于芸香科植物中的二氢黄酮类化合物, 具有抗炎,抗氧化,抗肿瘤等多种药理活性,显示出丰富的资源优势和巨大的潜在利用价值。有研究[8]发现,膳食补充Nar可以明显降低STZ诱导的DM小鼠的空腹血糖和血浆的糖化血红蛋白值,明显升高糖尿病小鼠血浆中胰岛素浓度;可降低血浆中ALT、AST、 ALP、LDH值,可以改善STZ诱导的DM小鼠的炎症反应[9]。并且,有研究[10]表明,在L6肌肉细胞中Nar通过激活AMPK磷酸化从而增加葡萄糖摄取。但是,目前还未有关Nar对3T3-L1脂肪细胞IR细胞模型的研究报道。
综上所述,本研究采用高糖/高胰岛素成功诱导3T3-L1和HepG2 细胞IR细胞模型,以不同浓度的Nar对诱导成功的IR细胞模型进行干预,发现Har对3T3-L1成熟脂肪细胞和HepG2 细胞IR模型细胞有促进增殖作用,并且能促进3T3-L1成熟脂肪细胞和HepG2 细胞IR模型细胞的葡萄糖摄取和增加胰岛素的敏感性,其中25、50、70 μg/mL Nar对3T3-L1和HepG2 细胞IR模型的葡萄糖摄取和胰岛素敏感性的促进作用最为理想。本研究证实,Nar通过缓解IR机制,在改善由于机体产生IR的糖代谢紊乱方面可以起到一定的改善效果,为进一步研究Nar对抗IR机制做了前期铺垫,可能成为今后防治T2DM IR机制的常用手段。
[1]汪会琴,胡如英,武海滨,等. 2型糖尿病报告发病率研究进展[J]. 浙江预防医学, 2016, 28(1), 37-39.
[2]钱虹, 陆锐明. 糖尿病的研究现状及进展[J]. 医学综述, 2015, 21(13): 2418-2420.
[3]Annadurai T, Muralidharan A R, Joseph T,etal. Antihyperglycemic and antioxidant effects of a flavanone, naringenin, in streptozotocin-nicotinamide-induced experimental diabetic rats[J]. J Physiol Biochem, 2012, 68(3): 307-318.
[4]王友升, 田元元, 蔡琦玮. 前体脂肪细胞3T3-L1诱导分化条件的优化[J]. 食品科学技术学报, 2014, 32(3): 38-42.
[5]陈立, 杨明炜, 库宝庆, 等. 3T3-L1脂肪细胞胰岛素抵抗模型建立的3种方法对葡萄糖转运时效关系的影响[J]. 武汉大学学报(医学版), 2012, 33(4): 491-494.
[6]姜保平, 乐亮, 姚霞, 等. HepG2细胞胰岛素抵抗模型的建立及在筛选两色金鸡菊活性化合物中的应用[J]. 中国现代中药, 2017, 19(2): 165-173.
[7]Martínez-Cerón E, García-Río F. Mortality and Cardiovascular Disease in Type 1 and Type 2 Diabetes[J]. N Engl J Med, 2017, 377(3): 300.
[8]Annadurai T, Thomas P A, Geraldine P. Ameliorative effect of naringenin on hyperglycemia-mediated inflammation in hepatic and pancreatic tissues of Wistar rats with streptozotocin-nicotinamide-induced experimental diabetes mellitus[J]. Free Radic Res, 2013, 47(10): 793-803.
[9]Tsai S J, Huang C S, Mong M C,etal. Anti-inflammatory and antifibrotic effects of naringenin in diabetic mice[J]. J Agric Food Chem, 2012, 60(1): 514-521.
[10] Zygmunt K, Faubert B, MacNeil J,etal. Naringenin, a citrus flavonoid, increases muscle cell glucose uptake via AMPK[J]. Biochem Biophys Res Commun, 2010, 398(2): 178-183.
TheEffectofNaringeninonGlucoseUptakeandInsulinSensitivityintheInsulinResistanceModelsof3T3-L1AdipocytesandHepG2Cells
WangYuan1,ZengKaiHong1, 2Δ,DengBo2,YuXueMei2,SongYi2,HuangLuJiao2,ZhouXue2.
1.SchoolofMedicine,UniversityofElectronicScienceandTechnologyofChina,Chengdu610054,China; 2.DepartmentofClinicalNutrition,SichuanAcademyofMedicalSciences&SichuanProvincialPeople'sHospital,Chengdu610072,China
ObjectiveTo investigate the effect of naringenin (Nar) on glucose uptake and insulin sensitivity in the insulin resistance (IR) models of 3T3-L1 adipocytes and HepG2 cells.MethodsThe 3T3-L1 cells were treated with 0.5 mM IBMX, 1μM dexamethasone and 10mg/L insulin to induce mature adipocytes. The IR models of 3T3-L1 adipocytes and HepG2 cells were induced and established by high glucose and high insulin. Then the cells were divided into the blank group, normal control group, IR model group, IR control group with drugs and IR groups with different concentrations of Nar. The cell proliferation was detected by the MTT method and the glucose uptake was detected by the glucose oxidase (GOD) method.ResultsCompared with the normal control group, the cell proliferation, glucose uptake and insulin sensitivity decreased significantly in the IR model of 3T3-L1 adipocytes and HepG2 cells (P<0.001), and the Nar intervention significantly increased their cell proliferation, glucose uptake and insulin sensitivity (P<0.001).ConclusionThe Nar intervention is an effective method in preventing the insulin resistance of 3T3-L1 adipocytes and HepG2 cells by improving their cell proliferation, glucose uptake and insulin sensitivity.
Naringenin; Insulin resistance; Cell proliferation; Glucose uptake; Insulin sensitivity
http://kns.cnki.net/kcms/detail/51.1705.R.20171108.0841.014.html
10.3969/j.issn.1674-2257.2017.06.001
R587.1
A
国家自然科学基金项目(No:81202206);四川省卫生计生委项目(No:150216)
△
曾凯宏,E-mail:zengkaihong2013@hotmail.com

