AFP阳性胃癌多药耐药蛋白水平的研究
杨 建,周业江
西南医科大学附属医院胃肠外科,四川 泸州 646000
AFP阳性胃癌多药耐药蛋白水平的研究
杨 建,周业江
西南医科大学附属医院胃肠外科,四川 泸州 646000
目的分析AFP阳性胃癌(alpha-fetoprotein positive gastric cancer, AFPGC)组织中胸苷酸合成酶(thymidylate synthase, TS)、胎盘型谷胱甘肽-S-转移酶(glutathione S-transferase Pi, GST-π)、P-糖蛋白(P-glycoprotein, P-gp)、DNA拓扑异构酶Ⅱ(topoisomerase Ⅱ, TopoⅡ)的表达,并与AFP阴性胃癌(即普通胃癌)进行对比,以了解AFPGC耐药情况。方法采用免疫组织化学染色法(S-P法)检测临床病理已确诊的27例AFPGC及46例同期普通胃癌组织中TS、GST-π、P-gp、TopoⅡ四种蛋白抗原的表达情况。结果TS、GST-π在AFPGC中的阳性表达率均高于其在普通胃癌中的阳性表达率(P<0.05),P-gp、TopoⅡ在两组胃癌中阳性表达率差异无统计学意义(P>0.05)。结论AFPGC可能较普通胃癌更易出现多药耐药,多药耐药可能是AFPGC预后差的原因之一;AFP的表达可能为胃癌耐药性增加的危险因素之一,AFP可能成为间接评估胃癌患者对化疗药物的敏感性一项指标,以指导临床进行个体化治疗。
AFP;TS;GST-π;P-gp;TopoⅡ;多药耐药;胃癌
胃癌是一种常见的恶性肿瘤,发病率与死亡率均较高,分别居所有恶性肿瘤的第2位及第3位[1]。AFP阳性胃癌(alpha-fetoprotein positive gastric cancer, AFPGC)作为胃癌中的一种特殊类型,1970年BOURREILLE等[2]对其进行了首次报道。随后国内外对其报道逐渐增多,其发病率占所有胃癌病例的1.5%~8.0%,具有高度侵袭性,易发生肝转移、淋巴转移,预后较差[3-8]。就诊时大多已是进展期胃癌,术后辅助化疗对改善总体预后极为重要。然而,化疗的疗效取决于肿瘤对化疗药物的敏感性,随着对肿瘤多药耐药(multidrug resistance, MDR)研究的深入,发现多药耐药与TS、GST-π、P-gp、Topo Ⅱ等蛋白的异常表达有关[9-12]。AFPGC作为一特殊类型的胃癌,总体预后较一般胃癌差,其对化疗药物的敏感性是否也较普通胃癌差?国内外针对AFPGC对化疗药物的敏感性的相关研究尚缺乏。本研究旨在应用免疫组织化学染色法(SP法)检测临床病理已确诊27例AFPGC及46例普通胃癌组织中TS、GST-π、P-gp、Topo Ⅱ四种蛋白抗原的表达情况,以间接了解AFPGC及普通胃癌对常规化疗药物的敏感性是否存在差异,进一步加深对AFPGC的认识,以求为其进行个体化诊治及预后评估提供更多的理论依据。
1 资料与方法
1.1研究对象采用回顾性分析方法,查阅并收集西南医科大学附属医院胃肠外科2013年12月至2017年4月行胃癌根治术或姑息性切除手术治疗,且最终经病理确诊的胃癌患者的完整病历资料。通过血清甲胎蛋白升高(sAFP>10 ng/ml)筛选出可能的AFPGC患者34例,在排除原发性肝癌、肝炎、肝硬化、妊娠等可能引起甲胎蛋白升高的情况下,最终确诊AFPGC患者27例,调用其石蜡块作为研究标本。同时,在排除原发性肝癌、肝炎、肝硬化、妊娠等情况下,随机筛选同期行胃癌手术治疗,且病理确诊的普通(AFP阴性)胃癌患者46例,调用其石蜡块作为研究对照组的标本。
1.2一般资料AFPGC患者中:(1)性别:男14例,女13例;(2)年龄:45~74 岁,≥60岁15例,<60岁12例;(3)肿瘤大小:直径≥5 cm 17例,<5 cm 10例;(4)组织分化:良好(高/中分化腺癌)11例, 差(低分化腺癌/黏液腺癌/印戒细胞癌)16例;(5)浸润深度:T1/T2有7例,T3/T4有20例;(6)淋巴结转移:有淋巴结转移22例,无淋巴结转移5例;(7)TNM分期:Ⅰ/Ⅱ期6例, Ⅲ/Ⅳ期21例(按UICC/AJCC 2010版TNM分期划分)。
普通胃癌患者中:(1)性别:男27例,女19例;(2)年龄:28~79岁,≥60岁22例,<60岁24例;(3)肿瘤大小:直径≥5 cm 11例,<5 cm 35例;(4)组织分化:良好(高/中分化腺癌)15例, 差(低分化腺癌/黏液腺癌/印戒细胞癌)31例;(5)浸润深度:T1/T2有24例,T3/T4有22例;(6)淋巴结转移:有淋巴结转移27例,无淋巴结转移19例;(7)TNM分期:Ⅰ/Ⅱ期30例,Ⅲ/Ⅳ期16例(按UICC/AJCC 2010版TNM分期划分)。
1.3方法所有标本均经质量浓度为100 g/L的甲醛固定,石蜡包埋,连续切片,制成4 μm切片。鼠抗人TS单克隆抗体(即用型),鼠抗人GST-π单克隆抗体(即用型),鼠抗人TopoⅡ单克隆抗体(即用型),SP检测试剂盒,DAB试剂盒均购自北京中杉金桥生物技术公司。鼠抗人P-gp单克隆抗体(即用型)购自福州迈新生物技术开发有限公司。以PBS代替一抗作为阴性对照,使用试剂公司提供的阳性片作为阳性对照。
1.4结果判定TS、GST-π以肿瘤细胞胞浆内出现棕黄色颗粒为阳性;P-gp以肿瘤细胞胞浆/胞膜出现棕黄色颗粒为阳性。随机观察10个高倍视野,根据染色强度与阳性细胞数进行判定:(1)阳性强度:无色为0分,淡黄色为1分,黄色为2分,棕黄为3分;(2)阳性细胞百分比:随机计数500细胞,阳性细胞<5%为0分,5%~25%为1分,25%~50%为2分,50%~75%为3分,>75%为4分;(3)按两者相加之和分为:0~1分为“-”,2~3分为“1+”,4~5分为“2+”,6~7分为“3+”。TopoⅡ以肿瘤细胞细胞核呈棕褐色为阳性,根据阳性细胞所占百分比,分为:<10%为“-”,10%~25%为“1+”,25%~50%为“2+”,>50%为“3+”。综合考虑如下:TS、GST-π、P-gp、Topo Ⅱ均将“-”、“+”视为阴性表达,将“2+”、“3+”视为阳性表达。结果如表1所示。
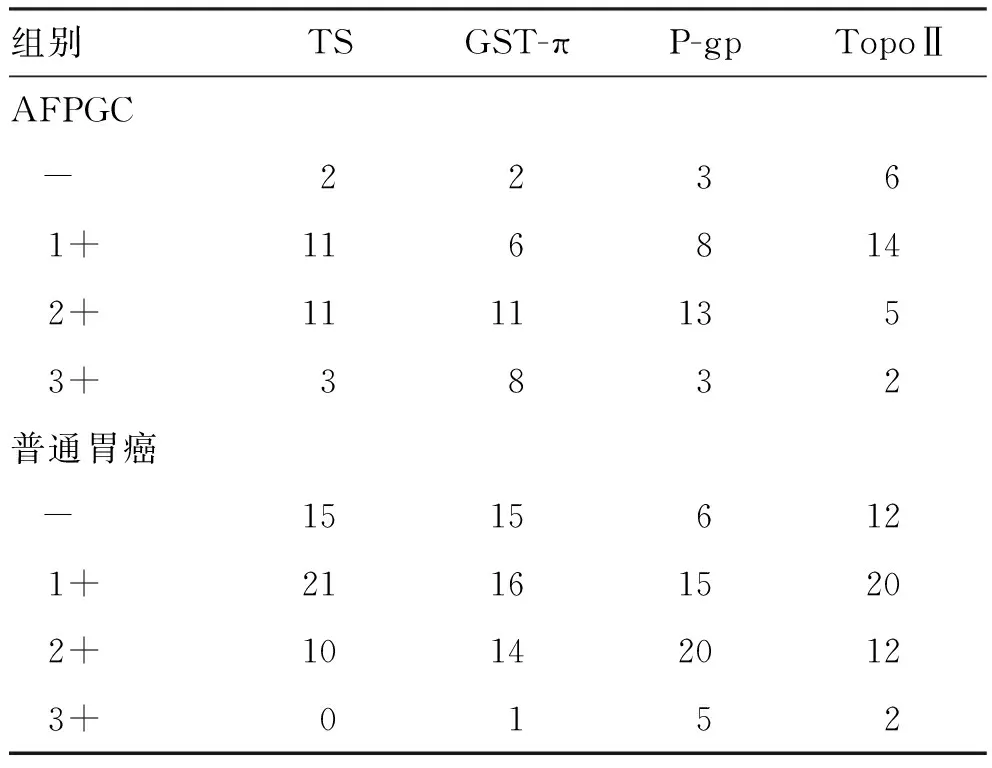
表1 AFPGC及普通胃癌中TS、GST-π、P-gp、TopoⅡ表达Tab 1 The expressions of TS, GST-π, P-gp and TopoⅡ in AFPGC and normal gastric cancer
1.5统计学处理采用SPSS 17.0软件进行统计学分析,检验水准α=0.05,χ2检验或Fisher确切概率法分析各个指标及其与临床特征之间的关系。P<0.05为差异有统计学意义。
2 结果
2.1TS、GST-π、P-gp及TopoⅡ在胃癌组织中的表达情况在胃癌组织中,TS、GST-π、P-gp阳性颗粒定位于胞质(见图1~3),TopoⅡ阳性颗粒定位细胞核(见图4)。TS在AFPGC组与普通胃癌组中表达阳性率分别为51.85%与21.74%,差异有统计学意义(χ2=6.991,P=0.008)。GST-π在AFPGC组与普通胃癌组表达阳性率分别为70.37%与32.61%,差异有统计学意义(χ2=9.750,P=0.002)。P-gp在AFPGC组与普通胃癌组表达阳性率分别为59.26%与54.35%,差异无统计学意义(χ2=0.167,P=0.683)。TopoⅡ在AFPGC组与普通胃癌组表达阳性率分别为 25.93%与30.43%,差异无统计学意义(χ2=0.169,P=0.681)(见表2)。
2.2TS、GST-π、P-gp及TopoⅡ在AFPGC组织中的表达与临床病理因素的关系在AFPGC中,TS的表达与性别、年龄、肿瘤大小、组织分化、浸润深度、淋巴结转移、病理分期均无关(P>0.05)。GST-π的表达与组织分化(良好、差)、淋巴结转移(有、无)具有相关性(P<0.05);而与性别、年龄、肿瘤大小、浸润深度、病理分期无关(P>0.05)。P-gp的表达与组织分化(良好、差)、淋巴结转移(有、无)具有相关性(P<0.05);而与性别、年龄、肿瘤大小、浸润深度、病理分期无关(P>0.05)。TopoⅡ的表达与组织分化(良好、差)、淋巴结转移(有、无)具有相关性(P<0.05);而与性别、年龄、肿瘤大小、浸润深度、病理分期无关(P>0.05)(见表3)。

图1 胃癌组织中TS的阳性表达(400×); 图2 胃癌组织中GST-π的阳性表达(400×); 图3 胃癌组织中P-gp的阳性表达(400×); 图4 胃癌组织中TopoⅡ的阳性表达(400×)Fig 1 Positive expression of TS in gastric cancer tissues (Original magnification, 400×); Fig 2 Positive expression of GST-π in gastric cancer tissues (Original magnification, 400×); Fig 3 Positive expression of P-gp in gastric cancer tissues (Original magnification, 400×); Fig 4 Positive expression of TopoⅡ in gastric cancer tissues (Original magnification, 400×)

组别例数TS阳性/%χ2值P值GST-π阳性/%χ2值P值P-pg阳性/%χ2值P值TopoⅡ阳性/%χ2值P值AFPGC2714(51.85)6.9910.00819(70.37)9.7500.00216(59.26)0.1670.6837(25.93)0.1690.681普通胃癌4610(21.74)15(32.61)25(54.35)14(30.43)

表3 AFPGC中TS、GST-π、P-pg及TopoⅡ的表达与临床病理因素的关系Tab 3 The relationship of clinicopathological factors with the expressions of TS, GST-π, P-pg and TopoⅡ in AFPGC
注:AFPGC例数<40,不满足χ2检验要求,此表P值均使用Fisher确切概率法计算。
2.3TS、GST-π、P-gp及TopoⅡ在普通胃癌组织中的表达与临床病理的关系在普通胃癌中,TS的表达与性别、年龄、肿瘤大小、组织分化、浸润深度、淋巴结转移、病理分期均无关(P>0.05)。GST-π的表达与组织分化、淋巴结转移具有相关性(P<0.05);而与性别、年龄、肿瘤大小、浸润深度、病理分期无相关性(P>0.05)。P-gp的表达与组织分化、淋巴结转移、病理分期有相关性(P<0.05);而与性别、年龄、肿瘤大小、浸润深度无相关性(P>0.05)。TopoⅡ的表达与组织分化具有相关性(P<0.05);而与性别、年龄、肿瘤大小、浸润深度、淋巴结转移、病理分期无关(P>0.05)(见表4)。
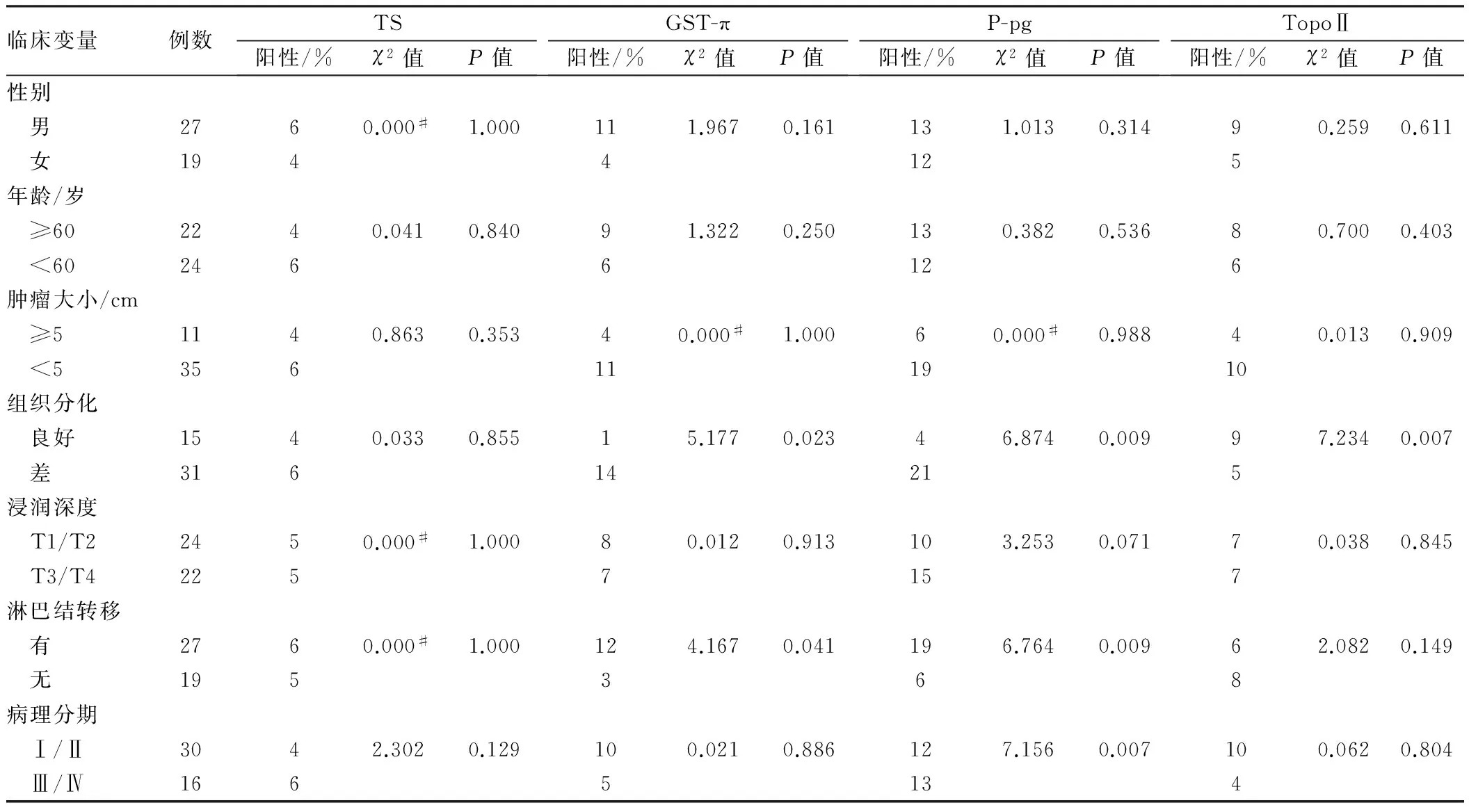
表4 普通胃癌中TS、GST-π、P-pg及TopoⅡ的表达与临床病理因素的关系Tab 4 The relationship of clinicopathological factors with the expressions of TS, GST-π, P-pg and TopoⅡ in normal gastric cancer
注: “#”为χ2值靠近0,但不等于0。
2.4AFPGC与普通胃癌临床病理资料的对比AFPGC与普通胃癌相比,在肿瘤大小、浸润深度、淋巴结转移及病理分期上有显著性差异(P<0.05)。而在性别、年龄及组织分化方面相比,差异无统计学意义(P>0.05)(见表5)。
3 讨论
当前,对胃癌这一恶性肿瘤的治疗,主要是以手术为主、放化疗为辅的综合治疗。由于早期无特异症状,就诊时多已是进展期胃癌。而AFPGC具有独特的生物学行为,侵袭性强,易发生淋巴结转移、肝转移,且分期多较晚[3-8],这是其预后差的主要原因之一。从本研究中也可看出,AFPGC与普通胃癌相比,具有肿瘤直径大、浸润深、分期晚及易发生淋巴结转移等特点,与国内外的报道[4,8,13]基本一致。此时,化疗在AFPGC的综合治疗中显得格外重要,然而多药耐药已成为化疗成功的严重障碍,众多研究发现,TS、GST-π、P-gp及TopoⅡ与肿瘤耐药紧密相关[10-18]。
目前已知的关于肿瘤耐药的机制有以下几种:(1)“药泵”作用[9,14]将化疗药物泵出到细胞外,如P-gp具有水解ATP的功能,可通过药物逆浓度梯度将药物泵细胞外而产生耐药,其高表达与羟基喜树碱、阿霉素耐类有关[9]。(2)促进药物代谢[9,15],如GST-π为多功能代谢酶,可与亲脂性药物结合增加其水溶性,促进药物代谢而产生耐药,高表达与顺氯氨铂、氟尿嘧啶、丝裂霉素耐药有关[9]。(3)其他机制: TopoⅡ为一种核内酶,与DNA的转录、翻译等过程有关,同时也是一些化疗药物作用靶点,一些化疗药物与其结合可形成DNA稳定断裂复合物, 从而干扰细胞DNA正常复制、翻译过程,其低表达与羟基喜树碱、阿霉素、丝裂霉素耐药有关[9]。TS可催化尿嘧啶脱氧核苷酸甲基化,为DNA生物合成所必需,同时也是氟尿嘧啶类的作用靶酶,氟尿嘧啶类药物可阻止TS与正常底物结合,从而抑制DNA的合成,进而抑制细胞生长形成抗肿瘤作用;有文献[16]报道,TS可与自身的mRNA结合形成特定的复合物(TS-mRNA),使mRNA翻译受阻,在对氟尿嘧啶有耐药性的患者,氟尿嘧啶与TS结合,导致TS-mRNA复合物减少,从而促进TS的高表达。总之,TS的高表达与氟尿嘧啶耐药有关已被许多文献证实[11-12,17]。曾有文献[18-19]报道,个别AFPGC患者在接受以手术为主的综合治疗后,仍可获得良好的预后。所以,探讨AFPGC与普通胃癌中TS、GST-π、P-gp及TopoⅡ表达的异同,对进一步认识AFPGC,对AFPGC及普通胃癌的个体化治疗具有指导意义。
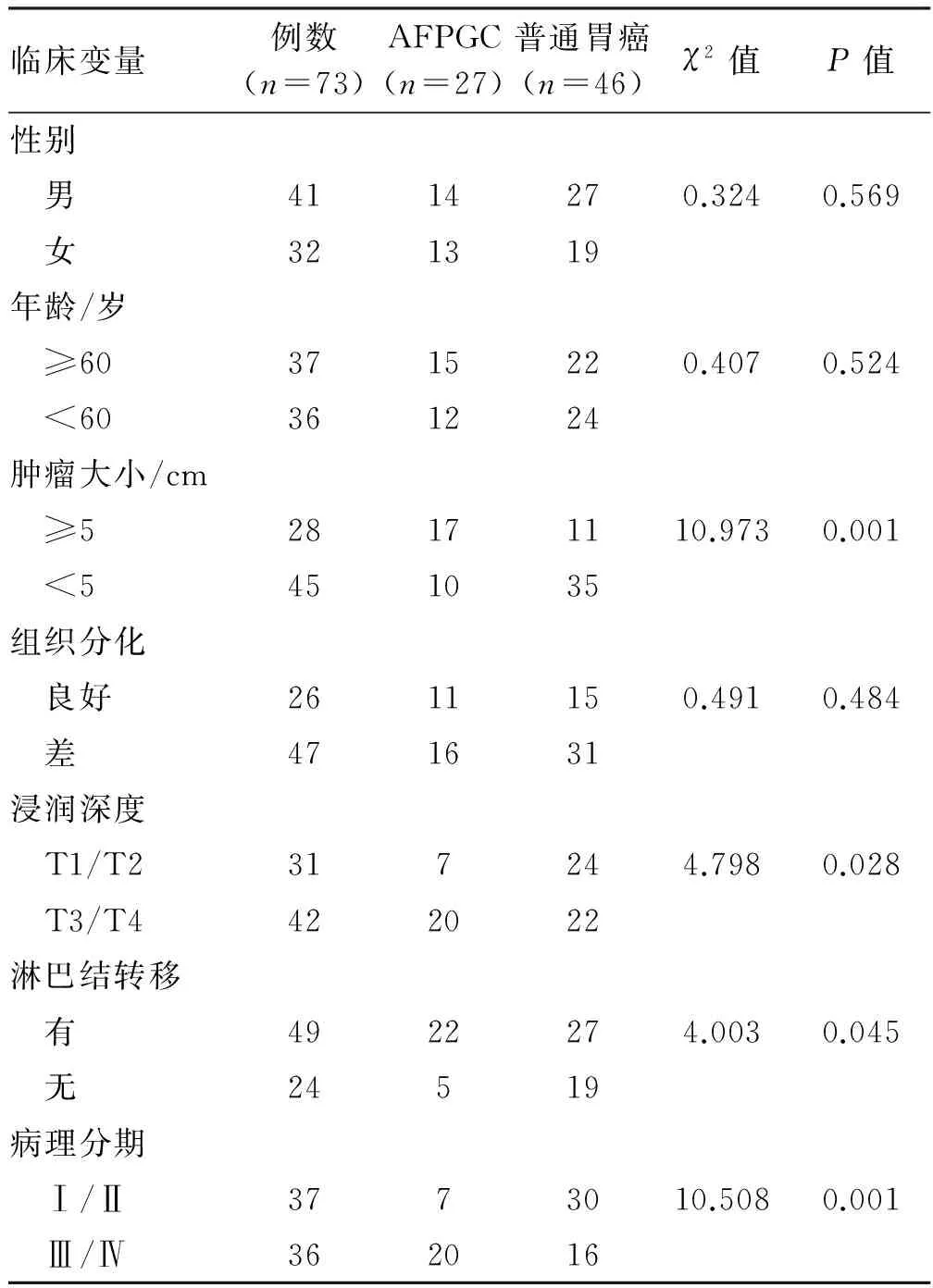
表5 AFPGC与普通胃癌临床病理资料的比较Tab 5 Comparison of clinicopathological factors of AFPGC and normal gastric cancer patients
本研究发现,AFPCG与普通胃癌在TS与GST-π的表达上差异有统计学意义,AFPGC均高于普通胃癌。这一发现提示,AFP的表达可能通过某种机制增加TS与GST-π的表达,或AFP的表达伴随着TS、GST-π的表达增加,进而可能导致AFPGC耐药性增加。同时,TS在AFPGC与普通胃癌中均未发现与临床病理因素有关;GST-π在AFPGC与普通胃癌中均与组织分化程度、淋巴结转移情况存在显著相关;这一发现进一步提示,AFP的表达可能成为TS、GST-π增加的危险因素之一。这表明,AFPGC相对于普通胃癌而言,可能更易出现多药耐药现象,可能更易对氟尿嘧啶类、铂类及丝裂霉素产生耐药,这可能是其总体预后较普通胃癌差的另一原因。
综上所述,本研究发现,AFP的表达与TS、GST-π的表达存在某种内在联系。血清AFP较易检测,若AFP的表达为胃癌耐药性增加的危险因素之一,临床通过检测胃癌患者血清AFP水平,可间接评估胃癌患者的耐药情况,以指导临床进行个体化治疗。但AFP的表达与TS、GST-π的表达之间具体关系,尚需大样本研究进一步证实,其内在联系的确切机制有待进一步研究。
[1] 陈万青, 郑荣寿, 张思维, 等. 2013年中国恶性肿瘤发病和死亡分析[J]. 中国肿瘤, 2017, 26(1): 1-7.
CHEN W Q, ZHENG R S, ZHANG S W, et al. Report of cancer incidence and mortality in China, 2013 [J]. China Cancer, 2017, 26(1): 1-7.
[2] BOURREILLE J, METAYER P, SAUGER F, et al. Existence of alpha feto protein during gastric-origin secondary cancer of the liver [J]. Presse Med, 1970, 78(28): 1277-1278.
[3] HE R, YANG Q, DONG X, et al. Clinicopathologic and prognostic characteristics of alpha-fetoprotein-producing gastric cancer [J]. Oncotarget, 2017, 8(14): 23817-23830.
[4] CHEN Y, QU H, JIAN M, et al. High level of serum AFP is an independent negative prognostic factor in gastric cancer [J]. Int J Biol Markers, 2015, 30(4): e387-e393.
[5] WEN S, LIU Z, HU X. Clinical features and prognostic analysis of alpha-fetoprotein positive gastric cancer [J]. Zhonghua Wei Chang Wai Ke Za Zhi, 2016, 19(1): 67-70.
[6] ZUO C T, JU Q. An analysis of clinical characteristics and prognosis for patients with serum alpha-fetoprotein-positive gastric cancer [J]. Minerva Med, 2015, 106(4): 185-191.
[7] LIU X, YANG M, GAO J, et al. Clinicopathologic features and prognosis of 51 patients with alpha-fetoprotein-producing gastric cancer [J]. Zhonghua Zhong Liu Za Zhi, 2015, 37(3): 231-234.
[8] WANG D, LI C, XU Y, et al. Clinicopathological characteristics and prognosis of alpha-fetoprotein positive gastric cancer in Chinese patie-nts [J]. Int J Clin Exp Pathol, 2015, 8(6): 6345-6355.
[9] GENG M, WANG L, CHEN X, et al. The association between chemosensitivity and Pgp, GST-pi and Topo II expression in gastric cancer [J]. Diagn Pathol, 2013, 8(12): 198-203.
[10] YU P, DU Y, CHENG X, et al. Expression of multidrug resistance-associated proteins and their relation to postoperative individualized chemotherapy in gastric cancer [J]. World J Surg Oncol, 2014, 12(10): 307-313.
[11] GAO Y, CUI J, XI H, et al. Association of thymidylate synthase expression and clinical outcomes of gastric cancer patients treated with fluoropyrimidine-based chemotherapy: a meta-analysis [J]. Onco Targets Ther, 2016, 9(1): 1339-1350.
[12] LIU X F, ZHANG H, SUN J Q, et al. Correlation between expression of thymidylate synthase and clinical outcome of advanced gastric cancer treated with capecitabine alone chemotherapy [J]. Tumour Biol, 2014, 35(12): 12409-12414.
[13] 甘涛, 夏涛, 李威, 等. 产甲胎蛋白胃癌的临床病理及预后分析[J]. 华中科技大学学报(医学版), 2012, 41(4): 481-484.
GAN T, XIA T, LI W, et al. Clinicopathology and prognosis of Alpha-fetoprotein-producing gastric cancer [J]. Acta Med Univ Sci Technol Huazhong, 2012, 41(4): 481-484.
[14] PEREZ-TOMAS R. Multidrug resistance: retrospect and prospects in anti-cancer drug treatment [J]. Curr Med Chem, 2006, 13(16): 1859-1876.
[15] ZHANG Y, ZHOU T, DUAN J, et al. Inhibition of P-glycoprotein and glutathione S-transferase-pi mediated resistance by fluoxetine in MCF-7/ADM cells [J]. Biomed Pharmacother, 2013, 67(8): 757-762.
[16] SULZYC-BIELICKA V, BIELICKI D, BINCZAK-KULETA A, et al. Thymidylate synthase gene polymorphism and survival of colorectal cancer patients receiving adjuvant 5-fluorouracil [J]. Genet Test Mol Biomarkers, 2013, 17(11): 799-806.
[17] YEH C N, JUNG S M, CHEN T W, et al. Expression of thymidylate synthase determines the response of gastric cancer patients undergoing gastrectomy to 5-fluorouracil-based adjuvant chemotherapy [J]. Langenbecks Arch Surg, 2010, 395(3): 217-225.
[18] GONG W, SHOU D, GONG P. Extremely high expression of serum alpha-fetoprotein level of gastric adenocarcinoma: a rare case with an unexpected well-prognosis [J]. Springer Plus, 2016, 5(1): 2056-2061.
[19] FANG Y U, WANG L, YANG N, et al. Successful multimodal therapy for an alpha-fetoprotein-producing gastric cancer patient with simultaneous liver metastases [J]. Oncol Lett, 2015, 10(5): 3021-3025.
Aresearchontheproteinofthemultidrugresistanceofthealpha-fetoproteinpositivegastriccancer
YANG Jian, ZHOU Yejiang
Department of Gastrointestinal Surgery, the Affiliated Hospital of Southwest Medical University, Luzhou 646000, China
ObjectiveTo analyze the expressions of thymidylate synthase (TS), glutathione S-transferase Pi (GST-π), P-glycoprotein (P-gp) and topoisomeraseⅡ (TopoⅡ) in alpha-fetoprotein positive gastric cancer (AFPGC), in order to study the drug resistance of AFPGC.MethodsImmunohistochemistry staining method (the S-P law) was used to examine the expressions of TS, GST-π, P-gp, TopoⅡ in 27 pathologically diagnosed as AFPGC and 46 pathologically diagnosed as alpha-fetoprotein negative gastric cancers (normal gastric cancer).ResultsCompared with normal gastric cancer, expressions of TS and GST-π were higher in AFPGC (P<0.05), but expressions of P-gp and TopoⅡ had no statistical difference between two groups (P>0.05).ConclusionCompared with alpha-fetoprotein negative gastric cancer, AFPGC is more likely to be multidrug resistance (MDR), MDR may be one reason of extremely poor prognosis of AFPGC. The expression of alpha-fetoprotein may be a risk factor for the increase of resistance of gastric cancer. Alpha-fetoprotein may be an indirect indication of the sensitivity of chemotherapy for gastric cancer, to guide the individualized treatment of gastric cancers.
AFP; TS; GST-π; P-gp; TopoⅡ; Multidrug resistance; Gastric cancer
杨建,硕士研究生,研究方向:消化道肿瘤的研究。E-mail: zyyj666666@163.com
周业江,主任医师,教授,博士,硕士生导师,研究方向:消化道肿瘤的诊治。E-mail: zyj7525@163.com
10.3969/j.issn.1006-5709.2017.12.011
R735.2
A
1006-5709(2017)12-1365-05
2017-07-07
马 军)

