肾功能衰竭合并丙型肝炎行血液透析患者的抗病毒治疗临床分析
顾青青,颜学兵
1.徐州医科大学,江苏 徐州 221002; 2.徐州医科大学附属医院感染性疾病科
肾功能衰竭合并丙型肝炎行血液透析患者的抗病毒治疗临床分析
顾青青1,颜学兵2
1.徐州医科大学,江苏 徐州 221002; 2.徐州医科大学附属医院感染性疾病科
目的观察肾功能衰竭(chronic renal failure,CRF)合并慢性丙型肝炎(chronic hepatitis C,CHC)行血液透析(hemodialysis,HD)患者采用干扰素(interferon,IFN)联合利巴韦林(Ribavirin,RBV)抗病毒治疗临床疗效及影响因素。方法对19例CHC合并CRF并行HD患者采用IFN联合RBV进行抗病毒治疗,对其临床资料(体质量指数、肝功能、基线HCV RNA载量、基因型、IL28基因分型等)进行总结,对快速病毒学应答(RVR)、早期病毒学应答(EVR)、持续病毒学应答(SVR)及其治疗过程中不良反应进行分析。结果19例患者中,获得RVR 9例(47.4%),获得EVR 16例(84.2%),获得SVR 16例(84.2%);基因1型获得SVR 13例(68.4%),非基因1型获得SVR 3例(15.8%)。HCV RNA非高病毒载量8例(42.1%),均获得SVR。IL28B rs12979860位点基因型为CC、CT、TT各17、2、0例,基因1型患者rs12979860 CC型共14例(73.7%),13例(68.4%)获得SVR。1例(5.3%)因严重贫血停用RBV,1例(5.3%)因不能耐受药物不良反应终止治疗。结论IFN联合RBV抗病毒治疗CRF合并CHC行HD患者治疗效果好,且基因1型非高载量的、宿主基因IL28b CC 型能达到较高的SVR率。患者不良反应能够耐受。
丙型肝炎;血液透析;干扰素;利巴韦林
直接抗病毒药物(DAAs)上市之前,国内抗丙型肝炎病毒(hepatitis C virus,HCV)治疗仍以聚乙二醇干扰素联合利巴韦林[pegylated-interferon-2a/2b+Ribavifin(RBV),PR]为标准治疗方案,对所有基因型HCV现症感染,同时无治疗禁忌证患者适用[1]。但是,肾功能衰竭(chronic renal failure,CRF)合并慢性丙型肝炎(chronic hepatitis C,CHC)行血液透析(hemodialysis,HD)患者与普通慢性丙型肝炎不同,患者往往营养状况较差,抵抗力低下,常常合并多种并发症,对于IFN的耐受性差,不良反应较多,RBV可引起严重的溶血性贫血[2-3],故此类患者治疗难度高,目前治疗方案包括普通IFN-α及PEG-IFN的单一疗法,及其与RBV的联合疗法[4],最近一项研究[5]比较了PEG-IFN单药和PEG-IFN与RBV 200 mg联用治疗HCV感染患者的疗效,联合用药组SVR率比单药组明显升高(64%vs33%,P<0.001)。现对19例CHC合并CRF并行HD患者采用IFN联合RBV进行抗病毒治疗临床资料进行总结及分析,报道如下。
1 资料与方法
1.1一般资料2012年至2015年19例CRF合并CHC行HD患者,男14例(73.7%),女5例(26.3%);年龄(39.84±7.86)岁(28~55岁),基因1型15例(78.9%),非基因1型4例(21.1%);7例(36.8%)既往有明确输血史;2例(10.5%)行肾移植;5例(26.3%)合并高血压;1例(5.3%)合并HBV感染,且HBV-DNA复制;1例(5.3%)合并轻度甲亢,无相关临床症状;CRF行HD感染丙型肝炎患者临床表现与常见丙型肝炎无明显差异,7例(36.8%)表现上腹部不适、乏力、纳差等,12例(63.2%)无症状。19例患者彩超均呈慢性肝损伤表现,其中4例(21.1%)脾大(见表1)。所有诊断均符合《丙型肝炎防治指南》中CHC的诊断标准[6],并自愿应用IFN联合(或)RBV抗病毒治疗,并符合下列条件:(1)纳入标准:HCV RNA≥5.02×102IU/ml,血清ALT正常,或ALT超过正常但在10倍内,血清总胆红素<正常值的2倍;(2)排除标准:妊娠期及哺乳期,除外失代偿性肝硬化,无精神病史、癫痫、恶性肿瘤、有症状的心脏病,无吸毒或酗酒史等。
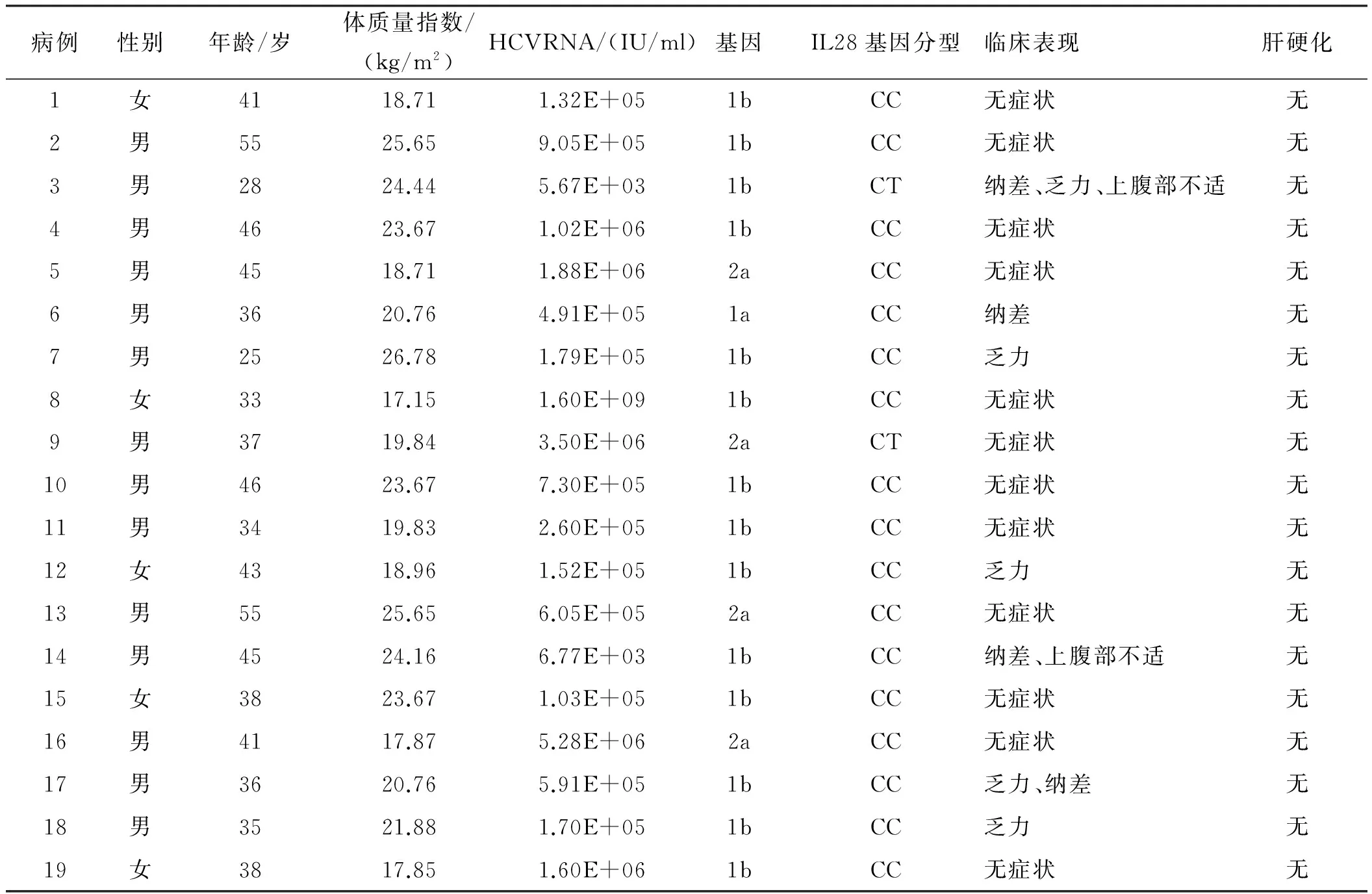
表1 19例CRF合并CHC行HD患者治疗前一般情况Tab 1 General situation on 19 patients with CRF complicated with CHC treated by HD before the treatment
1.2方法
1.2.1 治疗方法:19例患者行IFN联合RBV个体化治疗,其中16例(84.2%)予Peg-IFNα-2a 135 μg, 1次/周,联合RBV 0.1 g, 2次/d抗病毒治疗,2例(10.5%)予IFNα-2b 500 MU,隔日1次,联合RBV 0.1 g,3次/d抗病毒治疗,1例(5.3%)予IFNα-2b 300 MU,隔日1次抗病毒治疗。患者每周透析3次,IFN予以HD后给药(见表2)。根据患者基因型及疗效,总疗程为24~48周。停药随访24周。合并高血压者予降压治疗,血细胞减少给予地榆升白片和(或)粒细胞集落刺激因子等对症处理。
1.2.2 观察指标:记录患者的临床症状,治疗前血常规、肝肾功能、甲状腺功能、基因分型、HCV RNA定量、彩超。治疗4周、12周、24周、48周及停药24周患者血常规、肝功能、甲状腺功能、HCV RNA定量。
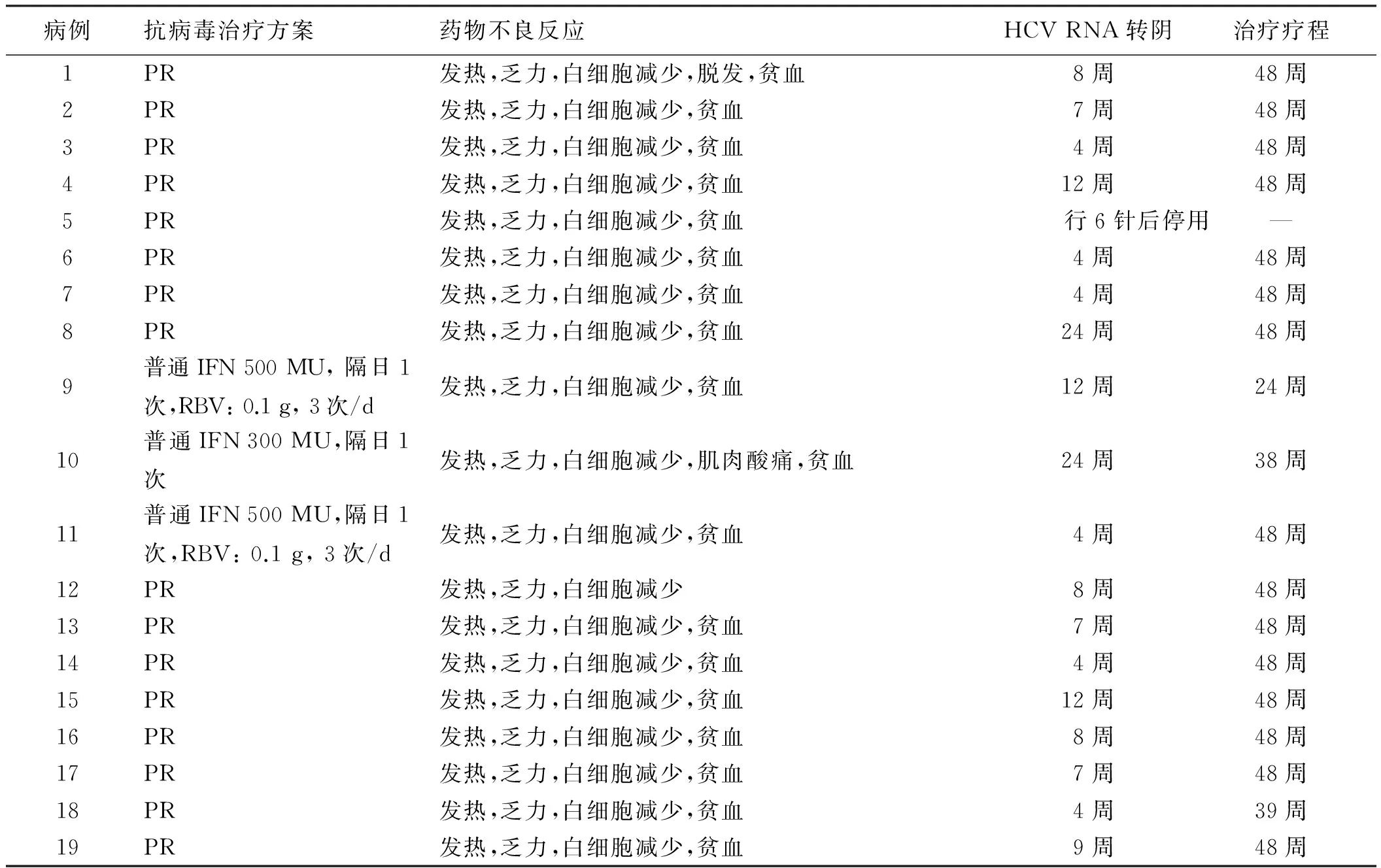
表2 CRF合并CHC行HD患者抗病毒治疗情况Tab 2 Antiviral treatment of patients with CRF complicated with CHC treated by HD
注:PR:Peg-IFNα-2a 135 μg,1次/周;RBV 0.1 g,2次/d;第6例患者因白细胞下降在第4周停用RBV。
1.2.3 检测方法及仪器:HCV基因分型:采用HCV分型特异性引物及荧光探针,应用一步法聚合酶链式反应结合Taqman技术(上海之江生物科技股份有限公司)。HCV RNA定量:采用COBAS全自动病毒载量分析系统定量检测HCV RNA载量,检测下限5.02E+02 IU/ml(Roche COBAS AmpliPrep/COBASTapMan48)。IL28 基因分型:通过对RS12979860位点测序后对IL28B 基因进行分型。肝功能检测:采用全自动生化分析仪检测(仪器厂家:OLYMPUS AU 2700)。外周血细胞检测:采用全自动血细胞分析仪检测(仪器厂家:YSMEXXE5000)[7-8]。
1.2.4 疗效评价标准:快速病毒学应答(RVR):治疗4周HCV RNA定量小于最低检测值。早期病毒学应答(EVR):治疗12周HCV RNA定量小于最低检测值。持续病毒学应答(SVR):治疗结束后第12周和24周HCV RNA定量小于最低检测值[9]。

2 结果
2.1治疗结果治疗前,12例(63.2%)患者肝功能正常,7例(36.8%)肝功能轻度损伤,19例(100%)患者HCV RNA均复制,给予IFN联合(或)RBV个体化抗病毒治疗,复查肝功能指标、HCV RNA,均较治疗前好转(见表3)。1例(5.3%)因严重贫血停用RBV,1例(5.3%)因不能耐受药物不良反应终止治疗。其中获得RVR 9例(47.4%),获得EVR 16例(84.2%),获得SVR 16例(84.2%);基因1型获得SVR 13例(68.4%),非基因1型获得SVR 3例(15.8%)。HCV RNA非高病毒载量8例(42.1%),均获得SVR。IL28B rs12979860位点基因型为CC、CT、TT各17、2、0例,基因1型患者rs12979860 CC型共14例(73.7%),13例(68.4%)获得SVR。

表3 CRF合并CHC行HD患者抗病毒治疗疗效Tab 3 Efficacy of antiviral therapy of patients with CRF and CHC by HD
注:“—”信息未采集。
2.2不良反应19例患者均出现发热、头痛、乏力等流感样症状,随用药时间延长症状缓解。19例治疗后均出现不同程度的白细胞下降、贫血等,给予地榆升白片和(或)粒细胞集落刺激因子、促红细胞生成素等对症处理后,1例(5.3%)服药后因贫血自行停用RBV,1例(5.3%)因患者担心IFN药物不良反应自行停用治疗。18例患者能耐受IFN药物不良反应,均未予以IFN减量。出现脱发1例(5.3%),随着用药时间延长,患者症状改善。1例(5.3%)合并甲亢,治疗过程中密切观察,定期复查甲状腺功能,未发现甲状腺功能加重。
3 讨论
据世界卫生组织统计,全球HCV的感染率约3%,每年新发丙型肝炎病例约3.5万例[10]。而HD患者感染HCV几率较其他人群高,尽管严格执行消毒隔离措施,但医源性感染因素仍然存在[11]。抗HCV治疗可改善或减轻肝损伤、阻止进展为肝硬化、肝衰竭或肝癌,并提高患者生活质量。尤其准备肾移植患者应抗病毒治疗[12]。目前采用IFN联合(或)RBV抗病毒治疗,2015年更新的《丙型肝炎防治指南》[6]指出:若患者GFR为20~40 ml/min,应将聚乙二醇干扰素α-2a的剂量降至135 μg/周,聚乙二醇干扰素α-2b的剂量降至每周1 μg/kg,同时调整RBV剂量为200 mg/d 或200 mg,隔日1次。普通干扰素未具体说明。本试验中观察患者抗HCV治疗后肝功能改善,HCV RNA阴转率达89.5%,其中获得RVR 9例(47.4%),获得EVR 16例(84.2%),获得SVR 16例(84.2%);基因1型获得SVR 13例(68.4%),非基因1型获得SVR 3例(15.8%)。IFN联合RBV对CRF行HD合并CHC抗病毒治疗效果好。同时患者对药物不良反应基本耐受,仅有1例(5.3%)因患者担心IFN药物不良反应自行停用治疗。另1例(5.3%)出现严重贫血,考虑RBV药物不良反应,对症处理后效果不佳,最终停用RBV。有国外研究[1]显示,15例长期HD合并丙型肝炎者(其中3例合并HIV感染,2例伴代偿性肝硬化)接受PEG-IFNα-2a(1周135 μg)和RBV 200 mg/d,结果显示,SVR约33.3%。分析本组试验患者获得较高SVR率及耐受药物不良反应较好,原因如下:(1)入组中患者基因1型患者IL28B rs12979860 CC型共14例(73.7%),研究[14]表明,IFN联合RBV对基因1型非高病毒载量的、宿主基因IL28 CC型的HCV感染者,能够达到较高的SVR率,且不良反应明显降低;(2)治疗基线时较低的HCV RNA水平也可能是取得较高SVR率的原因[15];(3)入组患者每周行3次HD,借助HD清除部分HCV RNA病毒,同时患者对于IFN的清除能力下降,对于RBV的滤除功能也降低,而且透析治疗无法清除蓄积在体内的RBV[8],且聚乙二醇干扰素不易通过半透膜,故适当地延长疗程[16];(4)入组患者BMI偏低,肥胖患者少,无明显胰岛素抵抗,抗病毒治疗效果好[17-18];(5)入组患者肝功能均为轻中度升高,彩超未见明显肝纤维表现,病情相对较轻,未见慢性肝炎相关并发症;(6)患者均为中青年,早发现、早治疗对丙型病毒性肝炎是有利的,依从性较好。此外,抗病毒治疗疗效与基因型、抗病毒药物剂量及疗程等因素密切相关。近年来,LIU 等[19]研究表明,聚乙二醇干扰素优于普通干扰素,且耐受性好。由于本研究样本量较小,需进一步研究明确聚乙二醇干扰素及普通干扰素在疗效及耐药性等方面的差异。
[1] CARRIERO D, FABRIZI F, URIEL A J, et al. Treatment of dialysis patients with chronic hepatitis C using pegylated interferon and low-dose ribavirin [J]. Int J Artif Organs, 2008, 31(4): 295-302.
[2] 李谦, 王瑞, 袁桂玉, 等. 终末期肾病患者丙肝病毒感染与防治进展[J]. 透析与人工器官, 2008, 19(1): 30-34.
LI Q, WANG R, YUAN G Y, et al. Development of HCV infection and prevention and treatment in patients with end-stage renal disease [J]. Chinese J Dialy and Artif Organs, 2008, 19(1): 30-34.
[3] 张文君. 抗病毒加辅助治疗对肾功能衰竭患者血液透析过程中丙型肝炎病毒感染疗效观察[J]. 河北医药, 2013, 35(8): 1221-1222.
[4] 姚兴梅, 汪年松. 干扰素在透析患者合并丙型肝炎病毒感染中的应用[J]. 世界临床药物, 2010, 31(5): 267-270.
YAO X M, WANG N S. Application of interferon in hemodialysis patients with hepatitis C virus infection [J]. World Clin Drugs, 2010, 31(5): 267-270.
[5] LIU C H, HUANG C F, LIU C J, et al. Pegylated interferon-2a with or without low-dose ribavirin for treatment-naive patients with hepatitis C virus genotype 1 receiving hemodialysis: a randomized trial [J]. Gut, 2015, 64(2): 303-311.
[6] 中华医学会肝病学分会, 中华医学会感染病学分会. 丙型肝炎防治指南(2015年版)[J]. 中国肝脏病杂志(电子版), 2015, 7(3): 19-35.
Chinese Society of Hepatology and Chinese Society Infectious Diseases, Chinese Medical Association. The guideline of prevention and treatment for hepatitis C: a 2015 update [J]. Chinese J Liver Dis (Electronic Version), 2015, 7(3): 19-35.
[7] 黎嘉敏, 李彤, 何永成. 维持性血液透析患者合并丙型肝炎病毒感染的实验室诊断方法及进展[J]. 医学综述, 2013, 19(16): 2967-2970.
LI J M, LI T, HE Y C. Laboratory diagnosis methods and progress of HCV infection in MHD patients [J]. Medical Recapitulate, 2013, 19(16): 2967-2970.
[8] Asian Pacific Association for the Study of the Liver (APASL) Hepatitis C Working Party, MCCAUGHAN G W, OMATA M, et al. Asian Pacific Association for the Study of the Liver Consensus Statements on the diagnosis, management and treatment of hepatitis C virus infection [J]. J Gastroenterol Hepatol, 2007, 22(5): 615-633.
[9] 易盼盼, 戴菱菱, 徐平声, 等. 慢性丙型肝炎直接抗病毒药物临床试验的有效性和安全性研究-美国FDA和欧洲E MA指南解读[J]. 中国感染控制杂志, 2014, 13(11): 698-701.
YI P P, DAI L L, XU P S, et al. Efficacy and safety of developing direct-acting antiviral agents for treatment of chronic hepatitis C: guidance from FDA and EMA [J]. Chin J Infect Control, 2014, 13(11): 698-701.
[10] 潘蕾, 魏欣, 谢玉梅, 等. 聚乙二醇干扰素α-2a治疗慢性丙型肝炎病毒/乙型肝炎病毒共感染临床疗效[J]. 临床肝胆病杂志, 2011, 27(1): 84-85.
PAN L, WEI X, XIE Y M, et al. Anti-viral therapy with pegylated interferon alpha-2a plus ribavirin in patients co-infected with HBV and HCV [J]. J Clini Hepatol, 2011, 27(1): 84-85.
[11] 孙彦玲, 王心捷, 李小林, 等. 血液透析患者丙肝1例临床分析[J]. 中国社区医师, 2014, 30(27): 116, 118.
SUN Y L, WANG X J, LI X L, et al. Clinical analysis of 1 cases of hepatitis C in hemodialysis patients [J]. Chinese Community Doctors, 2014, 30(27): 116, 118.
[12] ALEKSANDAR S, DZEKOVA P, ASANI A, et al. New approaches in the therapy of hepatitis C in dialysis patients [J]. Prilozi, 2008, 29(2): 155-164.
[13] 郭凤霞, 张霞意, 兰芸, 等. 广东地区慢性丙型肝炎患者IL28B基因多态性与抗病毒疗效的关系[J]. 中华实验和临床病毒学杂志, 2014, 28(6): 458-460.
GUO F X, ZHANG X Y, LAN Y, et al. Genotypes of interleukin 28B polymorphism and its relationship with responses to therapy in patients with chronic hepatitis C in Guangdong [J]. Chin J Exp Clin Virol, 2014, 28(6): 458-460.
[14] 姜天俊, 张纪元, 王福生. 特殊人群丙型肝炎抗病毒治疗进展[J]. 临床医学工程, 2010, 17(3): 148-150.
JIANG T J, ZHANG J Y, WANG F S. Progress in studies of antiviral therapy in special patient groups with hepatitis C [J]. Clin Med Enneering, 2010, 17(3): 148-150.
[15] 陈拉弟, 贾因棠. 干扰素治疗慢性丙型肝炎快速病毒学应答的影响因素分析[J]. 中国医疗前沿月刊, 2011, 6(3): 3-4.
CHEN L D, JIA Y T. Factors associated with rapid virologic response to interferon treatment in chronic hepatitis C patients [J]. National Medical Frontiers of China, 2011, 6(3): 3-4.
[16] 于乐成, 何长伦, 徐静, 等. 尿毒症合并丙型肝炎待肾移植患者的抗丙型肝炎病毒治疗1例[J]. 中华肝脏病杂志, 2011, 19(6): 477-478.
YU L C, HE C L, XU J, et al. Antiviral therapy of HCV infection in patients with uraemia on maintenance of hemodialysis and waiting for renal transplantation: a case report [J]. Chin J Hepatol, 2011, 19(6): 477-478.
[17] 王会琳, 李新华, 王国强, 等. 慢性丙型肝炎合并胰岛素抵抗的抗病毒治疗临床观察[J]. 中国热带医学, 2013, 13(3): 390-391.
WANG H L, LI X H, WANG G Q, et al. Results of antiviral treatment of chronic hepatitis C cases complicated with insulin resistance [J]. China Tropical Medicine, 2013, 13(3): 390-391.
[18] 王志勇, 邓国孙. 脂肪肝患者腹部手术风险及一级亲属癌症的发病率研究[J]. 胃肠病学和肝病学杂志, 2016, 25(3): 318-319.
WANG Z Y, DENG G S. Research on the risk of abdominal operation in patients with fatty liver and the prevalence of cancer in first-degree relatives [J]. Chin J Gastroenterol Hepatol, 2016, 25(3): 318-319.
[19] LIU H C, LIANG C C, LIN W J, et al. Pegylated interferon {alpha-2a versus standard interferon {alpha-2a for treatment-naive dialysis patients with chronic hepatitis C: a randomised study [J]. Gut, 2008, 57(4): 525-530.
ClinicalanalysisofantiviraltherapyonpatientswithrenalfailurecomplicatedwithhepatitisCtreatedbyhemodialysis
GU Qingqing1, YAN Xuebing2
1. Xuzhou Medical University, Xuzhou 221002; 2. Department of Infectious Diseases, the Affiliated Hospital of Xuzhou Medical University, China
ObjectiveTo observe the clinical efficacy and influence factors of interferon (IFN) combined with Ribavirin (RBV) in hemodialysis (HD) patients who sufferred from chronic renal failure (CRF) accompanied by chronic hepatitis C (CHC).MethodsNineteen HD patients with CRF and CHC were treated with a combination of the drug IFN and RBV. The clinical data, including body mass index, liver function, the baseline of HCV RNA load, HCV genotypes (GTs) and IL28 genotype were collected and summarized while RVR, EVR, SVR and adverse drug effects in the course of treatment were detected and analyzed.ResultsAmong the 19 patients, RVR were obtained in 9 cases (47.4%), while EVR and SVR were obtained in 16 cases (84.2%); SVR in 13 cases (68.4%) were obtained in GT-1 infected patients while SVR in 3 cases (15.8%) were obtained in non-GT-1 patients. The rate of SVR in 8 cases (42.1%) whose HCV RNA load were not high was 100%. The SVR rate in patients with rs12979860 of IL28B genotype were CC (17 cases), CT (2 cases), TT (0 case), respectively. 13 cases in the 14 GT-1 cases (73.7%) whose IL28B genotype were rs12979860 CC got a SVR, with the rate of 68.4%. One patient (5.3%) discontinued RBV due to severe anemia, and 1 case (5.3%) terminated the treatment for poor tolerance of adverse drug effects.ConclusionThe antiviral therapy on HD patients with CRF with CHC has a good efficacy. The SVR rate is higher in GT-1 infected paients with non-high viral load and IL28b CC of host genetype. The patient’s adverse reaction can be tolerated.
Hepatitis C; Hemodialysis; Interferon; Ribavirin
国家自然科学基金(81371867);江苏省医学科技专项—新型临床诊疗技术攻关(BL2014033);江苏省“科教兴卫”医学重点人才培养基金(RC2011117);江苏省“六大人才高峰”项目(NO2011-WS-068)
顾青青,主治医师,研究方向:病毒性肝炎诊断及防治。E-mail: guqingqing1986@tom.com
颜学兵,主任医师,博士,研究方向:病毒性肝炎诊断及防治。E-mail: yxbxuzhou@126.com
10.3969/j.issn.1006-5709.2017.12.019
R512.6+3
A
1006-5709(2017)12-1401-05
2017-04-18
王全楚)

