普拉梭菌及其上清液对葡聚糖酸钠诱导的结肠炎小鼠Treg/Th17平衡的影响
张 敏, 于成功,2
1.南京中医药大学鼓楼临床医学院消化科,江苏 南京 210008; 2.南京大学医学院附属鼓楼医院消化内科
普拉梭菌及其上清液对葡聚糖酸钠诱导的结肠炎小鼠Treg/Th17平衡的影响
张 敏1, 于成功1,2
1.南京中医药大学鼓楼临床医学院消化科,江苏 南京 210008; 2.南京大学医学院附属鼓楼医院消化内科
目的探讨普拉梭菌(Faecalibacterium prausnitzii,F.prausnitzii)及其上清液对葡聚糖酸钠(DSS)诱导的结肠炎小鼠Treg/Th17平衡的影响。方法将40只雄性C57BL/6J小鼠随机分为正常组、结肠炎对照组、F.prausnitzii活菌干预组、F.prausnitzii上清干预组,每组10只,正常组正常饮水,其余各组均饮用质量浓度为25 g/L的葡聚糖硫酸钠(DSS)诱导结肠炎模型,同时分别用磷酸缓冲盐溶液(PBS)、F.prausnitzii、F.prausnitzii上清灌胃。流式细胞术检测各组小鼠脾脏中的Treg、Th17比例,并计算各组Treg/Th17比值;ELISA法检测外周血清中IL-10、IL-17水平;RT-PCR检测结肠组织中Foxp3、ROR-γt mRNA的表达。结果与结肠炎对照组相比,F.prausnitzii活菌干预组和F.prausnitzii上清干预组的Treg细胞比例上升,Th17细胞比例下降,Treg/Th17比值升高;且血清中IL-10水平升高,IL-17水平降低(P<0.05)。与结肠炎对照组相比,F.prausnitzii上清干预组Foxp3 mRNA表达上升(P<0.05),但F.prausnitzii活菌干预组Foxp3 mRNA表达差异无统计学意义(P>0.05);两干预组肠组织中ROR-γt mRNA表达较结肠炎对照组下降(P<0.05)。结论F.prausnitzii及其上清液可调控T细胞亚群,其机制可能为通过提高Foxp3 mRNA表达,抑制ROR-γt mRNA的表达调节Treg/Th17的平衡。
普拉梭菌;结肠炎;Treg细胞;Th17细胞
炎症性肠病(inflammatory bowel disease,IBD)为肠道慢性非特异性及复发性炎症,包含溃疡性结肠炎(ulcerative colitis, UC)和克罗恩病(Crohn’s disease,CD)。目前认为,肠道菌群参与下引起肠黏膜免疫系统的异常反应,进而导致肠组织损伤、炎症进展为其研究热点[1-2]。Treg细胞能够减轻炎症反应,抑制自身免疫反应,而Th17细胞可促进炎症反应,参与自身免疫反应。普拉梭菌(F.prausnitzii)作为肠道益生菌一种,对维护肠道菌群的稳态起重要作用,可分泌丁酸盐及未知产物。有研究[3]发现,F.prausnitzii具有免疫调节和抗炎作用。本实验通过建立IBD模型,经F.prausnitzii及其上清干预后,观察脾脏中T淋巴细胞亚群的变化及Treg/Th17细胞的比例,探讨F.prausnitzii对实验性结肠炎的免疫调控机制。
1 材料与方法
1.1动物C57BL/6J小鼠(美国Jackson Laboratory)共40只,雄性,6~8周龄,体质量21~23 g。饲养于南京鼓楼医院无特定病原体(specific pathogen free,SPF)级动物实验中心,造模前适应性饲养1周。
1.2试剂DSS(MP Biomedicals);F.prausnitziiATCC27766(美国模式菌种保藏中心),血晶质、纤维二糖、L-半胱氨酸(SIGMA)、脑心浸液(B&D)、酵母提取物(OXOID)、麦芽糖(AMRESCO); FITC标记抗鼠 CD4 抗体、APC标记抗鼠 CD25 抗体、PE标记抗鼠Foxp3抗体(eBioscience,Inc),破膜固定套装(eBioscience),红细胞裂解液(MILTENYI BIOTEC),APC标记抗鼠 CD3抗体、PE标记抗鼠IL-17抗体(eBioscience,Inc.),淋巴细胞刺激剂leukocyte activation cocktail with BD GolgiPlug(BD Biosciences),固定/破膜试剂盒(BD Biosciences);反转录、PCR试剂盒及TRIZOL裂解液(TAKARA);小鼠IL-17、IL-10 ELISA试剂盒(eBioscience,Inc)。
1.3方法
1.3.1F.prausnitzii培养及上清液制备:把F.prausnitzii接种在37 ℃厌氧箱中LYHBHI培养基,培育48 h,OD值计菌数达1×109CFU/ml。同时将新鲜菌液5 000 r/min离心5 min,取F.prausnitzii上清液冻干成粉,100 ml上清约可得到 3 g 冻干粉,将冻干粉按1∶5的比例以 PBS 稀释,4 ℃冰箱备用。
1.3.2 动物模型制备、分组、标本处理:40只雄性C57BL/6J小鼠随机分为正常组、结肠炎对照组、F.prausnitzii活菌干预组,F.prausnitzii上清干预组,每组10只,正常组正常饮水,其余各组均饮用质量浓度为25 g/L的葡聚糖硫酸钠(DSS)诱导结肠炎模型,干预组小鼠分别用0.2 ml/10 gF.prausnitzii及等量的F.prausnitzii上清液每天灌胃1次,结肠炎对照组以等量的PBS每天灌胃1次,连续7 d。第8天用颈椎脱臼法处死小鼠,眼眶取血,无菌取脾及结肠。
1.3.3 流式检测脾脏中Treg、Th17细胞比例:无菌取小鼠新鲜脾结,充分研磨后,加入红细胞裂解液3 ml,静置5 min,PBS洗涤2次。予PBS重悬后计数,取细胞1×106加表面抗体APC-CD25 0.8 μl,FITC-CD4 1.0 μl,振荡,避光20 min,1 ml PBS洗涤1次,蜗旋,速度在4~5次为宜,加入固定破膜剂800 μl,避光1~2 h,用破膜Buffer洗涤2次,加入PE-Foxp3 2.5 μl,4 ℃避光孵育45 min,1×Buffer洗涤1次,用PBS重悬至100 μl后上机检测。
予PBS重悬后计数,取细胞1×106,加入淋巴细胞刺激剂2 μl/ml,放入37 ℃体积分数为5%的CO2细胞培养箱中孵育4~6 h,加1 ml PBS,300×g, 5 min离心,弃上清后加入表面抗体APC-CD3 1 μl、FITC-CD4 1 μl,4 ℃避光孵育40 min,1 ml PBS,300×g,5 min离心弃上清后轻度涡旋,使细胞完全重悬,加入250 μl固定/破膜剂,4 ℃避光孵育20 min后,加入1 ml破膜Buffer,250×g离心5 min,弃上清后再重复清洗1次,加入胞内抗体PE-IL-17 1 μl、4 ℃避光孵育1 h,加入1 ml破膜Buffer,250×g离心5 min离心,弃上清,以150~300 μl PBS重悬后上机检测。
1.3.4 ELISA法检测外周血清中IL-10、IL-17水平:按照试剂盒说明进行操作。
1.3.5 RT-PCR检测结肠组织中Foxp3、ROR-γt mRNA的表达:在各组中随机抽取4只小鼠,提取结肠中总RNA,反转录成cDNA,用其为模板行RT-PCR扩增。Foxp3引物F:5′-TCCCAGAGTTCTTCCACAAG-3′;R: 5′-TAAGGGTGGCATAGGTGAAA-3′;ROR-rt引物F:5′-CACGGCCCTGGTTCTCAT-3′;R: 5′-GCAGATGTTCCACTCTCCTCTTCT-3′;内参GAPDH引物F:5′-CATGGCCTTCCGTGTTCCTA-3′;R: 5′-TGTCATCATACTTGGCAGGTTTCT-3′。反应条件:95 ℃ 30 s,95 ℃ 5 s,60 ℃ 34 s,重复40个循环。结果用2-△△Ct计算Foxp3、ROR-γt mRNA的表达量。
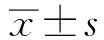
2 结果
2.1各组小鼠脾单核细胞中Treg细胞、Th17细胞比例及Treg/Th17细胞比例与结肠炎对照组相比,F.prausnitzii活菌干预组和F.prausnitzii上清干预组的Treg细胞比例上升,Th17细胞比例下降,Treg/Th17比值升高(P<0.05)(见表1)。
2.2血清中IL-10、IL-17的含量F.prausnitzii活菌干预组和F.prausnitzii上清干预组血清中IL-10水平较结肠炎对照组升高,IL-17水平较结肠炎对照组降低(P<0.05)(见图1)。

表1 各组脾脏中Treg细胞和Th17细胞比例及Treg/Th17比率Tab 1 Proportion of Treg cells and Th17 cells in spleen and the ratio of Treg/Th17 in each group (±s)
注:与结肠炎对照组比较,*P<0.05,**P<0.01,***P<0.001。
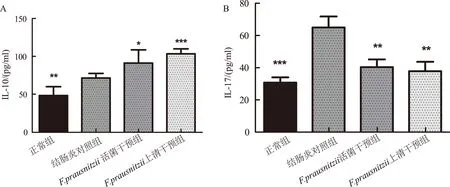
注:与结肠炎对照组比较,*P<0.05,**P<0.01,***P<0.001。
2.3结肠组织中Foxp3、ROR-γtmRNA的表达与结肠炎对照组相比,F.prausnitzii上清干预组的Foxp3 mRNA的表达上升(P<0.05),但F.prausnitzii活菌干预组Foxp3 mRNA的表达差异无统计学意义(P>0.05);两干预组肠组织中ROR-γt mRNA的表达较结肠炎对照组的表达下降(P<0.05)(见图2)。
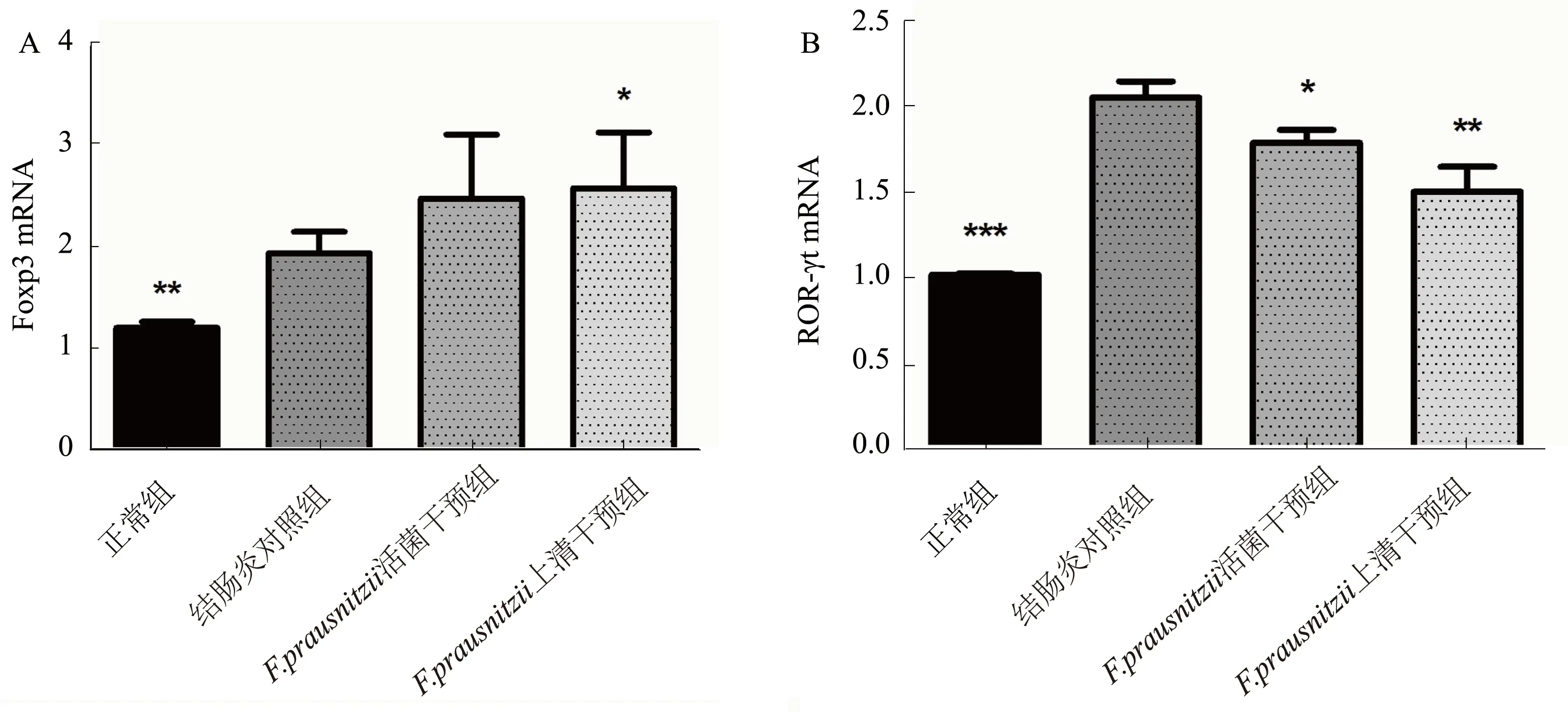
注:与结肠炎对照组比较,*P<0.05,**P<0.01,***P<0.001。
3 讨论
F.prausnitzii属于厚壁菌门,作为肠道益生菌的一种,对维护肠道菌群的稳态起重要作用,可分泌丁酸盐及未知产物。研究发现,F.prausnitzii具有免疫调节和抗炎作用[3]。本课题组前期的动物实验[4]发现,对于TNBS诱导的实验性结肠炎大鼠,F.prausnitzii及上清通过增加脾脏中Treg细胞比例发挥治疗作用,具体机理不清。也有研究[5]发现,对于DSS诱导的实验性结肠炎小鼠,F.prausnitzii上清可通过抑制脾和肠道Th17细胞的生成,减少促炎因子IL-17A的释放,从而减轻肠道炎症,说明益生菌在IBD治疗方面具有举足轻重的地位。Treg细胞可降低炎性反应,抑制炎性进展,在维持免疫稳态及抗炎等过程中扮演重要角色。研究[6]证明,Treg细胞数量减少或功能下降与IBD的发展相关。动物实验研究[7]显示,通过体内输注Treg细胞,重症联合免疫缺陷小鼠的结肠炎症状可以减轻。临床研究[8]表明,与正常人相比,IBD患者外周血Treg细胞比例显著下降。Th17细胞是新近发现的一群以分泌IL-17为特征的CD4+T 细胞亚群,该细胞及其相关炎症因子对IBD的发病有重要作用,大量研究[9-11]已证实,Th17细胞亚群可引起严重免疫反应性疾病。因此,通过提高Treg细胞比例,降低Th17细胞比例,调控两者之间的平衡,用以治疗IBD为目前关注的热点。由于Th17细胞在淋巴结中含量较低(1%~2%),提取难度大,且缺乏特异性表面标记,其特异性标记为细胞内分泌的IL-17细胞因子,难以通过流式方法获得肠道相关淋巴组织中的Th17细胞,一定程度上限制了其研究的可行性。故本实验只做了脾的流式,某种程度也能说明问题。流式细胞术结果显示,与结肠炎对照组相比,F.prausnitzii活菌干预组和F.prausnitzii上清干预组的Treg细胞比例上升,Th17细胞比例下降,Treg/Th17比值升高。提示F.prausnitzii及其上清可调控T细胞亚群 Treg/Th17的平衡来控制结肠炎炎症。Treg细胞以分泌TGF-β和IL-10在IBD中发挥抗炎作用。IL-10主要由巨噬细胞和单核细胞产生,具有抗炎作用。研究[12]证明,IL-10缺失可导致与CD相似的结肠炎,且CD的复发与低含量IL-10相关。动物实验模型表明,IL-10基因敲除的小鼠可制备出与人类相似的结肠炎模型,而对于TNBS模型的结肠炎大鼠,给予IL-10治疗后,可缓解结肠炎的症状[13]。由此可知,抗炎因子IL-10对IBD防治有重要影响。Th17细胞分泌的细胞因子IL-17、IL-6和IL-22有明显的致炎作用,能促进免疫反应的发生[14]。其中IL-17A的致炎性最为显著,通过增加细胞的通透性及促进其他炎症因子和趋化因子的产生方式,发挥致炎作用[15]。本实验发现,F.prausnitzii活菌干预组和F.prausnitzii上清干预组血清中IL-10水平较结肠炎对照组升高,IL-17水平较结肠炎对照组降低。提示F.prausnitzii活菌及其上清通过上调抗炎因子IL-10的表达,下调炎症因子IL-17的表达,抑制其他炎症因子和趋化因子的产生,进而减轻全身炎症反应。
Foxp3是Foxhead家族成员,表达于CD4+CD25+Treg细胞上,是Treg细胞特异转录因子。Foxp3不仅数量上更多地表达于CD4+CD25+Treg细胞,同时对其生物学特性有重要作用,尤其表现在对Treg细胞的发育和功能方面[16-17],而机体Treg细胞发育异常可致体内免疫功能紊乱,进而与IBD的发生相关。研究[16-18]表明,Foxp3基因突变可导致Treg细胞的数量明显减少或功能明显降低,引起人和小鼠发生较重的自身免疫性疾病。为进一步说明F.prausnitzii及其上清对Treg细胞的影响。本实验还检测小鼠结肠组织中Foxp3 mRNA的相对表达水平。结果显示,与结肠炎对照组相比,F.prausnitzii上清干预组的Foxp3 mRNA的表达上升,但F.prausnitzii活菌干预组Foxp3 mRNA的表达差异无统计学意义,但有上升趋势。本实验说明,F.prausnitzii上清的抗炎作用是通过促进Foxp3 mRNA的表达,进而增加CD4+CD25+Treg细胞,发挥抑制免疫效应,F.prausnitzii上清的效果优于活菌组,具体作用机制不明。Th17细胞分化依赖于信号传导与转录激活因子STAT3,并需要关键的转录因子维A酸相关核孤儿受体ROR-γt的表达[19]。因此本实验还检测小鼠结肠组织中ROR-γt mRNA的相对表达水平,进一步说明F.prausnitzii及其上清对Th17细胞的影响。结果显示,F.prausnitzii活菌干预组和其上清干预组肠组织中ROR-γt mRNA的表达较对照组表达下降。提示F.prausnitzii及其上清可通过下调结肠黏膜组织Th17细胞的表达,减少炎症因子的释放,从而减轻结肠炎症。
综上所述,F.prausnitzii及其上清可调控T细胞亚群,通过提高肠道中Foxp3 mRNA的表达,抑制ROR-γt mRNA的表达,促进脾脏Treg细胞的生成,减少Th17细胞,调节Treg/Th17的平衡,从而减轻肠道炎症及全身炎症反应。本研究为临床F.prausnitzii及其上清治疗IBD提供了一种新的思路。但F.prausnitzii上清中包含哪些具体物质?这些物质对免疫调节所起的具体作用机制及其对Foxp3、ROR-γt基因的平衡调控蛋白水平上的研究是未来需要进一步研究的方向。
[1] KASER A, ZEISSIG S, BLUMBERG R S. Inflammatory bowel disease [J]. Annu Rev Immunol, 2010, 28(1): 573-621.
[2] XAVIER R J, PODOLSKY D K. Unravelling the pathogenesis of inflammatory bowel disease [J]. Nature, 2007, 448(7152): 427-434.
[3] SOKOL H, SEKSIK P, FURET J P, et al. Low counts of Faecalibacterium prausnitzii in colitis microbiota [J].Inflamm Bowel Dis, 2009, 15(8): 1183-1189.
[4] 杨晓彤, 张明明, 洪娜, 等.Faecalibacteriumprausnitzii对实验性结肠炎大鼠FoxP3+Treg细胞的影响[J].胃肠病学, 2012, 17(3): 141-145.
YANG X T, ZHANG M M, HONG N, et al. Effects ofFaecalibacteriumprausnitziisonFoxP3+Treg cells in experimental colitis rats [J]. Chin J Gastroenterol, 2012, 17(3): 141-145.
[5] 黄晓丽, 张新, 于成功, 等. 普拉梭菌上清对葡聚糖酸钠诱导的溃疡性结肠炎小鼠Th17细胞及IL-17A 的影响 [J]. 中南大学学报, 2015, 40(12): 1320-1325.
HUANG X L, ZHANG X, YU C G, et al. Effects of Faecalibacterium prausnitzii supernatant on Th17 cell and IL-17A in dextran sulfate sodium-induced ulcerative colitis mice [J]. J Cent South Univ (Med Sci), 2015, 40(12): 1320-1325.
[6] 尚瑞, 吴军, 郑雪皎, 等. 外周血Th17、Treg细胞水平在溃疡性结肠炎和克罗恩病中的比较研究[J]. 胃肠病学和肝病学杂志, 2017, 26(5): 559-561.
SHANG R, WU J, ZHENG X J, et al. A comparative study of the peripheral blood Th17 and Treg cells in Crohn’s disease and ulcerative colitis [J]. Chin J Gastroenterol Hepatol, 2017, 26(5): 559-561.
[7] OGINO H, NAKAMURA K, IHARA E, et al. CD4+CD25+regulatory T cells suppress Th17-responses in an experimental colitis model [J]. Dig Dis Sci, 2011, 56(2): 376-386.
[8] 王轶, 刘雪平, 赵治彬, 等. 外周血CD4+CD25+FoxP3+调节性T细胞与炎症性肠病疾病活动度的关系[J]. 胃肠病学, 2010, 15(4): 218-221.
WANG Y, LIU X P, ZHAO Z B, et al. Relationship between peripheral CD4+CD25+FoxP3+regulatory T cells and activity of inflammatory bowel disease [J].Chin J Gastroenterol, 2010, 15(4): 218-221.
[9] DONG G, YE R, SHI W, et al. IL-17 induces autoantibody overproduction and peripheral blood mononuclear cell overexpression of IL-6 in lupus nephritis patients [J].Chin Med J (Engl), 2003,116(4):543-548.
[10] LANGRISH CL, CHEN Y, BLUMENSCHEIN WM, et al. IL-23 drives a pathogenic T cell population that induces autoimmune inflammation [J]. J Exp Med, 2005, 201(2): 233-240.
[11] PARK H, LI Z, YANG X O, et al. A distinct lineage of CD4 T cells regulates tissue inflammation by producing interleukin 17 [J].Nat Immunol, 2005, 6(11): 1133-1141.
[12] KUHN R, LOHLER J, RENNICK D, et al.Interleukin-10-deficient mice developchronic enterocolitis [J].Cell, 1993, 75(2): 263-274.
[13] MALOY K J, SALAUN L, CAHILL R, et al. CD4+CD25+ T(R)cells suppress innate immune pathology through cytokine dependent mechanisms [J]. J Exp Med, 2003, 197(1): 111-119.
[14] MACHIIELS K, JOOSSENS M, SABINO J, et al.A decrease of the butyrate-producing species Roseburia hominis and Faecalibacterium prausnitzii defines dysbiosisinpatients with ulcerative colitis[J]. Gut, 2014, 63(8): 1275-1283.
[15] WEAVER C T, HARRINGTON L E, MANGAN P R, et al. Th17: an effector CD4 T cell lineage with regulatory T cell ties [J]. Immunity, 2006, 24(6): 677-688.
[16] BEISSERT S, SCHWARZ A, SCHWARZ T. Regulatory T cells [J]. J Invest Dermatol, 2006, 126(1): 15-24.
[17] HORI S, NOMURA T, SAKAGUCHI S.Control of regulatory T cell developmentby the transcription factor Foxp3 [J].Science, 2003, 299(5609): 1057-1061.
[18] FONTENOT J D, RASMUSSEN J P, WILLIAMS L M, et al. Regulatory T cell lineage specification by the forkhead transcription factor foxp3 [J]. Immunity, 2005, 22(3): 329-341.
[19] IVANOV I I, MCKENZIE B S, ZHOU L, et al.The orphan nuclear receptor RORgammat directs the differentiation program of proinflammatory IL-17+ T helper cells [J].Cell, 2006, 126(6): 1121-1133.
EffectofFaecalibacteriumprausnitziianditssupernatantonthebalanceofTreg/Th17indextransulfatesodium-inducedcolitismice
ZHANG Min1, YU Chenggong1,2
1.Department of Gastroenterology, Drum Tower School of Clinical Medicine, Nanjing University of Traditional Chinese Medicine, Nanjing 210008; 2.Department of Gastroenterology, the Affiliated Drum Tower Hospital of Nanjing University Medical School, China
ObjectiveTo investigate the effect of Faecalibacterium prausnitzii (F.prausnitzii) and its supernatant on the balance of Treg/Th17 in mice induced by dextran sulfate sodium.MethodsA total of 40 C57BL/6J mice were randomly divided into four groups: normal group, colitis model group,F.prausnitziitreatment group andF.prausnitziisupernatant treatment group, respectively. The normal group drunk water normally, colitis were induced by drinking 25 g/L DSS solution in the other groups, which were injected the PBS, theF.prausnitziiand theF.prausnitziisupernatant through the stomach, respectively. Percentages of Treg cells and Th17 cells in spleen were analyzed by flow cytometry, and the ratio of Treg/Th17 was calculated. Serum levels of IL-10 and IL-17 were measured by ELISA and the levels of Foxp3 and ROR-γt mRNA in colonic tissue were detected by RT-PCR.ResultsPercentage of Treg cells inF.prausnitziitreatment group andF.prausnitziisupernatant treatment group in spleen was higher than that in colitis model group, and the percentage of Th17 cells in the two treatment groups in spleen was lower than that in colitis model group. The ratio of Ttreg/Th17 in the two treatment groups was higher than that in the colitis model group. Serum level of IL-10 inF.prausnitziitreatment group and theF.prausnitziisupernatant treatment group was higher than that in colitis model group, and serum level of IL-17 in the two treatment groups was lower than that in colitis model group. Compared with the colitis model group, the expression of Foxp3 mRNA inF.prausnitziisupernatant treatment group in colonic tissues was increased, but the expression of Foxp3 mRNA had no difference inF.prausnitziitreatment group. The expression of ROR-γt mRNA in the two treatment groups in colonic tissues were lower than that in colitis model group.Conclusion
TheF.prausnitziiand its supernatant could regulate the T lymphocyte subsets by increasing the expression of Foxp3 mRNA and inhibiting the expression of ROR-γt mRNA, which might regulate the balance of Treg/Th17.
Faecalibacterium prausnitzii; Colitis; Treg cell; Th17 cell
10.3969/j.issn.1006-5709.2017.12.018
国家自然科学基金项目(81470819)
张敏,硕士研究生,研究方向:炎症性肠病。E-mail:3054720471@qq.com
于成功,博士,博士生导师,教授,研究方向:炎症性肠病、消化道肿瘤等。E-mail: chenggong_yu@nju.edu.cn
R574
A
1006-5709(2017)12-1396-05
2017-02-26
马 军)

