不同光照强度下鹦鹉螺的行为观察
张艳珍,王彦鹏,栾 刚,张晓雁,蔡经江
(北京信沃达海洋科技有限公司(北京海洋馆),北京 100081)
不同光照强度下鹦鹉螺的行为观察
张艳珍,王彦鹏,栾 刚,张晓雁,蔡经江
(北京信沃达海洋科技有限公司(北京海洋馆),北京 100081)
由于鹦鹉螺(Nautilus pompilius)物种及构造的特殊性,在动物进化及科普教育多方面具有重要的研究价值。对人工养殖条件下鹦鹉螺对不同光照度的行为适应性进行研究。实验设定4个光照梯度(Ⅰ~Ⅳ),各梯度光照分别为:50 lx、200 lx、350 lx和450 lx,各梯度实验时间分别为1个月,并测定缸体25个不同位点照度,通过观察鹦鹉螺体态与行为变化,了解照度对鹦鹉螺行为的影响。结果显示:1)实验各照度下鹦鹉螺体态、吸附、游动及进食行为正常;2)各照度梯度未连续出现不吸附现象及灯光反应现象,第Ⅲ和第Ⅳ光照梯度两类现象出现频次增加,灯光反应现象有显著差异(P<0.05);3)随着照度增加,生长速度呈加快趋势;4)各照度梯度鹦鹉螺在缸体内各泳层及位点均有分布,分布最适照度范围依次为4.70~12.18 lx、15.39~58.90 lx、31.90~125.00 lx和42.35~75.00 lx。结果表明,实验各光照度对鹦鹉螺体态行为无明显影响,鹦鹉螺的最适光照上限为125 lx。
鹦鹉螺;光照度;行为反应
具有“活化石”之称的鹦鹉螺(Nautilus pompilius),繁盛时期在2~49.5亿万年前,与之同期的生物多数已灭绝[1-3]。鹦鹉螺分布于印度洋和太平洋海区,由于分布范围及深度较广,种群资源量难以得到正确评估,近年通过标志放流回捕技术以及对渔民渔业调查结果显示鹦鹉螺种群数量逐步下降[4],尽管分布范围广,但生态位相对较窄,国内几乎难见踪迹。因其物种特殊性,其独特的形态及进化地位在研究动物进化上,以及科学普及教育、仿生学等方面均有重要价值[5]。鹦鹉螺白天主要生活在黑暗的深水区域约300 m及以下,夜间会垂直迁移到水下75 m左右的珊瑚礁和岩石上索饵,这也与其视力较弱有一定的关系。作为对弱光敏感的有壳物种,其生态特殊性的研究可为其它物种提供借鉴与参考。国外对鹦鹉螺研究包括生态分布、生物学特性以及结构功能等,行为学研究主要针对摄食、求偶、迁移等行为[6-10],除对环境水流及水温有少量报道外,对于其它环境因子及其对形态行为的影响相关研究较少[11]。光照是影响鹦鹉螺的养殖寿命的关键因素之一,鹦鹉螺对于光照极为敏感,有学者认为光照与鹦鹉螺的昼夜垂直迁移等生命活动有关[6],鹦鹉螺在国外水族馆的养殖较多,其光照条件设定不尽相同,养殖寿命长短不一[11]。本研究通过设定不同光照度探索鹦鹉螺的行为变化,旨在找到鹦鹉螺的最适光照强度范围,为进一步保护鹦鹉螺提供依据,也为研究自然状态下鹦鹉螺的环境分布及迁移等行为习性提供基础资料。
1 材料与方法
1.1 实验对象
实验用5 ind鹦鹉螺,均来自北京海洋馆,引进时间为2012年7月22日,经暂养(期间饲养及水质管理同实验阶段)后螺况稳定,各样本生物学指标及螺况如表1所示,壳径指壳开口处侧边缘所在延长线上的壳长度(与壳高垂直方向)[7]。

表1 实验样本概况Tab.1 Information of samples
1.2 缸体条件
缸体为圆柱形亚克力缸体,直径1.15 m、高度2.09 m,缸体中央设有透明亚克力箱体供攀附,观察窗口大小1.6 m(弧长)×1.6 m(高度),观察窗为透明,缸体其它部位为黑色保温棉包裹。配备独立的循环过滤控制系统,水质指标控制:水温16~18℃、盐度30~35、溶解氧(DO):6.0~8.0 mg·L-1、酸碱度(pH):7.5~8.2、氨/铵(NH3/NH4+):<0.02 mg·L-1、亚硝酸盐(NO2-):<0.02 mg·L-1、硝酸盐(NO3-):25~35 mg·L-1、磷酸盐(P):0.5~2.0 mg·L-1。
1.3 饲养管理
饵料种类包括活饵刀额新对虾(Metapenaeus ensis)、凡纳滨对虾(Penaeus vannamei)[12],以及以上述种类为基础特制混合饵料等。每周喂食3次[12],每次各螺1 g到2 g不等量(根据个体大小确定)。池体清洁换水周期为1次/周,每次换水量为总水量的1/4,粪便和杂质每日巡检及时清除。
1.4 照度设定
采用水族馆专用长形蓝色生物灯管(功率:20 W,色温:3 000~6 800 K),悬置于缸体正上方,通过调整功率及使用滤光板进行照度调整控制,缸体周围环境避光。光周期控制为8 h∶16 h(光:暗;有光时段:9∶00~17∶00),夜间为完全黑暗。依据鹦鹉螺的海洋生活特点并结合以往报道,本次实验设定4个照度阶段(Ⅰ~Ⅳ),以深度1 cm中央照度为准光照分别为50 lx、200 lx、350 lx和450 lx,各照度实验时间分别为1个月。
采用KONICA MINOLTA T-10/T-10M水下光照度测定仪进行照度测定(测定范围0.01~299 900 lx,精度0.01)。将水体按水下深度分为5层,分别为 1 cm、50 cm、100 cm、150 cm、209 cm;每层平均分为A、B、C、D区以及E区5个部分,其中E区为中央直径0.3 m范围,其它区为平均划分,各区以缸体内设置的刻度线为参照,不遮挡以方便鹦鹉螺自由选择区域,各照度梯度下测定水体中25个不同位点的照度值,每次测定3个值取平均值。
1.5 行为记录
实验期间每日 5次观察并记录(9∶00、11∶00、13∶00、15∶00、17∶00),每次30~60 min,包括体态变化、活动位点、吸附能力、灯光反应以及进食反应等,并记录。各行为指标参照已有报道做记录[11,13],内容如下:
体态变化:笠部、触须、眼睛、鳃部、口部、吹水口及壳体等变化;
活动位点:活动位点或吸附位点,包括在水体中分布的泳层及区域;
吸附能力:吸附力度和稳定性以及吸附时间的变化;
灯光反应:开关灯10 min内鹦鹉螺的活动位点、吸附情况的变化;
进食反应:进食积极性及进食时间与结果。
根据以上内容定义适应与不适应反应,适应表现:体态无异常;可自由上下游动;可吸附,吸附时身体在水面以下,吸附力度大;对灯光无明显反应,或有反应能很快调整位点后吸附;进食情况较好。不适应表现:外观体态出现异常;泳层明显上移;吸附力弱,吸附触须少,吸附时间缩短;对灯光持久反应不能吸附;进食情况差或不进食等。
1.6 数据处理
行为结果以百分比(%)表示,即实验期间某行为出现频次占观察记录总次数的百分比。采用SPSS分析软件及Excel对数据进行分析处理,结果采用One-way ANOVA方差分析LSD法和Duncan法进行多重比较,P<0.05为显著性差异,采用Paired-Samples T Test对成对结果组间差异性检验,P<0.05为显著性差异。差异检验结果标明至图表中,有相同字母表示无显著差异(P>0.05),无相同字母表示有显著性差异(P<0.05)。
2 结果与分析
2.1 各光照梯度不同深度照度分布
各光照梯度不同深度照度分布如图1所示,各光照梯度25个位点照度实测结果详见表2。
2.2 各光照梯度实验螺体态反应
各光照梯度实验螺体态稳定。主要表现为:壳体颜色均匀,幼螺生长条纹清晰,成螺白色壳体均匀,笠部色素除Y5(为实验开始时色素少量缺失,实验过程中无变化),其它螺色素覆盖均匀,颜色均为橘黄色,无伤口,眼部、鳃、吹水口、触须无异常表现,吹水力度大,触须吸附有力。外观如图2所示。

图1 各梯度照度随缸体深度分布趋势(以E区照度为准)Fig.1 Relationship between illum ination and depth of tank in different stages(depends on the results of aera E)

图2 实验鹦鹉螺体态情况Fig.2 Appearances of Nautilus pompilius at the end of the experiment

表2 各光照梯度缸体各位点光照度结果Tab.2 Illum ination results at different sites in different stages (lx)
2.3 各光照梯度螺活动位点
第Ⅰ梯度活动深度与位点的分布比例及差异性详见图3、图4。各螺活动位点深度在100 cm至209 cm,所占总比例近80%,与1 cm处有显著性差异(P<0.05);主要活动区域为C区。鹦鹉螺在此阶段优势活动位点照度分布在4.70~12.18 lx。

图3 第Ⅰ梯度深度分布比例Fig.3 Depth results in stageⅠ

图4 第Ⅰ梯度池体各位点分布比例Fig.4 Area results in stageⅠ
第Ⅱ梯度活动深度与位点的分布比例及差异性详见图5、图6。各螺活动位点深度在100 cm和209 cm处;主要活动区域仍在C区,显著高于其它区域(P<0.05)。此阶段优势活动位点照度分布在 15.39~58.90 lx。

图5 第Ⅱ梯度深度分布比例Fig.5 Depth results in stageⅡ

图6 第Ⅱ梯度池体各位点分布比例Fig.6 Area resu lts in stageⅡ
第Ⅲ梯度活动深度与位点的分布比例及差异性详见图7、图8。各螺活动位点深度在209 cm处所占比例明显增加。主要活动区域仍在C区,与其它位点均有显著性差异(P<0.05)。此优势活动位点照度分布在31.9~125.00 lx。

图7 第Ⅲ梯度深度分布比例Fig.7 Depth results in stageⅢ

图8 第Ⅲ梯度池体各位点分布比例Fig.8 Area resu lts in stageⅢ
第Ⅳ梯度活动深度与位点的分布比例及差异性详见图9、图10。各螺活动位点深度主要分布在150 cm和209 cm,与1 cm和50 cm间均有显著性差异(P<0.05)。主要活动区域仍在C区。此阶段优势活动位点照度分布在42.35~75.00 lx。
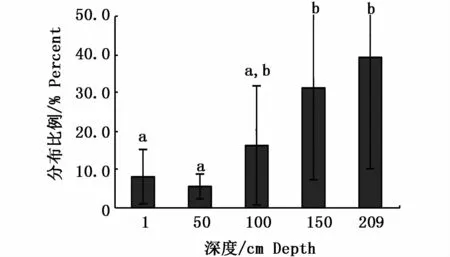
图9 第Ⅳ梯度深度分布比例Fig.9 Depth results in stageⅣ

图10 第Ⅳ梯度池体各位点分布比例Fig.10 Area results in stageⅣ
2.4 各光照梯度吸附能力
本实验各光照梯度未连续出现不吸附现象,不吸附次数比例均<10%,各螺各光照梯度不吸附比例详见图11。随着光照度增加,不吸附次数呈上升趋势,显著变化发生在第Ⅲ和第Ⅳ梯度阶段,与前2个梯度无显著性差异(P>0.05),而各实验螺之间均存在显著差异(P<0.05)。

图11 各光照梯度不吸附比例Fig.11 Percents of non-adsorbable in different stages
2.5 各光照梯度灯光反应
本实验前两个光照梯度,各螺无明显灯光反应,第Ⅲ和第Ⅳ光照梯度出现灯光反应,主要表现为开灯后立即活动,重新寻找吸附位点,或开灯后出现不吸附现象,经长时间适应后再吸附。出现频次呈增加趋势,第Ⅳ光照梯度显著高于第Ⅲ梯度(P<0.05)(图12)。

图12 第Ⅲ、Ⅳ光照梯度各螺灯光反应比较Fig.12 Percents of behavior of samples to light between stagesⅢ andⅣ
2.6 进食与生长
进食动作及行为积极性无明显异常,生长速度整体趋势表现为随着光照增加有所加快。其中4只螺最快生长在第Ⅳ阶段,最高达到0.351 mm·d-1。检验结果显示,第Ⅲ、Ⅳ梯度与第Ⅰ、Ⅱ梯度差异显著(P<0.05),Y8与 Y4、Y5有显著差异(P<0.05)。
各螺经长期养殖寿命最终最长1 014 d,最短565 d。
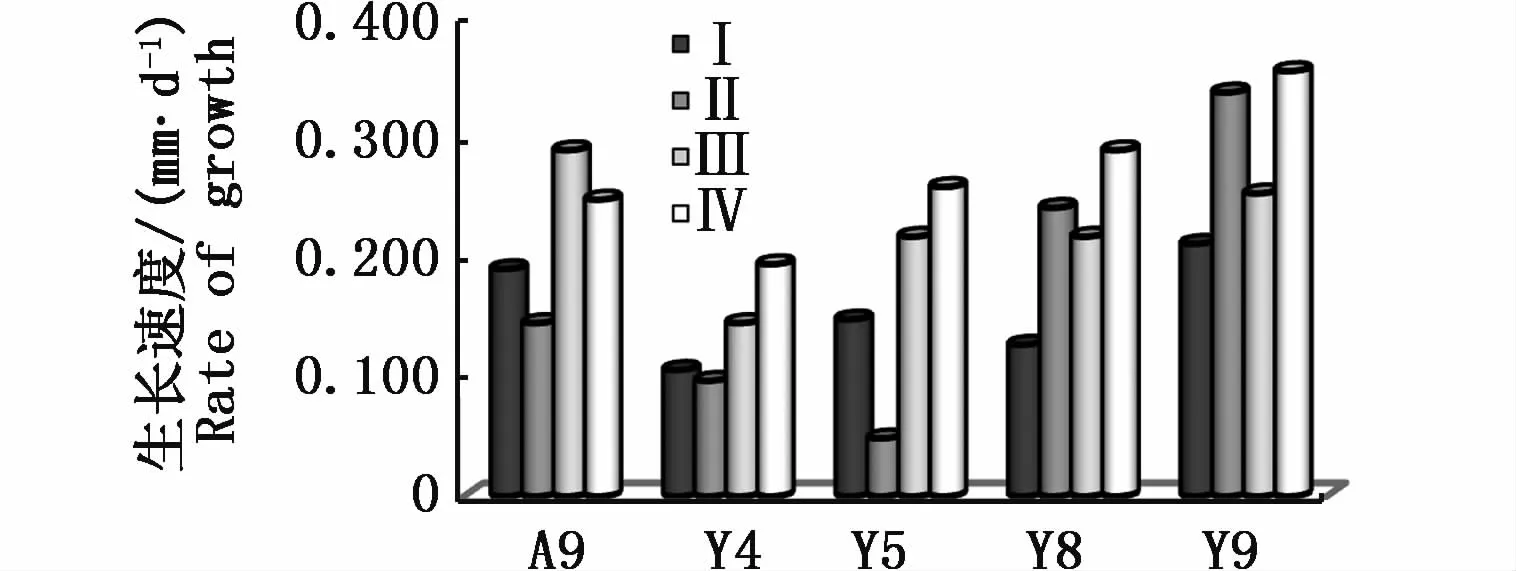
图13 各光照梯度新壳生长速度Fig.13 Rate of grow th in different stages
3 讨论
鹦鹉螺主要分布深度为100~500 m,长期暗环境生存形成了与环境相适应的光行为反应及生理适应特点[2-3],眼部构造特殊,通过针孔缝隙开合去适应外界光照强弱改变,区别于其它头足纲物种,其最大吸收光谱波长为 468 nm[14-15]。与多数鱼类一样,鹦鹉螺具有趋光性,已有研究显示实验条件下将光照亮度增加至远远高于其自然环境条件(32 cd·m-2),或降低至 2.4×10-5cd·m-2(该照度为海水深度约770 m处)时,鹦鹉螺仍表现为趋光反应或视网膜紫质有吸收光[15],可见,鹦鹉螺对微弱光极为敏感。本次实验期间照度分布范围4~500 lx,鹦鹉螺体态无明显异常,未出现疾病现象,可见本实验条件适合鹦鹉螺的养殖需求。而国外报道中鹦鹉螺极易出现粘液、寄生虫、色素细胞脱落、眼睛不对称以及黑壳等病症[7,16-17],导致死亡。
鹦鹉螺在国外水族馆养殖较多[18-19],但养殖光照范围不尽相同,包括40~200 W不同功率的红光、白光或荧光灯经蓝色滤光板等,养殖寿命平均 546 d(封闭系统)和 745 d(开放系统)[11]。本次实验各光照梯度活动位点的选择显示鹦鹉螺的活动区域广泛,最适光照度上限在125 lx左右,通过控制光照度范围,此封闭实验条件下螺长期养殖寿命最终高于以往报道结果[11]。
本次实验在后2个光照梯度,随着光照度增加,鹦鹉螺不吸附频次及对光的反应有显著上升,不吸附行为表明其对光照的胁迫反应,同时伴随活动增加,可能与鹦鹉螺的视动反应随光增加越明显有关[15]。鹦鹉螺随照度变化能较快地重新选择活动位点,多数为移至更暗环境,表现对光照的适应性选择,CROOK等[20]的研究显示鹦鹉螺对光的反应有长久记忆和短暂记忆两种,对曾感应过的光照强度有趋向性。
本次实验鹦鹉螺生长多数接近自然生长速度(0.124~0.23 mm·d-1)[17],而高光强度最高生长速度高于以往报道中自然生长速度,推断不同光照度与生长有显著相关性,其影响机制有待了解。鹦鹉螺的生长与个体大小、健康状况、季节变化、营养水平等有着直接的关系[17,21],对于其最适营养配比以及生长与环境的关系有待深入研究。
本次实验认为,鹦鹉螺对光反应极其敏感,光照度是影响鹦鹉螺的存活的重要因子,养殖条件下最适照度4~125 lx,可通过调整光照延长鹦鹉螺的养殖寿命,从而更好地实现鹦鹉螺的物种保护。
[1] REYNOLDS JD,DULVY N K,GOODWIN N B,et al.Biology of extinction risk in marine fishes[J].Proceedings of the Royal Society B-Biological Sciences,2005(272):2337-2344.
[2] BASIL J,HANLON R,SHEIKH S,et al.Threedimensional odor tracking by Nautilus pompilius[J].Journal of Experimental Biology,2000,203(9):1409-1414.
[3] RUTH P,SCHMIDTBERG H,WESTERMANN B,et al.The sensory epithelium of the tentacles and the rhinophore of Nautilus pompilius L.(Cephalopoda,Nautiloidea)[J].Journal of Morphology,2002,251(3):239-255.
[4] DUNSTAN A J,WARD P D,MARSHALL N J.Nautilus pompilius life history and demographics at the osprey reef seamount[J].Coral Sea,2011,6(2):e16312.
[5] 古玉霞.鹦鹉螺形仿生建筑数学建模及结构设计[D].厦门:厦门大学,2012.GU Y X.Bionic buildingmathematicalmodeling and structure design of the Nautilus pompilius shaped[D].Xiamen:Xiamen university,2012.
[6] LANDMAN N H,JONESD S,DAVISR A.Hatching depth of Nautilus pompilius in Fiji[J].Veliger,2001,44(4):333-339.
[7] WESTERMANN B,BECK-SCHILDWAECHTER I,BEUERLEIN K,et al.Shell growth and chamber formation of aquarium-reared Nautilus pompilius(Mollusca,Cephalopoda)by X-ray analysis[J].Journal of Experimental Zoology,2004,301(12):930-937.
[8] WESTERMANN B,CHMIDTBERG H,BEUERLEIN K.Functional morphology of the mantle of Nautilus pompilius(Mollusca,Cephalopoda)[J].Journal of Morphology,2005,264(3):277-285.
[9] CROOK R,BASIL J.A role for nautilus in studies of the evolution of brain and behavior[J].Communicative and Integrative Biology,2008,1(1):18-19.
[10] SUKHSANGCHANC,MEKSUMPUNS,NABHITABHATA J,etal.Distribution,biology,and stomach contents of paper Nautilus(Argonauta hians) in the Andaman Sea[J].Science Asia,2009,35(4):315-319.
[11] CARLSON B A.Nautilus:Collection and aquarium maintenance of Nautilus[M].England:Evertype,2009:563-578.
[12] WESTERMANN B,BEUERLEIN K,RUTH P,et al.Tracer studies of food absorption in the digestive tract of Nautilus pompilius (Cephalopoda,Tetrabranchiata)[J].Cell and Tissue Research,2000,300(1):173-179.
[13] BASIL J,BAHCTINOVA I,KUROIWA K,et al.The function of the rhinophore and the tentacles of Nautilus pompilius L.(Cephalopoda,Nautiloidea)in orientation to odor[J].Marine and Freshwater Behaviour and Physiology,2005,38(3):209-221.
[14] BARBER V C.Nautilus:The sense organs of Nautilus[M].England:Evertype,2009:223-230.
[15] MUNTZW R A.Nautilus:Visual behavior and visual sensitivity of Nautilus pompilius[M].England:Evertype,2009:231-244
[16] MEENAKSHIV R,MARTIN A W,WILBUR K M.Shell repair in Nautilusmacromphalus[J].Marine Biology,1974(27):27-35.
[17] LANDMAN N,SAUNDERSW.Nautilus:Incidence and kinds of epizoans on shells of live Nautilus[M].England:Evertype,2009:163-178.
[18] MORPURGO M.The new aquarium with Nautilus pompilius LINNAEUS,1758(Cephalopoda)in the South Tyrol Museum of Natural Science[J].Gredleriana,2006(6):389-393.
[19] SPINOSA C.Nautilus:A small,closed,aguarium system for Nautilus[M].England:Evertype,2009:585-595.
[20] CROOK R,BASIL J.A biphasic memory curve in the chambered Nautilus, Nautilus pompilius L.(Cephalopoda:Nautiloidea) [J].Journal of Experimental Biology,2008,211(12):1992-1998.
[21] ARNOLD J.Nautilus embryology:A new theory of molluscan shell formation[J].Biology Bulletin,1992,183(2):373-374.
Behavior of Nautilus pompilius exposed to different illum ination
ZHANG Yan-zhen,WANG Yan-peng,LUAN Gang,ZHANG Xiao-yan,CAIJing-jiang
(Beijing Xinwoda Marine Technology Co.Ltd(Beijing Aquarium),Beijing 100081,China)
Because of the particularity of the Nautilus,it has important research value in animal evolution and science education.This experiment was conducted on the cultured Nautilus pompilius to study the behavior exposed to different illumination.Four illumination gradientswere set up named stageⅠ -Ⅳ,which were 50 lx,200 lx,350 lx and 450 lx respectively.The experiment time was 1 month for each illumination gradient.The illumination of 25 sites in the tank were determined under every gradient.Through the observation of the Nautilus,we were going to understand the relationship between the illumination and the behavior,also to grope the ecological characteristics of the Nautilus and the optimal illumination in cultured conditions.The observation indexes included the body appearances of the samples,the activity depth and the activity area in the tank,the non-adsorbable reaction,the behavior changes to light and the rate of growth in different stages.In this study,we found that the body appearances,adsorption,swimming and eating behavior of Nautilus pompilius were all normal under different illumination.There was no continuous appearance of non adsorption and light reaction in different illumination stages,but the times of the two phenomena increased in stageⅢandⅣ.The percents of the non-adsorbable were about 2.2%and 1.6%respectively,and higher than the stageⅠandⅡ(average level:1.4%),there was no significant difference between different stages(P<0.05).The light reaction resultswere significantly differentbetween stageⅢ andⅣ(P<0.05),the average percent of the light reaction in stageⅢ andⅣ were 0.5%and 4.6%respectively.With the increase of illumination,the rate of growth was accelerating from 0.154mm·d-1to 0.264mm·d-1.Their activity area was throughout the tank in all stages.The optimal illumination range in four illumination gradientswere 4.70-12.18 lx,15.39-58.90 lx,31.90-125.00 lx and 42.35-75.00 lx respectively.The results showed that the behavior of the Nautilus was normal under the four illumination gradients,and the highest optimal illumination was 125 lx in cultured conditions.
Nautilus pompilius;illumination;behavior
S 968.3
A
1004-2490(2017)06-0649-08
2016-12-11
北京海洋馆企业内部专项课题(2014)
张艳珍(1985-),女,硕士,研究方向为濒危物种保护生理生态学。E-mail:zhyanzh1985@163.com

