西伯利亚鲟Sox17基因cDNA全长的克隆及其表达分析
宋 炜,陈芬芳,2,张凤英,马春艳,赵 明,马凌波
(1.中国水产科学研究院东海水产研究所,农业部东海与远洋渔业资源开发利用重点实验室,上海 200090;2.上海海洋大学水产与生命学院,上海 201306)
西伯利亚鲟Sox17基因cDNA全长的克隆及其表达分析
宋 炜1,陈芬芳1,2,张凤英1,马春艳1,赵 明1,马凌波1
(1.中国水产科学研究院东海水产研究所,农业部东海与远洋渔业资源开发利用重点实验室,上海 200090;2.上海海洋大学水产与生命学院,上海 201306)
采用RACE技术获得西伯利亚鲟(Acipenser baerii)Sox17基因cDNA全长,序列分析表明,西伯利亚鲟Sox17基因cDNA全长2 671 bp,包括588 bp的5’端非翻译区,901 bp的3’端非翻译区和编码393个氨基酸残基的1 183 bp开放阅读框。氨基酸序列比对显示,该基因具较高的保守性,与塞内加尔多鳍鱼(Polypterus senegalus)的相似度最高为72%。系统进化分析表明,西伯利亚鲟与塞内加尔多鳍鱼聚为一支,且支持率为95%。以延伸因子efla(elongation factor 1-alpha)作为内参基因,对Sox17基因在西伯利亚鲟各组织的相对表达量进行分析,发现Sox17基因在不同组织中均有表达,但表达具有明显的组织差异性。在脑中表达量最高,而在肾、血液、眼、肠和胸鳍5个组织中表达量均较低。同时,Sox17基因在西伯利亚鲟不同发育时期均有表达,但表达具有一定的时间差异性。在宽神经板期的表达量高,相当于表达量最低点11日龄仔鱼的167倍。本研究为量化西伯利亚鲟胚胎发育分化过程中相关基因提供了参照工具,同时可为今后深入研究西伯利亚鲟Sox17在胚胎发育过程中的作用提供基础参考资料。
西伯利亚鲟;Sox17;cDNA全长;表达分析
鲟形目鱼类是软骨硬鳞下纲中现存的唯一一目,素有“活化石”之称[1]。作为鲟形目鱼类中重要的一种,西伯利亚鲟(Acipenser baerii)隶属于辐鳍亚纲(Actinopterygii),软骨硬鳞下纲(Chondrostei),鲟形目(Acipenseriformes),鲟科(Acipenseridae),鲟属,主要分布于俄罗斯西部的鄂毕河至东部的科雷马河之间的西伯利亚各河流中,是目前世界上最古老的也是起源最早的脊椎动物类群之一,因而具有极高的进化研究价值。随着生物技术的迅速发展,人们对西伯利亚鲟的研究已向纵深方向展开,主要集中在分子进化[2],胚胎和仔鱼[3-4]及侧线神经发育等方面[5-6]。
Sox基因家族(Sry-related HMG-box)是一类由哺乳动物性别决定基因Sry(sex determin-ing region of Y chromosome)相关基因构成。该家族成员都含有一个保守的 HMG(high mobility group)盒,其编码产物能特异性地识别和结合DNA序列,使DNA发生弯曲,是一类重要的转录调控因子[7]。Sox基因编码一系列转录因子,参与了胚胎发育和细胞命运决定的调控。通过与其它蛋白形成复合体后作为转录调控子,广泛参与早期胚胎发育、神经系统发育、软骨及多种组织器官的形成、性别决定和分化等重要的生物学过程[8-9]。在胚胎发育过程中可在多种组织中表达,其表达具有时空特异性。同一种Sox基因在不同的组织中具有不同的功能,同时,不同的Sox基因在不同的组织中可以具有相似的功能,甚至可以相互替代[10-11]。根据 HMG盒序列的系统发生分析、蛋白质结构特征及功能不同,将Sox基因分成A-J 10个亚族。Sox17属于Sox家族的F亚族,作为Sox转录因子超家族的一员,在进化过程中高度保守[12]。Sox17能够调控内胚层发育、精子发生和血管生成过程;在控制少突胶质细胞的分化过程中具有重要作用,同时也是心脏中胚层发育的关键作用因子[13-18]。
目前关于鲟形目Sox17基因的研究尚未见报道,本研究采用 RACE法克隆出西伯利亚鲟Sox17基因cDNA全长,并对其进行序列分析,同时利用RT-PCR技术,对该基因在西伯利亚鲟不同组织以及胚胎发育不同时期的表达量进行研究,以期进一步探究该基因的功能及其在西伯利亚鲟胚胎发育与分化调控信号通路中的作用。
1 材料与方法
1.1 实验材料
实验动物:西伯利亚鲟成鱼和胚胎均采自浙江千岛湖鲟龙科技有限公司养殖场,其中成鱼100 ind(2龄,体长为 27.4~34.5 cm),胚胎1 000 ind,暂养于实验室循环水系统中。
实验试剂:总RNA抽提试剂RNApure total RNA Kit(艾德莱,北京),pMD19-T Vector试剂盒(TaKaRa,clontech,Japan),SMARTer®RACE 5’/3’Kit试剂盒 (TaKaRa,clontech,Japan)、SMARTerTMRACE cDNA Amplification Kit(TaKaRa,clontech,Japan),ReverTra Ace qPCR RT Kit,SYBR Premix Ex TaqTMⅡ(Tli RNaseH Plus)(TaKaRa, Dalian, China) (TOYOBO,Japan)。
1.2 实验方法
1.2.1 样品采集与RNA提取
西伯利亚鲟活体解剖,取肠、腹鳍、肝脏、肌肉、脑、肾、鳃、胸鳍、血液、心脏、眼各组织于研磨器(RNAase free)中,同时参考西伯利亚鲟不同发育阶段的分期方法[4],取西伯利亚鲟胚胎大卵黄栓期、宽神经板期、尾芽分离期,以及11日龄仔鱼、64日龄鱼电感受器神经节于研磨器(RNAase free)中,加液氮研磨,使用RNApure total RNA Kit试剂盒提取RNA,具体步骤参照试剂盒说明书。提取的RNA通过琼脂糖凝胶电泳检测,符合后续RACE扩增以及RT-PCR的要求。
1.2.2 Sox17基因 3’RACE扩增
利用转录组建库获得的Sox17部分cDNA片段,设计引物进行 3’RACE。按照 SMARTer®RACE 5’/3’Kit(TaKaRa,clontech,Japan)试剂盒的说明书进行。将3’端RACE扩增获得的目的条带连接至pMD-19T载体后送至上海杰李生物技术有限公司测序。测序所得序列先进行拼接、比对和分析,确定属于Sox17基因的cDNA片段,然后把两端序列和经验证后序列进行拼接,拼接完成的序列即为Sox17基因cDNA的全长,最后设计实验验证全长序列。

表1 实验中所使用的引物Tab.1 Primers used for sequencing Sox17
1.2.3 生物信息学分析
应用NCBI中blastn和blastp程序对获得的序列进行了同源性查找及比较(http://blast.ncbi.nlm.nih.gov/Blast.cgi),以确定是否为目的基因片段;应用ORFfinder程序进行开放阅读框(ORF)(http://www.ncbi.nlm.nih.gov/gorf/gorf.html)分析并将其推导为相应的氨基酸序列,分析CDS起始区域及氨基酸数量。应用MEGA 6.0软件,采用邻接法(Neighbour-joining)对同源蛋白质进行系统进化树构建,其中自展(Bootstrap)进行1 000次重复,其余参数为默认。蛋白质的分子质量、等电点及基本性质分析用Prot Param (http//www. expasy. ch/tools/protparam.html)进行预测。

表2 序列分析所用的Sox17蛋白质序列来源和登录号Tab.2 Origins and accession numbers of Sox17 gene sequence in this study
1.2.4 实时荧光定量 PCR
以西伯利亚鲟各个组织和不同发育时期的RNA转录得到的cDNA为模板,以efla作为内参基因进行实时荧光定量PCR实验,采用标准曲线法进行数据分析。RT-PCR反应体系为20μL,其中包括:SYBR Premix Ex TaqTMⅡ10μL,Primer F/R(10 mM)1μL,ddH2O 6μL,cDNA2μL。反应条件如下:94℃预变性10 min,94℃变性15 s,引物退火温度1 min,总共进行45个循环,72℃下10 min,最后采用溶解曲线法检测引物是否特异。
2 结果与分析
2.1 西伯利亚鲟Sox17基因的cDNA序列分析
通过建库克隆和RACE扩增拼接获得了西伯利亚鲟Sox17基因的cDNA序列,比对结果显示,西伯利亚鲟Sox17基因与其它物种的Sox17具有较高的相似性,综合分析后命名为AbSox17(图1)。AbSox17基因cDNA全长序列2 671 bp,已将该序列提交至 GenBank(登录号:KY353513)。AbSox17序列包括588 bp的5’端非翻译区(untranslated region,UTR)、可编码393个氨基酸的1 182 bp的开放阅读框(open reading frame,ORF)及包括大小为901 bp的3’端非翻译区(UTR)。利用ProtParam tool平台,对AbSox17的编码区推导的蛋白质的基本理化特征进行分析,推测该蛋白质相对分子质量约为4.41×104Da,等电点为 6.39,分子式为 C1896H2933N567O605S25。AbSox17蛋白包含两个结构域,在蛋白质序列63~133位置有一个HMG盒包含A、B两个DNA作用结构域。而在蛋白质序列276~392位置处有一个Sox羧基端结构域。
2.2 AbSox17蛋白的结构特征以及相似性
与其它物种蛋白质氨基酸序列进行比对分析,结果表明,AbSox17与塞内加尔多鳍鱼(Polypterus senegalus)Sox17氨基酸序列相似性为72%,与香鱼(Plecoglossus altivelis)、欧洲舌齿鲈(Dicentrarchus labrax)、南极岩斑鳕(Notothenia coriiceps)Sox17氨基酸序列的相似性为67%,与小家鼠Sox17氨基酸序列相似性为50%。从13种鱼氨基酸序列与西伯利亚鲟的比对结果可以得出,Sox17基因在鱼类中相似度比较高,且存在保守区域,70~150 bp相似度最高,为HMG盒作用结构域。同样,在序列的羧基端与氨基末端也非常保守(图2)。
2.3 AbSox17蛋白质的系统进化分析
从NCBI蛋白质数据库下载了23条其它物种Sox17蛋白的氨基酸序列,利用MEGA 6.0软件对AbSox17蛋白及多个物种Sox17蛋白的氨基酸序列进行了比对。另外,根据多重比对结果构建了 NJ系统进化树,Bootstrap重复次数设为1 000次。从系统进化树可以明显看到2个完好的分支,西伯利亚鲟首先与塞内加尔多鳍鱼聚为一支,且支持率为95%。紧接着与其它鱼类聚为一支。然后与其它哺乳类(如人类、黑猩猩、牛、小家鼠、猴等)聚为一支(图3)。从图3可以看出,西伯利亚鲟与塞内加尔多鳍鱼的Sox17基因相似度最高,且与已报道的其它鱼类以及哺乳类在进化过程中发生了一定程度的分化。

图1 西伯利亚鲟Sox17 cDNA核苷酸序列和氨基酸序列Fig.1 The cDNA and deduced am ino acid sequence of Sox17 gene of Siberian sturgeon注:图中阴影大写英文字母上面为核苷酸序列,下面为氨基酸序列,其中63~133 bp位置有一个Sox基因家族特有的HMG盒,276~392 bp位置处有一个Sox羧基端结构域都已用阴影标出,起始密码子和终止密码子用黑线框标出Note:Above the capital letters in the shaded part of the picture,is the nucleotide sequence,and below is the amino acid sequence.The shadow on the position of 63-133 bp is Sox gene family special HMG box,276-392 bp location has a Sox carboxyl end structure domain.The start codon and termination codon aremarked by black line box


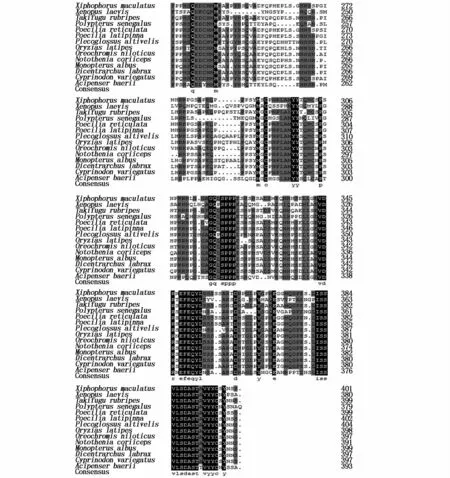
图2 西伯利亚鲟与其它物种Sox17氨基酸序列比对Fig.2 M ultiple alignments of the am ino acid sequence of Sox17 from other organisms注:“·”代表最大相似下的间隙,白底黑字表示非保守的氨基酸残基;浅灰底黑字表示大块儿的相似序列;灰底黑字表示保守区氨基酸;黑底白字表示完全相同的残基。用来比对的鱼为表2中的13种鱼Note:Gaps(·)were introduced to maximize the alignment.The relationships between residues are indicated as follows:nonsimilar residues,black letters on awhite background;block of similarity,black letters on a lightgrey background;conserved residues,black letters on a dark gray background;identical residues,white letters on a black background.The fish used to sequence blasted is from Tab.2

图3 MEGA 6.0构建的NJ系统进化树Fig.3 Construction system tree by MEGA 6.0注:进化树采用邻接法,且所用序列的GenBank登录号与表2中的相同Note:The tree is constructed by the neighbor-joining(NJ)algorithm.The GenBank number of the used sequences is the same as that in Tab.2
2.4 实时荧光定量PCR分析
运用实时荧光定量PCR技术,以efla作为内参基因,分析AbSox17基因在西伯利亚鲟成体各组织中的相对表达情况,发现AbSox17基因虽在不同组织中均有表达,但表达具有明显的组织差异性。其中,在肾脏、血液、眼3个组织中表达量均处于极低的水平,其次是在肠和胸鳍中表达也很低,在腹鳍的表达量为肠和胸鳍表达量的2.3倍,而在肝和心脏的表达量为腹鳍的2倍,在肌肉和鳃中的表达量大约为肠和胸鳍的10倍,在脑中的表达量最高,为肌肉的6倍(图4)。在不同发育阶段,在大卵黄栓期、宽神经板期及尾芽分离期、11日龄仔鱼和64日龄鱼电感受器神经节,AbSox17基因也均有表达(图5),AbSox17基因的mRNA在宽神经板期相对表达量最高,为表达量最低(11日龄仔鱼)的167倍。
3 讨论
本研究成功地采用RACE法从西伯利亚鲟中克隆出Sox17基因cDNA全长,该cDNA全长为2 671 bp,编码393个氨基酸。序列分析及同源性分析表明,该基因与其它动物有较高相似度,特别是与其它大多数鱼类的相似性均在60%以上,且存在保守区域。另外,在脊椎动物中,同一亚族中的同一Sox基因不仅在HMG基序区存在同源性,而且在其它区域也存在较大相似性。并且在某些亚族中,HMG基序的两侧序列也是十分保守的,例如,B亚族中保守区位于HMG基序的羧基端,而C、E亚族中的保守区则位于HMG基序的氨基端。AbSox17基因核苷酸序列中70~150 bp相似度最高,可预测为Sox基因特有的HMG盒作用结构域。同样,在序列的羧基端与氨基末端也非常保守[19],说明该基因具有较强的保守性,同时也预示该基因在脊椎动物生命活动中发挥着重要作用。

图4 不同组织中西伯利亚鲟Sox17的相对表达量(以efla为内参基因)Fig.4 Relative expression levels of Sox17 gene in various tissues detected by quantitative real-time PCR andnormalized to the efla transcript level

图5 不同发育时期西伯利亚鲟Sox17的相对表达量Fig.5 Relative expression levels of Sox17 during different development stages of A.baerii注:从左到右依次为:T1,大卵黄栓期;T2,宽神经板期;T5,尾芽分离期;T17,11日龄仔鱼;T22,64日龄鱼电感受器神经节Note:From left to right in turn is:T1,big yolk plug stage;T2,wide neural plate formation;T5,separation of tail bud stage;T17,11 days old larvae;T22:64 days old sturgeon with electric sensors ganglion
多个物种的Sox17氨基酸蛋白序列分析表明其多样性分化与分类学上的分化一致。系统进化树可以明显看到2个完好的分支,其中哺乳动物聚为一支,鱼类聚为一支。Ab Sox17基因与塞内加尔多鳍鱼的亲缘关系最近,其次与其它鱼类如香鱼、欧洲舌齿鲈、青鳉(Oryzias latipes)、尼罗罗非鱼(Oreochromis niloticus)、黄鳝(Monopterus albus)的亲缘关系也不远,但与哺乳动物如人类、黑猩猩、小家鼠等可以从系统进化树上看到明显的分支。
在对人类Sox17基因的研究中发现,Sox17基因广泛表达,包括在成人的心脏、肺、脾、睾丸、卵巢、胎盘、胃肠道、胎儿的肺以及肝脏中[20]。而西伯利亚鲟Sox17基因表达也很广泛,在肠、肝脏、心脏、眼、肾、鳃和肌肉等组织中均有表达。在对黄鳝Sox17基因的研究中表明,Sox17基因主要在在睾丸与卵巢中表达,在脑和脾中也有表达,但在心脏与肝脏中的表达比较微弱[21],在本实验对西伯利亚鲟研究中发现,Sox17基因在脑中表达量最高,在肝脏与心脏中也有表达但表达量不高。
另外,Sox17基因的表达不局限于某一特定时期或某种特定的组织。有研究者通过Northern Blots检测出Sox17基因存在两种不同的mRNA亚型,并在小鼠的精子发生时有不同表达,一种在精原细胞中表达,且随着早期粗线型细胞的发育而表达下降,另一种亚型在粗线型精原细胞时开始表达,并随着精子发育过程其表达量不断积累而上升[13]。本实验发现Sox17基因在西伯利亚鲟发育的不同时期的表达量也不同,在宽神经板时表达量最高,可推测Sox17基因可能与神经系统的发育相关,而神经系统主要是由外胚层发育形成的,可间接得到Sox17基因与外胚层发育之间可能存在关系。而之前的研究主要集中在Sox17基因与内胚层的发育中的的调控作用。如通过对爪蛙(Xenopus laevis)、斑马鱼(Brachydanio rerio)和小鼠等的研究,Sox17作为必不可少的下游调控因子与其它基因一起调控内胚层的发育[22];在爪蟾(Xenopus tropicalis)中,Sox17和 B-catenin协同作用调节内胚层基因的表达[23]。在对文昌鱼(Branchiastoma)的研究同样发现,Sox17基因对内胚层的发育调控起作用[24]。本实验中得到Sox17基因可能与神经系统的发育相关,这一发现将为Sox17基因参与外胚层的发育研究提供新的线索。
[1] 孟庆闻.鱼类学[M].上海:科学技术出版社,1989.MENG Q W. Ichthyography[M]. Shanghai:Shanghai Science and Technology Press,1989.
[2] SONGW,JIANG K J,ZHANG F Y,et al.Transcriptome sequencing,De Novo assembly and differential gene expression analysis of the early development of Acipenser baeri[J].PLOS One,2015,10(9):e0137450.
[3] 宋 炜,宋佳坤.西伯利亚鲟仔稚鱼胚后发育的形态学和组织学观察[J].中国水产科学,2012,19(5):790-798.SONGW,SONG J K.Observations on morphology of post-embryonic development and histology of sensory organs in larval and juvenile Siberian sturgeon,Acipenser baerii[J].Journal of Fishery Sciences of China,2012,19(5):790-798.
[4] 宋 炜,宋佳坤,范纯新,等.全人工繁殖西伯利亚鲟的早期胚胎发育[J].水产学报,2010,34(5):777-785.SONGW,SONG JK,FAN C X,et al.Studies on the early embryonic development of artificially-bred Siberian sturgeon(Acipenser baeri)[J].Journal of Fisheries of China,2010,34(5):777-785.
[5] SONGW,SONG JK.Morphological structure and peripheral innervation of the lateral line system in the Siberian sturgeon(Acipenser baerii)[J].Integrative Zoology,2012,7(1):83-93.
[6] 宋 炜,宋佳坤.西伯利亚鲟仔鱼侧线系统的发育[J].动物学研究,2012,33(3):261-270.SONGW,SONG J K.Development of the lateral line system in juvenile Siberian sturgeon(Acipenser baerii)[J].Zoological Research,2012,33(3):261-270.
[7] REHBERG S,LISCCHKA P,GLASER G,et al.Sox10 is an active nucleocytoplasmic shuttle protein,and shuttling is crucial for Sox10-mediated transactivation[J].Molecular and Cellular Biology,2002,22(16):5826-5834.
[8] SASAI Y.Roles of Sox factors in neural determi-nation: conserved signaling in evolution [J].International Journal of Developmental Biology,2001,45(1):321-326.
[9] ZANARIA E,MUSCATELLI F,BARDONI B,et al.An unusual member of the nuclear hormone receptor superfamily responsible for X-linked adrenal[J].Nature,1994,372(6507):635-641.
[10] BOWLES J,SCHEPERSG,KOOPMAN P.Phylogeny of the SOX family of developmental transcription factors based on sequence and structural indicators[J].Developmental Biology,2000,227(2):239-255.
[11] HASEGAWA M,HIRAOKA Y,HAGIUDA J,etal.Expression and characterization of Xenopus laevis SRY-related cDNAs, x Sox17α1 , x Sox17α2 ,xSox18αand xSox18β[J].Gene,2002,290(1-2):163-172.
[12] BOWLES J,SCHEPERSG,KOOPMAN P.Phylogeny of the SOX family of developmental transcription factors based on sequence and structural indicators[J].Developmental Biology,2000,227(2):239-255.
[13] XANTHOS J B,KOFRON M,WYLIE C,et al.Maternal VegT is the initiator of amolecular network specifying endoderm in Xenopus laevis [J].Development,2001,128(2):167-180.
[14] KIKUCHIY,TRINH L A,REITER JF,et al.The zebrafish bonnie and clyde gene encodes a Mix family homeodomain protein that regulates the generation of endodermal precursors[J].Genes and Development,2000,14(10):1279-1289.
[15] LIU Y,ASAKURA M,INOUE H,et al.Sox17 is essential for the specification of cardiacmesoderm in embryonic stem cells[J]. Proceedings of the National Academy of Sciences,2007,104(10):3859-3864.
[16] 崔素芬,王志志,张玲玲.Wnt信号通路抑制因子Sox17在肿瘤中的研究[J].国际肿瘤学杂志,2012,39(10):735-737.CUIS F,WANG Z Z,ZHANG L L.Wnt signaling pathway antagonist Sox17 in cancer[J].Journal of International Oncology,2012,39(10):735-737.
[17] SAUNDERS T L,KIM I,MORRISON S J.Sox17 dependence distinguishes the transcriptional regulation of fetal from adulthematopoietic stem cells[J].Cell,2007,130(3):470-483.
[18] CHHABRA A,MIKKOLA H K.Return to youth with Sox17[J].Genes and Development,2011,25(15):1557-1562.
[19] WILSON M,KOOPMAN P.Matching SOX:partner proteins and co-factors of the SOX family of transcriptional regulators[J].Current Opinion in Genetics and Development,2002,12(4):441-446.
[20] KATOH M.Molecular cloning and characterization of human Sox17 [J]. International Journal of Molecular Medicine,2002,9(2):153-157.
[21] RUIW,CHENG H,XIA L,et al.Molecular cloning and expression of Sox17 in gonads during sex reversal in the rice field eel,a teleost fish with a characteristic of natural sex transformation[J].Biochemical and Biophysical Research Communications,2003,303(2):452-457.
[22] CLEMENTSD,FRIDAY R V,WOODLANG H R.Mode of action of VegT in mesoderm and endoderm formation[J].Development,1999,126(21):4903-4911.
[23] CLEMENTS D,CAMELEYRE I,WOODLAND H R.Redundant early and overlapping larval roles of XSox17 subgroup genes in Xenopus endoderm development[J].Mechanisms of Development,2003,120(3):337-348.
[24] 赵 磊.文昌鱼AmphiSox7-like基因在内胚层发育中的研究[D].山东:山东大学,2013.ZHAO L.Study on amphioxus Sox7-like gene in endoderm development[D].Shandong:Shandong University,2013.
Cloning,analysis and expression detection of full-length cDNA of Sox17 from Acipenser baerii
SONGWei1,CHEN Fen-fang1,2,ZHANG Feng-ying1,MA Chun-yan1,ZHAO Ming1,MA Ling-bo1
(1.Key Laboratory of East China Sea and Oceanic Fishery Resources Exploitation,Ministry of Agriculture,East China Sea Fisheries Research Institute,Chinese Academy of Fishery Sciences,Shanghai 200090,China;2.College of Fisheries and Life Sciences,ShanghaiOcean University,Shanghai 201306,China)
In this study,the full-length cDNA of Sox17 gene from Siberian sturgeon(Acipense baerii)was obtained using RACE techniques.The full-length of Sox17 gene cDNA was 2 671 bp in length,including a 1 183 bp open reading frame(ORF)encoded 393 amino acids,a 588 bp 5 untranslated region(5’UTR)and a 901 bp 3 untranslated region(3’UTR).Multiple alignment analyses showed Siberian sturgeon was highly conservative to other fishes.It had high similarity with Ploypterus senegalus of 72%support rating.Phylogenetic analysis showd that Siberian sturgeon first clustered together with Ploypterus senegalus with the approval rating of95%.And then efla(elongation factor1-alpha,efla)genewas used as a internal reference on detecting the expression of Sox17 gene in various tissues of Siberian sturgeon by real-time fluorescence quantitative PCR.The results showed Sox17 gene expressed in diferent tissues and the expression level of Sox17 was relatively low in kidney,blood,eye,intestine and pelvic fin.However,in brain,the expression level of Sox17 was the highest in all of these tissues.At the same time,Sox17 gene also expressed in different development periods,but expressed with a certain amount of time difference.In wide neural plate,the expression level of Sox17 was the highest,reached 167 times thatof the quantity of11 days old larvae period.This study provides a reference to quantify the Siberian sturgeon differentiation genes involved in the process of embryonic development.At the same time,it provides the basic reference for the future study of the Siberian sturgeon Sox17 role in the process of embryonic development.
Acipenser baerii;Sox17 gene;full length of cDNA cloning;expression analysis
Q 959.468
A
1004-2490(2017)06-0629-11
2017-05-22
国家自然科学基金项目(31302161)
宋 炜(1983-),男,副研究员,主要从事鱼类发育生物学研究。E-mail:swift83@sina.com
马凌波,研究员。E-mail:malingbo@vip.sina.com

