高精料日粮对泌乳期奶山羊脂肪代谢的影响
马菊红,雷琦敬,倪迎冬,李 贤,殷玉鹏,李国红,胡小宏,张 艳,陈树林*,丛日华*
(1.西北农林科技大学动物医学院,陕西杨凌 712100;2.南京农业大学动物医学院,江苏南京 210095;3.陕西省城固县畜牧兽医工作站,陕西汉中 723200;4.海南省农业科学院畜牧兽医研究所,海南海口 571100)
高精料日粮对泌乳期奶山羊脂肪代谢的影响
马菊红1,雷琦敬1,倪迎冬2,李 贤1,殷玉鹏1,李国红1,胡小宏3,张 艳4,陈树林1*,丛日华1*
(1.西北农林科技大学动物医学院,陕西杨凌 712100;2.南京农业大学动物医学院,江苏南京 210095;3.陕西省城固县畜牧兽医工作站,陕西汉中 723200;4.海南省农业科学院畜牧兽医研究所,海南海口 571100)
为了探究长期饲喂高精料日粮对泌乳期奶山羊乳脂形成的影响机制,为科学饲养泌乳期的奶山羊提供理论基础。选用处于泌乳初期的14只关中奶山羊,随机分为2组,饲喂日粮精粗比为35∶65的作为对照组,65∶35的作为试验组,试验期为19周。结果表明,与对照组相比,饲喂高精料日粮的奶山羊血液谷丙转氨酶浓度显著升高(P<0.05),甘油三酯有降低的趋势;试验组肝细胞呈肿胀变性或空泡样变性;与对照组相比,试验组奶山羊肝脏内脂类的分解和合成代谢相关基因表达均未发生显著变化。说明长期饲喂高精料日粮可导致血液中谷丙转氨酶升高,这可能与肝细胞受损有关,但脂类代谢的相关基因表达均没有发生显著变化。
高精料日粮;谷丙转氨酶;甘油三酯;脂代谢
在过去的几十年里,经过激烈的品种选择,奶牛营养和奶牛管理的改善等显著提高了奶牛产奶量,尤其是在荷斯坦牛的品种上。众所周知,这些在提高产奶性能的同时,也伴随着一些负面的影响,例如代谢性疾病发病率的增加和繁殖性能的降低[1-4]。研究表明,采食量遗传优势的增加并不能同时增加产奶量的遗传优势,表示筛选高遗传性状产奶量的奶牛只有通过增加采食量进行部分的补偿[5]。因此,在现代奶业生产中,饲喂高精料日粮成了保持高产乳量进而追求高经济效益的一种策略。研究发现,用富含可发酵的碳水化合物的日粮饲喂反刍动物可引起瘤胃微生物的组成和代谢发生改变,导致挥发性脂肪酸在瘤胃内积累,引起瘤胃PH急剧下降[6-7]。对于反刍动物来说,日粮中的大部分碳水化合物和蛋白质是通过瘤胃微生物发酵转变成挥发性脂肪酸,即乙酸、丙酸和丁酸,随后在肠道内被吸收。丙酸作为肝糖异生的主要前体物质用来合成内源性的葡萄糖,而乙酸和丁酸被用来合成脂类[8]。肝脏在脂肪代谢的调控中起着非常重要的作用,几乎所有的有关脂肪代谢的反应都在肝脏中进行,是调控脂肪酸代谢去路的重要器官,对乳脂合成非常重要。已有研究表明,饲喂高精料的日粮可以增加乳腺脂肪酸的从头合成,导致乳脂增加,但是降低了肝脏中的脂质合成[9-10]。所以,本研究以关中奶山羊为动物模型,来模拟实际生产中的喂养模式,通过在日粮中添加高比例的精料来揭示长期饲喂高精料日粮对关中奶山羊血液生化指标和肝脏脂代谢关键基因表达的影响,为科学饲养泌乳期的奶山羊提供理论基础。
1 材料与方法
1.1 材料
1.1.1 试验用动物 试验选用14头体重相近、健康状况良好,泌乳初期的经产2胎~3胎的关中奶山羊,饲养于陕西杨陵西北农林科技大学牧场,随机分为2组,在试验期间可自由饮水,每日活动2次。
1.1.2 试剂与仪器 Trizol总RNA 提取试剂盒、DNA酶(DNaseI)、RNase抑制剂、反转录酶、SYBR Premix ExTaqTMⅡ试剂盒均为宝生物工程(大连)有限公司产品;引物由生工生物工程(上海)股份有限公司合成。4℃离心机,电动匀浆器,水浴锅,紫外分光光度计,Real-time PCR仪(Bio-Rad,Kodak,USA)。生化指标由西北农林科技大学附属医院检验科检测。
1.2 方法
1.2.1 试验设计 将14只泌乳初期的关中奶山羊随机分为2组,对照组6只,试验组8只,高精料组饲喂精粗比为65∶35的日粮,对照组饲喂精粗比为35∶65的日粮,饲喂3个月。日粮的配方详见表1。

表1 日粮的配方
1.2.2 样品采集与处理 饲养19周后,对奶山羊过夜禁食12 h,称重,颈静脉放血处死,采集肝脏、胃肠道、肌肉等样品,置-80℃保存,组织学检查样品多聚甲醛固定,保存。
1.2.2.1 血液的采集和处理 用肝素钠真空离心管采集颈静脉血液,在4℃采用3 500 r/min离心15 min,收集血清,置-20℃保存。测定血液生化指标,取颈静脉血血象分析仪测定血项(西北农林科技大学附属医院检验科测定)。
1.2.2.2 肝脏组织病理学检测 取相同部位肝脏组织块2 cm×2 cm×2 cm放入40 mL/L的多聚甲醛(paraformaldehyde,PFA)固定液中固定至少48 h,按常规操作步骤制作石蜡切片,在光学显微镜下观察肝脏组织的病理变化。
1.2.2.3 样品采集处理与荧光定量PCR检测 奶山羊颈静脉放血处死,立即将肝脏组织剥离,取相同部位肝脏分子样品放入液氮,1 d后,将其转入-80℃保存待测。Trizol法提取肝脏组织的总RNA,NanoDrop测定RNA样品的浓度和纯度。根据TaKaRaPrime ScriptTMRTKit试剂盒说明书反转录获得cDNA。荧光定量PCR反应参照SYBR Green Real-time PCR Master Mix Kit试剂盒说明书进行。以PPIA作为内标,结果分析采用2-△△CT法。所用引物采用Primer3.0软件自行设计,由上海生工生物工程有限公司合成,引物序列见表2。

表2 实时荧光定量PCR引物序列
2 结果
2.1 饲喂高精料日粮对血液生化指标的影响
由表3显示,与对照组相比,饲喂高精料日粮的试验组奶山羊血浆中谷丙转氨酶浓度显著升高(P<0.05),甘油三酯有下降的趋势(P>0.05),但是,在长期饲喂高精料日粮的条件下,血液中大部分的生化指标并没有发生显著性的变化(P>0.05)。

表3 饲喂高精料日粮对血液生化指标的影响
注:*表示组间差异显著(P<0.05),#表示组间有差异趋势(P<0.1),(n=14)。P值是均值+SEM。
Note:*P<0.05 means significant difference between two groups,#P<0.1 means a different tendency between two groups(n=6).P values are means +SEM.
2.2 高精料日粮对肝脏病理变化的影响
对照组细胞结构致密完整,胞质均匀。高精料组肝细胞高度肿胀,体积变大,胞浆溶解,肝细胞呈肿胀变性或空泡样变性(图1)。
2.3 高精料对肝脏脂代谢相关基因表达的影响
与对照组相比,长期饲喂高精料的试验组奶山羊肝脏脂代谢关键基因的表达均未发生显著性变化(P),虽然在长期饲喂高精料日粮的条件下,试验组肝脏脂代谢基因LPL、SCD、FADS2 mRNA的表达量有所升高,但是却没有达到显著的水平(图2)。
3 讨论
3.1 饲喂高精料日粮对血液生化指标的影响
为了提高奶畜的生产性能,以及牧草缺乏和品质低下,生产中通常大量饲喂精饲料以满足奶牛高产奶的需求。反刍动物饲喂高精料日粮极易导致瘤胃酸中毒,引起机体消化吸收和代谢功能的损坏,乳品质下降,饲料转化率降低并且影响了动物的健康和福利。本病的临床表现是牛的采食量和产奶量降低、蹄叶炎、肝脓肿和瘤胃微生物量及发酵产物的改变[11]。正常情况下,谷丙转氨酶主要存在于细胞内,在血清中的活性较低,在心脏和肝脏的活性最高。因此,当这些组织细胞受损时,可有大量的谷丙转氨酶逸入血液,造成血清中的转氨酶活性明显升高[12]。另一方面,转氨酶还参与了主要在肝、肾等组织中进行的联合脱氨基作用,这一过程是体内合成非必需氨基酸的重要途径,因此其活性在一定程度上还可以反应氨基酸的代谢强度。左之才[13]等研究发现高能量日粮的摄入可以增加围产期健康奶牛的血浆中谷丙转氨酶的活性。本研究发现,日粮的精粗比能影响血浆谷丙转氨酶(glutamic Pyruvictransaminase,GPT)的活性,饲喂高精料日粮的试验组奶山羊血浆GPT浓度显著升高,提示肝功能有一定程度的损伤,可能是由于饲喂高精料日粮,引起瘤胃酸中毒,内源性脂多糖(Lipopolysaccharide,LPS)经肝门静脉进入肝脏,对肝脏造成一定程度的损伤及肝脏功能(如糖异生作用,脂代谢,转氨基作用等)下降,大量的肝细胞结构遭到破坏,导致转氨酶进入血液。
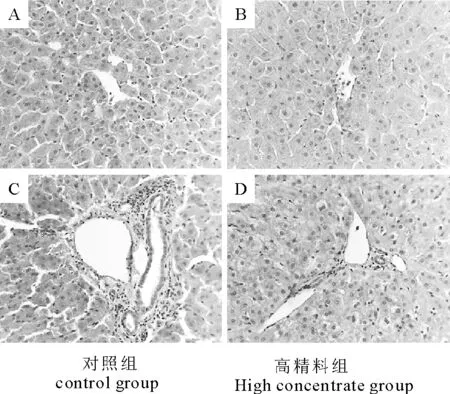
图1 HE染色观察高精料日粮对奶山羊肝脏病理变化的影响(40×)
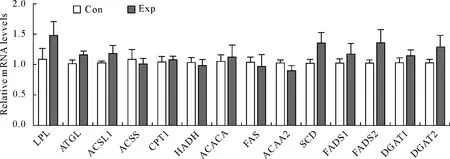
*表示组间差异显著,n=14 *P<0.05 means significant difference between two groups,n=14
反刍动物血液中的甘油三酯(TG)参与机体能量代谢,同时也可以作为合成乳脂的原料物质。Dong H B等[14]研究表明,给泌乳中期的奶山羊饲喂10周的高精料日粮后,血液中的甘油三酯浓度显著降低。本试验中,在饲喂高精料日粮19周后,结果发现试验组山羊血液中的甘油三酯具有下降的趋势,同之前的研究报道的结果基本一致。血液中甘油三酯的降低可能由于机体为了适应高能量的需求,脂肪被动员进行了脂肪酸的β-氧化供能,消耗了合成乳脂的前体物质。姜雪元等[15]研究表明,在饲喂6∶4精粗比日粮的条件下,肝脏脂的分解代谢增强,糖异生作用下降,乳腺中合成TG的前体物质被竞争性的消耗。
3.2 饲喂高精料对肝脏脂代谢基因表达的影响
膳食纤维、碳水化合物和蛋白质为瘤胃发酵提供了底物并且在瘤胃内发酵成挥发性脂肪酸(VFA),挥发性脂肪酸主要包括乙酸盐、丙酸盐和丁酸盐,乙酸盐和丁酸盐是生成脂类的前体物质,而丙酸盐是肝糖异生的主要前体物质[8]。瘤胃微生物发酵产生的挥发性脂肪酸和来源于日粮的长链脂肪酸等都是从胃肠道吸收通过门静脉汇集入肝脏[16],这些物质均为乳脂合成的前体物质。Miyazaki M等[17]的研究表明,用高碳水化合物喂养小鼠可以引起肝脏内的SCD1基因的蛋白表达和酶活性都急剧升高。SCD是不饱和脂肪酸生物合成的关键酶,催化饱和的长链脂肪酸形成单不饱和脂肪酸棕榈酸和油酸[18]。脂肪酸脱氢酶2(FADS2)催化2种必需脂肪酸亚油酸和α-亚麻酸最后脱氢形成长链多不饱和脂肪酸[19]。这两种酶催化分解的产物分别为单不饱和脂肪酸和多不饱和脂肪酸,有研究表明,普通牛奶中饱和脂肪酸:单不饱和脂肪酸:多不饱和脂肪酸通常为70∶25∶5[20]。本研究结果显示,饲喂高精料日粮的试验组山羊肝脏脂代谢基因SCD和FADS2 mRNA的表达量有所升高,但是却未达到显著的水平,这些基因的变化可能影响了血液中单不饱和脂肪酸和多不饱和脂肪酸的比例,从而影响了乳脂中脂肪酸的组成及比例。
[1] Van Arendonk J A M,Hovenier R,De Boer W.Phenotypic and genetic association between fertility and production in dairy cows[J].Livest Prod Sci,1989,21:1-12.
[2] Pryce J E,NielsenB L,Veerkamp R F,et al.Genotype and feeding system effects andinteractions for health and fertility traits[J].Livest Prod Sci,1999,57:193-201.
[3] Westwood C T,Lean I J,Garvin J K.Factors influencing fertility of Holstein dairy cows:amultivariate description[J].Dairy Sci,2002,85:3225-3237.
[4] Rajala-Schultz P J,Frazer G S.Reproductive performance in Ohio dairy herds in the 1990s[J].Anim Reprod Sci,2003,76:127-142.
[5] Veerkamp R F,Oldenbroek J K,Van DerGaast H J,et al.Genetic correlationbetween days until start ofluteal activity and milk yield,energybalance,and live weights[J].Dairy Sci,2000,83:577-583.
[6] Ameta B N,Zebeli Q,Saleem F,et al.Metabolomics reveals unhealthy alterations in rumen metabolism withincreased proportion of cereal grain in the diet of dairy cows[J].Metabolomics,2010,6:583-94.
[7] Hook S E,Steele M A,Northwood K S,et al.Impact of subacuteruminal acidosis (SARA) adaptation and recovery on thedensity and diversity of bacteria in the rumen of dairy cows[J].Fems Microbiol Ecol, 2011, 78 (2) :275-284.
[8] van Knegsel A T, Van B H, Dijkstra J, et al.Effect of dietary energy source on energy balance,production,metabolic disorders and reproduction in lactating dairy cattle[J].Reprod Nutr Dev,2005,45(6):665-688.
[9] Bernard L,Leroux C,Rouel J,et al.Effect of the level and type of starchy concentrate on tissue lipid metabolism,gene expression and milk fatty acid secretion in Alpine goats receiving a diet rich in sunflowerseed oil[J].Bri J Nutr,2012,107:1147-1159.
[10] Li X,Chen H,GuanY,et al.Acetic acid activates the AMP-activated protein kinase signaling pathway to regulate lipid metabolism in bovine hepatocytes[J].PLoS One, 2013, 138 (7) :445-454.
[11] Plaizier J C,Krause D O,Gozho G N,et al.Subacuteruminal acidosis in dairy cows:The physiological causes,incidence and consequences[J].Vet J,2008, 176 (1) :21-31.
[12] 王俊东,刘宗平.兽医临床诊断学[M].北京:中国业出版社,2004:237-239.
[13] 左之才,邓俊良,王 哲,等.不同能量摄入水平对围产期健康奶牛血清总胆红素、蛋白及转氨酶的影响[J].中国兽医学报,2007,27(6):865-869.
[14] Dong H B,Sun L L,Cong R H,et al.Changes in milk performance and hepatic metabolism in mid-lactating dairy goats after being fed a high concentrate diet for 10 weeks[J].Int J Animal Biosci, 2017, 11 (3) :418.
[15] 姜雪元,张树坤,张源淑.不同精粗比日粮对泌乳山羊肝脏蛋白表达谱及乳脂肪合成的影响[J].南京农业大学学报,2012,35(6):97-103.
[16] Kristensen N B.Splanchnic metabolism ofvolatile fatty acids in the daily cow[J].Animal Sci,2005,80:3-10.
[17] Miyazaki M,Kim Y C,Ntambi J M.A lipogenic diet in mice with a disruption of the stearoyl-CoA desaturase 1 gene reveals a stringent requirement of endogenous monounsaturatedfatty acids for triglyceride synthesis[J].J Lipid Res,2001,42(7):1018-1024.
[18] Enoch H G,Strittmatter P.Role of tyrosyl and arginyl residues in rat liver microsomal stearylcoenzyme A desaturase[J].Biochemistry,1978,17:4927-4932.
[19] Guillou H,Rioux V,Catheline D,etal.Conversion of hexadecanoicacid to hexadecenoic acid by rat Delta 6-desaturase[J].J Lipid Res,2003,44(3):450-454.
[20] Harvatine K J,Boisclair Y R,Bauman D E.Recent advances in the regulation of milk fat synthesis[J].Animal,2009,3:40-54.
EffectsofHigh-concentrateDietonBloodBiochemicalParametersandHepaticLipidMetabolisminLactatingDairyGoats
MA Ju-hong1,LEI Qi-jing1,NI Ying-dong2,LI Xian1,YIN Yu-peng1, LI Guo-hong1,HU Xiao-hong3,ZHANG Yan4,CHEN Shu-lin1,CONG Ri-hua1
(1.CollegeofVeterinaryMedicine,NorthwestA&FUniversity,Yangling,Shaanxi,712100,China; 2.CollegeofVeterinaryMedicine,NanjingAgriculturalUniversity,Nanjing,Jingsu,210095,China; 3.ChengguCountyAnimalHusbandryandVeterinarystation,Hanzhong,Shaanxi,723200,China;4.InstituteofAnimialHusbandry,HannanAgriculturalAcademy,Haikou,Hainan,571100,China)
The purpose of this study was to explore the effect of long-term feeding of high-concentrate diets on the formation mechanism of milk and provide a theoretical basis for scientific breeding of lactating dairy goats.In this study,14 early-lactation Guanzhong dairy goats were selected and randomly divided into two groups:the control group was fed 35% concentrate of dry matter,and fed 65% concentrate of dry matter as the experimental group.The experiment lasted for 19 weeks.Compared with the control group,the concentration of glutamic-pyruvic transaminase was up-regulated significantly (P<0.05) and triglyceride has a tendency to decrease in blood of dairy goats fed high-concentrate diets.In the experimental group,the hepatic cells showed swelling degeneration or vacuolar degeneration.However,there was no significant difference in the lipid metabolism and anabolism related gene expression between the experimental group and the control group.The results of this study showed that long-term feeding of high-concentrate diets can lead to increased blood glutamic-pyruvic transaminase,suggesting that this may be related to liver cell damage,but the expressions of genes related to lipid metabolism were not significantly changed.
high-concentrate diet; glutamic-pyruvic transaminase; triglyceride; lipid metabolism
2017-03-12
陕西省农业科技攻关项目(K3310215109); 陕西省自然科学基金项目(2016JM3033);海南省重大科技计划项目(ZDKJ2016017)
马菊红(1989-),女,山西临汾人,硕士研究生,主要从事分子营养生理学研究。*
S852.2
A
1007-5038(2017)12-0044-05

