NPY mRNA剪接形式与鸡摄食的关联分析
杨菲菲 (连云港生物工程中等专业学校 江苏 连云港 222000)
张 健 (江苏省连云港市畜牧兽医站)
周卫东 宋雪梅 (浙江省农业科学院畜牧兽医研究所)
NPY mRNA剪接形式与鸡摄食的关联分析
杨菲菲 (连云港生物工程中等专业学校 江苏 连云港 222000)
张 健 (江苏省连云港市畜牧兽医站)
周卫东 宋雪梅 (浙江省农业科学院畜牧兽医研究所)
下丘脑神经肽Y(NPY)是迄今发现的促采食作用最强的神经肽之一,本研究根据鸡NPY mRNA设计引物,分别在肉鸡和蛋鸡下丘脑组织中进行扩增,寻找不同品系鸡NPY mRNA是否存在剪接形式变化,推导对应的氨基酸和蛋白质的结构变化,初步探讨NPY mRNA剪接形式与蛋鸡和肉鸡迥异采食的关联性。结果表明,NPY在肉鸡cDPY3+端存在两种不同形式的剪接片段,检测出短序列中存在mRNA3+端终止现象。
NPY mRNA 摄食 NPYcDNA 氨基酸序列
NPY在动物摄食活动中发挥了十分重要的食欲促进作用,是迄今发现的促采食作用最强的神经肽之一[1]。研究发现,NPY mRNA在蛋鸡和肉鸡下丘脑表达存在差异,蛋鸡下丘脑IN、PVN、和LHA中的mRNA转录水平均高于同日龄的肉鸡,而肉鸡的采食量和体重分别是蛋鸡的1.7倍和1.5倍[2]。因此,单纯从mRNA转录水平差异的研究还不能够充分阐释蛋鸡和肉鸡生产性能方面的差异。虽然对NPY基因的研究已经持续了二十多年,但关于NPY选择性剪接方面的研究报道并不多见。陈贵钱等运用RACE克隆鸽子下丘脑NPY基因序列时,发现了美国王鸽下丘脑中存在615bp和535bp两种NPY mRNA不同的剪接形式,3’端存在79bp的选择性终止现象[3]。
本研究根据GenBank中登录的鸡NPY mRNA设计引物,分别在肉鸡和蛋鸡下丘脑组织中进行扩增,寻找肉鸡和蛋鸡的NPY mRNA是否存在剪接形式的变化,推导对应的氨基酸和蛋白质的结构变化,初步探讨NPY mRNA剪接形式与蛋鸡和肉鸡迥异采食的关联性。
1 材料与方法
1.1 材料
1.1.1 试验动物 AA肉鸡购自浙江富阳玉林养鸡场,按《AA肉鸡饲养管理标准》饲喂管理,7周龄时屠宰并取脑;罗曼蛋鸡购自浙江富阳移昌蛋鸡场,17周龄屠宰并取脑。
1.1.2 主要仪器及试剂 MyCyclerTM Thermal Cycler PCR仪(BIO-RAD,美国)、超净工作台(北京昌平长城空气净化工程公司,北京,中国)、Universal Hood Ⅱ-S.N.76S/ 02297凝胶成像系统(BIO-RAD,美国)、1-15型低温离心机(Sigma美国)、MLS-3750型高压灭菌器(SanYo,日本)、UV-1600紫外/可见分光光度计(瑞利分析仪器公司,北京,中国)等。γ-Taq DNA聚合酶、PMD19-T(TaKaRa,日本)、TransTaq DNA Polymerase High Fidelity(北京全式金生物技术有限公司)、琼脂(西班牙)、琼脂糖凝胶回收试剂盒(Omega,美国)。
1.2 试验方法
1.2.1 脑摘取 鸡脑摘取参照Zhou等[4]报道的方法。在无麻醉的情况下断头,并迅速用手术剪刀剪开脑部皮肤,暴露出颅骨;然后用骨钳剥开颅骨,用手术剪小心剪开脑膜并暴露出大脑、小脑部分;切断延髓后,用镊子小心地摘出整个鸡脑,并迅速冷冻在粉末状干冰中,待完全冰冻后置于-70℃冰箱中备用。
1.2.2 总RNA提取、纯化及检测 目标神经核团的总RNA提取参考RNeasy Lipid Tissue Mini Kit试剂盒说明书。将摘出的下丘脑核团组织迅速放入QLAzol溶胞液中,匀浆30s后,加200μl氯仿并剧烈震荡15s,4 ℃ 12000r/min 离心15min,吸取上清与600μl 70%乙醇溶液混合后过柱,用80μl除RNA酶的水洗脱。分离到的总RNA测定其OD260/280,-70℃保存备用。
1.2.3 cDNA第一链的合成及检测 3’RACE使用大连TaKaRa生物工程有限公司的3-Full RACE试剂盒中的反转录引物Oligo dT-3sites Adaptor Primer(3AP)反转录mRNA得到cDNA第一链。5’RACE采用SMART(Switching Mechanism At 5’ end of the RNA Transcript,SMART末端交换机制)技术扩增NPY 5’末端序列。反应体系(25µl)组成:2µl模 板 cDNA , 0.2µl Actin-F(25 pmol/µl), 0.2µl Actin-R(25pmol/µl); 2.0µl 10mM dNTP ; 2.5µl 10× Buffer(Mg2+);17.8µl ddH2O;0.3µl Taq DNA聚合酶;PCR扩增程序为:95℃预变性3min;95℃变性20sec;54℃退火20 sec;72℃延伸10min;共35个循环。
1.2.4 NPY基因cDNA 3’RACE 3’RACE引物设计参照GenBank登录的NPY mRNA序列(登录号:NM_205473)设计2条上游特异性引物,下游引物使用3-Full RACE试剂盒中的锚定引物3-AP。引物序列见附表。

附表 NPY全长cDNA扩增引物
3’RACE第一轮PCR扩增反应体系(25µl)反应体系为:cDNA模板0.2µl;10×Buffer(含Mg2+)2.5µl;dNTPs(2.5 mmol/L)2µl;Taq DNA聚合酶0.3µl;NPY3F1上游引物0.2µl;3-AP下游引物0.2µl;ddH2O19.6µl;反应程序为:94℃预变性3min,94℃变性20 sec;54℃退火20sec;72℃延伸10min;35个循环;4℃保存。第二轮PCR扩增以NPY3F2为上游引物,3-AP为下游引物。取第一轮PCR产物1µl,用双蒸水稀释到20µl后作为第二轮PCR反应的模板,其它反应体系同第一轮PCR。取第二轮PCR扩增产物,经1.2%琼脂糖凝胶电泳检测,EB染色后在紫外灯下观察试验结果,为500 bp大小的条带,初步判断为预期扩增结果,经琼脂糖凝胶检测后,纯化回收条带单一、亮度较高的扩增PCR产物。纯化的PCR产物与pMD19-T载体在Solution I(已包含DNA连接酶和Buffer)的作用下,16℃连接过夜。10µl连接体系中各组分如下:纯化后的PCR产物4µl;pMD19-T载体1µl;Solution I 5μl。在无菌操作下取2µl菌液作为模板,而后加入10× Buffer 1.5µl、dNTPs 1µl、上下游特异性引物各0.1µl和Taq DNA聚合酶0.1µl,蒸馏水补足至15µl体系。取重组成功的阳性克隆菌液0.5 ml,送交上海英骏生物技术有限公司测序。
1.2.5 NPY基因cDNA 5’RACE 与NPY 3’RACE类似,设计2条下游引物进行5’RACE,引物序列见表1。5’RACE第一轮 PCR扩增反应体系为:cDNA模板0.2µl;10× Buffer(含 Mg2+)2.5µl; dNTPs(2.5mmol/L)2µl; Taq DNA聚合酶0.3µl;上游引物:5-AP 0.2µl;下游引物:NPY5R1 0.2µl;ddH2O 19.6µl;反应程序为:94℃预变性3min,94℃变性20 sec;54℃退火20 sec;72℃延伸10 min;35个循环;4℃保存。第二轮PCR扩增以5-AP为上游引物,NPY5R2为下游引物,反应体系同上。取第一轮PCR产物1µl,用双蒸水稀释到20µl后作为第二轮PCR反应的模板,其它反应体系同第一轮PCR,产物回收纯化及克隆测序同3’RACE。
1.2.6 序列分析 将克隆测序得到的鸡NPY基因cDNA翻译区序列、3’UTR序列和5’UTR序列,依据重复序列拼接成一条全长cDNA序列。应用Clustal X 1.83软件进行多种比对及同源性分析。应用SignalP3.0 Server软件在线分析鸡NPY蛋白质是否存在信号肽,以及信号肽的存在区域。运用SWISS-MODEL数据库进行蛋白质的3D结构预测。
2 结果与分析
2.1 鸡下丘脑总RNA
提取的下丘脑组织总RNA经紫外分光光度计测定,OD260/OD280=1.85,表明总RNA的纯度较好,经1%的琼脂糖凝胶电泳检测,电泳图谱见1。

图1 鸡下丘脑组织总RNA电泳图
2.2 鸡NPY基因cDNA
3’UTR和5’UTR的PCR扩增产物检测 利用3’RACE和5’RACE技术分别扩增鸡下丘脑NPY cDNA,其PCR扩增产物经琼脂糖凝胶电泳检测分别见图3-2、图3-3。3’RACE扩增NPY cDNA时,罗曼蛋鸡和AA肉鸡第一轮PCR扩增产物检测均有3条带出现,250bp和750bp上下各一条。第二轮PCR扩增后,AA肉鸡扩增产物片段出现了2条带,500bp上下各1条,而罗曼蛋鸡的扩增产物中只检测到1条>500bp的条带。5’RACE扩增第一轮PCR扩增产物检测蛋鸡和肉鸡都有2条带出现,分别为300bp和750bp左右,第二轮PCR扩增后,罗曼蛋鸡和AA肉鸡的扩增产物片段均为300bp左右。

图2 鸡NPY 3’UTR PCR扩增产物电泳图(图A:第一轮PCR产物电泳图谱图B:第二轮PCR产物电泳图谱;M:DL2000 plus Ladder;泳道1、2分别表示AA肉鸡和罗曼蛋鸡)
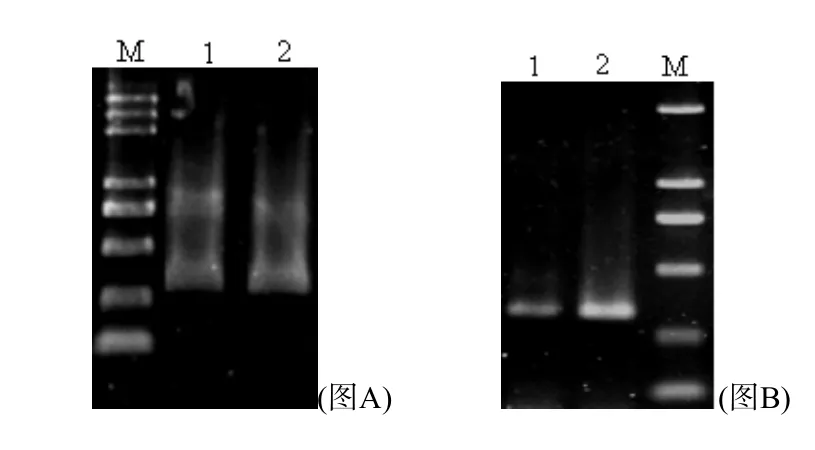
图3 鸡NPY 5’UTR PCR扩增产物电泳图(图A:第一轮PCR产物电泳图谱图B:第二轮PCR产物电泳图谱;M:DL2000 plus Ladder;泳道1、2分别表示AA肉鸡和罗曼蛋鸡)
2.3 鸡NPY基因c DNA 3’UTR的PCR扩增产物克隆测序
利用3’RACE技术分别扩增AA肉鸡和罗曼蛋鸡的NPY cDNA,AA肉鸡第二轮PCR扩增产生的2条500bp左右的条带分别割胶回收和纯化,经克隆测序后与GenBank登录序列(NM_205473)进行比对。发现肉鸡3’末端长序列比登录序列多了82bp大小的片段,短序列与登录序列一致,蛋鸡3’末端未检测出长片段序列,短片段与肉鸡扩增序列一致。
2.4 鸡NPY基因c DNA 5’UTR的PCR扩增产物克隆测序
利用5’RACE技术分别扩增蛋鸡和肉鸡的NPY cDNA,第二轮PCR扩增产生的300bp条带经克隆测序,与GenBank登录序列(NM_205473)进行比对后,发现蛋鸡、肉鸡的5’UTR均比登录序列多了40bp,并在蛋鸡扩增的cDNA序列中发现有79bp片段缺失的现象。
2.5 蛋鸡、肉鸡NPY基因全长c DNA的拼接及推导的氨基酸序列
根据序列重叠区,将测得的鸡NPY基因编码区序列、3’UTR和5’UTR序列拼接成一条完整的cDNA序列。肉鸡长序列3’末端比登录序列多了82个碱基,蛋鸡和肉鸡的5’端均比登录序列多了40bp,运用DNAMAN软件将拼接好的肉鸡、蛋鸡全长cDNA序列推测出其相应的氨基酸序列。肉鸡长、短cDNA序列推测出的氨基酸序列与登录序列完全一致,而蛋鸡cDNA序列只推测出53个氨基酸,缺失44个氨基酸。
2.6 鸡NPY蛋白质保守结构功能域分析
利用NCBI Blast 软件“BlastP”程序,分析蛋鸡、肉鸡NPY基因编码蛋白质的保守结构功能域(图5、6)。由结构分析可知,该基因属于胰腺激素超家族(Pancreatic Hormone,PAH),其受体结合位点和激活位点分别位于N端和C-末端。蛋鸡由于N端缺失了44个氨基酸,导致其蛋白质保守功能域发生改变,受体结合位点消失,而肉鸡蛋白质保守功能域未发生变化,具有典型的PAH超家族的结构功能特征。
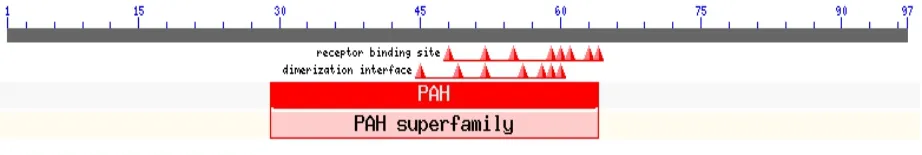
图5 肉鸡NPY基因推测编码蛋白质的结构功能域分析
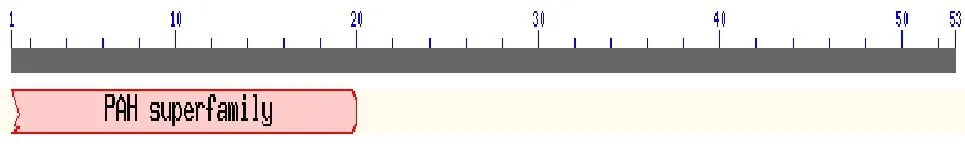
图6 蛋鸡NPY基因编码蛋白质的结构功能域分析
3 讨论
3.1 鸡NPY c DNA拼接全序列及推导的氨基酸序列种间差异
应用3’和5’RACE法分别扩增蛋鸡、肉鸡的cDNA末端,将序列拼接后,分别得到蛋鸡和肉鸡完整的cDNA序列,其中肉鸡短序列3’端与GeneBank登录序列一致,长序列多了82bp,这在基因选择性剪接中是一种常见形式,即:3’和5’端外显子被有选择的延长或缩短,也称为3’和5’端选择性剪接。肉鸡中检测发现的短序列出现了3’端终止现象。陈贵钱等运用3’RACE克隆鸽下丘脑NPY时,在美国王鸽下丘脑也发现了两条长短不同的序列,分别为615bp和535bp,代表2种不同的NPY mRNA剪接形式,其3’端也存在79bp的选择性终止现象[3]。推导出相应的氨基酸序列比对发现,肉鸡长、短cDNA序列推导出的相应氨基酸序列与登录序列完全一致。蛋鸡cDNA靠近5’端序列缺失了79bp,导致推导出的氨基酸序列比登录序列少了44个氨基酸。缺失的79个核苷酸序列位于NPY基因的编码区,导致相应位点的编码蛋白产物发生改变,44个氨基酸序列缺失,其中包括信号肽和一部分主体成熟肽序列,可能导致表达的NPY生理功能受损,推测该剪接可能是造成蛋鸡、肉鸡采食行为和生产性状迥异的部分原因之一。
3.2 鸡信号肽和蛋白质保守结构功能域的种间差异
蛋鸡和肉鸡信号肽预测结果显示,肉鸡信号肽结构完整,切割位点位于28~29位氨基酸之间。蛋鸡N端由于缺失了44个氨基酸,导致信号肽消失,主体成熟肽序列缺失了16个氨基酸。信号肽的主要功能是引导核糖体定位于内质网的通道上,使核糖体附着在内质网上,并将不断延长的蛋白质链穿透通过通道,随后信号肽被切割下来,合成完成的蛋白质被释放到内质网腔,随后蛋白被转运到胞外[5]。蛋鸡NPY信号肽缺失,能够影响核糖体的定位及新生肽链穿透内质网膜的过程,对蛋白产物的后期分泌表达产生影响,最终抑制了NPY生物活性的发挥。保守功能域分析结果显示,由于蛋鸡NPY主体序列中有16个氨基酸缺失,导致预测的蛋白质保守功能域发生变化,与相应受体结合位点消失,已知NPY生物学功能的发挥须与受体结合才能完成实现,故由于氨基酸缺失引起的NPY保守功能域的改变也是影响NPY功能发挥的重要原因之一。
4 结论
本试验发现,NPY在肉鸡cDNA 3’端存在2种不同形式的剪接片段,检测出短序列中存在mRNA 3’端终止现象。肉鸡长序列3’端的82bp核苷酸序列属于非编码序列。蛋鸡cDNA 5’端发生的79bp缺失位于编码区,导致相应位点的编码蛋白产物发生改变,44个氨基酸序列缺失,其中包括信号肽和一部分主体成熟肽序列,并且造成受体结合位点消失,影响NPY蛋白的分泌及表达活性。
[1] Kuenzel W J, Fraley G S. Neuropeptide Y: its role in the neural regulation of reproductive function and food intake in avian and mammalian species. Avian and Poultry Biology Reviews, 1995, 6(3): 185-209.
[2] 杨菲菲. 神经肽Y基因转录_剪接和变异与鸡摄食和生长的关联分析[D]. 南京: 南京农业大学. 2009.
[3] 陈贵钱. 中枢神经肽Y在雏鸡采食早熟性中的作用[D]. 杭州: 浙江理工大学, 2008.
[4] Zhou W, Murakami M, Hasegawa S et al. Neuropeptide Y content in the hypothalamic paraventricular nucleus responds to fasting and refeeding in broiler chickens[J]. Comp Biochem Physiol, 2005, 141(A):146-152.
[5] 郑斌, 詹希美. 信号肽序列及其在蛋白质表达中的应用[J]. 生物技术通讯. 2005, 16, 3: 296-298.
S831.2
A
1007-1733(2017)12-0013-03
2017-07-01)

