用SSR分子标记分析香菇原生质体单核体的遗传多样性
,
(1.新疆大学 科学技术学院,新疆 阿克苏 843000;2.上海农业科学院 食用菌研究所, 农业部南方食用菌资源利用重点实验室,上海 201403)
用SSR分子标记分析香菇原生质体单核体的遗传多样性
吴锦荣1,2,鲍大鹏2
(1.新疆大学 科学技术学院,新疆 阿克苏 843000;2.上海农业科学院 食用菌研究所, 农业部南方食用菌资源利用重点实验室,上海 201403)
运用根据香菇全基因组设计的104 对SSR引物,对香菇21 株原生质体单核体进行了遗传多样性分析,有58 对SSR引物表现出多态性,多态性引物比例为55.8%,获得了430 条扩增条带,其中多态性条带占298 条,多态性条带比例达69.3%.运用NTSYS-pc21软件分析了供试菌株之间的遗传相似性,研究表明:栽培品种和野生菌株之间存在明显的遗传差异性,但具有很高的相似系数的栽培品种之间则存在很近的亲缘关系;同一双核体得到的两个原生质体单核体菌株之间存在非常近的遗传关系.
香菇;原生质体单核体;SSR标记;遗传多样性
中国是香菇栽培的发源地,距今已有近900 年的香菇栽培历史.香菇在我国食用菌产业链中占有举足轻重的地位.香菇是世界第二大人工栽培食用菌,其产量仅次于双孢蘑菇.香菇产业的发展对香菇育种工作提出许多新的要求,香菇菌株遗传多样性分析是育种工作中一项非常重要的基础性研究,目前已经有很多学者对我国香菇自然种质资源和栽培品种的遗传背景进行了研究[1-5],我国香菇野生品种拥有丰富的多样性,但是栽培品种的亲缘关系很近,遗传背景单一,多样性不丰富.
香菇属于四极性异宗结合担子菌,有性生活史中绝大部分是以双核体菌丝体形式存在.目前对香菇遗传多样性的研究都是以双核体为研究材料,因而所获得的遗传差异是两个可亲和的细胞核的共同表现.而在香菇的杂交育种中,杂交亲本通常是单核体菌株.原生质体单核体菌株在杂交育种中的优点表现为:单核体直接来源于营养菌丝体,无减数分裂过程,从而有利于保存和稳定表达亲本优良性状;直接从菌丝体中获得单核体,减少了育种工作量,也缩短了育种时间;拓宽了无法形成子实体的野生菌质的杂交亲本基因型.1995年,杨岱筠等[6]得到金针菇菌丝体单核体,并分析了其遗传特性;1993年,潘迎捷[7]在异宗结合食用菌原生质体制备的研究中发现,单核体是重要的遗传材料,为食用菌育种开辟新的道路;1999年,上海市农科院以香菇栽培菌种Le1和野生菌种0426单核体为亲本,杂交选育出了申香8号菌种,相比亲本增产24%~30%[8].2002年,焦海涛等[9]进行了香菇单核体杂交试验研究,研究显示:杂交双核菌丝生长速度明显快于其亲本单核体;2008年,宋春艳等进行单核体杂交试验时,以单核体香菇939和中19为亲本,考查杂交体和亲本菌种子实体性状,研究结果表明:10 个杂交体的子实体与亲本有明显差异,且杂交后代的性状与亲本的交配类型有一定的关联性[10].所以,对香菇单核体菌株的遗传多样性的研究不仅能够对品种资源有更加深入的了解,而且能够有助于选择杂交亲本,以及有助于了解品种的遗传背景,开展品种溯源研究.笔者选取了7 对栽培品种的原生质体单核体和7 个野生菌株的原生质体单核体作为供试材料,采用基于香菇全基因组中发掘的SSR分子标记对这些单核体的遗传多样性进行分析.研究表明:21株香菇原生质体单核体间存在遗传差异性,相互之间存在一定的遗传多样性.这是首次对香菇单核体之间的亲缘关系进行报道.
1 材料与方法
1.1 供试菌株
供试香菇菌株共21 株(表1),均为原生质体单核体,其中9 对菌株分别来源于同一香菇双核体菌株,Xd2-6-1,Xd2-3-1和Xd3-3-1菌株分别来源于3个不同亲本.
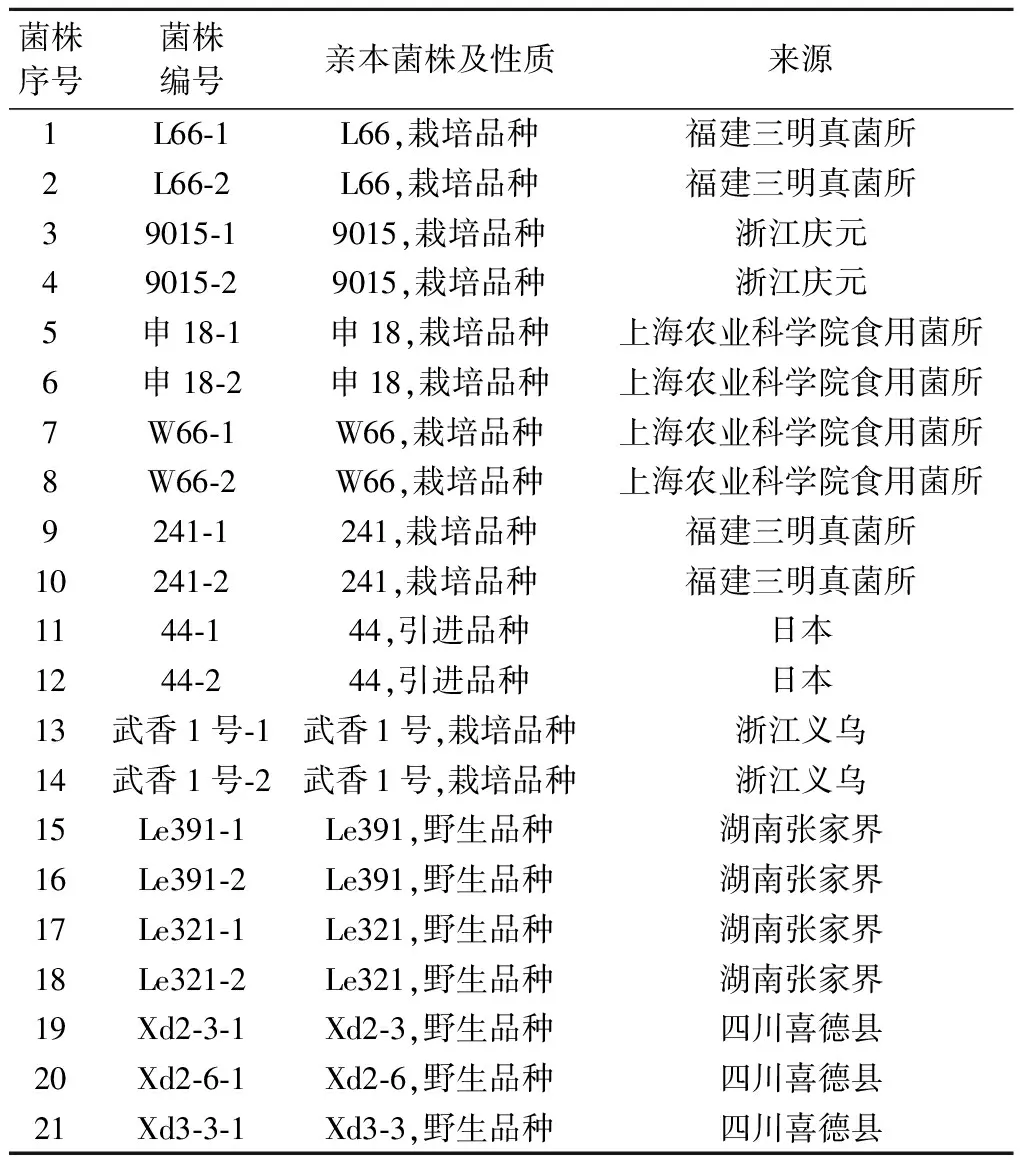
表1 供试香菇菌株Table 1 Lentinus edodes strains tested in this study
1.2 SSR引物设计
根据香菇全基因组数据(http://172.17.21.49/),运用Primer primer 5软件设计SSR引物,并由上海生工生物技术公司合成.
1.3 香菇单核体菌丝中基因组DNA提取
采用改进的CTAB法[11]提取香菇单核菌丝体中的基因组DNA.
1.4 PCR扩增和凝胶电泳
10 μL PCR反应体系中含有:1 μL的基因组DNA(50~100 ng/μL),1 μL 10×PCR缓冲液,0.2 μL dNTP(10 nmol/L),1 μL MgCl2(25 nmol/L),0.1 μL Taq DNA聚合酶(5 U/μL,Takara公司),引物(10 μmol/L)各0.75 μL,5.2 μL ddH2O.
PCR反应程序为:94 ℃下5 min;然后在94 ℃下50 s,55 ℃下50 s,72 ℃下50 s,共30 个循环;最后72 ℃保持5 min.PCR扩增产物加入6 μL加样缓冲液,混合均匀后在95 ℃下变性5 min,然后置于冰水混合物中冷却3 min,取3 μL于6%变性聚丙烯酰胺凝胶上进行电泳,电泳缓冲液为1×TBE,电泳条件为:电压1 000 V,电流200 mA,功率200 W,电泳时间为45 min.电泳结果银染显色后拍照,进行数据分析.
1.5 数据分析
根据电泳结果,有扩增条带记为1,无条带记为0,生成距阵,利用NTSYS-pc软件对数据进行ΜPGMA聚类分析[12].
2 结果与分析
2.1 供试SSR引物的多态性分析
根据香菇全基因组序列设计了共显性、稳定性、多态性和易操作性高,具有扩增产物的104 对SSR引物,经对21 个单核体菌株的遗传多样性分析,其中有58 对引物表现出多态性,占总数的55.8%,如表2所示.
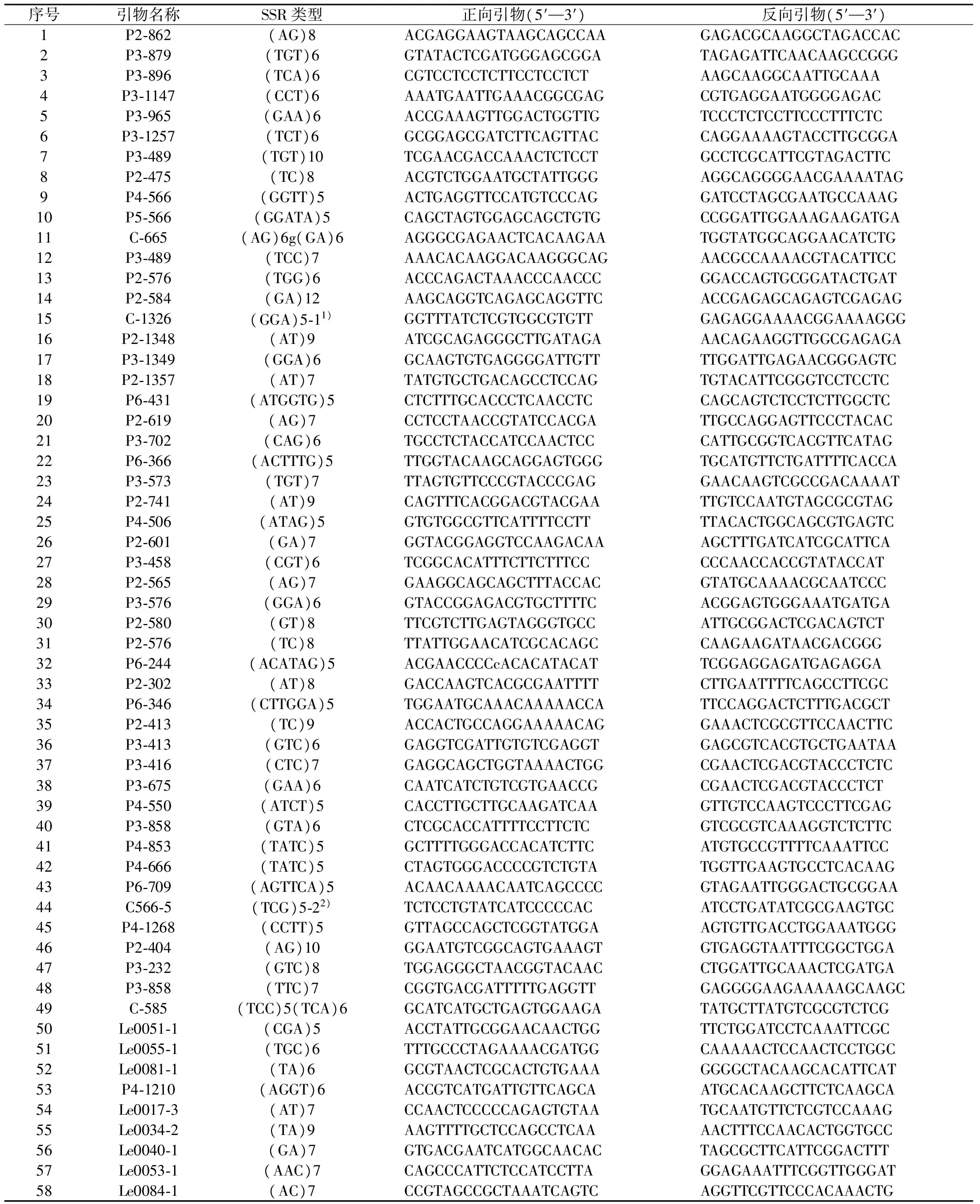
表2 具有多态性的SSR标记对应引物Table 2 The information on polymorphic SSR maker and corresponding primers
注:1) (GGA)5-1为(GGA)5gtcgaaggtggaggaggttgttgaggaggaatcccctgcaccggcacctt(CCA)5;2) (TCG)5-2为(TCG)5tcatcatccgaggaatgttccga(ACC)8.
在具有多态性的58 对SSR引物标记中,以遗传稳定、多态性高和可靠性强的重复单位二核苷酸和三核苷酸的类型最多,分别为18 个和22 个,分别占总数的31.0%和37.9%.即不采用单拷重复位点进行扩增,从而有效地提高原生质体单核体遗传多样性的鉴定成功率.
上述58 对多态性SSR引物在21 个单核体菌株中共扩增出430 条条带,其中多态性条带为298 条,比例达69.3%.
2.2 供试单核体菌株的遗传多样性分析
应用NTSYS-pc21软件对21 个供试香菇单核体菌株进行遗传聚类分析(图1),以0.58相似性为切割点,供试菌株可以分为三大类群:类群一为4 株来自湖南张家界的野生菌株的单核体;类群二为3 株来自四川喜德县野生菌株的单核体;类群三为14 株来自栽培菌种的单核体.其中2 株单核体亲本为日本栽培菌株.
试验发现在相似系数很高的点,约为0.78,有一个聚集类群,即来自于国内的7 个(表1中的菌株编号为1,2,3,4,5,6,7)栽培菌株的原生质体单核体,从而揭示出它们之间很相似的遗传背景.遗传背景最相似的是源自亲本L66、申18、241及9015菌株的单核体,它们之间存在着最高的相似系数,约为0.88.这一现象暗示了它们可能有比较近的共同祖先,也表明来自相同亲本的单核体间得到的亲本遗传物质较丰富且稳定.
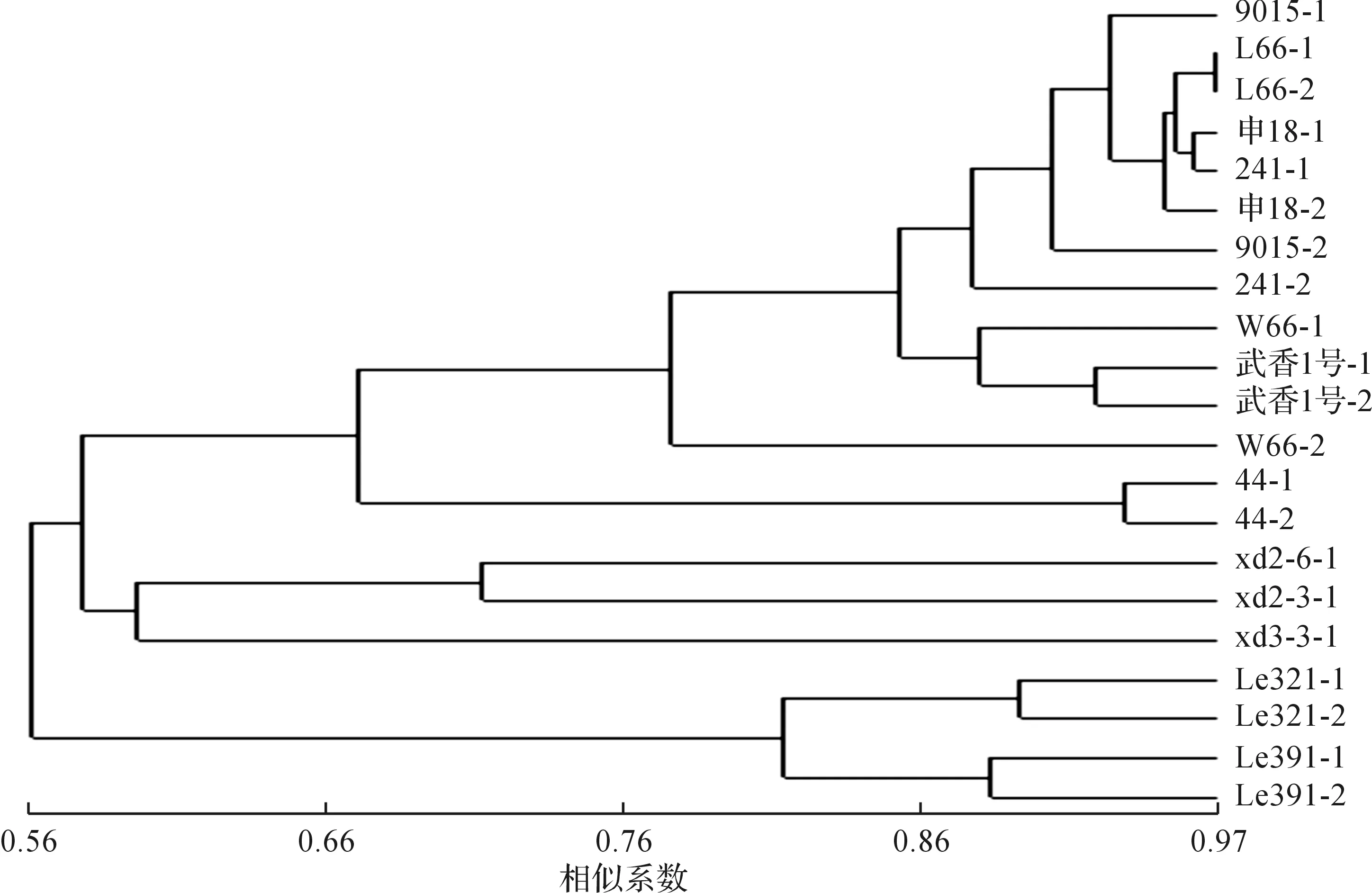
图1 基于58个SSR标记的21个香菇单核体的聚类图Fig.1 Cluster analysis dendrogram based on 58 SSR markers in 21 monokaryons of L. edodes
3 结 论
已经有很多学者对香菇栽培品种和野生菌株的遗传多样性进行了研究,对亲本的遗传多样性进行研究是育种工作的基础,成功选育优良性状的菌种,关键在于正确选择杂交亲本,在杂交过程中将亲本的优良性状保留并传递下去.迄今为止,所开展的香菇遗传多样性研究都是以双核体菌株为供试材料,导致发生遗传距离偏向于双核菌种中某一单核受体亲本的情况.而以单核体为供试材料的香菇遗传多样性研究则不会出现这种状况.本文的供试原生质体单核体与孢子单核体完全不同:一是依靠原生质体单核化技术得到;二是双核菌丝体未经减数分裂阶段.因最终获得的单核体未经基因重组阶段,因此供试菌株的杂交遗传背景被纯粹、完整和准确地反映出来.此次研究的21 株供试单核体的聚类分析结果表明:所试香菇的栽培与野生菌株之间具有较大的遗传距离,栽培菌株之间的亲缘关系非常相近,与之前对香菇双核体的遗传多样性的研究结果相一致[13-14].本研究首次对香菇单核体的遗传多样性进行了报道,为以后对香菇遗传多样性的研究开辟了一条新路径.笔者的研究方法助推了今后对香菇杂交亲本遗传背景的全面、细致地解剖与了解.在本研究的聚类分析中一个比较有趣的结果:来自同一亲本的两个原生质体单核体多数聚集在一个小类群中,具有相似性,表明它们之间具有很近的亲缘关系.这种现象不仅表现在栽培菌株中,如L66-1和L66-2,武香1号-1和武香1号-2,44-1和44-2,而且也表现在野生菌株中,如L321-1和L321-2,L391-1和L391-2.可以将这个结果称之为“亲本近缘”现象,虽然目前所获得的实验数据尚不足以充分证明“亲本近缘”这一结论,但这种自然现象的发现值得进一步开展研究,并从中揭示新的自然规律,有意识地引入外来类型和野生菌株等重要的种质资源,拓宽育种基础,为香菇杂交育种工作提供新的理论指导.
[1] 宋莹,刘娜,肖千明,等.十五个香菇菌株遗传特异性研究[J].北方园艺,2014,22(18):163-166.
[2] 宋莹,张忠伟,刘俊杰,等.香菇辽抚4号遗传差异性分析[J].育种驯化,2016,38(5):19-20.
[3] 罗海凌,邹龙玉,方雪婷,等.香菇遗传多样性研究进展[J].北方园艺,2014,24(21):185-187.
[4] 巫萍,章炉军,张丹,等.利用SSR标记鉴定香菇单核体及杂交后代[J].微生物学通报,2016,43(2):444-455.
[5] 刘靖宇,宋秀高,叶夏,等.香菇菌株遗传多样性ISSR、RAPD
和SRAP综合分析[J].食用菌学报,2011,18(3):1-8.
[6] 杨岱筠,张丕奇,郑美媛,等.白色金针茹原生质体单核菌系的建立及其遗传特性分析[J].食用菌学报,1995,2(4):18-21.
[7] 潘迎捷.异宗结合食用菌的原生质体单核化[J].上海农业学报,1993,9(2):1-5.
[8] 谭埼,潘迎捷,等.用单核原生质体杂交育成香茹新菌株申香8号[J].食用菌学报,1999,6(2):3-6.
[9] 焦海涛,杨先新,周伟,等.香茹原生质体单核体杂交方法试验[J].中国食菌,2002,21(6):8-10.
[10] 宋春艳,尚晓冬,谭琦,等.香茹原生质体单核体杂交后代性状变异初探[J].食用菌学报,2008,15(3):1-6.
[11] 张红,秦莲花,谭琦,等.用改进的CTAB法提取香菇基因组DNA[J].上海大学学报(自然科学版),2006,12(5):547-550.
[12] JAIN N, JAIN S, SAINI N, et a1. SSR analysis of chromosome 8 regions associated with aroma and cooked kernel elongation in Basmati rice[J]. Euphytica, 2006,152(2):259-273.
[13] 龚利娟,李玉,刘淑艳.香菇品种遗传多样性RAPD分子标记的研究[J].菌物研究,2005,3(1):17-21.
[14] 刘春滟,李南羿,张玉琼.香菇EST-SSR标记的开发及应用[J].食用菌学报,2010,17(2):1-6.
TheanalysisofgeneticdiversityofLentinulaedodesprotoplastedmonokaryonsbySSRmarkers
WU Jinrong1,2, BAO Dapeng2
(1.School of Science and Technology, Xinjiang University, Akesu 843000, China;2.Key Laboratory of Applied Mycological Resources and Utilization, Ministry of Agriculture, Edible Fungi Institute, Shanghai Academy of Agricultural Sciences, Shanghai 201403, China)
By using 104 pairs of SSR primers designed from the whole genome ofLentinulaedodes, the genetic diversity of 21 protoplasted monokaryons ofLentinulaedodeswas analyzed. The results showed that 58 pairs of SSR primers, accounting for 55.8% of the designed primers, produce 298 polymorphic fragments, accounting for 69.3% of the total 430 amplified fragments. The genetic similarity among the tested stains was analyzed by using NTSYS-pc21 software, and the results found significant differences existed between the cultivated strain and the wild strain. However, the cultivars with high similarity coefficients exhibited close genetic relationships between each other. At the same time, the study also showed that very close genetic relationship exists between the two protoplast mononuclear strains obtained from the same two nucleosomes.
Lentinulaedodes; protoplasted monokaryon; SSR marker; genetic diversity
2017-09-11
上海市科委重点科技攻关项目(10391900900);上海市农委种业专项(沪农科种字(2012)第6号资助)
吴锦荣(1985—),女,新疆博乐人,讲师,硕士,研究方向为食用菌遗传,E-mail:850640619@qq.com.
S646
A
1674-2214(2017)04-0233-05
朱小惠)

