组学技术在氨基酸生产菌株选育中的研究现状与发展趋势
,, ,2,3
(1.天津科技大学 生物工程学院,天津 300457;2.代谢控制发酵技术国家地方联合工程实验室,天津 300457;3.天津市氨基酸高效绿色制造工程实验室,天津 300457)
组学技术在氨基酸生产菌株选育中的研究现状与发展趋势
张权威1,林高扬1,马倩1,2,3
(1.天津科技大学 生物工程学院,天津 300457;2.代谢控制发酵技术国家地方联合工程实验室,天津 300457;3.天津市氨基酸高效绿色制造工程实验室,天津 300457)
系统生物学研究手段包括基因组学、转录组学、代谢组学、蛋白组学和通量组学等,可以获得研究对象整体代谢途径、调控网络的信息.将组学技术应用于氨基酸的发酵菌株优化过程,可以为菌株的进一步代谢工程改造提供信息基础与理论指导.介绍各种组学技术在氨基酸微生物发酵研究中的应用与发展趋势,通过综合运用各种组学数据信息,可以更好地指导氨基酸发酵优良菌株的理性设计与构建.
氨基酸;组学;代谢工程;理性设计;高产菌株
氨基酸具有重要的代谢与调控功能,它们不仅是很多重要物质合成的必要前体物质,而且可以调节关键代谢途径与过程,是人体生命活动所必需物质,因而被广泛应用于食品、药品、化妆品、保健品和饲料等行业[1-2].2016年,我国氨基酸总产量460 万吨,预计2017将超过500 万吨.2016年,我国谷氨酸钠(味精)总产量270 万吨,赖氨酸总产量135 万吨,苏氨酸总产量48 万吨,另外色氨酸、丙氨酸和三支链氨基酸产能均已超过万吨以上,其他氨基酸综合产能约在10 万吨左右[3].氨基酸的生产方法主要包括化学合成法、水解法、酶法以及微生物发酵法.其中,微生物发酵法以其高效性、低成本和低污染等优势获得迅速发展,成为目前大多数氨基酸工业生产的重要方法[4].
早期,氨基酸生产菌株的产能提高与性能优化主要采用多轮随机诱变筛选的方式.然而,由于诱变具有随机性,基因组发生不确定改变,因而在没有突变株基因信息的条件下,很难再对诱变获得的高产菌株进行进一步的代谢改造.近年来,随着代谢工程与合成生物学的发展,基因的定向改造技术得到广泛应用,通过对微生物DNA的重组,获得理想的基因型以及表型,这种方法使得研究者对菌株的改造更加理性化[5].然而,定向改造策略仍然具有一定的局限性,位点改造的范围通常是局部的,而非基因组范围,通常缺乏对整个代谢网络的考虑.系统生物学研究手段包括基因组学、转录组学、代谢组学、蛋白组学和通量组学等,可以获得研究对象整体代谢途径、调控网络的信息[6].将组学应用于氨基酸的发酵菌株优化过程[7],可以为进一步的代谢工程改造提供信息基础与理论指导[8].通过综合考虑整个代谢与调控网络、中游的发酵过程以及下游的提取纯化过程,实现改造目标的选定[5],进一步通过代谢工程改造获得高产菌株.
1 氨基酸的微生物发酵
1956年,Kinoshita等[9]发现谷氨酸棒状杆菌Corynebacteriumglutamicum是L-谷氨酸的高效生产菌株,从此开启了L-谷氨酸的微生物发酵历程.随后,L-赖氨酸、L-缬氨酸、L-异亮氨酸、L-苏氨酸、L-天门冬氨酸和L-丙氨酸等大多数氨基酸都开始运用Corynebacteria进行发酵生产,因而棒状杆菌在氨基酸发酵领域有着举足轻重的地位[7].除棒状杆菌以外,大肠杆菌Escherichiacoli也是一种常用的氨基酸生产菌株,主要用来生产L-苯丙氨酸、L-色氨酸等芳香氨基酸及L-苏氨酸、L-脯氨酸等非芳香族氨基酸[10].
目前,国际上氨基酸生产的强国主要是日本和德国.日本的味之素、协和发酵以及德国的德固沙是世界氨基酸生产的三大巨头.我国是世界上的氨基酸生产大国,谷氨酸产量居世界首位,赖氨酸产量占全球产量的50%左右[2].目前,我国已实现工业化生产的氨基酸品种有谷氨酸、赖氨酸、谷氨酰氨、苏氨酸、色氨酸、异亮氨酸、亮氨酸、缬氨酸、脯氨酸、天冬氨酸、胱氨酸、半胱氨酸、精氨酸、苯丙氨酸、酪氨酸和丙氨酸等[3].在这些氨基酸中,除了组氨酸、丝氨酸和半胱氨酸尚未采用发酵法进行工业生产,其他氨基酸均可通过微生物发酵生产.但是,目前我国在菌株生产能力、生产技术与工艺方面,与日本、德国仍然存在较大的差距.因此,进行菌株性能优化获得高产菌株,改进生产工艺,仍然是目前我国氨基酸生产领域亟待解决的重要问题.
2 组学研究技术的发展
各种不同的组学研究可选用的技术手段如图1所示.随着1980年首个噬菌体基因组测序的完成,基因组学开始了迅速的发展.第二代测序仪(NGS,如Ⅲumina 454,ABI SOLiD sequencer等)和第三代测序仪(TGS,如HeliScope)的开发,逐步取代了传统的Sanger测序法,使得测序的准确性与精确性有了显著提高,同时测序周期与测序成本大大下降.目前,罗氏公司致力于开发的纳米孔测序技术将促使新一代测序技术的开发.丰富的基因组数据信息是后续进行转录组学、蛋白组学、代谢组学以及通量组学研究的基础.20世纪90年代中期以来,微阵列技术(Microarray)被用于大规模基因表达分析,自此展开了转录组学的研究.基于Sanger测序法的SAGE(Serial analysis of gene expression)技术以及MPSS(Massively parallel signature sequencing)技术逐渐得到应用.随着新一代测序仪的开发,转录组mRNA的高通量测序逐渐展开,成为一种流行的转录组分析方法.
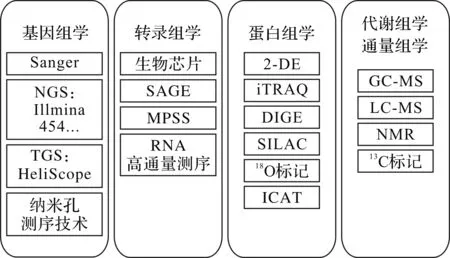
图1 组学研究的技术方法Fig.1 The technical method of omics
蛋白组学的发展,始于1975年O’Farrell[11]开发的二维凝胶电泳技术.该技术是一种经典的蛋白质分离技术,被认为是蛋白组学研究的“黄金标准”[12].20世纪90年代,随着基因组测序技术、现代质谱技术、计算能力和生物信息学的迅速发展,蛋白组学也得到了飞速发展,实现了通过二级质谱图(MS/MS)进行肽段的鉴定.同时,越来越多的研究围绕定量蛋白组学展开,一系列新型的蛋白质定量方法涌现,包括iTRAQ,cICAT,SILAC和Label-free等[13].从基因组学、转录组学到蛋白组学的研究是一种自上而下(top-down)的研究策略,逐步从基因水平过渡到蛋白功能水平研究.代谢组与通量组信息获取的途径,主要包括GC-MS,NMR,LC-MS和13C标记等.代谢组学可以从功能水平反映细胞活力,与细胞的表型有最直接的联系[14].通过代谢水平分析,可以实现上游基因型与下游表型的连接,进行自下而上(bottom-up)的研究,而它们的结合研究,可以为代谢工程改造提供信息基础与方向指导,使得人们对研究对象的改造更加理性化,具有方向性.
3 氨基酸发酵中组学研究的现状
3.1 基因组学
诱变筛选是氨基酸优良生产菌株选育的一种常用方法,经过多轮诱变筛选过程可以获得具有优良性状的菌株,但是如果想更进一步地提高高产菌株的生产能力往往会受到瓶颈制约.若要突破这种制约,需要获得突变高产菌株的代谢、调控信息,以及它们发生的突变信息[15].基因组学作为一种高通量的现代测序手段,可以从上游基因水平寻找突变株与原始菌株之间的差异,而这些差异很可能是菌株高产的原因.同时,获得的突变株基因信息可以使人们更加全面地认识突变株的代谢与调控网络信息,这是设计新的代谢工程改造方案的必要基础.此外,基因组学获得的基因组信息是转录组、蛋白组、代谢组以及通量组研究开展的基础,通过其他组学的研究,可以进一步为代谢与调控网路的重构提供更加丰富的补充信息.
Kalinowski等[15]首先对具有代表性的野生菌株C.glutamicumATCC 13032进行了全基因组测序,并将基因组信息应用于L-天冬氨酸衍生类氨基酸合成的研究.目前,C.glutamicum的基因组信息在高产菌株的构建中已经发挥出重要的作用.Ohnishi等[16]通过赖氨酸高产菌株与原始菌株的基因组序列比对后发现高丝氨酸脱氢酶基因(hom)、天冬氨酸激酶基因(lysC)和丙酮酸羧化酶基因(pyc)的突变可能对赖氨酸的高产起作用.于是,他们将这些突变引入原始菌株中,提高了原始菌株的L-赖氨酸产量;随后,通过进行基因组比对,又进一步在高产菌株中引入有利突变gnd(6-磷酸葡萄糖脱氢酶基因),使L-赖氨酸产量提高了15%[17];最后,又引入了mqo突变(苹果酸:喹啉氧化还原酶基因),进一步提高了L-赖氨酸的生产速度与产量[18].全基因组测序技术还可被用于发现基因新功能以及新的代谢途径,Mchardy等[19]通过基因组分析以及实验验证,在C.glutamicum中发现了参与支链氨基酸与L-苯丙氨酸合成的11 种潜在的氨基转移酶基因.此外,通过基因组水平分析、靶基因删除以及同源互补等研究,使得C.glutamicum中L-甲硫氨酸的合成途径逐渐清晰.
3.2 转录组学
通过比较不同菌株、不同时间点样品或者不同培养条件下的转录组变化,可以发现可能的调控路径、基因改造靶点等,进而为菌株的进一步改造与优化提供信息指导.C.glutamicum中谷氨酸的大量合成需要刺激因子引发,如生物素亚适量控制,添加青霉素和表面活性剂等.Stansen等[20]发现一株可以被温度变化诱导谷氨酸大量合成的谷氨酸棒状杆菌C.glutamicum2262,同时获得了一株不生产谷氨酸的突变株C.glutamicum2262NP,通过对比分析这两株菌的转录组,发现在温度发生变化时,C.glutamicum2262中NCg12816,NCg12817两个基因(分别对应乳酸通透酶、L-乳酸脱氢酶)的转录水平显著提高.在谷氨酸的生产过程中,会产生副产物L-乳酸,后续的研究表明,NCg12817基因编码的L-乳酸脱氢酶对C.glutamicum在L-乳酸中正常生长起关键作用.Hayashi等[21]通过比较赖氨酸工业生产菌株C.glutamicumB-6与其原始出发菌株的转录组,发现C.glutamicumB-6具有磷酸戊糖途径基因的高表达、TCA循环基因的低表达以及氨基酸合成基因的诱导表达.他们的研究发现亮氨酸氨基肽酶编码基因(leuC)是一种有利突变,于是被引入到另一株L-赖氨酸生产菌株AHD-2中,最终产量提高了14%.Sindelar等[22]采用DNA芯片技术,比较分析赖氨酸生产菌株MH20-22B以及其他几株C.glutamicum的转录组,发现NCg10855,amtA-ocd-soxA操纵子对赖氨酸生产有重要的作用,通过对其进行过表达,赖氨酸产量可以提高40%.Park等[23]首先利用文献报道的代谢调控信息构建了生产L-缬氨酸的E.coli,又进一步解除了产物抑制,然后通过比较改造菌株与对照菌株的转录组数据,并结合原位基因敲除模拟获得的信息,进行了进一步的代谢工程改造,最终获得了可将每克葡萄糖转化为0.378 g L-缬氨酸的L-缬氨酸高产菌株.近年来,转录组学在氨基酸生产菌株的系统代谢工程改造(Systems metabolic engineering)中发挥着越来越重要的作用[24],通过比较改造菌株与出发菌株的转录组差异,获得进一步改造的位点,可提高氨基酸的产量和转化率.
3.3 蛋白组学
细胞内的大部分代谢活动都是直接或者间接受蛋白质调控,因而对细胞蛋白组的分析,可以更好地了解细胞代谢状态.随着现代蛋白质分离与鉴定技术的发展,可被鉴定的蛋白质种类越来越多.由于提取、分离等过程的蛋白损失,对蛋白组的鉴定不如基因组、转录组全面,但是通过对不同条件下的蛋白组进行差异分析,即可发现差异表达的蛋白,进而发现不同条件下蛋白表达及调控蛋白的差异.
目前,对C.glutamicum的蛋白组研究主要包括三个方面:1) 菌株蛋白谱图的绘制;2)C.glutamicum在环境刺激(氮缺失、芳香化合物、重金属、有机酸[25]和高渗透压[26]等)下的蛋白组机制研究;3) 高产菌株与原始菌株的蛋白组比较.1998年,Hermann等[27]首次绘制了C.glutamicum的蛋白组谱图,采用二维凝胶电泳分离,利用银染技术显色,共分离1 000多种胞浆蛋白与700多种膜蛋白,并利用N-末端测序的方法鉴定了10 种蛋白质.随后,他们又将MALDI-TOF-MS以及ESI-MS技术用于C.glutamicum的蛋白鉴定[28].Bendt等[29]采用两种方法构建了C.glutamicum的磷酸化蛋白组谱图.Schluesener等[30]构建了C.glutamicum的膜蛋白组谱图.在C.glutamicum的转录组研究中发现,氮缺失会造成细胞中一系列氨基酸,包括精氨酸、亮氨酸、苏氨酸和芳香族氨基酸等的合成基因表达下调[31].因而,氮代谢调控的研究具有重要的价值,一系列针对此过程的蛋白组学研究也相继展开.其中,Bendt等[29]从磷酸化蛋白组角度研究了氮缺失对C.glutamicum的影响.在碳源代谢方面,Qi等[32]比较了C.glutamicum在芳香化合物(苯甲酸盐、对甲酚、苯酚、间苯二酚和龙胆酸)与葡萄糖中生长的蛋白组.研究结果表明:芳香化合物降解的中间代谢产物主要通过糖异生途径进入中心碳代谢,糖异生途径的增强是C.glutamicum在芳香化合物中得以生长的必需过程.由于细胞膜会受到芳香化合物的影响,Haussmann等[33]比较了在苯甲酸盐、葡萄糖条件下C.glutamicum的膜蛋白组,揭示了在苯甲酸盐条件下出现的两种苯基酸盐转运蛋白BenK与BenE的共表达、中心碳代谢与能量代谢调节以及饥饿反应等现象.此后,又比较了在原儿茶酚、葡萄糖碳源条件下C.glutamicum的蛋白组[34],发现GlxR与McbR调节子对原儿茶酚条件下菌株的适应性调节有关键作用.
在异亮氨酸的微生物合成中,生产1 mol/L异亮氨酸需要消耗4 mol/L的NADPH[35],因而保证细胞内一定的NADPH浓度是异亮氨酸获得高产的关键因素.江南大学Shi等[35]通过在C.glutamicumJHI3-156中分别过表达POS5基因(编码外源NADH激酶)与zwf-ppnK基因(编码葡萄糖-6-磷酸脱氢酶-多聚(P)/ATP-NAD激酶),异亮氨酸的产量分别提高了26%和31%.为了解析POS5与zwf-ppnK过表达对异亮氨酸合成的整体影响,比较分析了过表达菌株与原始菌株的蛋白组[36].他们的研究发现了一种新的肌醇代谢途径,同时表明了回补途径在异亮氨酸生产中的重要性.Kedar等[37]通过敲除E.coli中编码丙酮酸激酶的pyK-F基因,获得了高产芳香氨基酸的菌株.通过比较此高产菌株与原始菌株的蛋白组,发现敲除pyK-F基因的菌株在芳香氨基酸合成途径中的一系列蛋白表达显著提高,同时说明磷酸烯醇式丙酮酸与赤藓糖-4-磷酸在芳香氨基酸合成过程中有重要作用.
3.4 代谢组学
代谢组学是对细胞内所有代谢物的定量分析,通常利用气相色谱质谱联用仪、液相色谱质谱联用仪等仪器进行检测,采用主成分分析(PCA)、偏最小二乘(PLS)等多元统计方法进行数据分析.2004年,Strelkov等[38]首次构建了C.glutamicum代谢组检测的方法,共检测到1 000多种化合物,其中164 种物质得到鉴定.Plassmeier等[39]运用代谢组学手段对C.glutamicum中的中心碳代谢以及2-甲基柠檬酸循环途径进行了研究.Woo等[40]将代谢组学研究方法应用于C.glutamicum在磷缺失条件下的代谢状况研究,结果发现在磷缺失的条件下,C.glutamicum通过增强自身的糖原代谢来适应该条件下的碳代谢要求.此外,代谢组学在氨基酸优良生产菌株的高通量筛选以及高产菌株的构建与性能研究中也发挥了重要的作用.Börner等[41]运用96孔板培养C.glutamicum,并采用了高通量代谢组分析的方法,该方法一天可以测定72 组样品,并且具有较高的灵敏度与可重复性.这种方法的建立,使得通过大规模测定突变株文库的代谢组筛选优势菌株得以实现.随后,对258 株转座子突变株文库进行了高通量代谢组分析,通过对代谢物进行成对关系比较分析,筛选了特定代谢途径改变的突变株.Bartek等[42]通过删除磷酸葡糖异构酶基因pgi,使得C.glutamicum生产L-缬氨酸的产量提高了36%.通过比较pgi基因删除菌株与原始菌株之间的代谢组,发现pgi基因删除后,胞内NADPH产生途径相关的代谢物含量(包括葡萄糖-6-磷酸、6-磷酸葡萄糖酸、柠檬酸和异柠檬酸等)有明显提高,说明了NADPH供应对L-缬氨酸生产有重要作用.在赖氨酸的生产中,同样需要充足的NADPH来源,因此可通过pgi基因的删除增强NADPH的供应.此外,有研究报道柠檬酸合成酶(CS)活性的下降可以增加酮戊二酸的积累,进而可以实现L-赖氨酸的高产.Van等[43]通过等位基因无痕置换技术构建了一些列CS活力逐渐降低的C.glutamicum菌株,并对这些菌株进行了代谢组比较,发现这些菌株中天冬氨酸半缩醛的含量有显著提高,而天冬氨酸半缩醛可以进一步转化为赖氨酸,因此这些菌株具有进一步提高赖氨酸产量的潜在能力.基于这一推测,又进一步过表达了赖氨酸合成的若干基因,最终进一步提高了赖氨酸产量.
3.5 通量组学
通量组学,又称代谢流分析,是对细胞内代谢网络中流量的定量分析,即对细胞内酶与代谢途径活力的定量分析,可以动态反映基因改造、环境变化对细胞内代谢网络的影响,因此可以为菌株的选育提供重要信息.目前,通量组学主要采用基于同位素标记、GC-MS的方法进行测定.
近年来,通量组学在氨基酸生产菌株选育方面表现出越来越重要的作用.Bartek等[44]利用13C标记的方法对丙酮酸脱氢酶复合体(PDHC)缺陷的L-缬氨酸生产菌株进行了代谢流分析.结果表明:与野生型菌株相比,PDHC的缺失使细胞中PPP的代谢流增强了113%左右,这与赖氨酸合成对NADPH的需求相契合.Kind等[45]通过敲除C.glutamicum中succinyl-CoA合成酶基因sucCD,将TCA循环与赖氨酸合成中的琥珀酰化分支途径耦合起来,使得更多的琥珀酰辅酶A用于赖氨酸合成.通过比较分析敲除sucCD前后菌株的通量组,确认了途径的耦合提高了赖氨酸的产量.此外,通量组学通过提供细胞内动态的代谢通量信息,为菌株的insilico模拟提供了有效信息,在此基础上可以有效预测细胞中特定基因敲除或过表达后的代谢情况.
4 氨基酸发酵中组学应用的发展趋势
各种组学手段,包括基因组学、转录组学、蛋白组学、代谢物组学以及通量组学等,可以分别从DNA、mRNA、蛋白质、代谢物以及代谢流水平对研究对象进行阐释,它们在各自的研究层面展现着丰富的生物信息.在氨基酸的微生物发酵研究过程中,组学已经表现出了重要的作用.但是单独组学的研究仍然存在一定的局限性:大量的代谢物难以用一种提取、分离和检测手段进行分析,并且存在着结构鉴定的困难;由于未测序物种基因数据库的缺失导致蛋白鉴定困难,蛋白质提取分离造成的蛋白损失导致鉴定到的蛋白质数量有限;大量基因组冗余数据的存在,导致注释困难等.这些问题的存在,使得获取的信息难免会存在缺失与片面性,这种不完整性会在进行各种组学数据整合分析时,出现结果冲突、变化多向性等结果,使得对体系的解析更加困难.如何整合这些不同层次的组学数据,实现数据的上下关联和不同组学研究方法之间的信息互补,是从整体上把握研究体系的重要内容.
在氨基酸生产菌株C.glutamicum的研究中,组学的结合运用已经进行了一些尝试.Krömer等[46]综合运用转录组、代谢组以及通量组,对赖氨酸生产菌株C.glutamicum进行了研究.Buchinger等[47]结合蛋白组与转录组分析,找到了C.glutamicum中氮素调节子AmtR作用的新靶点.Silberbach等[31]运用转录组与蛋白组研究了C.glutamicum在氨盐缺失条件下的代谢途径变化.Yoon等[48]则利用转录组与蛋白组对高密度培养条件下的E.coli进行了研究.但是,他们的研究结果中仍然有很多不同组学来源的数据没有得到有效利用,这主要是由生物样品的复杂性造成的.如何能利用生物信息学分析,应用新型的多元统计工具,从大量的数据中挖掘出有用的生物信息,是跨组学研究的重要目标,也是组学在氨基酸的微生物发酵方面发挥更大作用的关键.综合自上而下、自下而上的研究策略(图2),将各种组学综合研究结果应用于指导高产菌株的理性设计构建,将是未来氨基酸微生物发酵研究的发展趋势.

图2 组学研究方法与代谢工程关系图 Fig.2 The relationship between omics research methods and metabolic engineering
5 结 论
利用组学研究手段可获得菌种的代谢途径、调控网络的信息,为氨基酸生产菌株的代谢改造提供研究思路,为相关菌种的理性设计与构建提供更明确的理论指导.目前,组学研究迅速发展并与多项领域相结合.通过使用各种组学研究手段及数据分析方法,将进一步提高氨基酸生产菌株的选育与改造效率.同时,组学研究的相关方法可进一步推广至更多领域,为其他领域的研究提供参考.
[1] IKEDA M. Amino acid production processes[J]. Advances in biochemical engineering-biotechnology, 2003, 79:1-35.
[2] 陈宁. 我国氨基酸发酵工业现状及发展战略[C]//中国生物工程学会. 海峡两岸重大生物技术产业化论坛会刊: 创新生物经济环境, 培育战略新兴产业——第四届中国生物产业大会. 济南: 中国生物工程学会, 2010:50-60.
[3] 中国生物发酵产业协会. 氨基酸分会2016年工作总结及2017年工作计划[C]//中国生物发酵产业协会. 中国生物发酵产业协会二届四次理事会暨二届四次常务理事会会议文件汇编. 渭南: 中国生物发酵产业协会2017:22-23.
[4] HERMANN T. Industrial production of amino acids by coryneform bacteria[J]. Journal of biotechnology, 2003, 104(1):155-172.
[5] JIN H P, SANG Y L. Towards systems metabolic engineering of microorganisms for amino acid production[J]. Current opinion in biotechnology, 2008, 19(5):454-460.
[6] STEPHANOPOULOS G, ALPER H, MOXLEY J. Exploiting biological complexity for strain improvement through systems biology[J]. Nature biotechnology, 2004, 22(10): 1261-1267.
[7] WENDISCH V F, BOTT M, KALINOWSKI J, et al. EmergingCorynebacteriumglutamicum, systems biology[J]. Journal of biotechnology, 2006, 124(1):74-92.
[8] TAKORS R, BATHE B, RIEPING M, et al. Systems biology for industrial strains and fermentation processes-example: amino acids[J]. Journal of biotechnology, 2007, 129(2):181-190.
[9] KINOSHITA S, UDAKA S, SHIMONO M. Studies on the amino acid fermentation. Part 1. Production of L-glutamic acid by various microorganisms[J]. Journal of general and applied microbiology, 2004, 50(6):331-343.
[10] POLEN T, WENDISCH V F. Genomewide expression analysis in amino acid-producing bacteria using DNA microarrays[J]. Applied biochemistry and biotechnology, 2004, 118(1):215-232.
[11] O’FARRELL P H. High resolution two-dimensional electrophoresis of proteins[J]. Journal of biological chemistry, 1975, 250(10):4007-4021.
[12] KLOSE J. Protein mapping by combined isoelectric focusing and electrophoresis of mouse tissues. A novel approach to testing for induced point mutations in mammals[J]. Human genetics, 1975, 26(3):231-243.
[13] MACCOSS M J, MATTHEWS D E. Quantitative MS for proteomics: teaching a new dog old tricks[J]. Analytical chemistry, 2005, 77(15):294.
[14] REIMER L C, SPURA J, SCHMIDTHOHAGEN K, et al. High-throughput screening of aCorynebacteriumglutamicummutant library on genomic and metabolic level[J]. PLoS one, 2014, 9(2):86799.
[15] KALINOWSKI J, BATHE B, BARTELS D, et al. The completeCorynebacteriumglutamicumATCC 13032 genome sequence and its impact on the production of L-aspartate-derived amino acids and vitamins[J]. Journal of biotechnology, 2003, 104(1/3):5-25.
[16] OHNISHI J, MITSUHASHI S, HAYASHI M, et al. A novel methodology employing,Corynebacteriumglutamicum, genome information to generate a new L-lysine-producing mutant[J]. Applied microbiology and biotechnology, 2002, 58(2):217-223.
[17] OHNISHI J, KATAHIRA R, MITSUHASHI S, et al. A novel gnd, mutation leading to increased L-lysine production inCorynebacteriumglutamicum[J]. Fems microbiology letters, 2005, 242(2):265-274.
[18] IKEDA M, OHNISHI J, HAYASHI M, et al. A genome-based approach to create a minimally mutatedCorynebacteriumglutamicumstrain for efficient L-lysine production[J]. Journal of industrial microbiology and biotechnology, 2006, 33(7):610-615.
[19] MCHARDY A C, TAUCH A, RÜCKERT C, et al. Genome-based analysis of biosynthetic aminotransferase genes ofCorynebacteriumglutamicum[J]. Journal of biotechnology, 2003, 104(1/3):229-240.
[20] STANSEN C, UY D, DELAUNAY S, et al. Characterization of aCorynebacteriumglutamicumlactate utilization operon induced during temperature-triggered glutamate production[J]. Applied and environmental microbiology, 2005, 71(10):5920-5928.
[21] HAYASHI M, MIZOGUCHI H, OHNISHI J, et al. AleuCmutation leading to increased L-lysine production and rel-independent global expression changes inCorynebacteriumglutamicum[J]. Applied microbiology and biotechnology, 2006, 72(4):783-789.
[22] SINDELAR G, WENDISCH V F. Improving lysine production byCorynebacteriumglutamicumthrough DNA microarray-based identification of novel target genes[J]. Applied microbiology and biotechnology, 2007, 76(3):677-689.
[23] PARK J H, LEE K H, KIM T Y, et al. Metabolic engineering ofEscherichiacolifor the production of L-valine based on transcriptome analysis andinsilicogene knockout simulation[J]. Proceedings of the national academy of sciences, 2007, 104(19):7797-7802.
[24] PARK S H, KIM H U, KIM T Y, et al. Metabolic engineering ofCorynebacteriumglutamicumfor L-arginine production[J]. Nature communications, 2014, 5:4618.
[27] HERMANN T, WERSCH G, UHLEMANN E M, et al. Mapping and identification ofCorynebacteriumglutamicumproteins by two-dimensional gel electrophoresis and microsequencing[J]. Electrophoresis, 1998, 19(18):3217-3221.
[28] HERMANN T, PFEFFERLE W, BAUMANN C, et al. Proteome analysis ofCorynebacteriumglutamicum[J]. Electrophoresis, 2001, 22(9):1712-1723.
[29] BENDT A K, BURKOVSKI A S, BOTT M, et al. Towards a phosphoproteome map ofCorynebacteriumglutamicum[J]. Proteomics, 2003, 3(8):1637-1646.
[30] SCHLUESENER D, FISCHER F, KRUIP J, et al. Mapping the membrane proteome ofCorynebacteriumglutamicum[J]. Proteomics, 2005, 5(5):1317-1330.
[31] SILBERBACH M, SCHFER M, HÜSER A T, et al. Adaptation ofCorynebacteriumglutamicumto ammonium limitation: a global analysis using transcriptome and proteome techniques[J]. Applied and environmental microbiology, 2005, 71(5):2391-2402.
[32] QI S W, CHAUDHRY M T, ZHANG Y, et al. Comparative proteomes ofCorynebacteriumglutamicumgrown on aromatic compounds revealed novel proteins involved in aromatic degradation and a clear link between aromatic catabolism and gluconeogenesis via fructose-1,6-bisphosphatase[J]. Proteomics, 2007, 7(20):3775-3787.
[33] HAUSSMANN U, QI S W, WOLTERS D, et al. Physiological adaptation ofCorynebacteriumglutamicumto benzoate as alternative carbon source-a membrane proteome-centric view[J]. Proteomics, 2009, 9(14):3635-3651.
[34] HAUSSMANN U, POETSCH A. Global proteome survey of protocatechuate-and glucose-grownCorynebacteriumglutamicum, reveals multiple physiological differences[J]. Journal of proteomics, 2012, 75(9):2649-2659.
[35] SHI F, LI K, HUAN X, et al. Expression of NAD(H) kinase and glucose-6-phosphate dehydrogenase improve NADPH supply and L-isoleucine biosynthesis inCorynebacteriumglutamicumssp.lactofermentum[J]. Applied biochemistry and biotechnology, 2013, 171(2):504-521.
[36] SHI F, LI K, LI Y. Comparative proteome analysis of global effect ofPOS5 andzwf-ppnKoverexpression in L-isoleucine producingCorynebacteriumglutamicumssp.lactofermentum[J]. Biotechnology letters, 2015, 37(5):1063-1071.
[37] KEDAR P, COLAH R, SHIMIZU K. Proteomic investigation on thepyk-F, gene knockoutEscherichiacoli, for aromatic amino acid production[J]. Enzyme and microbial technology, 2007, 41(4):455-465.
[38] STRELKOV S, VON E M, SCHOMBURG D. Comprehensive analysis of metabolites inCorynebacteriumglutamicumby gas chromatography/mass spectrometry[J]. Biological chemistry, 2004, 385(9):853-861.
[39] PLASSMEIER J, BARSCH A, PERSICKE M, et al. Investigation of central carbon metabolism and the 2-methylcitrate cycle inCorynebacteriumglutamicumby metabolic profiling using gas chromatography-mass spectrometry[J]. Journal of biotechnology, 2007, 130(4):354-363.
[40] WOO H M, NOACK S, SEIBOLD G M, et al. Link between phosphate starvation and glycogen metabolism inCorynebacteriumglutamicum, revealed by metabolomics[J]. Applied and environmental microbiology, 2010, 76(20):6910-6919.
[41] BÖRNER J, BUCHINGER S, SCHOMBURG D. A high-throughput method for microbial metabolome analysis using gas chromatography/mass spectrometry[J]. Analytical biochemistry, 2007, 367(2):143-151.
[42] BARTEK T, BLOMBACH B, ZÖNNCHEN E, et al. Importance of NADPH supply for improved L-valine formation inCorynebacteriumglutamicum[J]. Biotechnology progress, 2010, 26(2):361-371.
[43] VAN O J, NOACK S, BOTT M, et al. Improved L-lysine production withCorynebacteriumglutamicumand systemic insight into citrate synthase flux and activity[J]. Biotechnology and bioengineering, 2012, 109(8):2070-2081.
[44] BARTEK T, BLOMBACH B, LANG S, et al. Comparative13C metabolic flux analysis of pyruvate dehydrogenase complex-deficient, L-valine-producingCorynebacteriumglutamicum[J]. Applied and environmental microbiology, 2011, 77(18): 6644-6652.
[45] KIND S, BECKER J, WITTMANN C. Increased lysine production by flux coupling of the tricarboxylic acid cycle and the lysine biosynthetic pathway-metabolic engineering of the availability of succinyl-CoA inCorynebacteriumglutamicum[J]. Metabolic engineering, 2013, 15: 184-195.
[46] KRÖMER J O, SORGENFREI O, KLOPPROGGE K, et al. In-depth profiling of lysine-producingCorynebacteriumglutamicumby combined analysis of the transcriptome, metabolome, and fluxome[J]. Journal of bacteriology, 2004, 186(6):1769-1784.
[47] BUCHINGER S, STRÖSSER J, REHM N, et al. A combination of metabolome and transcriptome analyses reveals new targets of theCorynebacteriumglutamicum, nitrogen regulator AmtR[J]. Journal of biotechnology, 2009, 140(1/2):68-74.
[48] YOON S H, HAN M J, LEE S Y, et al. Combined transcriptome and proteome analysis ofEscherichiacoliduring high cell density culture[J]. Biotechnology and bioengineering, 2003, 81(7):753-767.
Researchstatusanddevelopmenttrendofomicstechnologiesinscreeningaminoacidsproductionstrains
ZHANG Quanwei1, LIN Gaoyang1, MA Qian1,2,3
(1.College of Biotechnology, Tianjin University of Science and Technology, Tianjin 300457, China; 2.National and Local United Engineering Lab of Metabolic Control Fermentation Technology, Tianjin 300457, China; 3.Tianjin Engineering Lab of Efficient and Green Amino Acid Manufacture, Tianjin 300457, China)
Omics technology, including genomics, transcriptomics, metabolomics, proteomics, etc, can be used to acquire the whole metabolic pathway information and regulatory network information of the research objects. The application of omics technology to the optimization of amino acid fermentation provides important theoretical guidance for further metabolic engineering of microorganisms with enhanced production of target products. This paper introduces the application and development trend of omics techniques applied in microbial fermentation of amino acids, which is conducive to the rational design and construction of excellent amino acid production strains.
amino acid; omics; metabolic engineering; rational design; high-yield strains
2017-04-24
工业发酵微生物教育部重点实验室暨天津市工业微生物重点实验室(天津科技大学)主任基金项目(2016IM104);天津科技大学青年教师创新基金(2016LG11);天津市大学生创新创业训练计划项目(201710057094)
张权威(1993—),男,河南周口人,硕士研究生,研究方向为氨基酸发酵组学分析,E-mail: zquanweiyx@126.com. 通信作者:马倩讲师,E-mail: qianma1987@tust.edu.cn.
TQ92
A
1674-2214(2017)04-0205-07
朱小惠)

