姜黄素联合多奈哌齐治疗老年性痴呆患者疗效观察
叶茂盛 潘锋 蒋蓝英 傅仲颖 郦旦明
姜黄素联合多奈哌齐治疗老年性痴呆患者疗效观察
叶茂盛 潘锋 蒋蓝英 傅仲颖 郦旦明
阿尔茨海默病;姜黄素;多奈哌齐;认知功能
阿尔茨海默病(alzheimer’s disease,AD)也被称为老年性痴呆,一种以进行性记忆损害和认知功能障碍为主要表现的神经系统退行性疾病。目前尚无根治AD的药物,成为公共健康和医疗界的挑战之一[1-2]。WHO报告显示,AD越来越严重威胁着人类的健康,美国有调查显示年龄在85岁左右的老年人,其中有50%正面临AD的侵袭[3]。姜黄素(curcumin)是近年来研究的热点之一,研究[4]表明,姜黄素具有改善认知功能的作用。多奈哌齐用于治疗阿尔茨海默病已有20余年,具有较好的疗效及安全性。本研究观察姜黄素联合多奈哌齐治疗AD的疗效,探讨姜黄素对痴呆的防治作用。
1 临床资料
1.1 一般资料选择2013年6月—2016年12月在我院老年病科门诊及住院符合条件的AD患者60例,采用随机数字表法随机分为多奈哌齐治疗组30例,男16例,女14例,平均年龄(74.26±6.38)岁,吸烟9例,受教育时间(9.78±1.52)年。姜黄素联合多奈哌齐治疗组(联合用药组)30例,男17例,女13例,平均年龄(75.18±7.42)岁,吸烟10例,受教育时间(9.56±1.61)年。两组治疗前均进行神经心理学测试评分,两组均完成研究。本研究经过医院伦理委员会批准。两组患者的人口学特征(性别、年龄)、吸烟、受教育时间以及MMSE评分、ADL评分、ADAS-cog评分方面具有可比性(P>0.05)。
1.2 纳入标准(1)65岁以上,男女不限,小学及以上文化程度;(2)主诉或知情者报告有认知障碍,病程超过6个月;(3)哈金斯基缺血指数量表(hachinskilschemic scale,HIS)评分<4分,排除血管性痴呆;(4)汉密尔顿抑郁量表<17分,排除抑郁症;(5)符合美国精神障碍诊断和统计手册第4版(DSM.IV)的诊断标准以及美国国立神经病和卒中学会阿尔茨海默病及相关疾病协会(NINCD-ADRDA)制定的AD诊断标准;头颅CT或MRI扫描支持AD诊断;按简易精神状态检查表(minimum mentol state examination,MMSE)评分标准:小学文化得分≤20分,中学及以上文化≤24分为阿尔茨海默病。(6)患者及家属同意并签署知情同意书,具有较高的治疗依从性。
1.3 排除标准(1)急性谵妄状态等意识障碍;(2)伴有帕金森病、Pick病、脑出血、脑血栓、癫痫等影响认知功能的神经系统疾病患者;(3)有严重心、肝、肾、血液、内分泌系统等疾病及严重听力及视力障碍的患者;(4)患者及家属病史提供不可靠;(5)过敏体质及对姜黄素或盐酸多奈哌齐过敏者;(6)未签署知情同意书的患者。
2 方法
2.1 治疗方法多奈哌齐组:给予多奈哌齐片(商品名:安理申)1次5mg,1天1次,口服,睡前服,4周后将剂量改为1次10mg,1天1次,口服,维持该剂量至24周研究结束;联合用药组:在同样方法服用多奈哌齐基础上加服姜黄素(商品名:杰诺)0.5g,1天2次,口服,持续24周。两组均给予常规治疗,包括抗血小板聚集、抗凝、调脂、降压、降糖及β受体阻滞剂、硝酸酯类等,服药期间停用银杏叶制剂等促智及改善认知药物。
2.2 神经心理学测试方法两组患者分别在治疗前、治疗后12周和24周进行MMSE、日常生活活动量表(activies of daily living,ADL)、阿尔茨海默病评估量表认知分量表(alzheimer's disease assessment scale cognitive subscale,ADAS-cog)的测评,并根据评分判定疗效。MMSE量表评定患者的认知功能,检查项目包括定向力(时间和地点)、记忆力(即刻记忆和延迟记忆)、计算力、注意力、语言能力和视空间能力等,满分为30分,分值越高,患者认知功能越好。ADL行为量表评价患者日常生活活动能力,共20个项目,总分为80分,分值越高,患者日常生活能力越差。ADAS-cog量表评定认知功能及药物疗效,包括单词回忆、命名、命令、结构性练习、意向性练习、定向力、单词辨认测试、口语能力、注意力等12个项目,量表评分范围0(无损害),-70分(严重损害),分值越高,认知损害越严重,将改善4分作为药物显效的判断标准[5]。
2.3 统计学方法数据应用SPSS13.0统计软件进行分析。计量资料以(±s)表示,采用t检验,计数资料采用χ2检验,以P<0.05为差异有统计学意义。
3 结果
治疗后,两组患者MMSE评分均有升高,联合用药组明显好于多奈哌齐组(P<0.05);两组患者ADL评分均有降低,联合用药组较多奈哌齐组有明显改善(P<0.05)。经药物治疗24周后,两组患者ADAS-cog评分均较治疗前明显降低,且改善均超过4分(P<0.05或P<0.01)。联合用药组较多奈哌齐组ADAS-cog评分降低更明显(P<0.05),见表1~3。
4 讨论
阿尔茨海默病病因及发病机制尚不明确。乙酰胆碱是与学习、记忆相关的神经递质,海马、皮质等部位的胆碱乙酰转移酶(ChAT)活性降低,导致突触前间隙乙酰胆碱合成、摄取、储存和释放减少,乙酰胆碱浓度的降低导致认知功能下降。胆碱酯酶抑制剂可改善乙酰胆碱的代谢平衡,从而达到改善认知的作用。
多奈哌齐是一种特异性的胆碱酯酶抑制剂,目前广泛应用于临床,被多个指南所推荐,对包括阿尔茨海默病在内的多种认知功能障碍均有改善作用,具有较好的安全性和耐受性。姜黄素是从姜黄根茎中提取的一类二酮类化合物,具有降血脂、抗肿瘤、抗炎、抗氧化等作用。研究表明,姜黄素在神经系统中具有抗淀粉样蛋白形成和聚集、抑制细胞凋亡和减轻免疫炎症反应等作用,起到神经保护、改善认知损害的作用[6-7]。姜黄素能够保护并增加转基因小鼠海马CA1区ChAT的表达及活性,提示姜黄素可能是通过改善胆碱能神经元功能发挥作用[8]。
表1 两组老年性痴呆患者治疗前后MMSE评分对比(分±s)

表1 两组老年性痴呆患者治疗前后MMSE评分对比(分±s)
注:与治疗前比较,*P<0.05;**P<0.01;与多奈哌齐组比较,△P<0.05
?
表2 两组老年性痴呆患者治疗前后ADL评分对比(分±s)
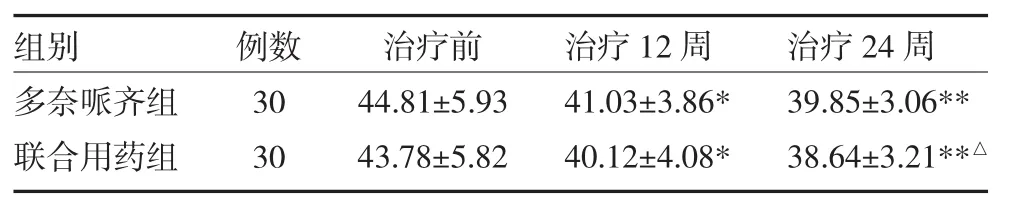
表2 两组老年性痴呆患者治疗前后ADL评分对比(分±s)
注:与治疗前比较,*P<0.05;**P<0.01;与多奈哌齐组比较,△P<0.05
?
表3 两组老年性痴呆患者治疗前后ADAS-cog评分对比(分±s)
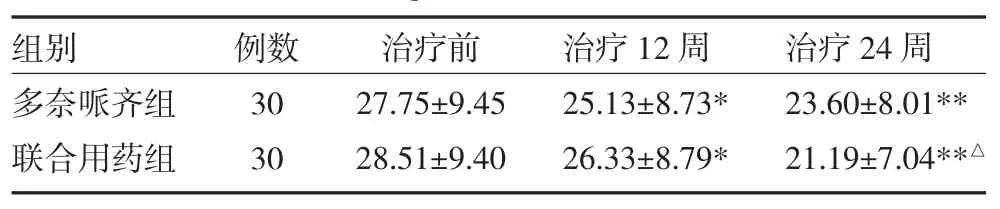
表3 两组老年性痴呆患者治疗前后ADAS-cog评分对比(分±s)
注:与治疗前比较,*P<0.05;**P<0.01;与多奈哌齐组比较,△P<0.05
?
AD典型病理学改变为老年斑和神经纤维缠结形成。β淀粉样蛋白(amyloid β protein,Aβ)是老年斑的主要成分,Aβ的异常沉积及对神经细胞的毒性作用,被认为是AD形成和发展的关键因素之一。研究[9]显示,姜黄素能干扰Aβ合成和延伸,并且能使已形成的Aβ纤维降解。动物实验证实姜黄素可明显减少Aβ在海马区的沉积[10],通过Aβ降解酶限制Aβ诱导的炎症反应而发挥神经保护作用,可能是姜黄素减少Aβ沉积的作用机制之一[11]。糖原合成酶激酶3β(glycogen synthesis kinase 3β,GSK3β)可以调节γ-分泌酶的产生,姜黄素能抑制GSK3β活性,减少Aβ的形成。GSK3β是多种信号转导途径中的一个关键酶,参与了阿尔茨海默病等神经系统退行性疾病的病理生理过程[12-13]。GSK3β参与了Wnt/β-catenin信号通路的调节,其活性升高可促进细胞凋亡[14]。有研究[15]发现,姜黄素通过抑制GSK3β的表达激活Wnt/β-catenin信号通路途径,从而减少细胞凋亡。姜黄素发挥神经保护作用的机制可能是通过多种途径实现的。
本研究结果显示,多奈哌齐组及联合姜黄素用药组在治疗12周及24周后,MMSE评分均有提高,均有效改善AD患者的认知功能,联合用药改善认知功能的疗效更显著。两组在治疗12周及24周后ADL评分均有减少,表明药物治疗可提高患者生活自理能力,联合用药组改善日常生活能力的疗效优于多奈哌齐单药组。两组ADAS-cog评分在24周治疗后均较治疗前下降明显,且联合用药组药物疗效优于多奈哌齐单药组。联合用药疗效优于单药的原因可能与两种药物不同的作用机制及药物之间的协同作用有关。由于本研究样本量较小、观察时间较短,姜黄素是否能作为痴呆的辅助治疗方法,改善痴呆患者的预后,还需要更大规模样本、更长时间的前瞻性研究来进一步证实,其安全性也需进一步观察。
[1]Alzheimer’s Disease International.World Alzheimer Report 2014[M].London:Alzheimer’s Disease International,2014:10-15.
[2]Amemori T,Jendelova P,Ruzicka J,et al.Alzheimer's Disease:Mechanism and Approach to Cell Therapy[J].Int J Mol Sci,2015,16(11):26417-26451.
[3]Weuve J,Hebert L E,Scherr PA,et al.Deaths in the United States among persons with Alzheimer’s disease(2010-2050)[J].Alzheimers Dement,2014,10(2):140-146.
[4]Potter PE.Curcumin:a natural substance with potential efficacy in Alzheimer's disease[J].J Exp Pharmacol,2013,5:23-31.
[5]贾建平.中国痴呆与认知障碍诊治指南(2015年版)[S].北京:人民卫生出版社,2016:211-238.
[6]Potter PE.Curcumin:a natural substance with potential efficacy in Alzheimer’s disease[J].J Exp Pharmacol,2013,5:23-31.
[7]Ahmed T,Enam SA,Gilani AH.Curcuminoids enhance memory in an amyloid-infused rat model of Alzheimer's disease[J].Neuroscience,2010,169(3):1296-1306.
[8]任映,李瑞晟,王虹,等.姜黄素对APP/PS1双转基因小鼠海马神经元ChAT表达的影响[J].北京中医药大学学报,2012,35(10):679-682.
[9]Ono K,Hasegawa K,Naiki H,et al.Curcumin has potent anti-amyloidogenic effects for Alzheimer’s beta-amyloid fibrils in vitro[J].J Neurosci Res,2004,75(6):742-750.
[10]Mithu VS,Sarkar B,Bhowmik D,et al.Curcumin alters the salt bridge-containing turn region in amyloid beta(1~42)aggregates[J].J Biol Chem,2014,289(16):11122-11131.
[11]董云芳,冯慧利,何瑛琨,等.姜黄素对小鼠海马Aβ生成酶和降解酶的影响[J].北京中医药大学学报,2016,39(3):230-234.
[12]Hohman TJ,Chibnik L,Bush WS,et al.GSK3β Interactions with Amyloid Genes:An Autopsy Verification and Extension[J].Neurotox Res,2015,28(3):232-238.
[13]Kettunen P,Larsson S,Holmgren S,et al.Genetic variants of GSK3B are associated with biomarkers for Alzheimer’s disease and cognitive function[J].J Alzheimers Dis,2015,44(4):1313-1322.
[14]Vossel KA,Xu JC,Fomenko V,et al.Tau reduction prevents Aβ-induced axonal transport deficits by blocking activation of GSK3β[J].J Cell Biol,2015,209(3):419-433.
[15]Zhang X,Yin WK,Shi XD et a1.Curcumin activates Wnt/β-catenin Signaling pathway through inhibiting the activity of GSK-3β in APPswe transfected SY5Y cells[J].EurJ Pharm Sci,2011,42(5):540-546.
浙江省中医药科技计划项目(No.2013ZB097);杭州市科技发展计划项目资助(No.20150733Q40)
浙江省中西医结合医院老年病科(杭州310003)
叶茂盛,Tel:15068892185;E-mail:maoshengyea@126.com
(收稿:2017-04-22修回:2017-05-29)

