青蒿素抑制CD133+HepG2细胞对γδ T细胞的耐受性及其机制研究
郑璟瑶
青蒿素抑制CD133+HepG2细胞对γδ T细胞的耐受性及其机制研究
郑璟瑶
目的探讨青蒿素是否能抑制CD133+肝癌细胞HepG2对γδT细胞的耐受性及研究其机制。方法LDH释放实验检测γδT细胞及青蒿素共培养对CD133+及CD133-HepG2的杀伤活性;Western blot实验检测γδT细胞及青蒿素共培养对CD133+HepG2细胞MCL-1表达水平、Caspase-9、Caspase-3活化水平和细胞色素C释放水平的影响;流式细胞技术检测γδT细胞及青蒿素共培养对CD133+HepG2细胞凋亡和线粒体膜电位的影响。结果LDH释放实验结果显示,在相同数量γδT细胞处理下,CD133+HepG2细胞LDH释放率显著低于CD133-HepG2细胞,表明CD133+HepG2细胞对γδT细胞治疗存在耐受性;同时,γδT细胞+青蒿素组CD133+HepG2的LDH释放率显著高于γδT细胞组和青蒿素+γδT细胞+MCL-1质粒组[(55.3±6.1)%比(18.7±2.6)%、(24.2±2.8)%,P<0.05]。流式细胞实验结果显示,γδT细胞+青蒿素组CD133+HepG2的凋亡率显著高于γδT细胞组和青蒿素+γδT细胞+MCL-1质粒组[(38.2±3.5)%比(10.5±1.1)%、(14.3±1.2)%,P<0.05]。Western blot实验结果显示,青蒿素处理能显著抑制CD133+HepG2细胞MCL-1蛋白表达水平。流式细胞实验结果显示,γδT细胞+青蒿素组CD133+HepG2相对线粒体膜电位显著高于γδT细胞组和青蒿素+γδT细胞+MCL-1质粒组[(0.21±0.02)比(0.78±0.05)、(0.71±0.05),P<0.05]。Western blot实验结果则显示,γδT细胞+青蒿素组CD133+HepG2的活化Caspase-9、Caspase-3及细胞色素C的释放均显著高于γδT细胞组和青蒿素+γδT细胞+MCL-1质粒组。结论青蒿素可能通过抑制CD133+肝癌细胞MCL-1表达水平抑制其对γδT细胞的耐受性。
青蒿素;MCL-1;γδT细胞;CD133;HepG2
肝癌患者的预后很差且5年生存率低[1]。手术和肝移植是目前最有效的治疗肝癌手段,很大部分患者在确诊时肿瘤往往已经进入中晚期,因此,化疗或免疫治疗是不可缺少的治疗手段[2-3]。研究发现,一些肿瘤细胞,特别是CD133+肿瘤细胞对化疗或免疫治疗有很强的耐受性[4],因此采取辅助治疗手段降低CD133+肝癌细胞对化疗或免疫治疗的耐受性具有十分重要的意义。本研究目的在于探讨青蒿素是否能抑制CD133+肝癌细胞HepG2对γδT细胞的耐受性及研究其机制。
1 材料与方法
1.1 材料Annexin V细胞凋亡试剂盒(批号APOAF)和青蒿素购于美国Sigma-Aldrich。线粒体膜电位染料JC-1(5,5,6,6-tetrachloro-1,1,3,3-tetraethylbenzimidazolylcarbocyanine iodide)、乳酸脱氢酶细胞毒性检测试剂盒(批号C0016)和线粒体分离试剂盒(批号C3601)购于江苏碧云天生物技术有限公司。RPMI-1640培养基购于美国Gibco。溴代醇磷酸(BrHPP)购于法国Innate Pharma。白细胞介素2购于美国R&D System公司。髓样细胞白血病-1(MCL-1)、活化半胱天冬酶-9(活化Caspase-9)、活化半胱天冬酶-3(活化Caspase-3)、细胞色素C和β肌动蛋白(β-actin)抗体购于美国Cell Signaling。pcDNA3.1质粒和脂质体2000购于美国Invitrogen公司。增强化学发光(ECL)试剂盒(批号32106)购于美国Pierce。异硫氰酸荧光素标记的CD133(CD133-FITC)荧光抗体购于美国BD公司。
1.2 细胞培养HepG2细胞购于中国科学院典型培养物保藏委员会细胞库。按文献所述将HepG2细胞用CD133-FITC荧光抗体和流式细胞分选仪对其中的CD133+及CD133-细胞进行分群[5]。分选后的细胞培养在含10%胎牛血清的RPMI-1640培养基中,培养环境为37°C恒温培养箱中培养并通入5%CO2。γδT细胞的培养按文献所述[6],取15例健康人的全血采取密度梯度离心法获取单个核细胞并培养在含10%胎牛血清的RPMI-1640培养基中,加入3μmol/L γδT细胞特异性扩增剂溴代醇磷酸和400IU/mL的白细胞介素2培养14天。
1.3 MCL-1过表达质粒构建和转染将人MCL-1基因的开放阅读框架序列经PCR扩增后以分子克隆的方法与pcDNA3.1连接后构建成MCL-1重组过表达质粒。MCL-1过表达质粒用脂质体2000按试剂操作说明书步骤进行转染,简要步骤如下:将2μg/mL质粒用脂质体2000进行包裹后将其加入到无血清培养基进行混合。将贴壁的HepG2细胞置于该无血清培养基孵育6h,之后弃去无血清培养基并加入新鲜的含10%胎牛血清的RPMI-1640培养基培养24h。
1.4 乳酸脱氢酶释放实验检测CD133+及CD133-HepG2细胞对γδT细胞的敏感性按不同的E:T(效应γδT细胞个数:目标CD133+或CD133-HepG2靶细胞个数)将靶细胞和γδT细胞分别接种在transwell上室(0.4μM孔径)和下室中进行共培养,12h后用乳酸脱氢酶细胞毒性检测试剂盒按说明书步骤检测CD133+及CD133-HepG2靶细胞乳酸脱氢酶(LDH)的释放率。
1.5 乳酸脱氢酶释放实验检测青蒿素是否影响CD133+HepG2细胞对γδT细胞的敏感性实验分为对照组、青蒿素组、γδT细胞组、青蒿素+γδT细胞组及青蒿素+γδT细胞+MCL-1质粒组。对照组为CD133+HepG2细胞单独培养24h;青蒿素组为CD133+HepG2细胞加入10μmol/mL青蒿素处理24h;γδT细胞组为CD133+HepG2细胞与10倍CD133+HepG2数目的γδT细胞(E∶T=10∶1)共培养24h;青蒿素+γδT细胞组为CD133+HepG2细胞与10μmol/mL青蒿素及2.5倍CD133+HepG2数目的γδT细胞共培养24h;青蒿素+γδT细胞+MCL-1质粒组为转染MCL-1质粒的CD133+HepG2细胞与10μmol/mL青蒿素及2.5倍CD133+HepG2数目的γδT细胞共培养24h。细胞处理完毕后用乳酸脱氢酶细胞毒性检测试剂盒按说明书步骤检测CD133+HepG2细胞LDH的释放率。
1.6 线粒体分离将CD133+HepG2细胞按上述进行分组。用线粒体分离试剂盒按试剂说明书步骤将处理后的CD133+HepG2细胞的线粒体从细胞质中分离出来,取无线粒体的细胞质进行后续的Western blot实验,检测其中细胞色素C的释放水平。
1.7 Western blot实验将CD133+HepG2细胞按上述进行分组。细胞处理完毕后提取其中的总蛋白质。将等量的总蛋白质用12%丙烯酰胺凝胶电泳进行分离。分离完毕后通过电转方法将蛋白质从分离胶上转到PVDF膜上,用MCL-1、活化Caspase-9、活化Caspase-3、细胞色素C和β-actin抗体孵育过夜,之后再用带辣根过氧化物酶的二抗孵育2h,蛋白条带用ECL试剂盒显色发光。
1.8 细胞凋亡和线粒体膜电位测定将CD133+HepG2细胞按上述进行分组。收集细胞后用凋亡检测试剂盒按照说明书步骤检测CD133+HepG2细胞的凋亡,Annexin V阳性细胞所占比例即为细胞凋亡率;用JC-1试剂按照说明书步骤检测CD133+HepG2细胞的线粒体膜电位,相对线粒体膜电位为实验组的红色荧光强度与对照组红色荧光强度的比值[7]。
2 结果
2.1 CD133+HepG2细胞对γδT细胞的耐受性将γδT细胞和CD133+或CD133-HepG2细胞按不同的E:T进行共培养后检测肿瘤细胞LDH的释放率。结果显示,在γδT细胞的共培养下,CD133+HepG2细胞的LDH释放率显著低于CD133-HepG2细胞(见图1),表明CD133+HepG2细胞对γδT细胞有耐受性。
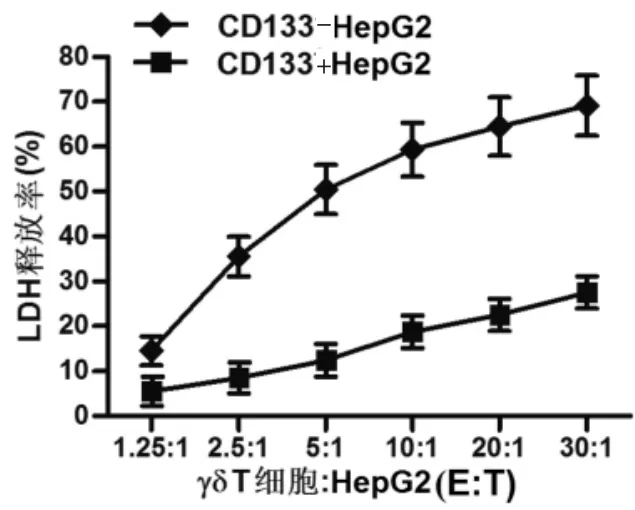
图1 CD133+和CD133-HepG2细胞与γδT细胞共培养后LDH释放率
2.2 青蒿素通过抑制MCL-1表达抑制CD133+HepG2细胞对γδT细胞的耐受性Western blot结果显示,CD133+HepG2细胞MCL-1表达水平显著高于CD133-HepG2细胞(见图2),提示MCL-1高表达可能是CD133+HepG2细胞对γδT细胞有耐受性的机制。LDH释放实验和凋亡检测实验结果显示,γδT细胞+青蒿素组CD133+HepG2的LDH释放率和细胞凋亡率显著高于γδT细胞组和青蒿素组(见表1),提示青蒿素能抑制CD133+HepG2细胞对γδT细胞的耐受性。同时,转染MCL-1表达质粒后,青蒿素和γδT细胞联合处理后的CD133+HepG2细胞的LDH释放率和细胞凋亡率明显降低(见表1),表明青蒿素通过抑制MCL-1表达抑制CD133+HepG2细胞对γδT细胞的耐受性。
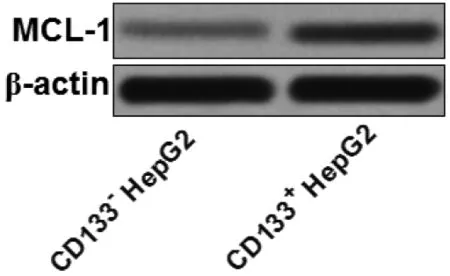
图2 CD133+与CD133-HepG2细胞MCL-1表达水平
表1 各组LDH释放率、细胞凋亡率比较(%±s)

表1 各组LDH释放率、细胞凋亡率比较(%±s)
注:与对照组比较,*P<0.05;与γδT细胞组比较,▲P<0.05;与青蒿素组比较,△P<0.05;与γδT细胞+青蒿素组比较,□P<0.05
?
2.3 青蒿素促进CD133+HepG2细胞发生γδT细胞依赖的线粒体途径凋亡流式细胞结果显示,青蒿素能显著促进γδT细胞对CD133+HepG2细胞线粒体膜电位的损伤,而转染MCL-1质粒则能明显抑制线粒体膜电位的下降(见表2),表明青蒿素能通过抑制MCL-1的表达促进CD133+HepG2细胞发生γδT细胞依赖的线粒体膜电位的下降。另外,Western blot结果显示,青蒿素能显著促进γδT细胞对CD133+HepG2细胞线粒体中细胞色素C的释放,从而诱导细胞发生Caspase-9和Caspase-3的活化,而MCL-1质粒则同样能抑制细胞色素C的释放和Caspases的活化(见图3)。这些结果表明青蒿素能通过抑制MCL-1表达促进CD133+HepG2细胞发生γδT细胞依赖的线粒体途径凋亡。
3 讨论
γδT细胞是效应性T细胞的一个亚群,具有良好的抗肿瘤作用[8-9]。CD133是一种糖蛋白,表达于细胞表面,被认为是“干细胞样”细胞的表面标志。在包括肝癌在内的一些肿瘤细胞中,CD133+细胞亚群也被称为肿瘤干细胞[10-11]。研究[12]表明,CD133+肿瘤细胞对抗肿瘤治疗有较强的抵抗能力,因此CD133+肿瘤细胞已经成为肿瘤治疗的重要靶点。
表2 各组相对线粒体膜电值比较(±s)

表2 各组相对线粒体膜电值比较(±s)
注:与对照组比较*P<0.05;与γδT细胞组比较,▲P<0.05;与青蒿素组比较,△P<0.05;与γδT细胞+青蒿素组比较,□P<0.05
?
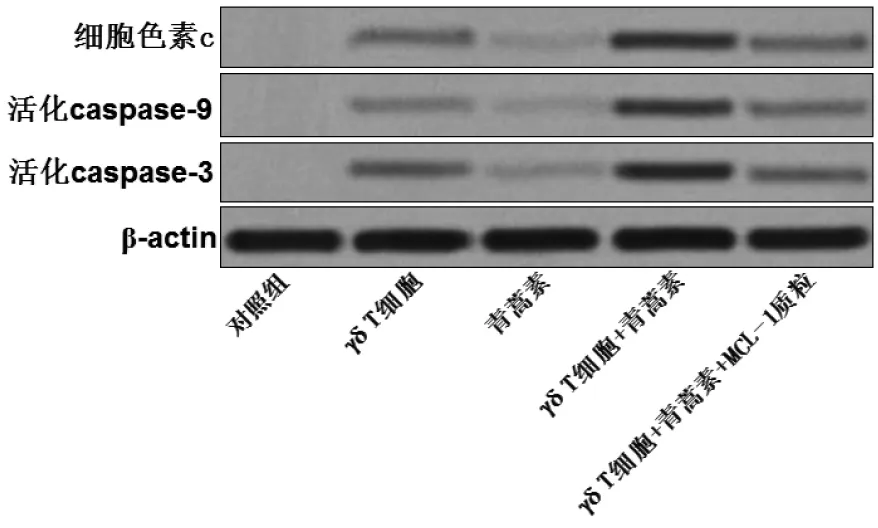
图3 青蒿素促进CD133+HepG2细胞发生γδT细胞依赖的细胞色素C释放和Caspase-9,Caspase-3活化
近年研究表明,青蒿素有一定的抗肿瘤效应,如青蒿素能显著抑制肺癌的发展和转移,又能抑制胆囊癌的细胞周期并促进其发生凋亡[13-14]。本研究结果表明,CD133+肝癌细胞对γδT细胞治疗有明显的耐受性,然而青蒿素能显著增强γδT细胞对CD133+HepG2肝癌细胞的杀伤活性,因此,青蒿素可能是良好的免疫治疗辅助药物。
MCL-1属于Bcl-2抗凋亡蛋白家族,主要表达于线粒体外膜上。研究[15-18]表明,过表达的MCL-1能阻碍肿瘤细胞的凋亡途径,抑制由药物引起的肿瘤细胞线粒体的损伤,从而使细胞色素C等凋亡活性物质不能从线粒体中释放到细胞质中,抑制下游Caspase-9和Caspase-3的活化,保护肿瘤细胞逃避凋亡途径。因此肿瘤细胞的MCL-1往往会发生过度,且MCL-1的过表达程度与肿瘤细胞对抗肿瘤治疗的敏感性呈负相关[19]。
本研究Western blot实验结果发现,青蒿素能显著下调CD133+肝癌细胞中MCL-1表达水平。当转染MCL-1过表达质粒上调肝癌细胞中MCL-1的蛋白水平后,青蒿素联合γδT细胞对CD133+肝癌细胞的杀伤活性受到明显抑制,且线粒体途径的凋亡通路受到明显阻断,证明青蒿素是通过降低肝癌组织MCL-1蛋白表达促进γδT细胞对CD133+肝癌细胞线粒体途径凋亡的诱导,使CD133+肝癌细胞发生凋亡性死亡。
综上所述,青蒿素能显著提高CD133+肝癌细胞对免疫治疗的敏感性,可能为肿瘤免疫治疗提供更有效的策略和思路。
[1]Siegel R,Naishadham D,Jemal A.Cancer statistics,2013[J].CA Cancer J Clin,2013,63(1):11-30.
[2]Huang JS,Chang PH.Refractory hypoglycemia controlled by systemic chemotherapy with advanced hepatocellular carcinoma:A case report[J].Oncol Lett,2016,11(1):898-900.
[3]Liang C,Xu Y,Wu J,et al.Downregulation of DcR3 sensitizes hepatocellular carcinoma cells to TRAIL-induced apoptosis[J].Onco Targets Ther,2017,10:417-428.
[4]Lee SH,Hyun SK,Kim SH,et al.Potential Role of CD133 Expression in the Susceptibility of Human Liver Cancer Stem-Like Cells to TRAIL[J].Oncol Res,2016,24(6):495-509.
[5]Feng X,Jiang J,Zheng S,et al.Knockdown of miR-25 increases the sensitivity of liver cancer stem cells to TRAIL-induced apoptosis via PTEN/PI3K/Akt/Bad signaling pathway[J].Int J Oncol,2016,49(6):2600-2610.
[6]Gonnermann D,Oberg HH,Wesch D,et al.Resistance of cyclooxygenase-2 expressing pancreatic ductal adenocarcinoma cells against γδ T cell cytotoxicity[J].Oncoimmunology,2015,4(3):e988460.
[7]Prathapan A,Vineetha VP,Raghu KG.Protective effect of Boerhaavia diffusa L.against mitochondrial dysfunction in angiotensin II induced hypertrophy in H9c2 cardiomyoblast cells[J].PLoS One,2014,9(4):e96220.
[8]Dokouhaki P,Schuh NW,Zhang L,et al.NKG2D regulates production of soluble TRAIL by ex vivo expanded human γδ T cells[J].Eur J Immunol,2013,43(12):3175-3182.
[9]Li Z.Potential of human gammadelta T cells for immunotherapy of osteosarcoma[J].Mol Biol Rep,2013,40(1):427-437.
[10]Zhang L,Li H,Li JJ,et al.Inhibitory effects of transcription factor Ikaros on the expression of liver cancer stem cell marker CD133 in hepatocellular carcinoma[J].Oncotarget,2014,5(21):10621-10635.
[11]Jiang J,Feng X,Yang Y,et al.MiR-128 reverses the gefitinib resistance of the lung cancer stem cells by inhibiting the c-met/PI3K/AKT pathway[J].Oncotarget,2016,7(45):73188-73199.
[12]Ma L,Liu T,Zhang H,et al.ABCG2 is required for self-renewal and chemoresistance of CD133-positive human colorectal cancer cells[J].Tumour Biol,2016,37(9):12889-12896.
[13]Tong Y,Liu Y,Lu L,et al.Artemisinin and its derivatives can significantly inhibit lung tumorigenesis and tumor metastasis through Wnt/β-catenin signaling[J].Oncotarget,2016,7(21):31413-31428.
[14]Jia J,Qin Y,Qian J,et al.Artemisinin inhibits gallbladder cancer cell lines through triggering cell cycle arrest and apoptosis[J].Mol Med Rep,2016,13(5):4461-4468.
[15]Xie Q,Wang S,Yang X,et al.MiR-519d impedes cisplatin-resistance in breast cancer stem cells by down-regulating the expression of MCL-1[J].Oncotarget,2017,8(13):22003-22013.
[16]Tong J,Wang P,Zhang L,et al.Mcl-1 Degradation Is Required for Targeted Therapeutics to Eradicate Colon Cancer Cells[J].Cancer Res,2017,77(9):2512-2521.
[17]Huang G,Chen X,Xing C,et al.miR-20a-directed regulation of BID is associated with the TRAIL sensitivity in colorectal cancer[J].Oncol Rep,2017,37(1):571-578.
[18]Laussmann MA,Passante E,Rehm M,et al.Proteasome inhibition can impair caspase-8 activation upon submaximal stimulation of apoptotic tumor necrosis factor-related apoptosis inducing ligand(TRAIL)signaling[J].J Biol Chem,2012,287(18):14402-14411.
[19]Ma J,Zhao Z,Liu K,et al.MCL-1 is the key target of adjuvant chemotherapy to reverse the cisplatin-resistance in NSCLC[J].Gene,2016,587(2):147-154.
Effect of Artemisinin on Reducing the Tolerance of CD133+HepG2 to γδT Cells and Its Related Mechanism
ZHENG Jingyao.
Clinical Testing Center,Branch Hospital of Zhejiang Hospital,Hangzhou(310000),China
ObjectiveTo investigate the effect of artemisinin on the tolerance of CD133+HepG2 to γδT cells and the underlying mechanism.MethodsCD133+HepG2 cells were co-cultured with artemisinin and γδT cells,then LDH release assays were performed to evaluate the cell viability,Western blot analysis was performed to evaluate the expression of MCL-1,activation of caspase-9,caspase-3 and release of cytochrome c in CD133+HepG2 cells,Flow cytometry analysis was performed to measure the apoptosis and mitochondrial membrane potential in CD133+HepG2 cells.ResultsResults of LDH release assays showed that under the treatment of equal amount of γδT cells,the release rate of LDH in CD133+HepG2 cells was significantly lower than that in the CD133-HepG2 cells,which indicating that CD133+HepG2 cells were tolerant to γδT cell treatment.Meanwhile,the LDH release rate in γδT cells+artemisinin group(55.3%±6.1%)was significantly higher than that in the γδT cell group(18.7%±2.6%,P<0.05)and γδT cells+artemisinin+MCL-1 plasmid group(24.2%±2.8%,P<0.05).Flow cytometry analysis results showed that the apoptotic rate in γδT cells+artemisinin group(38.2%±3.5%)was significantly higher than that in the γδT cells group(10.5%±1.1%,P<0.05)and γδT cells+artemisinin+MCL-1 plasmid group(14.3%±1.2%,P<0.05).Western blot assays showed that artemisinin downregulated the expression of MCL-1 in CD133+HepG2 cells.In addition,relative mitochondrial membranepotential in γδT cells+artemisinin group(0.21%±0.02%)was significantly lower than that in the γδT cells group(0.78%±0.05%,P<0.05)and γδT cells+artemisinin+MCL-1 plasmid group(0.71%±0.05%,P<0.05).The activation of caspase-9,caspase 3,and release of cytochrome c in γδT cells+artemisinin group was significantly stronger than that in the γδT cells group and γδT cells+artemisinin+MCL-1 plasmid group.ConclusionArtemisinin suppressed the tolerance of CD133+liver cancer cells to γδT cells through the inhibition of MCL-1 expression.
浙江医院分院检验科(杭州310000)
artemisinin;MCL-1;γδT cells;CD133;HepG2
(收稿:2017-06-04修回:2017-07-30)

