Erk1/2失活对FGF21调节糖脂代谢调控的影响*
吴朝明, 郑巨佳, 潘莹莹, 叶艳娜, 潘薛波, 林灼锋, 3△
(温州医科大学 1附属第二医院, 2药学院, 浙江 温州 325035; 3暨南大学附属第一医院, 广东 广州 510630)
Erk1/2失活对FGF21调节糖脂代谢调控的影响*
吴朝明1, 郑巨佳2, 潘莹莹2, 叶艳娜2, 潘薛波2, 林灼锋2, 3△
(温州医科大学1附属第二医院,2药学院, 浙江 温州 325035;3暨南大学附属第一医院, 广东 广州 510630)
目的探索细胞外信号调节激酶1/2(Erk1/2)失活对成纤维细胞生长因子21(FGF21)调节机体血糖平稳及改善异常血脂的影响。方法选取8~10周龄雄性db/db小鼠,给予Erk1/2激酶抑制剂U0126(抑制Erk1/2磷酸化,使之失活)处理1周后,再分别给予重组人FGF21蛋白和腺病毒携带的FGF21(Ad-FGF21)处理,观察120 min内及4周后小鼠血糖、血脂及其相关调控基因的变化;同时,从体外细胞培养方面探索其分子机制。结果给予db/db小鼠重组人FGF21蛋白处理120 min能显著下调血糖和甘油三酯水平,但这与U0126处理与否无关。给予Ad-FGF21处理4周能显著改善db/db小鼠异常血糖水平及葡萄糖和胰岛素耐受能力,降低机体脂肪含量,并改善异常血清甘油三酯水平,然而,这些变化仍与U0126处理与否无关。此外,在细胞信号转导的分子机制方面,Ad-FGF21处理能显著上调皮下脂肪组织Erk1/2磷酸化活性及过氧化物酶体增殖物激活受体γ(PPARγ)的表达水平,同时上调机体脂联素(adiponectin)mRNA及蛋白的表达水平(P<0.05),但与U0126处理与否无关。在体外实验方面,FGF21处理能显著激活Erk1/2磷酸化,并上调PPARγ和adiponectin的表达水平;然而,给予U0126处理并不能抑制PPARγ和adiponectin的表达。结论FGF21具有调节机体血糖平稳及改善异常血脂的生物学功能,但Erk1/2失活可能不影响FGF21调节血糖血脂的功能。
成纤维细胞生长因子21; 细胞外信号调节激酶1/2; 胰岛素增敏效应; 糖脂代谢紊乱
糖尿病是常见的代谢性疾病,其发病机制与机体糖脂代谢紊乱和对胰岛素的敏感性下降有关。成纤维细胞生长因子21(fibroblast growth factor 21,FGF21)是一种新型的糖脂代谢调控内分泌因子。我们前期的研究发现,FGF21能够由脂联素(adiponectin)介导对胰岛素起到增敏的作用,从而调节小鼠血糖水平[1]。然而,FGF21通过何种信号途径发挥其降糖降脂作用仍不清楚。细胞外信号调节激酶 1/2(extracellular signal-regulated kinase 1/2,Erk1/2)和丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)通路参与广泛的生理过程。相关研究证明,FGF21能够通过增加Erk1/2磷酸化,降低肝脏HepG2细胞载脂蛋白的表达[2],增加巨噬细胞源性泡沫细胞THP-1胆固醇外流[3],刺激下丘脑神经元表达促肾上腺皮质激素释放素,从而维持血糖稳态[4],预防由高血脂或糖尿病引起的心肌细胞凋亡[5]。由此可知,Erk1/2 MAPK信号通路对FGF21生理作用的发挥起着重要的作用。我们的前期研究表明,FGF21通过过氧化物酶体增殖物激活受体γ(peroxisome proliferator-activated receptor γ,PPARγ)信号通路,上调脂联素的表达和分泌。然而在这条通路里面,FGF21通过何种途径刺激PPARγ并进一步传递信号的过程仍不清楚。本研究通过急性实验和慢性实验验证,在血脂代谢紊乱的db/db肥胖小鼠中,FGF21的降糖和降脂作用是否与Erk1/2 MAPK信号通路有关。
材 料 和 方 法
1 实验动物
8~10周龄SPF 级db/db小鼠购自南方模式动物中心,体重(30.0±2.3) g,许可证号: SCXK(沪)2012-0002。饲养环境为室温20~24 ℃, 相对湿度40%~60%,基础饲料由温州医科大学实验动物中心提供,自由摄食饮水,12 h/12 h交替照明。
2 主要试剂
人重组FGF21蛋白、U0126(Erk1/2激酶抑制剂,抑制Erk1/2磷酸化,使之失活)和HE染色相关试剂购自Sigma-Aldrich;限制性内切酶XbaI和BglII及T4 DNA连接酶购自NEB;pAd-Track-CMV-GFP、Lipofectamine 2000、Trizol、逆转录试剂盒和OneStep RT-PCR试剂盒购自Thermo Fisher Scienti-fic;DMEM液体培养基和胎牛血清购自Gibco;抗鼠Erk1/2、p-Erk1/2、PPARγ、脂联素和F4/80多克隆抗体购自Cell Signaling Technology;FGF21、脂联素和胰岛素试剂盒购自AIS;甘油三酯(triglyceride,TG)检测试剂盒购自北京百奥莱博科技有限公司;血糖仪及血样试纸采用罗氏公司产品;其它生化试剂均为进口分装或国产分析纯。所用引物由Thermo Fisher Scientific根据设计合成,见表1。
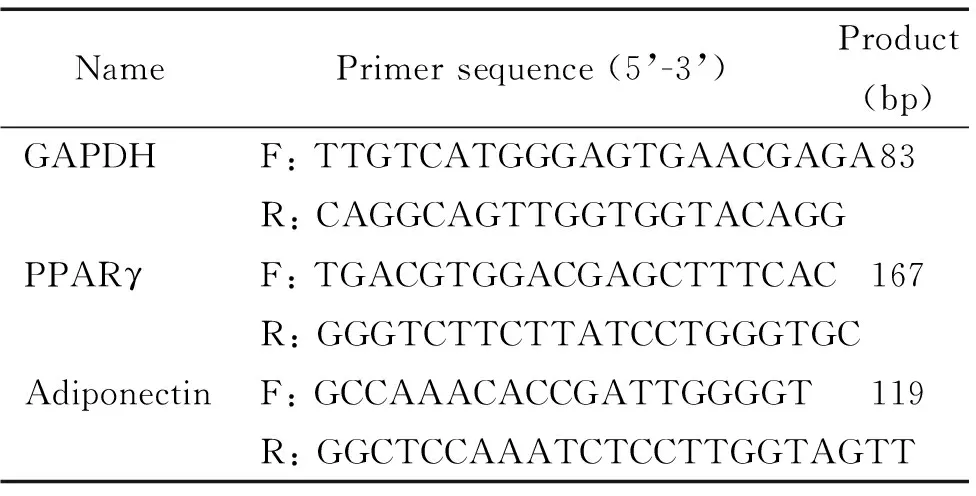
表1 引物序列
F: forward; R: reverse.
3 主要方法
3.1小鼠分组及处理 急性实验:取12只10周龄的雄性db/db小鼠,随机分成实验组(FGF2组)和对照组(control组),每组6只,分别经尾静脉注射0.5 mg/kg的FGF21和等量的PBS,检测0、60和120 min时小鼠血糖、TG和胰岛素水平。另取12只10周龄雄性db/db小鼠,以10 mg·kg-1·d-1剂量的 U0126处理1周以后,分为U0126+FGF21和U0126两组,每组6只,经尾静脉注射FGF21(0.5 mg/kg)和等量的PBS,检测0、60和120 min时小鼠血糖、TG和胰岛素水平。
慢性实验:取8周龄的db/db雄性小鼠24只,随机分成control组、Ad-FGF21组、U0126组和U0126+Ad-FGF21组4组, 给予正常饮食喂养。其中U0126和U0126+Ad-FGF21组给予腹腔注射U0126(10 mg·kg-1·d-1);与此同时,U0126+Ad-FGF21组小鼠通过皮下腹腔注射FGF21重组表达腺病毒(1×108pfu/kg)处理,每2周1次;U0126组注射同等剂量的对照病毒并给予DMSO;Ad-FGF21组小鼠通过皮下腹腔注射FGF21重组表达腺病毒(1×108pfu/kg,每2周1次)并给予DMSO;control组注射同等剂量的对照病毒并给予DMSO(正常对照组)。处理4周以后,处死小鼠,收集器官组织,称重,一部分固定于OCT组织包埋液中,制作冰冻切片,一部分置于-80 ℃冰箱中保存。
3.2葡萄糖耐受试验 实验前一晚用灭菌PBS配制250 g/L的葡萄糖溶液,各组小鼠禁食过夜16 h,第2天称量小鼠体重,用尾部取血的方法测空腹血糖值;按2 g/kg 的剂量腹腔注射葡萄糖,分别检测 0、15、30、60和90 min时的血糖值。
3.3胰岛素耐受试验 实验前称量小鼠体重并置于新笼,新鲜配制胰岛素溶液,按1 mU/kg的剂量腹腔注射胰岛素,测定0、20、40、60和80 min的血糖值。
3.4FGF21重组表达腺病毒的构建包装 由于重组人FGF21蛋白在体外的半衰期非常短,因此,我们采用体外重组腺病毒表达的模式,进行动物实验研究。即克隆人源的FGF21基因至质粒pUC-19上,将经双酶切(XbaI和BglII)的FGF21基因序列插入到穿梭质粒pAd-Track-CMV-GFP中,构建成pAd-Track-FGF21质粒,并送公司测序鉴定有无基因突变。经过测序检测无突变的pAd-Track-FGF21质粒线性化后,转入含腺病毒骨架质粒pAdEasy-1的感受态大肠杆菌BJ5183中,构建腺病毒重组质粒pAdEasy-1-CMV-GFP-FGF21,将该质粒线性化以后转染HEK-293A细胞,获得FGF21重组表达腺病毒,再经过扩增培养后进行纯化,获得高纯度的FGF21重组表达腺病毒。
将包装好的重组腺病毒pAdEasy-1-FGF21和空载重组腺病毒pAdEasy-1(阴性对照)感染HEK-293A细胞,48 h后收集细胞,提取总蛋白,经SDS-PAGE后,转膜,封闭。Western blot结果显示,空载重组腺病毒pAdEasy-1没有条带,而重组腺病毒pAdEasy-1-FGF21可见到与FGF21蛋白标准品一致的位置有条带,说明表达的蛋白正确。
3.5油红O染色 切片干燥后入50%乙醇稍洗,用油红O乙醇染液作用8 min,再用50%乙醇分化,自来水终止分化后苏木素复染核,自来水返蓝,甘油明胶封片。
3.6ELISA检测 按照厂家提供的说明书操作。
3.7Real-time PCR 采用Trizol试剂提取组织总RNA,NanoDrop超微量分光光度计测定总RNA含量。取1.0 μg RNA进行一步法行逆转录,总反应体积20.0 μL。逆转录完成后取1 μL cDNA进行real-time PCR。扩增条件为: 95 ℃初始化15 min; 94 ℃变性1 min, 55 ℃ 1 min, 72 ℃ 1 min, 40个循环; 72 ℃ 10 min。
3.8Western blot 提取小鼠皮下脂肪组织和附睾脂肪组织总蛋白,BCA 法测定总蛋白浓度。10% SDS-PAGE分离,PVDF 膜印迹,10%脱脂奶粉室温下封闭1 h,分别加入抗GAPDH(1∶1 000)、Erk1/2(1∶1 000)、p-Erk1/2(1∶1 000)和抗PPARγ(1∶1 000)抗体,4 ℃孵育过夜。用封闭液稀释相应的经辣根过氧化物酶标记的II 抗(1∶5 000),37 ℃摇床孵育1 h。洗去多余 II 抗,经ECL 发光液发光、X 光胶片压片后显影、定影。分析胶片灰度值,确定样品中目的蛋白相对含量。
3.9小鼠皮下脂肪细胞原代培养 小心剥离小鼠皮下脂肪组织,用灭菌的手术剪剪碎,将组织块放入瓶内,然后加入 1 mL胶原蛋白酶液。37 ℃水浴振荡器孵育约 1 h,直至细胞混合物形成乳脂样浓稠液体;加入 4 mL KRBH 缓冲液(37 ℃),250 μm孔径的滤网过滤, KRBH 缓冲液(37 ℃)洗细胞3次。用DMEM-A 培养液[DMEM,pH 7.4,添加 25 mmol/L 葡萄糖、2 mmol/L 谷氨酰胺、200 nmol/L (R)-N6-(1-甲基-2-苯乙基)腺苷、100 mg/L 庆大霉素和 25 mmol/L HEPES]于37 ℃、5 % CO2条件下培养。
4 统计学处理
用SPSS 16.0统计软件进行分析。数据均采用均数±标准差(mean±SD)表示,多组间数据比较采用Bonferroni校正t检验,以P<0.05为差异有统计学意义。
结 果
1 尾静脉注射FGF21的急性实验及抑制Erk1/2信号通路的影响
与对照组小鼠相比,db/db小鼠给予尾静脉注射FGF21 (0.5 mg/kg)后,在60 min内具有降低小鼠的血糖、TG和胰岛素含量的趋势,在120 min时,db/db小鼠的血糖、TG和胰岛素下调水平进一步增加(P<0.05),见图1。
为了探索Erk1/2信号通路对FGF21调节血糖、TG和胰岛素水平的影响,db/db小鼠给予U0126(10 mg·kg-1·d-1)处理1周以后,尾静脉注射FGF21(0.5 mg/kg)。与正常对照组相比较,单纯U0126处理并不影响db/db小鼠的血糖、血脂和胰岛素水平;与单纯FGF21处理组结果相似,U0126预处理1周,并不影响FGF21下调db/db小鼠的血糖、血脂和胰岛素水平,两者之间的差异无统计学显著性,见图1。
上述结果表明,在尾静脉注射FGF21的急性实验中, 采用U0126抑制Erk1/2信号通路不影响FGF21下调db/db小鼠血糖、甘油三酯和胰岛素的生物学功能。
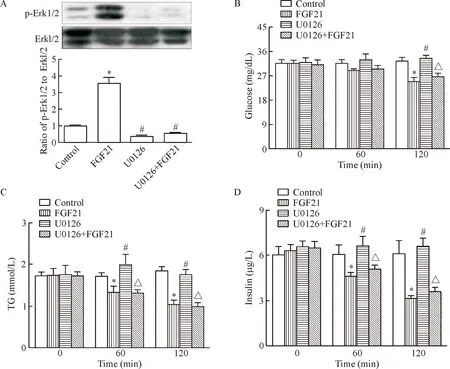
Figure 1. Inhibition of Erk1/2 signaling pathway (A) did not affect the acute effect of FGF21 on blood glucose (B), triglyceride (TG; C) and insulin (D) indb/dbmice. Mean±SD.n=6.*P<0.05vscontrol group;#P<0.05vsFGF21 group;△P<0.05vsU0216 group.
图1抑制Erk1/2信号通路对注射FGF21急性实验后小鼠血糖、甘油三酯和胰岛素的影响
2 腺病毒介导转染FGF21的慢性实验
2.1腺病毒介导转染FGF21改善db/db小鼠异常的血糖水平,改善葡萄糖和胰岛素耐受能力 ELISA检测结果显示,分别与control和U0126组相比,Ad-FGF21和U0126+Ad-FGF21组小鼠的FGF21血清循环水平在注射FGF21重组表达腺病毒第3天后就显著上升,1周后上调约2.5倍,见图2A。此外,FGF21重组表达腺病毒处理后第4周的糖耐受和胰岛素耐受能力得到明显改善,但与U0126处理与否差异无统计学显著性,见图2B、C。与control和U0126组小鼠相比,Ad-FGF21和U0126+Ad-FGF21组注射Ad-FGF21 4周后,小鼠血糖水平随着体内的FGF21和胰岛素循环水平上调而显著下调,但这2组之间血糖和胰岛素下调幅度的差异无统计学显著性,见图3A~C。上述结果说明,转染重组腺病毒表达FGF21能下调db/db小鼠血糖水平,改善db/db小鼠的糖耐受及胰岛素耐受能力,但这些功能与Erk1/2信号通路失活并无关系。
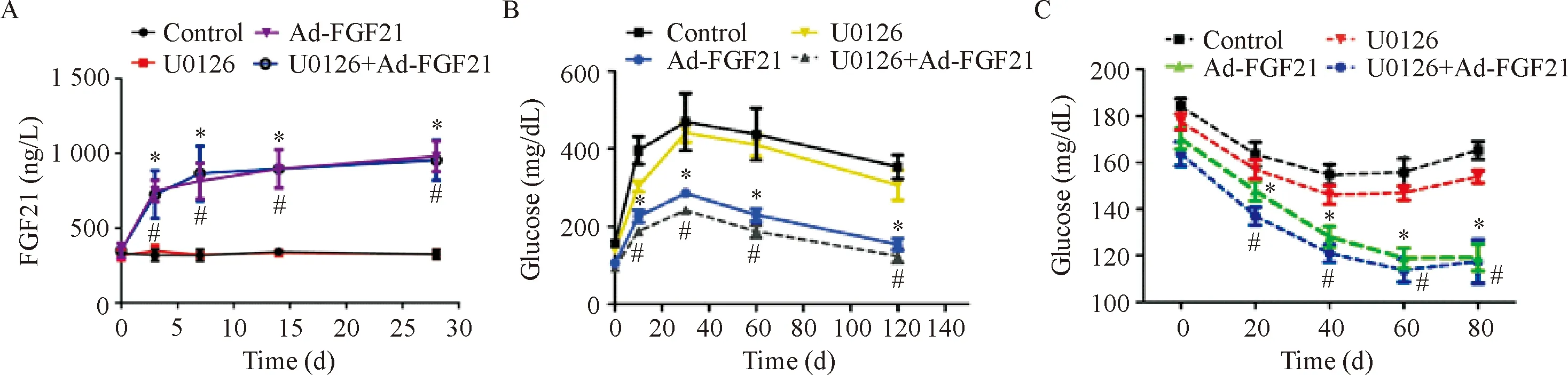
Figure 2. Inhibition of Erk1/2 signaling pathway did not affect the effect of FGF21 on the glucose tolerance and insulin resistance in mice. A: circulating FGF21 levels during 4 weeks of Ad-FGF21 administration; B and C: glucose tolerance and insulin tolerance tests at the 4th week of Ad-FGF21 treatment. Mean±SD.n=6.*P<0.05vscontrol group;#P<0.05vsU0216 group.
图2Ad-FGF21处理4周血清FGF21循环水平的变化及第4周葡萄糖耐受和胰岛素耐受状况
2.2腺病毒介导转染FGF21降低db/db小鼠的异常甘油三酯水平 分别与control和U0126组小鼠相比,Ad-FGF21和U0126+Ad-FGF21组注射Ad-FGF21 4周后,小鼠的甘油三酯水平随着体内的FGF21循环水平上调而显著下调(P<0.05),但这2组间甘油三酯水平下调幅度的差异无统计学显著性,见图3D。上述结果表明,腺病毒介导表达的FGF21具有降低甘油三酯的功能,但与Erk1/2失活无关。
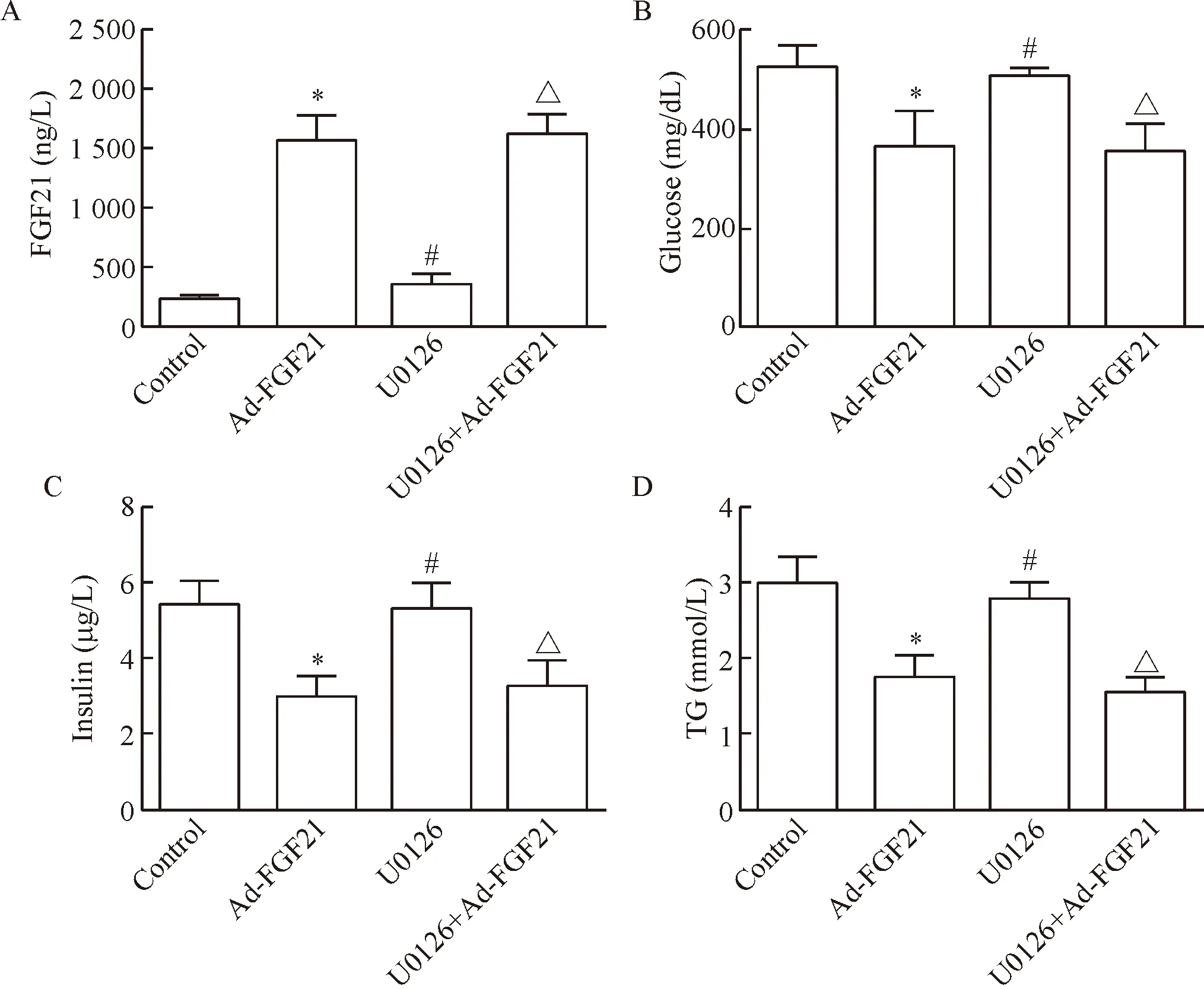
Figure 3. Inhibition of Erk1/2 signaling pathway did not affect the effect of FGF21 on glucose, insulin and triglyceride (TG) indb/dbmice. A: cirulating level of FGF21 at the 4th week; B: blood glucose level; C: serum insulin level; D: serum TG level. Mean±SD.n=6.*P<0.05vscontrol group;#P<0.05vsAd-FGF21 group;△P<0.05vsU0126 group.
图3Ad-FGF21处理4周后小鼠血清FGF21、葡萄糖、胰岛素及甘油三酯的变化
2.3腺病毒介导转染FGF21对db/db小鼠各主要器官重量和组织形态学的影响 与正常对照组相比较,db/db小鼠单独注射U0126后,小鼠各主要脏器占体重的比值没有显著变化;而单独注射FGF21则显著下调褐色及白色脂肪组织与小鼠体重的比值(P<0.05),但U0126处理对FGF21降低脂肪/体重的比值并无显著的影响,见图4。此外,组织形态学分析结果也表明,FGF21处理后,脂肪细胞的面积显著增加,巨噬细胞浸润明显减少,脂联素表达明显增加(P<0.05),而U0126处理对FGF21引发的这些生物学效应并无明显的影响,见图5。上述结果表明,FGF21具有降低机体脂肪含量的生物学功能,但该效应与Erk1/2信号通路失活无关。
2.4腺病毒介导转染FGF21显著上调皮下脂肪组织Erk1/2的磷酸化及PPARγ的表达水平 与正常对照组相比,给予Ad-FGF21处理4周后,小鼠皮下脂肪中Erk1/2磷酸化活性和PPARγ表达均显著上调(P<0.05);然而,U0126处理后,小鼠皮下脂肪中Erk1/2磷酸化活性和PPARγ表达均显著降低(P<0.05),同时给予Ad-FGF21处理后,小鼠皮下脂肪中Erk1/2磷酸化活性并没有增加,但是PPARγ表达水平显著增加,见图6。
此外,我们发现,给予Ad-FGF21及U0126处理后,小鼠附睾脂肪中Erk1/2磷酸化活性和PPARγ表达的变化与皮下脂肪组织相似,见图7。这些结果表明,在db/db小鼠脂肪组织中,FGF21处理引发的PPARγ表达上调可能与Erk1/2信号失活无关。
2.5腺病毒介导转染FGF21对db/db小鼠adiponectin表达的影响 与正常对照组相比,给予Ad-FGF21处理4周后,db/db小鼠脂肪组织中adiponectin的mRNA和血清循环水平均显著上调(P<0.05);而单独给予U0126处理4周并不影响小鼠皮下脂肪组织中adiponectin的mRNA表达及血清循环水平;然而,同时给予U0126和FGF21重组腺病毒FGF21处理后,小鼠脂肪组织中adiponectin的mRNA表达及血清循环水平均显著上调,见图8。这些结果表明FGF21引发的脂联素表达与不受Erk1/2信号调控。
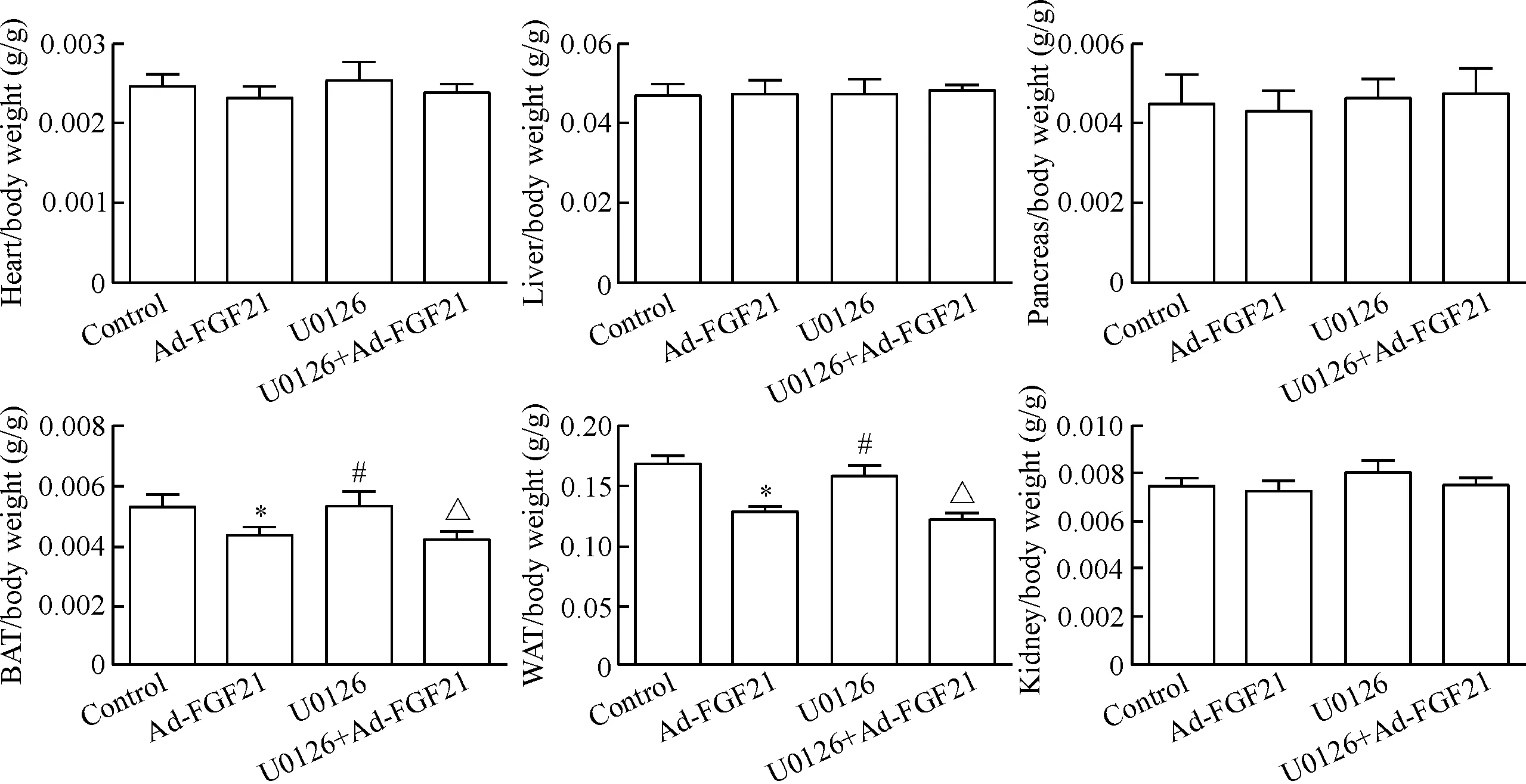
Figure 4. Inactivation of Erk1/2 did affect the effect of FGF21 on body parameters indb/dbmice. BAT: brown adipose tissue; WAT: white adipose tissue. Mean±SD.n=6.*P<0.05vscontrol group;#P<0.05vsAd-FGF21 group;△P<0.05vsU0126 group.
图4Ad-FGF21处理后小鼠各主要器官重量的变化状况

Figure 5. Representative images and quantitative analysis of the morphology of adipose tissues, macrophage accumulation and adiponectin expression indb/dbmice treated with Ad-FGF21, U0126 or Ad-FGF21+U0126. A: HE staining, scale bar=100 μm; B: F4/80 macrophage accumulation, scale bar=50 μm; C: adiponectin expression, scale bar=50 μm.*P<0.05vscontrol group;#P<0.05vsAd-FGF21 group;△P<0.05vsU0126 group.
图5Ad-FGF21及U0126处理后小鼠脂肪组织形态学、巨噬细胞浸润及脂联素表达状况
3 Erk1/2 信号通路失活对 FGF21 抗糖尿病病变的影响
3.1小鼠原代脂肪细胞分离培养及油红O染色鉴定 结果显示,原代分离培养的脂肪细胞中有80%~90%左右是脂肪细胞,见图9。
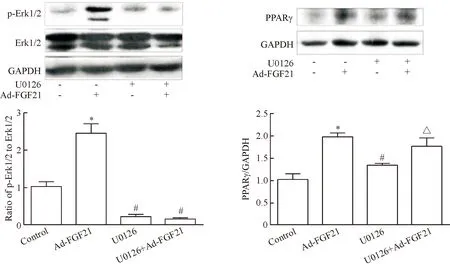
Figure 6. Inhibition of Erk1/2 signaling pathway did not affect FGF21-induced subcutaneous adipose PPARγ expression indb/dbmice. Mean±SD.n=6.*P<0.05vscontrol group;#P<0.05vsAd-FGF21 group;△P<0.05vsU0126 group.
图6Erk1/2对FGF21调节小鼠皮下脂肪组织PPARγ表达的影响
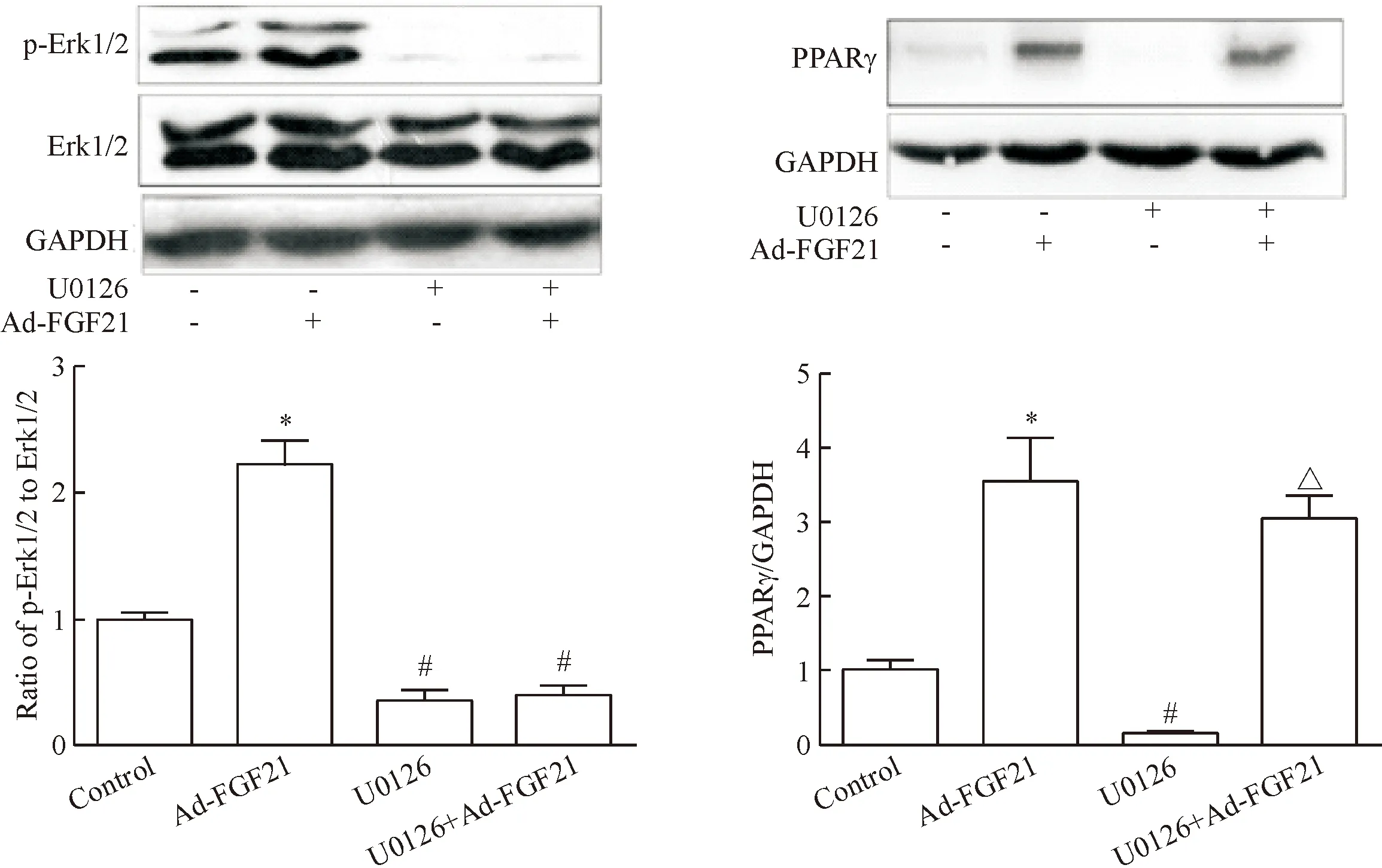
Figure 7. Inactivation of Erk1/2 did not affect FGF21-induced epididymal adipose PPARγ expression indb/dbmice. Mean±SD.n=6.*P<0.05vscontrol group;#P<0.05vsAd-FGF21 group;△P<0.05vsU0126 group.
图7Erk1/2对FGF21调节小鼠附睾脂肪组织PPARγ表达的影响
3.2抑制Erk1/2信号通路对原代培养小鼠皮下脂肪细胞PPARγ表达的影响 前期研究发现,重组人FGF21蛋白处理后可上调Erk1/2活性和PPARγ的活性。我们的结果显示,与对照组相比较,给予U0126处理后,Erk1/2磷酸化活性被显著抑制,而PPARγ的活性保持不变;同时给予U0126和重组人FGF21蛋白处理后,PPARγ的活性则明显上调,见图10。与此同时,给予U0126抑制Erk1/2活性时,原代培养小鼠脂肪细胞中脂联素的表达并没有显著的变化,而给予U0126和重组人FGF21蛋白处理后,原代培养的小鼠脂肪细胞中PPARγ及adiponectin的mRNA水平均显著上调,与此同时,培养基中的adiponectin蛋白水平也显著上调,见图11。这些结果提示,脂肪细胞中PPARγ及adiponectin的表达不受Erk1/2信号通路的调控。
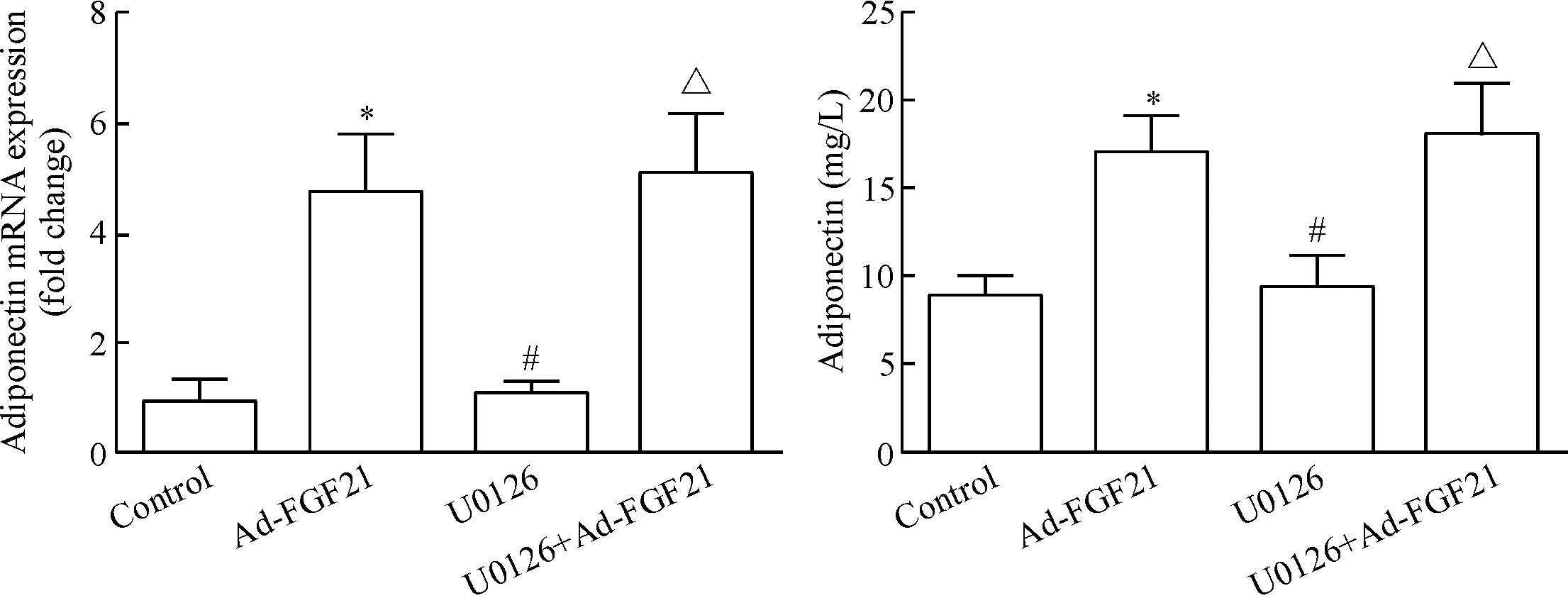
Figure 8. Inhibition of Erk1/2 signaling pathway did not affect FGF21-induced adiponection expression indb/dbmice. A: the mRNA expression level of adiponectin in subcutaneous adipose tissue; B: circulating adiponectin level in the mice. Mean±SD.n=6.*P<0.05vscontrol group;#P<0.05vsAd-FGF21 group;△P<0.05vsU0216 group.
图8Ad-FGF21处理后小鼠皮下脂肪组织脂联素mRNA及循环水平变化状况

Figure 9. Oil red O staining of primary adipocytes before and after differentiation. Scale bar=100 μm.
图9原代培养脂肪细胞分化前后油红O染色结果

Figure 10. Inhibition of Erk1/2 signaling pathway did not affect FGF21-induced PPARγ expression in primary adipocytes of mice. Mean±SD.n=6.*P<0.05vscontrol group;#P<0.05vsFGF21 group;△P<0.05vsU0216 group.
图10Erk1/2对原代培养小鼠皮下脂肪细胞PPARγ表达的影响

Figure 11. Inhibition of Erk1/2 signaling pathway did not affect FGF21-induced expression of PPARγ and adiponectin in primary cultured subcutaneous adipocytes of mice. Mean±SD.n=6.*P<0.05vscontrol group;#P<0.05vsFGF21 group;△P<0.05vsU0216 group.
图11Erk1/2对原代培养小鼠皮下脂肪细胞PPARγ及adiponectin表达的影响
讨 论
FGF21是一个约210个氨基酸序列组成的,主要由肝脏细胞表达的分泌蛋白[6-8]。不同于传统的其它FGF家族成员,FGF21主要以内分泌因子的角色参与机体的物质代谢调控作用[6, 9]。最近大量动物实验研究表明,FGF21是一个重要的调节糖脂代谢的激素,并在治疗肥胖及糖尿病相关疾病中有着广泛的潜力[9-11]。我们的早期研究发现[1],FGF21在调控机体血糖代谢平稳、胰岛素敏感性和脂质代谢与脂联素的表达分泌存在密切的关系。在体外培养的脂肪细胞中,FGF21通过PPARγ信号通路,上调脂联素的表达和分泌;在动物实验方面,重组FGF21显著提高小鼠的循环脂联素水平;而在FGF21基因敲除小鼠中,血清脂联素水平显著降低。更重要的是,在脂联素基因缺失的糖尿病小鼠中,重组FGF21的降血糖和降血脂效应均显著低于对照组。此外,重组FGF21对脂联素缺失的糖尿病小鼠的调节能量代谢的效应也显著降低。这些结果表明,FGF21的抗糖尿病特性可能是通过某些信号分子调控PPARγ的活性,然后进一步刺激脂联素的表达与分泌,最终达到发挥其降血糖、提高胰岛素敏感性的目标。然而,FGF21是如何调控PPARγ,发挥其抗糖尿病的生物功能?这有待于深入探索。
MAPK家族是细胞内的一类丝氨酸/苏氨酸蛋白激酶,主要包括生长因子引发的Erk1/2以及压力应激引发的p38 MAPK和JNK等家族成员[12-13]。在肥胖引发的相关疾病中,MAPK直接参与了机体内的肝脂代谢调控,并参与机体胰岛素抵抗的调控。p38 MAPK 通过磷酸化核受体PPARα而促进脂肪酸的β氧化[14-16]。在肥胖及其引发的糖尿病大鼠模型中,JNK1 MAPK的活性伴随着胰岛素抵抗的增加而显著上升;相反,抑制JNK1 MAPK的活性能显著缓解胰岛素抵抗、增加胰岛素敏感性[17]。此外,JNK1 MAPK与肝脏脂肪代谢密切相关[18]。有意思的是,JNK1 MAPK活性与PPARγ活性及其表达状况也存在密切的关系, 抑制JNK活性显著上调PPARγ的表达[19]。在palmitate引发的胰岛素抵抗条件下,FGF21能显著抑制JNK1 MAPK的活性[20]。由此可见,在肥胖及糖尿病发病过程中,FGF21、JNK1、Erk1/2 MAPK与PPARγ均参与了疾病的病变过程,并且在相互之间还存在着相互调控的密切关系。然而,在FGF21调节PPARγ过程中,是否也通过调控或影响JNK1和Erk1/2 MAPK通路,进而激活下游相关靶基因的活性,最终发挥其抗糖尿病效应,这有待于深入探索。
本研究发现,无论是急性实验还是慢性实验,FGF21的降糖降脂作用并不随着Erk1/2 MAPK通路关闭而丧失。葡萄糖耐受试验和胰岛素耐受试验的结果表明,Erk1/2 MAPK通路的关闭并不会影响FGF21对db/db小鼠葡萄糖和胰岛素耐受能力的改善。此外,比较U0126抑制Erk1/2 MAPK通路与否,FGF21对db/db小鼠血糖、胰岛素水平和血清TG水平的下调作用,发现二者并没有显著的差异。同时,我们观察了Erk1/2 MAPK通路对FGF21-PPARγ-adiponectin通路的影响。发现无论是血清脂联素水平还是脂肪组织中的脂联素水平都不受Erk1/2 MAPK通路的影响。体外实验和体内实验的结果表明脂肪细胞/脂肪组织中PPARγ的mRNA表达水平和蛋白水平亦不受Erk1/2 MAPK通路的影响。
综上所述,我们的研究表明,Erk1/2失活对FGF21降血糖及降甘油三酯的功能与Erk1/2活性并无直接的明显的作用。这些结果提示,Erk1/2可能不参与FGF21调节脂肪细胞下游信号分子PPARγ/adiponectin,进而发挥其降血糖及调节甘油三酯等脂质代谢的生物功能。
[1] Lin Z, Tian H, Lam KS, et al. Adiponectin mediates the metabolic effects of FGF21 on glucose homeostasis and insulin sensitivity in mice[J]. Cell Metab, 2013, 17(5): 779-789.
[2] Lin X, Li G, He X, et al. FGF21 inhibits apolipoprotein(a) expression in HepG2 cells via the FGFR1-ERK1/2-Elk-1 pathway[J]. Mol Cell Biochem, 2014, 393(1-2):33-42.
[3] Lin XL, He XL, Zeng JF, et al. FGF21 increases cholesterol efflux by upregulating ABCA1 through the ERK1/2-PPARγ-LXRα pathway in THP1 macrophage-derived foam cells[J]. DNA Cell Biol, 2014, 33(8):514-521.
[4] Liang Q, Zhong L, Zhang J, et al. FGF21 maintains glucose homeostasis by mediating the cross talk between liver and brain during prolonged fasting[J]. Diabetes, 2014, 63(12):4064-4075.
[5] Zhang C, Huang Z, Gu J, et al. Fibroblast growth factor 21 protects the heart from apoptosis in a diabetic mouse model via extracellular signal-regulated kinase 1/2-dependent signalling pathway[J]. Diabetologia, 2015, 58(8):1937-1948.
[6] Nishimura T, Nakatake Y, Konishi M, et al. Identification of a novel FGF, FGF-21, preferentially expressed in the liver[J]. Biochim Biophys Acta, 2000, 1492(1): 203-206.
[7] Reitman ML. FGF21: A missing link in the biology of fasting[J]. Cell Metab, 2007, 5(6):405-407.
[8] Kharitonenkov A, Shiyanova TL, Koester A, et al. FGF-21 as a novel metabolic regulator[J]. J Clin Invest, 2005, 115(6):1627-1635.
[9] Kharitonenkov A, Wroblewski VJ, Koester A, et al. The metabolic state of diabetic monkeys is regulated by fibroblast growth factor-21[J]. Endocrinology, 2007, 148(2): 774-781.
[10] Kharitonenkov A, Shanafelt AB. Fibroblast growth factor-21 as a therapeutic agent for metabolic diseases[J]. BioDrugs, 2008, 22(1):37-44.
[11] Inagaki T, Dutchak P, Zhao G, et al. Endocrine regulation of the fasting response by PPAR α-mediated induction of fibroblast growth factor 21[J]. Cell Metab, 2007, 5(6):415-425.
[12] Berglund ED, Li CY, Bina HA, et al. Fibroblast growth factor 21 controls glycemia via regulation of hepatic glucose flux and insulin sensitivity[J]. Endocrinology, 2009, 150(9):4084-4093.
[13] Dutchak PA, Katafuchi T, Bookout AL, et al. Fibroblast growth factor-21 regulates PPARγ activity and the antidiabetic actions of hiazolidinediones[J]. Cell, 2012, 148(3):556-567.
[14] Raman M, Chen W, Cobb MH. Differential regulation and properties of MAPKs[J]. Oncogene, 2007, 26(22):3100-3112.
[15] Weston CR, Davis RJ. The JNK signal transduction pathway[J]. Curr Opin Cell Biol, 2007,19(2):142-149.
[16] 李素娟, 金可可, 赵亚萍, 等. 氧化应激激活JNK-MAPK参与波动性高血糖诱导的大鼠肝细胞损伤[J]. 中国病理生理杂志, 2015, 31(7):1259-1265.
[17] Barger PM, Browning AC, Garner AN, et al. p38 mitogen-activated protein kinase activates peroxisome proliferator-activated receptor α: a potential role in the cardiac metabolic stress response[J]. J Biol Chem, 2001, 276(48):44495-44501.
[18] Xiong Y, Collins QF, An J, et al. p38 mitogen-activated protein kinase plays an inhibitory role in hepatic lipogenesis[J]. J Biol Chem, 2007, 282(7):4975-4982.
[19] Hirosumi J, Tuncman G, Chang L, et al. A central role for JNK in obesity and insulin resistance[J]. Nature, 2002, 420(6913):333-336.
[20] Schattenberg JM, Singh R, Wang Y, et al. JNK1 but not JNK2 promotes the development of steatohepatitis in mice[J]. Hepatology, 2006, 43(1):163-172.
Pharmaceutical inactivation of Erk1/2 does not affect function of FGF21 to regulate glucose and lipid metabolic hemostasis
WU Chao-ming1, ZHENG Ju-jia2, PAN Ying-ying2, YE Yan-na2, PAN Xue-bo2, LIN Zhuo-feng2, 3
(1TheSecondAffiliatedHospital,2SchoolofPharmaceuticalScience,WenzhouMedicalUniversity,Wenzhou325035,China;3TheFirstAffiliatedHospitalofJinanUniversity,Guangzhou510630,China.E-mail:zflwf@126.com)
AIM: To investigate whether inactivation of extracellular signal-regulated kinase 1/2 (Erk1/2) will affect the function of fibroblast growth factor 21 (FGF21) to regulate glucose and lipid metabolism.METHODSMaledb/dbmice (8 weeks old) were treated with U0126 (an inhibitor of Erk1/2 kinase) for 1 week, and then treated with recombinant human FGF21 protein and adenovirus-mediated FGF21 (Ad-FGF21). The profile changes of blood glucose and blood lipid were evaluated at 120 min or 4 weeks after FGF21 administration. Meanwhile, the molecular mechanism was explored byinvitrostudy.RESULTSTreatment ofdb/dbmice with recombinant human FGF21 protein significantly reduced blood glucose and triglyceride levels at 120 min after FGF21 administration, but these changes were comparable in U0126-treated mice. Furthermore, abnormal glucose and triglyceride levels, and glucose and insulin tolerance were strongly improved indb/dbmice as accompanied with decreasing body fat content after 4 weeks of ad-FGF21 administration. Interestingly, treatment with or without U0126 did not influence these effects of FGF21. Mechanically, treatment with Ad-FGF21 significantly upregulated the protein levels of p-Erk1/2 and peroxisome proliferator-activated receptor γ (PPARγ) as well as the expression of adiponectin at mRNA and protein levels in adipose tissues. However, treatment with or without U0126 did not change the profiles. On the other hand, invitroexperiments also indicated that treatment of adipocytes with recombinant human FGF21 protein significantly activated Erk1/2 phosphorylation, and upregulated the expression levels of PPARγ and adiponectin (P<0.05). However, pre-administration of U0126 did not affect the profiles.CONCLUSIONPharmaceutical inactivation of Erk1/2 by U0216 does not affect the biological function of FGF21 to regulate blood glucose balance and improve abnormal blood lipidsinvivo.
Fibroblast growth factor 21; Extracellular signal-regulated kinase 1/2; Insulin-sensitizing effect; Glucose and lipid metabolism disorder
1000- 4718(2017)12- 2212- 10
2017- 06- 30
2017- 11- 16
国家自然科学基金资助项目(No. 81471075);浙江省自然科学基金资助项目(No. LY15H070003)
△通讯作者 Tel: 0577-86699350; E-mail: zflwf@126.com
R329.21; R587.1
A
10.3969/j.issn.1000- 4718.2017.12.016
(责任编辑: 陈妙玲, 罗 森)

