EphA2调控结直肠癌细胞耐药的初步研究
李 霞, 马 超, 孔令伟, 李 慧, 许聪聪, 李军峰
(1山东省枣庄矿业集团枣庄医院内六科, 山东 枣庄 277100; 2山东大学齐鲁医院病理科, 山东 济南 250012)
EphA2调控结直肠癌细胞耐药的初步研究
李 霞1, 马 超2△, 孔令伟1, 李 慧1, 许聪聪1, 李军峰1
(1山东省枣庄矿业集团枣庄医院内六科, 山东 枣庄 277100;2山东大学齐鲁医院病理科, 山东 济南 250012)
目的探究Eph受体A2(EphA2)在结直肠癌细胞化疗耐药中的作用及相关机制。方法Western blot及real-time PCR检测人结肠癌细胞株LoVo及结肠癌耐药细胞株LoVo/5-FU中EphA2的表达情况。转染EphA2 siRNA干扰结肠癌耐药细胞株LoVo/5-FU中EphA2的表达,CCK-8法检测细胞对化疗药物的敏感性,划痕实验及Transwell实验检测细胞迁移及侵袭能力的变化,Western blot检测上皮-间充质转化(EMT)及相关信号通路分子的蛋白水平。结果耐药细胞株LoVo/5-FU中EphA2的mRNA及蛋白表达水平均明显高于亲本细胞株(P<0.05);并且在亲本细胞株LoVo中,EphA2的蛋白表达水平随着5-FU浓度的增加有升高趋势。沉默EphA2可降低结肠癌耐药细胞株LoVo/5-FU的细胞活力,增加其对化疗药物的敏感性,并抑制细胞的侵袭迁移;同时上调细胞中上皮细胞标志物E-cadherin和β-catenin的表达并下调间充质细胞标志物N-cadherin和vimentin的表达,可抑制结肠癌耐药细胞株LoVo/5-FU的EMT进程。此外,干扰EphA2的表达之后,Notch和Snail的表达也明显降低。结论沉默EphA2可部分恢复结肠癌耐药细胞株LoVo/5-FU对化疗药物的敏感性,其机制可能与抑制细胞侵袭和迁移、同时通过Notch/Snail信号通路影响细胞的EMT进程有关。
Eph受体A2; 耐药性; 上皮-间充质转化; 结直肠癌; Notch/Snail信号通路
结直肠癌是消化系统常见肿瘤之一,目前主要的治疗手段依然是放疗、化疗及手术治疗。以FOLFIRI和FOLFOX为标准的一线化疗方案依然是进展期结直肠癌的主要治疗手段,但是化疗药物的长期应用会引起肿瘤细胞对其产生耐受性,进而影响治疗效果及患者生存率[1-2]。研究表明,肿瘤细胞的耐药性包括原发性和获得性2种,但更为常见的是获得性化疗耐药产生,通常是由于化疗药物的长期应用而诱导产生,且尤为棘手的是在这种情况下,肿瘤细胞会对其它抗肿瘤药物产生交叉耐药。因此,有关结直肠癌化疗耐药的研究具有重要的临床意义。
人Eph受体A2(Eph receptor A2,EphA2)基因定位于1p36.1,编码一个含有976个氨基酸残基的多肽,隶属于Eph受体家族,而该家族又是受体酪氨酸激酶(receptor tyrosine kinases,RTKs)中最大的一个亚族,广泛参与胚胎发育、炎症反应和血管形成等病理生理过程[3-4]。近来,EphA2在肿瘤发生发展中的作用备受研究者关注,大量研究发现,在包括胃癌[5]、直肠癌[6]、乳腺癌[7]和恶性胶质瘤[8]等多种实体肿瘤中都出现Eph受体家族的异常表达;同时有研究表明,EphA2可促进结直肠癌的侵袭和迁移,进而影响患者预后[9-10],但是EphA2在结直肠癌化疗耐药中的作用并没有明确的阐释。本文通过EphA2 siRNA干扰技术,系统研究了EphA2在结直肠癌化疗耐药中的作用及其相关机制。
材 料 和 方 法
1 实验材料
胎牛血清、RPMI-1640培养基及Opti-MEM培养基均购自HyClone;抗EphA2、上皮钙黏素(E-cadhe-rin)、 β-联蛋白(β-catenin)、神经钙黏素(N-cadherin)、波形蛋白(vimentin)、 Notch、Snail及β-actin抗体购自Abcam;CCK-8细胞活力及增殖检测试剂盒购自广州奕源生物技术有限公司; EphA2 siRNA及其阴性对照siRNA购自Santa Cruz;干扰试剂和SYBR Green I Real-Time PCR Kit购自上海吉玛制药技术有限公司。倒置相差显微镜购自Olympus;7500型实时荧光定量PCR仪购自ABI;Transwell小室购自Corning;Matrigel购自BD。
2 方法
2.1细胞培养 结肠癌细胞株LoVo和结肠癌耐药细胞株LoVo/5-FU购自中科院上海细胞库,为本实验室自行传代冻存。培养基选用含10%胎牛血清的RPMI-1640完全培养基,将细胞置于37 ℃、饱和湿度、5% CO2的培养箱中进行培养。每2 d换液1次,细胞生长至90%融合时可用0.25%胰酶消化后按1∶3的比例传代。
2.2Real-time PCR检测mRNA的表达 细胞总RNA的抽提参考Trizol一步法。用紫外吸收法测定mRNA的纯度和浓度后,取2 μg总RNA在逆转录酶的作用下逆转录至终体积为20 μL,而后采用SYBR Green实时荧光PCR的方法检测mRNA的表达。EphA2的正向引物为5’-GAGAAGGATGGCGAGTTCAG-3’,反向引物为5’-TCAGACACCTTGCAGACCAG-3’;β-actin作为内参照,正向引物为5’-ACAGAGCCTCGCCTTTGCCGATC-3’,反向引物为5’-ATCCTTCTGACCCATGCCCACCA-3’。 PCR反应体系包括1 μL逆转录产物、10 μL SYBR Green PCR Master Mix和100 nmol/L正反向引物,总体积为25 μL。循环条件为:95 ℃孵育5 min; 95 ℃ 10 s, 60 ℃ 30 s,40个循环。采用2-ΔΔCt法分析mRNA相对表达量。
2.3CCK-8法检测细胞对化疗药物的敏感性 采用CCK-8法检测化疗药物对结肠癌细胞的半数抑制浓度(IC50)。取对数生长期的细胞以每孔1×104的密度接种于96孔板中,待细胞长至90%融合进行同步化处理,并加入不同浓度的5-氟尿嘧啶(5-fluorouracil,5-FU;终浓度分别为6.25、12.5、25、50、100、200和400 mg/L)、奥沙利铂(oxaliplatin;终浓度分别为1、2、4、8、16、32和64 mg/L)或伊立替康(irinotecan;终浓度分别为1、2、4、8、16、32和64 mg/L),继续培养46 h,每孔加入100 μL CCK-8试剂并置于细胞培养箱中继续孵育2 h,测定450 nm波长处的吸光度(A)值,据此计算细胞的生存率及各种药物的IC50。
2.4siRNA转染 取对数期细胞,常规消化后接种于6孔板中,待细胞生长至60%~80%融合后同步化处理12 h,然后进行siRNA转染。实验分为空白对照(control)组、阴性对照(negative control siRNA,Neg)组和siRNA转染(EphA2 siRNA,siRNA)组。将阴性对照siRNA和EphA2 siRNA溶解于Opti-MEM培养基中,室温孵育5 min,同时另取Lipofectamine 2000加入Opti-MEM培养基中室温孵育5 min,然后将两者轻柔混合,室温静置20 min。并将上述转染混合物加入各组细胞,置于细胞培养箱中培养6 h,将培养基更换为正常细胞培养基继续培养48 h。提取细胞蛋白测定转染效率并进行后续实验分析。
2.5划痕实验 取对数生长期的细胞接种于6孔板中,待细胞生长至90%融合时,用10 μL的枪头(预先消毒)按垂直方向划痕,而后用PBS轻轻冲洗2遍后,加入新的完全培养基,置于倒置相差显微镜下观察细胞的划痕修复过程。观察时长24 h,其中每隔10 min进行拍照记录。
2.6Transwell实验 处于对数生长期的细胞经胰酶消化后,500×g离心收集细胞,而后加入新鲜的培养基重悬细胞,调整细胞密度为2×108/L,将细胞接种至Transwell小室的上室中,Transwell小室的下室内则加入完全培养基。处理完成后将培养板置于细胞培养箱中继续培养6 h。取出培养板并用PBS冲洗3次,每次5 min,然后用棉签擦除上室表面的细胞。经体积分数为90%的乙醇固定后加0.1%的结晶紫染色,PBS再次漂洗细胞,最后置于倒置相差显微镜下观察并计数染色细胞的数目(每组细胞计3个视野并取其均值)。
2.7Western blot分析 冰上裂解并离心收集各组细胞蛋白样品,采用BCA蛋白定量试剂盒进行蛋白定量后,调整各组上样量为60 μg并加入4倍体积的上样缓冲液,98 ℃水浴变性5 min。8% SDS-PAGE至溴酚蓝跑出凝胶,将凝胶中的蛋白电转至PVDF膜(约90 min)。依照试剂盒说明加5%脱脂牛奶室温封闭1 h,加入抗EphA2、E-cadherin、β-catenin、 N-cadherin、 vimentin、 Notch、Snail及β-actin单克隆抗体,4 ℃孵育过夜;复温后,TBST洗涤3次,每次5 min。分别加入抗HRP标记的 II 抗,室温孵育1.5 h,TBST洗涤3次,每次10 min。于暗室中将PVDF膜的蛋白面浸入HRP-ECL发光液中激发荧光,压X胶片并冲洗胶片。使用ImageJ进行灰度分析以示蛋白表达情况。
3 统计学处理
采用SPSS 13.0标准版统计软件包行数据分析,所有数据以均数±标准差(mean±SD)表示。两组计量资料的组间差异采用t检验,多组计量资料行单因素方差分析,两两比较采用Bonferroni校正的t检验。 计数资料的比较采用χ2检验。以P<0.05为差异有统计学意义。
结 果
1 EphA2的表达与结肠癌细胞化疗耐药之间的关系
我们首先检测了结肠癌耐药细胞株LoVo/5-FU及其亲本细胞株LoVo对不同化疗药物的IC50,结果证明与亲本株LoVo比较,LoVo/5-FU对5-FU的耐药性明显增强(P<0.05),而且对奥沙利铂和伊立替康出现了交叉耐药,见表1。我们同时还检测了这2株细胞中EphA2的mRNA及蛋白表达情况,结果显示,耐药细胞株LoVo/5-FU中EphA2的mRNA及蛋白表达水平均明显高于亲本细胞株;并且在亲本细胞株LoVo中,EphA2的蛋白表达水平随着5-FU浓度的增加呈增加趋势(P<0.05),见图1。该结果提示EphA2的表达可能与结肠癌化疗耐药之间存在一定的正相关关系。
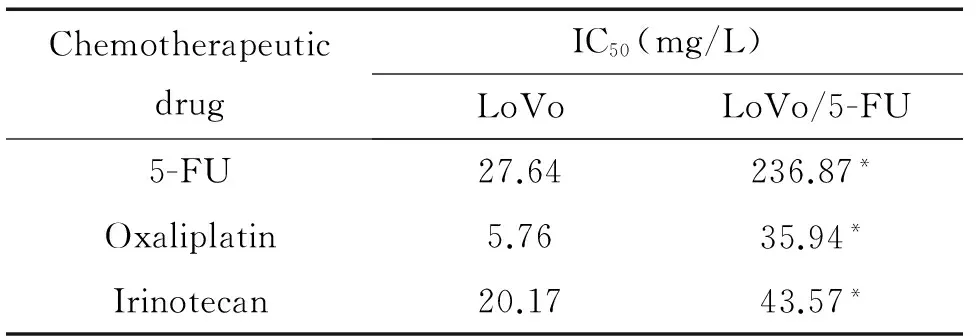
表1 化疗药物对LoVo和LoVo/5-FU细胞的IC50
*P<0.05vsLoVo.
2 干扰EphA2的表达对耐药细胞株LoVo/5-FU化疗敏感性的影响
为进一步证明EphA2的表达与结肠癌化疗耐药之间的相互关系,我们在耐药细胞株LoVo/5-FU中转染siRNA,干扰EphA2的表达,并检测其化疗敏感性的变化。在LoVo/5-FU中转染EphA2 siRNA后,EphA2的表达明显下调(P<0.05),见图2A;同时CCK-8的结果显示,在LoVo/5-FU细胞中干扰EphA2的表达可显著提高细胞对5-FU的敏感性,差异具有统计学意义(P<0.05),见图2B。
3 干扰EphA2的表达对细胞生长的影响
我们观察了干扰EphA2对细胞生长能力的影响,结果显示,在LoVo/5-FU细胞中干扰EphA2的表达可显著抑制细胞活力(P<0.05),见图3A。细胞生存状况分析显示,干扰EphA2后细胞数量无明显变化,但在48 h及72 h时,低倍显微镜(×100)下可明显看出部分细胞贴壁附着能力下降,高倍镜(×400)下观察可见72 h细胞形态由长梭形转变为不规则形态,并有伪足伸出,部分细胞胞浆中可见颗粒增多,见图3B。以上结果提示干扰EphA2可抑制细胞生长。
4 干扰EphA2的表达对细胞迁移的影响
本实验进一步检测了干扰EphA2对细胞迁移能力的影响。划痕实验结果显示,在LoVo/5-FU细胞中干扰EphA2的表达可显著抑制细胞损伤修复能力(P<0.05),见图4A。Transwell实验结果显示,干扰EphA2的表达后细胞的迁移能力明显降低(P<0.05),见图4B。上述结果提示干扰EphA2可抑制细胞迁移。
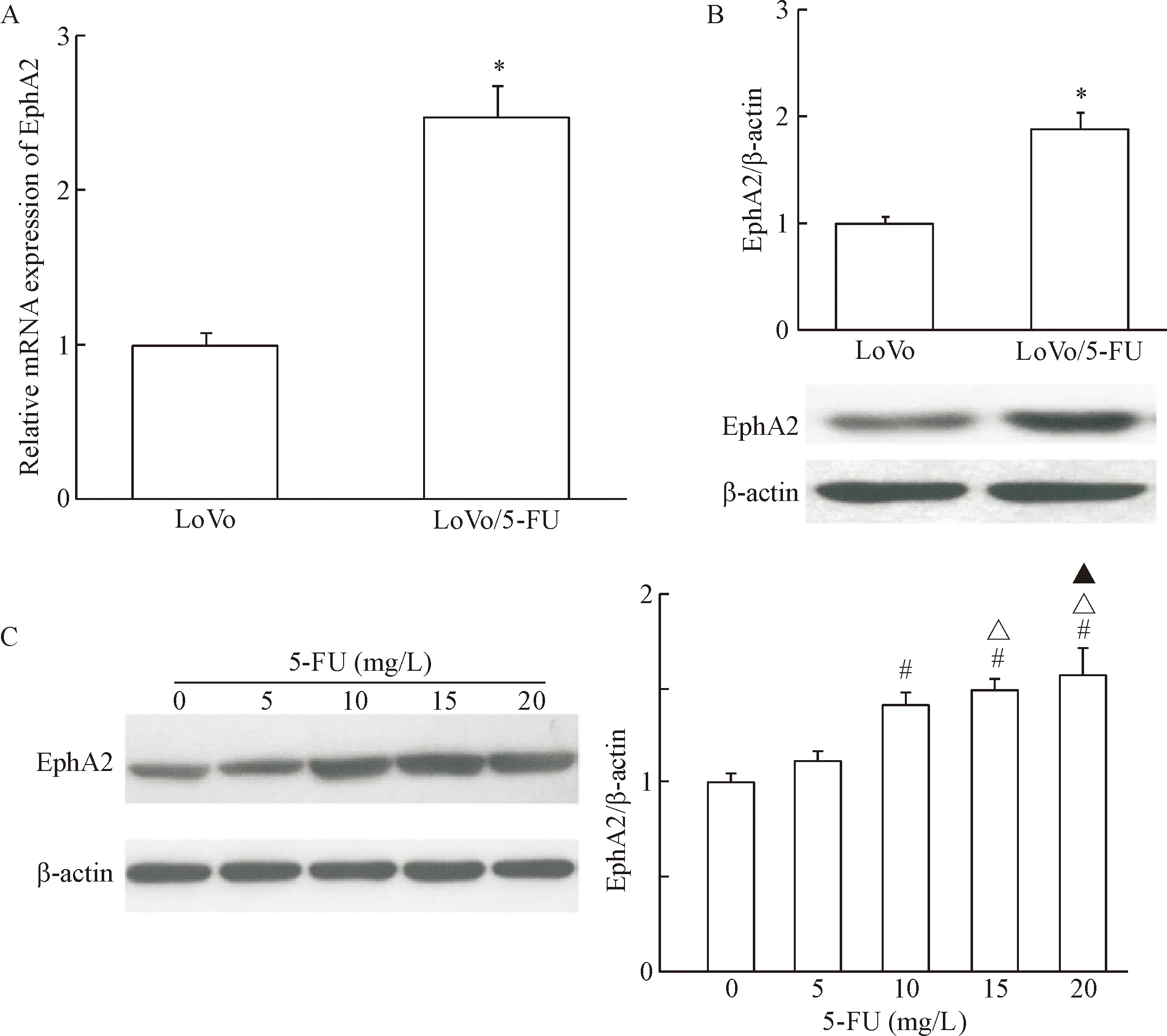
Figure 1. The relationship between EphA2 expression and drug resistance of colorectal cancer cells. A: the mRNA expression level of EphA2 in LoVo and LoVo/5-FU cells; B: the protein expression level of EphA2 in LoVo and LoVo/5-FU cells; C: EphA2 expression increased in a dose-dependent manner in LoVo cells treated with 5-FU. Mean±SD.n=6.*P<0.05vsLoVo;#P<0.05vs0 mg/L;△P<0.05vs10 mg/L;▲P<0.05vs15 mg/L.
图1EphA2的表达与结肠癌细胞化疗耐药之间的关系
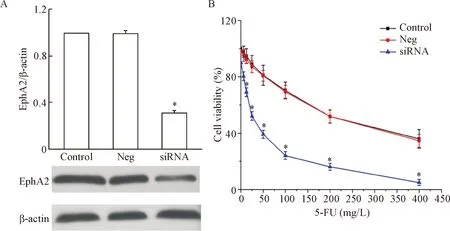
Figure 2. Knockdown ofEphA2 increased the sensitivity of LoVo/5-FU cells to 5-FU. A: the efficiency ofEphA2 siRNA transfection; B: knockdown ofEphA2 on the viability of LoVo/5-FU cells treated with different concentrations of 5-FU. Mean±SD.n=6.*P<0.05vscontrol group.
图2干扰EphA2的表达可提高耐药细胞LoVo/5-FU对5-FU的敏感性
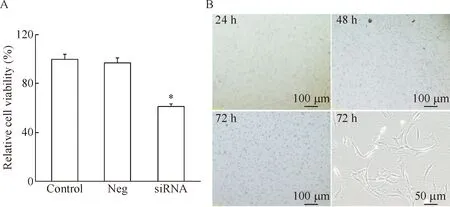
Figure 3. The effect ofEphA2 knockdown on the growth of LoVo/5-FU cells. A: the cell viability decreased; B: the morphological changes of LoVo/5-FU cells after transfected withEphA2 siRNA for 24, 48 and 72 h. Mean±SD.n=6.*P<0.05vscontrol group.
图3干扰EphA2的表达对LoVo/5-FU细胞生长的影响
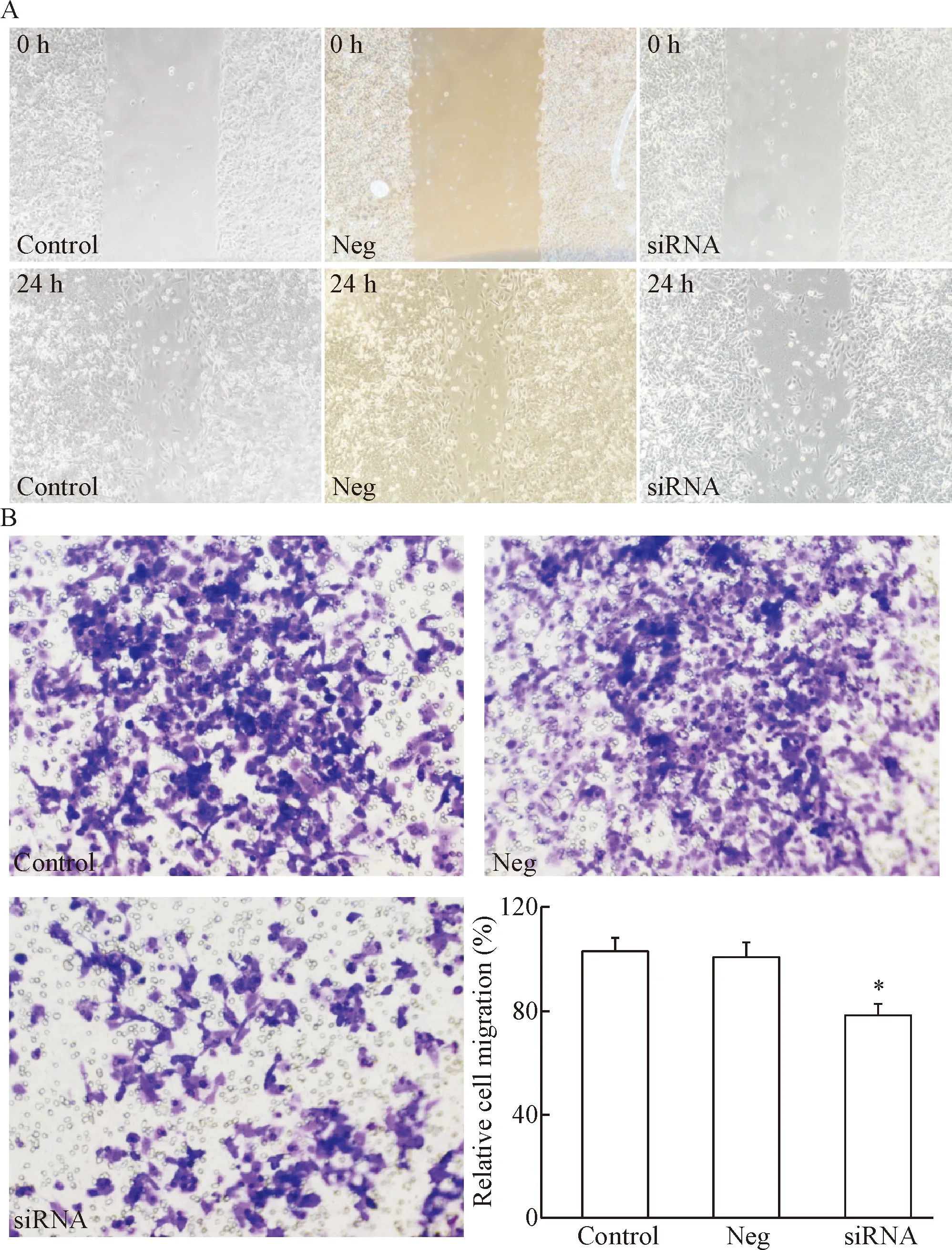
Figure 4. The effect ofEphA2 knockdown on the migration of LoVo/5-FU cells. A: the wound-healing ability decreased (×200); B: relative cell migration rate decreased (×400). Mean±SD.n=6.*P<0.05vscontrol group.
图4干扰EphA2对LoVo/5-FU细胞迁移的影响
5 干扰EphA2的表达对细胞上皮-间充质转化(epithelial-mesenchymal transition,EMT)及Notch/Snail信号通路分子蛋白水平的影响
结果所示,干扰EphA2的表达后,上皮细胞标志物E-cadherin和β-catenin表达升高,而间充质细胞标志物 N-cadherin和vimentin的表达则明显下降(P<0.05);同时,Notch和Snail的蛋白表达也减少(P<0.05),见图5。这说明干扰EphA2可能通过Notch和Snail通路抑制LoVo/5-FU细胞的EMT过程。
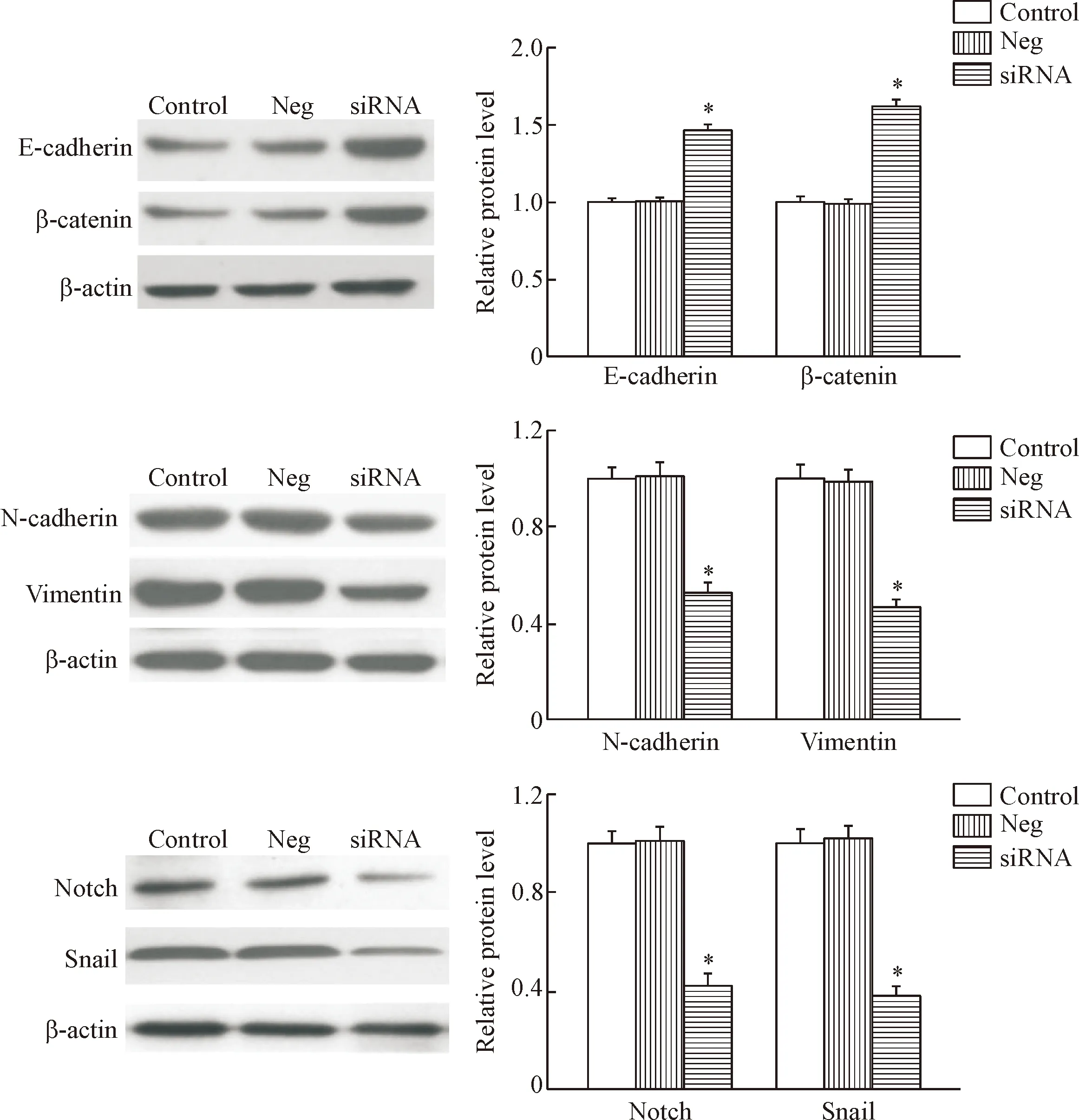
Figure 5. Western blot images and statistic analysis of protein expression. Mean±SD.n=6.*P<0.05vscontrol group.
图5干扰EphA2对细胞EMT及Notch/Snail通路蛋白表达的影响
讨 论
对肿瘤化疗耐药的研究通常是通过构建耐药细胞株来实现,本实验通过分析结肠癌耐药细胞株LoVo/5-FU及其对照亲本细胞株LoVo中EphA2的表达情况并进一步干扰EphA2的表达来综合评价EphA2对结肠癌细胞LoVo/5-FU化疗耐药性的影响,结果显示干扰EphA2可提高耐药细胞LoVo/5-FU对5-FU的敏感性,部分逆转其化疗耐药。该部分结果提示EphA2确实参与调控结直肠癌细胞获得性耐药的产生。
多年来对肿瘤模型的相关研究提示,EphA2在调节肿瘤细胞生长、迁移及血管形成中具有潜在的作用。在针对肝癌的研究中发现,过表达EphA2可逆转miR-26b引起的增殖抑制效应[11]。此外,EphA2还可促进前列腺癌LNCaP细胞的增殖和迁移[12]。为进一步了解EphA2调控结直肠癌化疗耐药的机制,我们通过siRNA干扰技术沉默耐药细胞株LoVo/5-FU中的EphA2,并检测细胞生长状况的变化。结果显示,干扰EphA2的表达可显著抑制细胞活力及细胞的迁移能力。EMT是指上皮来源的肿瘤细胞逐渐失去上皮样特性而获得间充质样特性的病理生理学过程,这一过程在肿瘤的侵袭、迁移及化疗耐药中发挥着重要的作用,并与抗肿瘤治疗密切相关[13-15]。我们的研究发现,干扰EphA2的表达后上皮细胞标志物E-cadherin和β-catenin表达升高,而间充质细胞标志物N-cadherin和vimentin的表达则明显下降,说明干扰EphA2可抑制LoVo/5-FU细胞的EMT进程,这一作用可能是其调控细胞迁移的机制之一。而后我们进一步探讨了EphA2调控EMT可能涉及的信号通路及作用机制。Notch信号通路是一条多调控的复杂通路,在肿瘤相关的EMT过程中同样发挥重要的作用[16-17]。本研究的检测结果显示,干扰EphA2可抑制Notch和Snail的表达。结果表明,EphA2对结直肠癌化疗耐药过程中EMT的影响可能与Notch/Snail信号通路有关,但是是否还有其它通路的参与及其具体的调控机制还有待进一步的研究。
综上所述,沉默EphA2可部分恢复结肠癌耐药细胞株细胞LoVo/5-FU对化疗药物的敏感性,其机制可能与抑制细胞生长、同时通过Notch/Snail通路影响细胞的EMT进程及细胞迁移有关。
[1] Rentsch M, Schiergens T, Khandoga A, et al. Surgery for colorectal cancer: trends, developments, and future perspectives[J]. Visc Med, 2016, 32(3):184-191.
[2] Holch J, Stintzing S, Heinemann V. Treatment of metastatic colorectal cancer: standard of care and future perspectives[J]. Visc Med, 2016, 32(3):178-183.
[3] Beauchamp A, Debinski W. Ephs and ephrins in cancer: ephrin-A1 signalling[J]. Semin Cell Dev Biol, 2012, 23(1):109-115.
[4] Funk SD, Orr AW. Ephs and ephrins resurface in inflammation, immunity, and atherosclerosis[J]. Pharmacol Res, 2013, 67(1):42-52.
[5] Uchiyama S, Saeki N, Ogawa K. Aberrant EphB/ephrin-B expression in experimental gastric lesions and tumor cells[J]. World J Gastroenterol, 2015, 21(2):453-464.
[6] Herath NI, Boyd AW. The role of Eph receptors and ephrin ligands in colorectal cancer[J]. Int J Cancer, 2010, 126(9):2003-2011.
[7] Husa AM, Magic Z, Larsson M, et al. EPH/ephrin profile and EPHB2 expression predicts patient survival in breast cancer[J]. Oncotarget, 2016, 7(16):21362-21380.
[8] Ferluga S, Tomé CM, Herpai DM, et al. Simultaneous targeting of Eph receptors in glioblastoma[J]. Oncotarget, 2016, 7(37):59860-59876.
[9] Dunne PD, Dasgupta S, Blayney JK, et al. EphA2 expression is a key driver of migration and invasion and a poor prognostic marker in colorectal cancer[J]. Clin Cancer Res, 2016, 22(1):230-242.
[10] De Robertis M, Loiacono L, Fusilli C, et al. Dysregulation of EGFR pathway in EphA2 cell subpopulation significantly associates with poor prognosis in colorectal cancer[J]. Clin Cancer Res, 2017, 23(1):159-170.
[11] Li H, Sun Q, Han B, et al. MiR-26b inhibits hepatocellular carcinoma cell proliferation, migration, and invasion by targeting EphA2[J]. Int J Clin Exp Pathol, 2015, 8(5):4782-4790.
[12] Chen P, Huang Y, Zhang B, et al. EphA2 enhances the proliferation and invasion ability of LNCaP prostate cancer cells[J]. Oncol Lett, 2014, 8(1):41-46.
[13] Du B, Shim JS. Targeting epithelial-mesenchymal transition (EMT) to overcome drug resistance in cancer[J]. Molecules, 2016, 21(7):E965.
[14] Zhang Y, Zeng S, Ma J, et al. Nestin overexpression in hepatocellular carcinoma associates with epithelial-mesenchymal transition and chemoresistance[J]. J Exp Clin Cancer Res, 2016, 35:111.
[15] Bao Y, Lu Y, Wang X, et al. Eukaryotic translation initiation factor 5A2 (eIF5A2) regulates chemoresistance in colorectal cancer through epithelial mesenchymal transition[J]. Cancer Cell Int, 2015, 15:109.
[16] Lee TY, Liu CL, Chang YC, et al. Increased chemoresistance via Snail-Raf kinase inhibitor protein signaling in colorectal cancer in response to a nicotine derivative[J]. Oncotarget, 2016, 7(17):23512-23520.
[17] Fan F, Samuel S, Evans KW, et al. Overexpression of Snail induces epithelial-mesenchymal transition and a cancer stem cell-like phenotype in human colorectal cancer cells[J]. Cancer Med, 2012, 1(1):5-16.
Preliminary exploration for effect of EphA2 on drug resistance of colorectal carcinoma cells
LI Xia1, MA Chao2, KONG Ling-wei1, LI Hui1, XU Cong-cong1, LI Jun-feng1
(1TheSixthDepartmentofInternalMedicine,ZaozhuangHospital,ShandongZaozhuangMiningGroup,Zaozhuang277100,China;2DepartmentofPathology,QiluHospital,ShandongUniversity,Jinan250012,China.E-mail:muzi760408@sina.com)
AIM: To investigate the effect of Eph receptor A2 (EphA2) on drug resistance of colorectal carcinoma cells and its possible mechanisms.METHODSReal-time PCR and Western blot were used to detect the expression of EphA2 at mRNA and protein levels in LoVo and LoVo/5-FU cells.EphA2 siRNA was transfected to down-regulate theEphA2 expression in LoVo/5-FU cells, and the drug sensitivity was calculated by CCK-8 assay. Meanwhile, cell migration and invasion were measured by wound healing assay and Transwell assay, and the protein levels of E-cadherin, β-catenin, N-cadherin, vimentin, Notch and Snail were determined by Western blot.RESULTSThe expression of EphA2 at both mRNA and protein levels was significantly up-regulated in LoVo/5-FU cells (P<0.05). Knockdown ofEphA2 suppressed the cell viability, and migration and invasion abilities, but promoted drug sensitivity of LoVo/5-FU cells. Up-regulation of E-cadherin and β-catenin, and down-regulation of N-cadherin and vimentin were observed, indicating that the epithelial-mesenchymal transition (EMT) process was suppressed. Knockdown ofEphA2 decreased the expression levels of Notch and Snail.CONCLUSIONDown-regulation ofEphA2 partly reverses drug resistance of LoVo/5-FU cells. The mechanism may be related to suppressing cell growth, migration, invasion and EMT process via Notch/Snail signaling pathway.
Eph receptor A2; Drug resistance; Epithelial-mesenchymal transition; Colorectal carcinoma; Notch/Snail signaling pathway
1000- 4718(2017)12- 2188- 07
2017- 07- 06
2017- 10- 30
△通讯作者 Tel: 0531-82169220; E-mail: muzi760408@sina.com
R735.3; R363.2
A
10.3969/j.issn.1000- 4718.2017.12.012
(责任编辑: 陈妙玲, 罗 森)

