miR-21对血管内皮功能及血管生成调节作用的研究进展*
谭晓勇, 方 丹, 吴剑波, 罗 茂△
(1西南医科大学药物研究中心, 四川 泸州 646000; 2宣汉县人民医院药学部, 四川 达州 635000)
miR-21对血管内皮功能及血管生成调节作用的研究进展*
谭晓勇1, 2, 方 丹1▲, 吴剑波1, 罗 茂1△
(1西南医科大学药物研究中心, 四川 泸州 646000;2宣汉县人民医院药学部, 四川 达州 635000)
微小RNA-21; 血管内皮细胞; 血管生成; 心血管疾病
血管内皮细胞作为血管的内衬,一方面参与构成血管的通透性屏障,调节液体、气体及生物大分子物质的选择性通透;另一方面可分泌大量血管活性因子,参与对凝血与抗凝功能、纤溶系统和炎症发生发展等的调控,与血管功能和循环系统的稳定密切相关。研究表明,血管内皮细胞功能激活是血管生成的先决条件[1]。血管内皮细胞在多种细胞因子的诱导下增殖迁移,为血管管腔形成提供内皮细胞数量的积累。血管生成因子与内皮细胞受体结合可激活内皮细胞内相关的信号通路,诱导内皮细胞小管形成以及细胞外基质的重构,参与调节血管生成。此外,血管内皮细胞的功能损伤是高血压和动脉粥样硬化、糖尿病及血栓形成等心血管疾病的关键步骤[2-4]。因此,研究血管内皮细胞功能的变化及其机制对预防、诊断和治疗多种心血管疾病有重大意义。
微小RNA(microRNA,miRNA,miR)是一类内源性的非编码小分子RNA,长度约为19~25个碱基,它的功能主要是通过与靶基因mRNA的3’端非翻译区(3’-untranslated region,3’-UTR)相结合,降解靶基因或者抑制其翻译,产生负性调控的作用,从而广泛参与调节多种生命体活动[2-4]。近年来研究发现,miRNA在糖尿病、高血压、动脉粥样硬化等多种心血管疾病中扮演着重要的角色,已经成为新一代心血管疾病的特异性标志物[5]。miR-21是近几年研究最广泛的miRNA之一,它主要通过调控平滑肌细胞和内皮细胞的增殖、迁移及凋亡等成为重要的血管生成调节因子。本文综述了与血管内皮细胞功能调节相关miRNA的发现及研究现状,特别是miR-21及其靶基因在血管内皮功能调节中的作用,明确了miR-21与血管生成的关系,展望了miR-21成为临床心血管疾病的预防、诊断和治疗新靶点的潜力。
1 内皮功能调节相关miRNA的发现和研究现状
目前,约有超过500种人源miRNA被发现识别,越来越多的证据表明miRNA存在不同的表达谱,在包括糖尿病和高血压等疾病的病理生理过程中扮演着重要的角色,而miRNA所介导的心血管效应主要是通过调节血管内皮细胞和平滑肌细胞等血管壁细胞的功能来实现的。
研究表明,在血管内皮细胞增殖迁移的过程中,miRNA调节扮演着重要的角色。血管内皮细胞的增殖和迁移受多种细胞因子的调节,主要包括血管内皮生长因子(vascular endothelial growth factor,VEGF)、血管生成素1(angiopoietin-1,Ang-1)和成纤维细胞生长因子(fibroblast growth factor,FGF)等内皮细胞增殖促进因子,以及凝血酶敏感蛋白1(thrombin sensitive protein-1,TSP-1)、血管内皮抑素 (endostatin,ES)和血管抑素(angiostatin,AS)等内皮细胞增殖抑制因子。而上述调节因子部分已证实是miRNA的上游调控因子或下游靶基因。例如,Soufi-Zomorrod等[6]研究发现,miR-129-1和miR-133能靶向抑制血管内皮生长因子受体2(vascular endothelial growth factor receptor 2,VEGFR2)和成纤维细胞生长因子受体1(fibroblast growth factor receptor 1,FGF1)的表达,进而抑制人脐静脉内皮细胞(human umbilical vein endothelial cells,HUVECs)的增殖迁移和细胞活力,发挥抗血管生成的作用。同时,Yang等[7]研究表明,高糖能减少猴视网膜内皮细胞RF/6A中miR-126的表达,而增加VEGF-A及磷脂酰肌醇3-激酶调节亚基2(phosphatidylinositol 3-kinase regulatory subunit 2,PIK3R2)的表达;进一步研究表明,上调miR-126能通过阻断 VEGF/PI3K/AKT信号通路,抑制高糖诱导的RF/6A细胞的增殖迁移。更有趣的是有文献报道称miR-221/222在血管平滑肌细胞和内皮细胞中的作用截然相反,一方面,miR-221/222能促进血管平滑肌细胞增殖迁移,抑制其凋亡;而另一方面,miR-221/222能抑制内皮细胞的增殖迁移,促进其凋亡。有研究表明,小鼠心肌梗死后,miR-130a表达下调,miR-130a能靶向抑制PTEN的表达,从而激活PI3K/Akt信号通路,促进HUVECs的增殖迁移,在心肌梗死后的心脏保护以及血管重构中发挥着重要的作用。Wang等[8]研究揭示,间充质干细胞分泌的细胞外囊泡中miR-210高表达,高表达的miR-210能够靶向下调EFNA3基因的表达,促进HUVECs的增殖迁移及小管形成,进而促进血管生成。
炎症是宿主抵抗外来感染和损伤的重要形式,而miRNA作为能调控基因表达的上游调控因子在内皮细胞的炎症反应中发挥了重要的作用。Tang等[9]研究表明基因敲除的ApoE-/-糖尿病小鼠的主动脉内皮细胞中miR-126表达明显减少,而高迁移率族盒蛋白1(high mobility group box protein 1,HMGB1)的表达上调,并伴有明显的炎症反应;进一步研究显示,miR-126能够靶向下调HMGB1的表达,进而降低下游肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)和活性氧簇(reactive oxygen species,ROS)的表达,促进内皮型一氧化氮合酶(endothelial nitric oxide synthase, eNOS)和AKT的磷酸化,发挥抗炎的作用。Ye等[10]研究揭示miR-146a能通过阻断微血管内皮细胞(microvascular endothelial cells,MECs)中TLR4/NF-κB信号通路以及抑制TNF-α的表达,减少MECs中炎症的发生。
血管内皮细胞凋亡是动脉粥样硬化、肺动脉高压及糖尿病大血管病变等心血管疾病的早期事件。此外,内皮细胞凋亡常伴随着TNF-α、ROS和血管紧张素II(angiotensin II,Ang II)等的异常表达。研究显示,miRNA与上述生成因子密切相关,提示miRNA可能参与调控内皮细胞凋亡。Luo等[11]研究表明,Ang II能够诱导HUVECs凋亡,并伴随着miR-590-5p的下调,而miR-590-5p的下调能进一步导致氧化低密度脂蛋白(oxidized low-density lipoprotein,ox-LDL)和ROS表达增加,从而促进HUVECs的凋亡。部分研究发现,低表达的miR-365能抑制ox-LDL诱导的内皮细胞凋亡,提示通过抑制miR-365的表达来治疗动脉粥样硬化将成为可能。血管内皮细胞衰老主要是其增殖和凋亡失衡的结果,是心血管疾病的主要危险因素之一。沉默信息调节因子2相关酶1(silent information regulator 2 homolog 1,Sirt1)是一种NAD+依赖的高度保守的蛋白去乙酰化酶。研究发现,Sirt1能参与eNOS的去乙酰化作用,在细胞寿命的调节中具有必不可少的作用。例如,Menghini等[12]的研究结果表明miR-217能抑制Sirt1的转录翻译过程,进而影响eNOS的表达,参与调控内皮细胞的衰老。
2 血管内皮细胞miR-21简介
研究表明,人miR-21编码基因定位于17q23.2,跨膜蛋白49(transmembrane protein-49,TMEM-49)基因的第10个内含子上,由72个核苷酸经茎环剪切加工成只包含22个核苷酸的成熟RNA小分子,人miR-21的保守序列为5’-UAGCUUAUCAGACUGAUGUUGA-3’。研究表明,miR-21的生成受上游转录调控因子的调节,主要包括核转录因子激活蛋白1(activator protein-1,AP-1)、信号转导及转录激活因子3(signal transducer and activator of transcription 3,STAT3)和转化生长因子β(transforming growth factor-β,TGF-β)等。调控因子在转录前和转录后均可以调控miR-21的表达,而这些转录调控因子往往在内皮功能障碍时异常表达,暗示着miR-21可能在血管内皮细胞结构和功能的稳定中起着重要的作用。研究miR-21在内皮细胞功能调节中的作用机制,关键在于准确找到它的靶基因。目前,主要利用miRBase、miRanda、TargetScan6.2和PicTar等在线软件对miR-21潜在的靶基因进行预测,然后通过双萤光素酶报告基因实验鉴别验证其与靶基因结合的结构学特征,RT-qPCR和Western blot鉴别验证功能学特点。尽管现阶段已经预测出约210种miR-21可能直接调控的靶基因,但得到证实的靶基因并不多,并且现有大多数研究主要集中于肿瘤方面,关于心血管系统尤其是调节血管内皮功能方面的研究还比较少,有待进一步的深入探索和研究。
越来越多的证据表明,miR-21是血管内皮细胞增殖迁移的一个重要调节因子,然而,有关其作用的报道却存在着争议。Jiang等[13]研究表明,VEGF能上调miR-21的表达,而miR-21过表达能显著增强VEGF诱导的HUVECs增殖迁移;同时,Guduric-Fuchs等[14]的研究也发现,下调miR-21的表达能抑制视网膜微血管内皮细胞的增殖迁移和小管形成。然而Sabatel等[15]研究表明miR-21过表达能通过靶向下调Ras同族体基因家族成员B(Ras homolog gene family member B, RhoB)的表达,进而抑制内皮细胞增殖迁移;Jin等[16]证实了RhoB是miR-21在内皮细胞中的直接靶标,并且miR-21能靶向下调RhoB的表达,从而促进内皮细胞凋亡,抑制其增殖迁移等。而导致这一矛盾结论的原因可能是细胞种类以及miR-21靶基因选择的不同。
miR-21部分靶基因也被证实参与调控血管平滑肌细胞增殖迁移。Li等[17]利用双萤光素酶报告基因实验证明了AP-1是miR-21的直接靶标,而miR-21能靶向上调AP-1的表达,抑制VEGF诱导的血管平滑肌细胞的增殖迁移,提示,通过调控细胞内miR-21的表达治疗增生性血管疾病将成为可能。同时,Wang等[18]研究表明,原肌球蛋白1(tropomyosin 1,TPM1)是miR-21在动脉平滑肌细胞中的靶基因,miR-21能通过调节TPM1的表达参与抑制动脉平滑肌细胞的增殖迁移,参与动脉粥样硬化的发生发展过程。
已发现miR-21通过部分靶基因参与调控二甲双胍的作用机制。Luo等[19]研究发现,miR-21能与第PTEN和SMAD7的mRNA 3’-UTR互补结合,抑制miR-21的表达,靶向上调PTEN和SMAD7的表达,进而抑制AKT、细胞外信号调节激酶(extracellular signal-regulated kinase, ERK)和信号转导蛋白SMAD2/3的磷酸化,抑制HUVECs的增殖迁移,参与二甲双胍损伤内皮细胞功能的过程。
内皮细胞凋亡是内皮功能障碍的主要表现形式之一。研究表明,miR-21能通过调控其相关靶基因调节内皮细胞的凋亡。例如,Ge等[20]研究揭示,外伤性损伤大鼠大脑后,miR-21-5p表达上调,研究进一步显示,利用划痕损伤脑微血管内皮细胞(brain microvascular endothelial cells,BMVECs)后,miR-21-5p能通过激活AKT信号通路抑制BMVECs凋亡,以及阻断核因子κB(nuclear factor κB,NF-κB)信号通路抑制炎症的发生,从而减弱划痕对内皮屏障的损伤,保护血脑屏障。Wei等[21]研究发现,NF-κB能显著上调氧化应激损伤的心肌细胞中miR-21的表达,且证明了程序性细胞凋亡因子4(programmed cell death 4,PDCD4)是miR-21的直接靶标,进一步研究显示,miR-21能靶向下调PDCD4的表达,抑制心肌细胞凋亡,减轻ROS诱导的心肌细胞损伤。Weber等[22]利用低密度阵相实验和RT-qPCR证实了在剪切应力的作用下,HUVECs中miR-21、miR-155、miR-19a、miR-126和miR-27b等13种miRNA的表达均上调,其中miR-21上调趋势最为明显,miR-21过表达能抑制HUVECs凋亡,这一过程和增加内皮细胞中eNOS磷酸化及NO的表达有着密切的关联。
血管老化是多种心血管疾病的促进因素,而内皮细胞衰老在血管老化中发挥着重要的作用,因此,探究内皮细胞衰老的具体分子机制是研究血管老化复杂调控网络的重要方向。Dellago等[23]发现衰老的HUVECs中miR-21、miR-23、miR-23b、miR-24、miR-221和miR-222等12种miRNA表达上调,上调的miR-21能诱导血管内皮细胞生长抑制,从而促进细胞衰老。Zhu等[24]研究也证实了miR-21能通过抑制Hmga2 的表达促进内皮祖细胞(endothelial progenitor cells,EPCs)的衰老。表1列出了已经证实的部分与血管细胞功能相关的miR-21的靶基因。
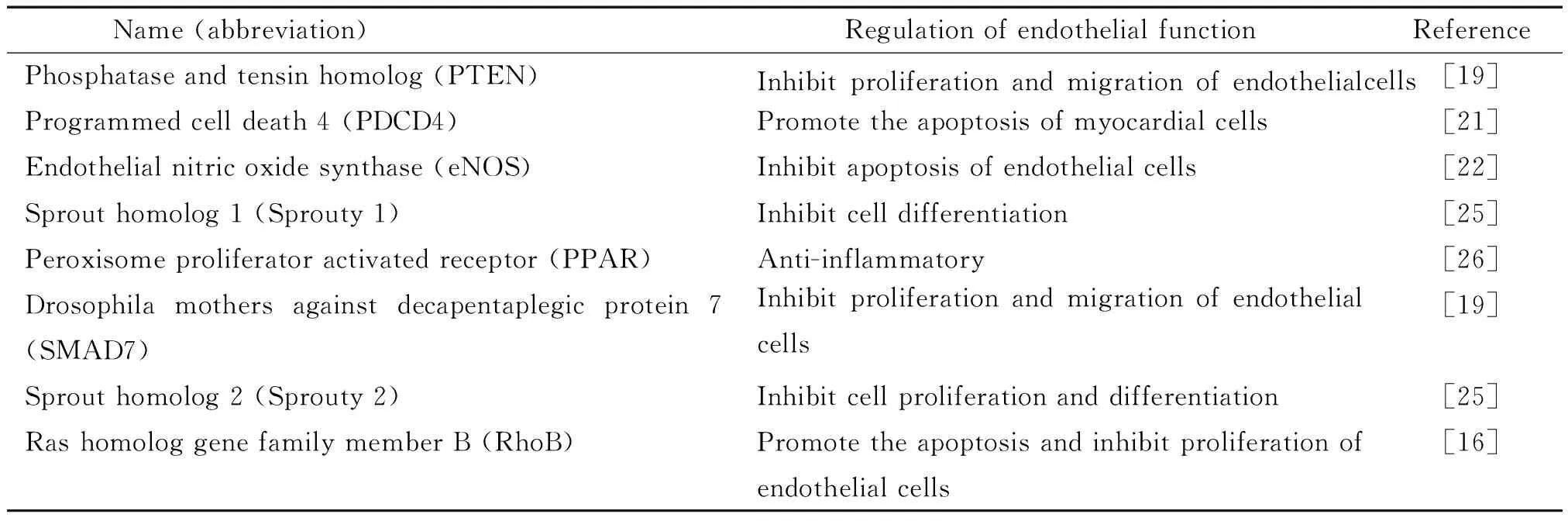
表1 与内皮功能调节相关的miR-21靶基因
3 miR-21与血管生成
广义的血管生成是指生命体在生理和病理状态下形成新的血管和血管网的过程,主要包括血管发生、血管生成和动脉形成,是一个涉及了多种血管细胞和细胞因子的过程,而miR-21就是其中的一种细胞因子。血管发生是指在创伤、炎症等情况下,EPCs分化成成熟的血管内皮细胞并聚集于损伤部位,形成新生血管的过程。近几年研究表明,miR-21广泛参与调节EPCs的增殖、凋亡和衰老等,在血管发生中扮演着重要的角色。Zuo等[27]研究发现,动脉粥样硬化病人的EPCs中miR-21高表达,并且EPCs的增殖能力显著减弱,将miR-21基因敲除后,低氧诱导的EPCs的生长抑制效应被废除;进一步研究显示,miR-21通过靶向下调E3蛋白泛素连接酶WWP1的表达,进而激活TGF-β信号通路,抑制EPCs的增殖。Zeng等[28]研究发现,糖尿病病人的循环内皮祖细胞中miR-21表达上调,而抑制miR-21的表达后,高糖诱导的EPCs的生殖毒性显著增加,促进内皮祖细胞凋亡,这可能与miR-21靶向抑制死亡结构域相关蛋白的表达有关。同时,Zhu等[24]研究表明,miR-21能通过靶向抑制 Hmga2的表达,促进EPCs的衰老。
血管生成是机体在已有微血管基础上通过血管内皮细胞增殖、迁移和分化以出芽的方式萌生的血管分支。内皮细胞的激活和增殖迁移是血管生成的关键,调控内皮细胞激活,促进血管生成是目前治疗部分缺血性心血管疾病的一种新方法和新思路。Yang等[29]研究发现,miR-21能够通过靶向下调心脏微血管内皮细胞中PTEN的表达,促进其增殖迁移,以及增加VEGF的表达,促进血管生成,减少大鼠急性心肌梗塞面积,保护心脏。同时,Jiang等[13]证实了,miR-21能通过AKT和ERK信号通路增加VEGF诱导的HUVECs的增殖迁移和小管形成,从而促进血管生成。Xu等[30]研究揭示,miR-21在肾脏缺血再灌注损伤中扮演着双重角色,一方面通过靶向调控PDCD4和缺氧诱导因子调控细胞凋亡以及促进血管生成起到保护肾脏的作用;另一方面,长期过表达miR-21能导致肾间质纤维化,从而进一步加重器官的损伤。有文献报道称,低氧诱导因子1α(hypo-xia-inducible factor-1α, HIF-1α)能够显著上调HUVECs中VEGF-1和miR-21的表达,而miR-21的上调能通过靶向调控TSP-1的表达,进而促进HIF-1α诱导的血管生成。最新研究表明,雷帕霉素[26]、豆蔻明[13]和异氟烷[31]等临床药物均能通过调控HUVECs内miR-21的表达,影响其增殖、迁移能力,参与调节血管生成。
动脉形成则主要包括了血管内皮细胞和血管平滑肌细胞的增殖、迁移、凋亡以及血管重构等步骤。Hutcheson等[32]利用冠状动脉结扎手术建立了心肌缺血模型后,发现SD大鼠在第9天时,冠状动脉侧支血管形成成熟,而代谢综合征JCR大鼠却没有明显的冠状动脉侧支血管管腔形成,进一步研究表明,低氧诱导的JCR大鼠平滑肌中miR-21的表达明显高于SD大鼠,miR-21调控的冠状动脉平滑肌细胞增殖作用显著增加,导致血管管腔铺展障碍,从而导致JCR大鼠冠状动脉侧支血管形成障碍。同时,Yang等[33]也发现,miR-21在慢性低氧诱导的肺血管重构中扮演着重要的角色,其机制可能和miR-21调控人肺动脉平滑肌细胞(human pulmonary artery smooth muscle cells,PASMCs)中增殖细胞核抗原和细胞周期蛋白D1等的表达进而调节PASMCs的表型改变有关。
4 展望
随着miR-21参与调控血管内皮细胞功能的分子机制和信号通路的逐步揭示及研究的不断进展,越来越多的证据表明,miR-21广泛参与血管内皮细胞功能的调节,在维持血管内皮细胞结构和功能的稳定中扮演着重要的角色,使得miR-21成为潜在的血管内皮细胞功能调节的标志物,将可用于临床动脉粥样硬化、高血压、糖尿病及心力衰竭等诸多心血管疾病的诊断、治疗和疗效评估。目前,关于miR-21参与调控肿瘤发生发展过程的机制研究已经比较详尽,然而关于miR-21通过影响血管内皮细胞功能参与调控心血管疾病病理过程的研究还有待进一步完善,这使得更加广泛和深入的研究血管内皮功能相关miR-21的上游调控因子以及下游靶基因,全面了解血管内皮细胞功能相关miR-21调控网络成为当前研究的热点。研究显示,在大多数心血管疾病中,PTEN、PDCD4、AKT和VEGF等细胞因子均异常表达。假设miR-21能纠正上述基因表达,那么利用miRNA基因治疗手段上调或抑制miR-21表达,纠正血管细胞中异常表达的细胞因子,通过基因手段治疗糖尿病、心肌缺血、动脉粥样硬化等心血管疾病将成为可能。例如,Yang等[34]研究表明,盐酸曲美他嗪能够通过上调H9C2细胞miR-21的表达,靶向抑制PTEN的表达,进而促进AKT的磷酸化,减少Bcl-2/Bax比率以及caspase-3的活化,抑制细胞凋亡,从而保护心脏功能。Li等[35]研究表明,miR-21能通过靶向调控 mt-Cytb的翻译过程,降低自发性高血压大鼠的血压以及心脏肥厚。
随着对血管内皮miR-21的发现及miR-21与其靶基因表达调控机制研究的成熟,为彻底揭示血管内皮miR-21参与调控内皮细胞功能的分子机制提供有力支持,深入研究血管内皮细胞miR-21的调控网络,势必将成为未来研究内皮细胞功能调节的重要方向,血管内皮功能相关miR-21也将成为未来心血管类疾病临床早期诊断、治疗、预后及疗效评估等多个环节的功能研究及基因治疗药物研发中的重要标志物和靶点。
[1] Friis T, Engel AM, Bendiksen CD, et al. Influence of levamisole and other angiogenesis inhibitors on angiogenesis and endothelial cell morphologyinvitro[J]. Cancers (Basel), 2013, 5(3):762-785.
[2] 张文宇, 王 辉, 李玉媚, 等. miRNA-24对内皮型一氧化氮合酶表达调节及血管内皮细胞增殖的影响[J]. 中国病理生理杂志, 2014, 30(8):1415-1420.
[3] 郑志伟, 劳海燕, 余细勇, 等. 冠心病患者血浆循环miR-126的表达及其对血管内皮细胞的影响[J]. 中国病理生理杂志, 2011, 27(12):2313-2317.
[4] 谭晓勇, 罗 茂, 卢培林, 等. miR-30c调控PAI-1对血管内皮细胞活力和迁移的影响[J]. 中国病理生理杂志, 2016, 32(12):2199-2204.
[5] Wu JH, Wang YH, Wang W, et al. MiR-18b suppresses high-glucose-induced proliferation in HRECs by targeting IGF-1/IGF1R signaling pathways[J]. Int J Biochem Cell Biol, 2016, 73:41-52.
[6] Soufi-Zomorrod M, Hajifathali A, Kouhkan F, et al. MicroRNAs modulating angiogenesis: miR-129-1 and miR-133 act as angio-miR in HUVECs[J]. Tumour Biol, 2016, 37(7):9527-9534.
[7] Yang WZ, Yang J, Xue LP, et al. MiR-126 overexpression inhibits high glucose-induced migration and tube formation of rhesus macaque choroid-retinal endothelial cells by obstructing VEGFA and PIK3R2[J]. J Diabetes Complications, 2017, 31(4):653-663..
[8] Wang N, Chen C, Yang D, et al. Mesenchymal stem cells-derived extracellular vesicles, via miR-210, improve infarcted cardiac function by promotion of angiogenesis[J]. Biochim Biophys Acta, 2017, 1863(8):2085-2092.
[9] Tang ST, Wang F, Shao M, et al. MicroRNA-126 suppresses inflammation in endothelial cells under hyperglycemic condition by targeting HMGB1[J]. Vascul Pharmacol, 2017, 88:48-55.
[10] Ye EA, Steinle JJ. miR-146a attenuates inflammatory pathways mediated by TLR4/NF-κB and TNFα to protect primary human retinal microvascular endothelial cells grown in high glucose[J]. Mediators Inflamm, 2016, 2016:3958453.
[11] Luo P, Zhang WF, Qian ZX, et al. MiR-590-5p-meidated LOX-1 upregulation promotes angiotensin II-induced endothelial cell apoptosis[J]. Biochem Biophys Res Commun, 2016, 471(4):402-408.
[12] Menghini R, Casagrande V, Cardellini M, et al. MicroRNA 217 modulates endothelial cell senescence via silent information regulator 1[J]. Circulation, 2009, 120(15):1524-1532.
[13] Jiang FS, Tian SS, Lu JJ, et al. Cardamonin regulates miR-21 expression and suppresses angiogenesis induced by vascular endothelial growth factor[J]. Biomed Res Int, 2015, 2015:501581.
[14] Guduric-Fuchs J, O’Connor A, Cullen A, et al. Deep sequencing reveals predominant expression of miR-21 amongst the small non-coding RNAs in retinal microvascular endothelial cells[J]. J Cell Biochem, 2012, 113(6):2098-2111.
[15] Sabatel C, Malvaux L, Bovy N, et al. MicroRNA-21 exhibits antiangiogenic function by targeting RhoB expression in endothelial cells[J]. PLoS One, 2011, 6(2):e16979.
[16] Jin C, Zhao Y, Yu L. MicroRNA-21 mediates the rapamycin-induced suppression of endothelial proliferation and migration[J]. FEBS Lett, 2013, 587(4):378-385.
[17] Li Y, Yan L, Zhang W, et al. MicroRNA-21 inhibits platelet-derived growth factor-induced human aortic vascular smooth muscle cell proliferation and migration through targeting activator protein-1[J]. Am J Transl Res, 2014, 6(5):507-516.
[18] Wang M, Li W, Chang GQ, et al. MicroRNA-21 regulates vascular smooth muscle cell function via targeting tropomyosin 1 in arteriosclerosis obliterans of lower extremities[J]. Arterioscler Thromb Vasc Biol, 2011, 31(9):2044-2053.
[19] Luo M, Tan X, Mu L, et al. MiRNA-21 mediates the antiangiogenic activity of metformin through targeting PTEN and SMAD7 expression and PI3K/AKT pathway[J]. Sci Rep, 2017, 7:43427.
[20] Ge X, Huang S, Gao H, et al. miR-21-5p alleviates lea-kage of injured brain microvascular endothelial barrierinvitrothrough suppressing inflammation and apoptosis[J]. Brain Res, 2016, 1650:31-40.
[21] Wei C, Li L, Kim IK, et al. NF-κB mediated miR-21 regulation in cardiomyocytes apoptosis under oxidative stress[J]. Free Radic Res, 2014, 48(3):282-291.
[22] Weber M, Baker MB, Moore JP, et al. MiR-21 is induced in endothelial cells by shear stress and modulates apoptosis and eNOS activity[J]. Biochem Biophys Res Commun, 2010, 393(4):643-648.
[23] Dellago H, Preschitz-Kammerhofer B, Terlecki-Zaniewicz L, et al. High levels of oncomiR-21 contribute to the senescence-induced growth arrest in normal human cells and its knock-down increases the replicative lifespan[J]. Aging Cell, 2013, 12(3):446-458.
[24] Zhu S, Deng S, Ma Q, et al. MicroRNA-10A* and microRNA-21 modulate endothelial progenitor cell senescence via suppressing high-mobility group A2[J]. Circ Res, 2013, 112(1):152-164.
[25] Seeger T, Fischer A, Muhly-Reinholz M, et al. Long-term inhibition of miR-21 leads to reduction of obesity in db/db mice[J]. Obesity (Silver Spring), 2014, 22(11):2352-2360.
[26] Zhou J, Wang KC, Wu W, et al. MicroRNA-21 targets peroxisome proliferators-activated receptor-α in an autoregulatory loop to modulate flow-induced endothelial inflammation[J]. Proc Natl Acad Sci U S A, 2011, 108(25):10355-10360.
[27] Zuo K, Li M, Zhang X, et al. MiR-21 suppresses endothelial progenitor cell proliferation by activating the TGF-β signaling pathway via downregulation of WWP1[J]. Int J Clin Exp Pathol, 2015, 8(1):414-422.
[28] Zeng J, Xiong Y, Li G, et al. MiR-21 is overexpressed in response to high glucose and protects endothelial cells from apoptosis[J]. Exp Clin Endocrinol Diabetes, 2013, 121(7):425-430.
[29] Yang F, Liu W, Yan X, et al. Effects of miR-21 on cardiac microvascular endothelial cells after acute myocardial infarction in rats: role of phosphatase and tensin homolog (PTEN)/vascular endothelial growth factor (VEGF) signal pathway[J]. Med Sci Monit, 2016, 22:3562-3575.
[30] Xu X, Kriegel AJ, Liu Y, et al. Delayed ischemic preconditioning contributes to renal protection by upregulation of miR-21[J]. Kidney Int, 2012, 82(11):1167-1175.
[31] Olson JM, Yan Y, Bai X, et al. Up-regulation of microRNA-21 mediates isoflurane-induced protection of cardiomyocytes[J]. Anesthesiology, 2015, 122(4):795-805.
[32] Hutcheson R, Chaplin J, Hutcheson B, et al. miR-21 normalizes vascular smooth muscle proliferation and improves coronary collateral growth in metabolic syndrome[J]. FASEB J, 2014, 28(9):4088-4099.
[33] Yang S, Banerjee S, Freitas Ad, et al. miR-21 regulates chronic hypoxia-induced pulmonary vascular remodeling[J]. Am J Physiol Lung Cell Mol Physiol, 2012, 302(6):L521-L529.
[34] Yang Q, Yang K, Li AY. Trimetazidine protects against hypoxia-reperfusion-induced cardiomyocyte apoptosis by increasing microRNA-21 expression[J]. Int J Clin Exp Pathol, 2015, 8(4):3735-3741.
[35] Li H, Zhang X, Wang F, et al. MicroRNA-21 lowers blood pressure in spontaneous hypertensive rats by upregulating mitochondrial translation[J]. Circulation, 2016, 134(10):734-751.
Advances on studies of miR-21 in vascular endothelial function and angiogenesis
TAN Xiao-yong1, 2, FANG Dan1, WU Jian-bo1, LUO Mao1
(1DrugDiscoveryResearchCenter,SouthwestMedicalUniversity,Luzhou646000,China;2DepartmentofPharmacy,XuanhanCountyPeople’sHospital,Dazhou635000,China.E-mail:luomao20050908@163.com)
MicroRNAs (miRNAs) are a class of non-coding, endogenous, single-stranded small RNA molecules composed of 19~25 nucleotides. miRNAs are widely involved in the process of human life activities. Recent studies have shown that part of miRNAs regulate the vascular endothelial function and angiogenesis. High expression of miRNA-21 is found to play important roles in the cell proliferation, cell apoptosis, cell growth and death of vascular endothelial cells. This review will focus on the recent progress related to miRNAs in vascular endothelial function and angiogenesis, providing a new insight in cardiovascular disease prevention, clinical diagnosis, prognosis and target therapeutics.
MicroRNA-21; Vascular endothelial cells; Angiogenesis; Cardiovascular disease
1000- 4718(2017)12- 2299- 06
2017- 05- 15
2017- 08- 07
国家自然科学基金资助项目(No. 81570263);四川省教育厅重点项目(No. 16ZA0178);泸州市科技局资助项目(No.2016LZXNYD-J24;No.2016-R-70(11/24);No.2016-R-70(8/24)
△ 通讯作者:Tel:0830-3161673;E-mail: luomao20050908@163.com
▲ 并列第1作者
R543; R363
A
10.3969/j.issn.1000- 4718.2017.12.031
(责任编辑: 陈妙玲, 余小慧)

