锌对于原发性肝细胞癌BEL-7404细胞生物学行为的影响*
郑佳莹, 李亚东, 郑庆祝, 邱福南, 伍严安, 黄 毅△
(1福建医科大学省立临床医学院, 福建省立医院 2检验科, 3肝胆外科, 福建 福州350001)
锌对于原发性肝细胞癌BEL-7404细胞生物学行为的影响*
郑佳莹1, 2, 李亚东1, 2, 郑庆祝1, 2, 邱福南1, 3, 伍严安1, 2, 黄 毅1, 2△
(1福建医科大学省立临床医学院, 福建省立医院2检验科,3肝胆外科, 福建 福州350001)
目的观察外源锌对原发性肝细胞癌(HCC)BEL-7404细胞生物学行为的影响。方法应用TSQ锌离子荧光探针、MTT法、DNA倍体法、吖啶橙/溴乙啶双荧光染色法和Transwell小室法分别检测不同浓度硫酸锌刺激下BEL-7404细胞内锌离子含量、细胞活力、细胞周期、细胞凋亡及细胞迁移和侵袭能力的变化。应用real-time PCR和Western blot法分别检测不同浓度锌离子对BEL-7404细胞白蛋白的mRNA和蛋白表达的影响。结果随着培养环境中锌离子浓度的升高,BEL-7404细胞内的锌离子含量增加,细胞的存活率和细胞迁移与侵袭能力降低,凋亡率升高(P<0.05);G0/G1期细胞比例降低,G2/M期细胞比例升高(P<0.05);细胞白蛋白的mRNA和蛋白表达量增加(P<0.05)。结论外源性给予锌离子可抑制HCC细胞的活力、迁移与侵袭能力,诱导细胞凋亡,阻滞细胞周期在G2/M期,并可能降低细胞的恶性表型。
肝细胞癌; BEL-7404细胞; 锌
原发性肝细胞癌(hepatocellular carcinoma,HCC)是常见的消化系统恶性肿瘤之一,具有早期诊断难、治疗难、易转移、易复发和死亡率高的特点。手术切除虽然是根治HCC的首选治疗方法,但由于HCC的病因和病理性质具有不同的特点,结合多种方法的综合治疗方案将更具有成效,这一点对于无法行根治术和(或)肝功能差的HCC患者来说显得尤为重要。锌(zinc,Zn)是体内重要的微量元素之一,人体内多种含有锌指结构酶的关键组成成分与其有关[1],涉及DNA的合成、细胞分化和基因的表达等过程。正常的肝脏是一个锌含量丰富的器官[2]。研究表明,HCC患者癌组织的锌浓度明显低于癌旁组织与正常对照组肝脏组织的锌浓度[3-6];此外,HCC患者的血清锌浓度亦低于其它消化道疾病或者非肝病患者[4-6],提示HCC患者体内存在着低锌的环境,其肝脏癌组织锌含量的减少可能参与了疾病的发生发展进程。本研究旨在通过不同浓度锌离子作用于人HCC细胞株BEL-7404,观察其对于肿瘤细胞活力、细胞凋亡、细胞周期、迁移与侵袭能力和分化等生物学行为的影响,探讨锌作为一种辅助治疗手段在HCC的可能应用前景。
材 料 和 方 法
1 研究对象
人HCC细胞株 BEL-7404购自中科院细胞所,以含10%胎牛血清(fetal bovine serum,FBS)的RPMI-1640培养于37 ℃、5% CO2、饱和湿度的细胞培养箱内。2~3 d换液传代1次,实验用细胞为状态良好的对数生长期细胞。
2 主要试剂
七水硫酸锌(ZnSO4·7H2O,细胞培养级)购自上海阿拉丁生化科技股份有限公司;RPMI-1640、PBS和青-链霉素混合液(100×)均购自HyClone;FBS和胰蛋白酶(含EDTA)购自Gibco;MTT和DMSO购自Amresco;Matrigel和Transwell小室购自Corning;细胞周期检测试剂盒购自杭州联科生物科技有限公司;TSQ锌离子探针和活细胞/坏死细胞/凋亡细胞鉴别试剂盒[吖啶橙(acridine orange,AO)/溴乙啶(ethidium bromide,EB)法]购自南京凯基生物科技发展有限公司;氯仿(分析纯)、异丙醇(分析纯)和无水乙醇(分析纯)购自上海振兴化工一厂;RevertAid First Strand cDNA Synthesis试剂盒购自Thermo Fisher Scientific;DEPC水、TRIzol和UltraSYBR Mixture (Low ROX)购自北京康为世纪生物科技有限公司;蛋白裂解液和BCA蛋白浓度测定试剂盒购自上海碧云天生物科技有限公司。所用引物由南京金斯瑞生物科技有限公司根据设计合成。
3 主要方法
3.1MTT法检测锌离子对BEL-7404细胞活力的影响 收集对数期细胞,调整细胞悬液浓度为2.0×107/L,每孔加入100 μL于96孔板中,边缘用无菌PBS液填充。设计6个药物实验组(ZnSO4浓度分别为12.5、25、50、75、100和125 μmol/L)、1个正常对照组和1个空白组,每组设置5个复孔。37 ℃、5% CO2培养18~20 h。细胞贴壁培养18 h后,小心移去上层细胞完全培养基,依据实验设计,分别加入200 μL的含有相应浓度硫酸锌的细胞完全培养基,空白组保持总体积为200 μL的细胞培养基,分别培养24、48和72 h。达到相应培养时间后,每孔加入20 μL MTT溶液,混匀, 继续孵育4 h。小心吸弃孔内溶液,每孔加入150 μL DMSO溶解甲臜,置摇床上低速振荡10 min,使结晶物充分溶解。用酶标仪(Thermo Multiskan MK3)测量各孔的吸光度(A)值(检测波长为490 nm,校正波长为630 nm),以空白对照孔调零,取3次实验均值,绘制细胞生长曲线,计算细胞存活率。细胞存活率(%)=(A实验组-A空白组)/(A正常对照组-A空白组)×100%。
3.2七水硫酸锌预处理BEL-7404细胞 锌离子提供者ZnSO4·7H2O的水溶性良好,在水溶液中可以充分地解离出二价锌离子。配制含有七水硫酸锌的细胞完全培养基,使得锌离子的终浓度分别为50 μmol/L和100 μmol/L,作为实验组,以不含有硫酸锌(0 μmol/L)的完全培养基作为正常对照组。收集对数期细胞,调整细胞悬液浓度为5.0×107/L, 以每孔1 mL接种细胞于6孔板中,37 ℃、5% CO2条件下培养20 h后,弃去原培养液,根据实验设计加入含有相应浓度锌离子的完全培养基,每孔2 mL。37 ℃、5% CO2条件下培养48 h,以此预处理的细胞可以用于后续细胞功能学实验。
3.3TSQ锌离子探针检测BEL-7404细胞内的锌离子 细胞经过硫酸锌刺激48 h后,移去培养基,PBS洗3遍;4%多聚甲醛固定30 min,再用PBS洗3遍;加入已稀释好的工作浓度的TSQ染液,避光染色15 min;移去染料,PBS洗3遍,加入抗荧光淬灭剂,以360 nm为激发波长,荧光倒置显微镜(Olympus IX53)下观察、拍照。
3.4Transwell小室细胞迁移实验 消化并收集锌离子干预浓度相同的BEL-7404细胞于同一只离心管中,离心去培养基,PBS洗2次后,用无血清培养基重悬细胞,并调整细胞悬液浓度到5.0×108/L;取出Transwell小室,置于24孔板内,下室加入含有10% FBS的完全培养基600 μL,上室加入无血清细胞悬液100 μL。37 ℃、5% CO2条件下培养24 h;将小室的上室取出,用棉签擦去上室内未迁移的细胞, PBS液漂洗小室2遍;用4%多聚甲醛固定上室20 min;取固定后的上室细胞,PBS漂洗2遍,适当风干后用0.5%结晶紫染色20 min,PBS漂洗2遍,风干。倒置显微镜(ZEISS AxioCam ERc 5s)高倍镜下任意选取5个不相同的视野,拍照并计数细胞。
3.5Transwell小室细胞侵袭实验 铺胶前1 d将事先分装好的Matrigel martrix基质胶取出, 4 ℃冰盒过夜;实验器具-20 ℃过夜预冷;第2天用预冷过的RPMI-1640以基质胶∶RPMI-1640=1∶29的比例稀释,迅速往每个小室的上室加入75 μL稀释后的基质胶,37 ℃静置3 h。消化并收集药物干预浓度相同的BEL-7404细胞于同一只离心管中,离心去培养基,PBS清洗2次,用无血清培养基重悬细胞,并调整细胞悬液浓度到1.0×109/L;向已铺好基质胶的Transwell小室加入无血清细胞悬液100 μL,下室加入含有10% FBS的完全培养基600 μL,37 ℃、5%CO2条件下培养48 h;将小室的上室取出,用棉签擦去上室内未迁移的细胞, PBS液漂洗小室2遍;用4%多聚甲醛固定上室20 min;取固定后的上室细胞,PBS漂洗2遍,适当风干后用0.5%结晶紫染色20 min,PBS漂洗2遍,风干。倒置显微镜(ZEISS AxioCam ERc 5s)高倍镜下任意选取5个不相同的视野,拍照并计数细胞。
3.6DNA倍体法检测细胞周期分布 消化并收集锌离子干预浓度相同的BEL-7404细胞于同一只离心管中,1 000 r/min离心5 min,用完全培养基重悬细胞,并调整细胞悬液浓度到1.0×109/L;取1 mL单细胞悬液离心,去除培养基,再用PBS洗2次;离心去PBS液后,加入1 mL DNA染色液(已含有PI和RNase)和10 μL破膜剂,漩涡振荡器上振荡5~10 s,避光30 min。在FACSCalibur流式细胞仪上对样本进行检测。运用Modfit软件分析计算实验结果。
3.7AO/EB荧光染色实验 消化并收集锌离子干预浓度相同的BEL-7404细胞, 1 000 r/min离心5 min,并调整细胞悬液浓度到6.0×109/L; PBS液洗涤细胞2次,将AO和EB染料等体积混合;吸取25 μL的细胞悬液同1 μL的混合染料轻轻混匀,吸取上述10 μL的混合液置于一洁净的载玻片,并用盖玻片盖上细胞,荧光显微镜510 nm激发波长观察,拍照记录,并计算细胞凋亡率,一次计数的细胞总数应大于200个。细胞凋亡率(%)=(凋亡早期细胞+凋亡晚期细胞)/细胞总数×100%。
3.8Real-time PCR检测BEL-7404细胞白蛋白(albumin,ALB)的mRNA表达 以TRIzol法提取相同浓度硫酸锌干预后的BEL-7404细胞的总RNA,用紫外分光光度仪对RNA纯度与浓度进行测定,分别取1 μg RNA按照RNA逆转录试剂盒的要求逆转录为cDNA,以SYBR GreenⅠ为荧光染料,在real-time PCR仪(ABI ViiATM7)上进行扩增。反应体系为25 μL。反应条件为:预变性95 ℃ 10 min;变性95 ℃ 15 s, 退火/延伸60 ℃ 1 min,共40个循环。熔解曲线分析条件为: 95 ℃ 15 s, 60 ℃ 1 min, 95 ℃ 15 s, 60 ℃ 15 s。以GAPDH为内参照基因,采用相对定量的方法,根据2-ΔΔCt计算公式对结果进行数据分析。扩增引物序列见表1。
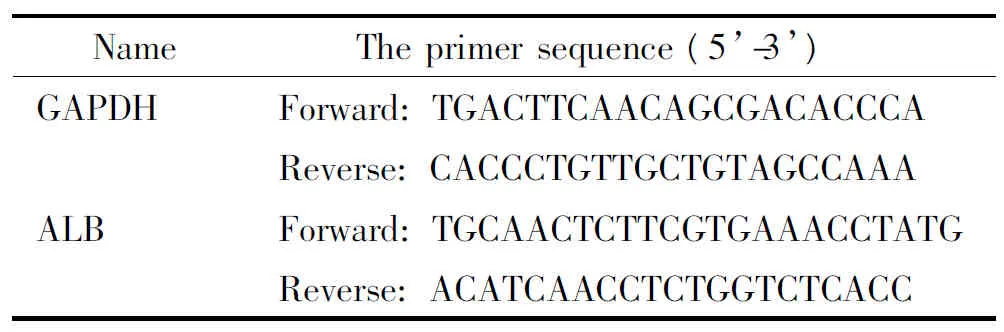
表1 引物序列
3.9Western blot法检测BEL-7404细胞白蛋白的表达 按1×105∶1的比例加入细胞裂解液提取处于对数生长期HCC细胞株BEL-7404的总蛋白,经紫外分光光度计(Beckman DU640)测定含量后,分别取等量总蛋白99 ℃变性5 min,进行12% SDS-PAGE,电转移至NC膜上;封闭NC膜1 h,加入相应抗体4 ℃孵育过夜,其中GAPDH和白蛋白兔抗购自CST;TBS洗涤后,加辣根过氧化物酶标记的羊抗兔IgG(KPL),室温孵育1 h;TBS洗涤后加LumiGLO Chemiluminescent Substrate(KPL)室温下孵育1 min,曝光,洗片,然后在GelDoc凝胶图像分析仪(Bio-Rad)上扫描条带的灰度,并以GAPDH为内参照,计算白蛋白的相对表达量。
4 统计学处理
采用GraphPad Prism 5.0作图;采用IBM SPSS Statistics 23.0进行统计学分析。各组实验均重复3次,所有计量资料用均数±标准差(mean±SD)表示,采用Kolmogorov-Smirnov法作正态性检验,对符合正态分布的数据,2组样本均值的差异比较采用t检验,多组样本行Levene方差齐性检验,方差齐即采用单因素方差分析(one-way ANOVA)进行组间差异的显著性检验,并用LSD法或Dunnett-t检验进行两两比较;若方差不齐,采用Dunnetts’s T3和Games-Howell法进行多重比较。以P<0.05为差异有统计学意义。
结 果
1 MTT法检测锌离子对BEL-7404细胞的抑制作用
以0 μmol/L的硫酸锌作为对照组,MTT法检测结果显示,在加入锌离子的第3天开始, 12.5 μmol/L组的细胞存活率开始降低(P<0.05); 25 μmol/L组的细胞存活率则是在加入锌离子的第2天开始降低(P<0.05);在加入锌离子的第1天开始,50、75、100和125 μmol/L组的细胞存活率均明显降低(P<0.01)。此外,随着锌离子作用时间的延长,各实验组细胞的存活率呈递减趋势,见图1。
在发电状态下,主电机运行在3 kV额定电压下,超过1.5倍额定电压下作用于跳闸。因为f=np/60(f为频率,n为转速,p为极对数),因为电机的极对数一定,即转速与频率成正比,频率高,这就显示转速高,设定当f大于1.2额定频率时,保护作用于跳闸。
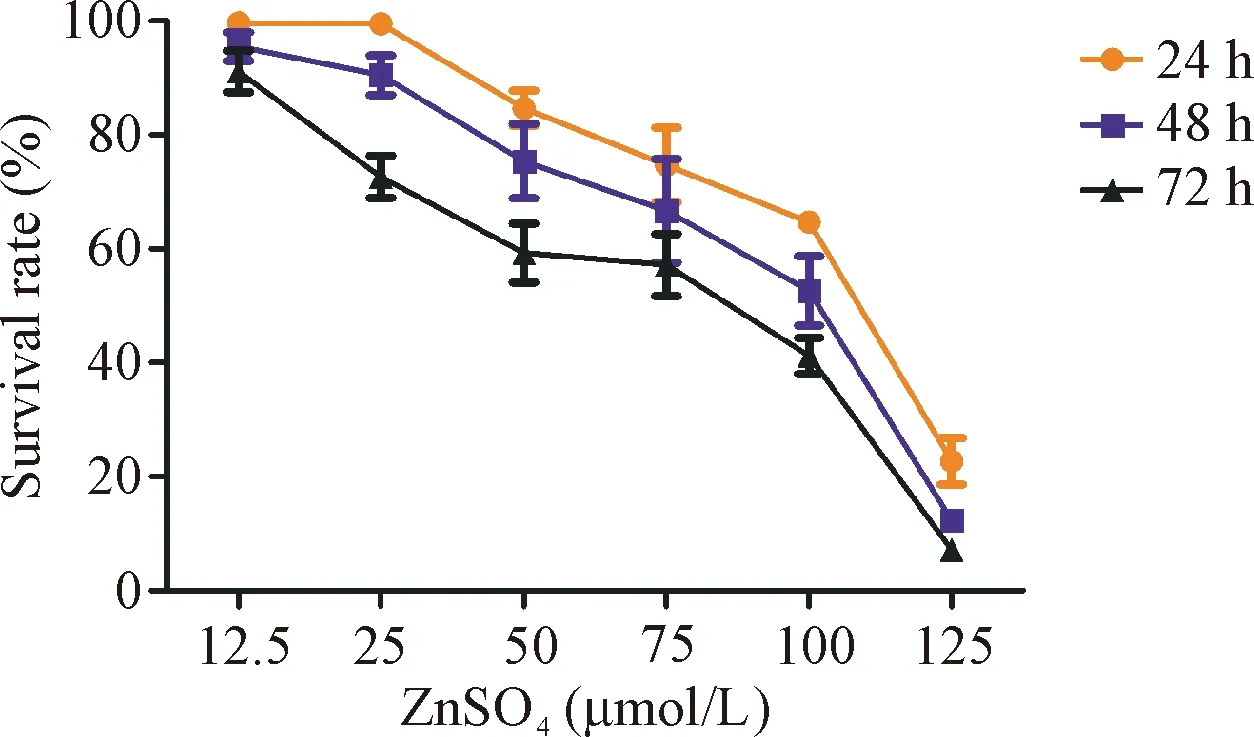
Figure 1. The effect of Zn2+on the viability of BEL-7404 cells. Mean±SD.n=5.
图1锌离子刺激对BEL-7404细胞活力的影响
2 TSQ锌离子探针检测BEL-7404细胞内锌离子
TSQ锌离子探针与Zn2+结合后,吸收波长和发射波长分别位于360 nm和495 nm。以TSQ对经过硫酸锌预处理48 h的BEL-7404细胞株进行染色,在495 nm激发波长下以相同的曝光时间观察实验组与对照组,蓝色荧光即为锌离子所处位置,荧光强度越强,表明锌离子含量越高。结果可见,细胞内锌离子并非分布均匀,而是大量分布于细胞质内,仅少数位于细胞核内;随着硫酸锌浓度提高,蓝色荧光越来越强,可见部分形成颗粒状聚集。经过ImageJ软件分析所得不同硫酸锌刺激下细胞的平均光密度进行相对定量比较,结果显示利用50 μmol/L和100 μmol/L的硫酸锌刺激细胞48 h后,细胞内平均光密度皆明显高于对照组(P<0.05),见图2。
3 Transwell小室法检测锌离子对BEL-7404细胞迁移能力的影响
通过计数相同面积内穿过小室的细胞数,与预处理时不加入硫酸锌(即0 μmol/L)的细胞比较,结果显示50 μmol/L和100 μmol/L的硫酸锌实验组细胞的迁移能力随锌离子浓度升高而明显降低(P<0.05),见图3。
4 Transwell小室法检测锌离子对BEL-7404细胞侵袭能力的影响
通过计数相同面积内穿过小室的细胞数,与预处理时不加入硫酸锌(即0 μmol/L)的细胞比较,结果显示50 μmol/L和100 μmol/L的硫酸锌实验组细胞的侵袭能力随锌离子浓度升高而明显降低(P<0.05),见图3。
5 不同浓度锌离子对BEL-7404细胞周期的影响
DNA倍体法检测经过硫酸锌预处理48 h的细胞,结果显示随着锌离子浓度升高,细胞处于G2/M期的比例增加,处于G0/G1期的比例减少;其中50 μmol/L组与100 μmol/L组G2/M期的细胞比例明显高于0 μmol/L组(P<0.01),100 μmol/L组G0/G1期的细胞比例明显低于0 μmol/L组(P<0.05),见图4。
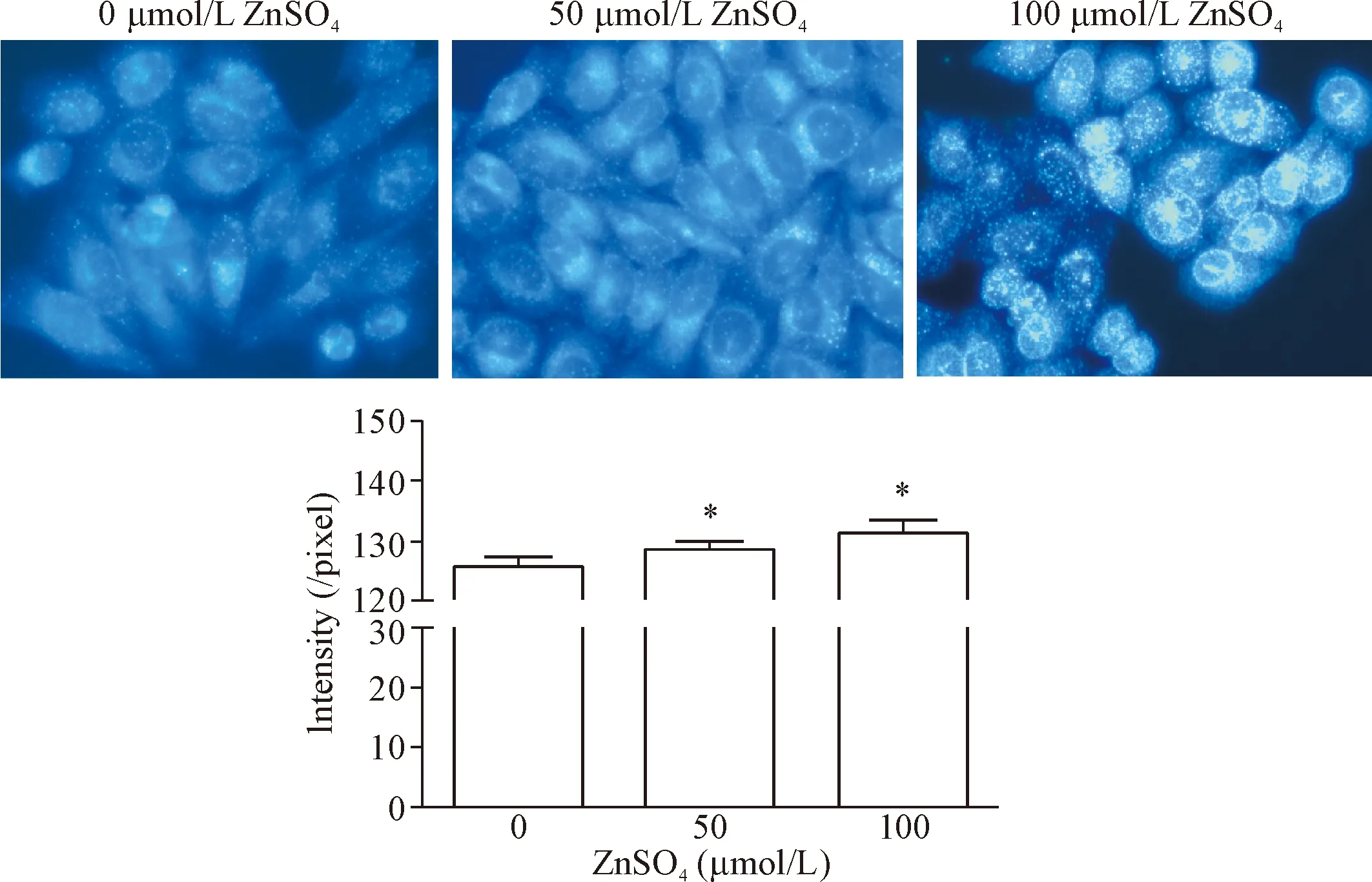
Figure 2. TSQ fluorescence staining of the BEL-7404 cells stimulated by Zn2+at different concentrations (×400). Mean±SD.n=3.*P<0.05vs0 μmol/L group.
图2不同浓度硫酸锌刺激下BEL-7404细胞TSQ荧光染色实验
6 不同浓度锌离子对BEL-7404细胞凋亡的影响
利用AO/EB染色法分别对经过硫酸锌预处理48 h的BEL-7404细胞株进行染色,荧光显微镜下观察可见, 0 μmol/L组细胞绝大部分呈圆形,细胞浆与核质体被均匀染成绿色,核染色质结构正常,大小形状较单一,为正常细胞;而在50 μmol/L硫酸锌刺激BEL-7404细胞48 h后,镜下可以见到一定量的核质体呈橙色,染色质固缩甚至破裂的晚期凋亡细胞;在100 μmol/L硫酸锌处理组,镜下可见晚期凋亡细胞明显增多,凋亡率明显高于0 μmol/L组(P<0.01),见图5。
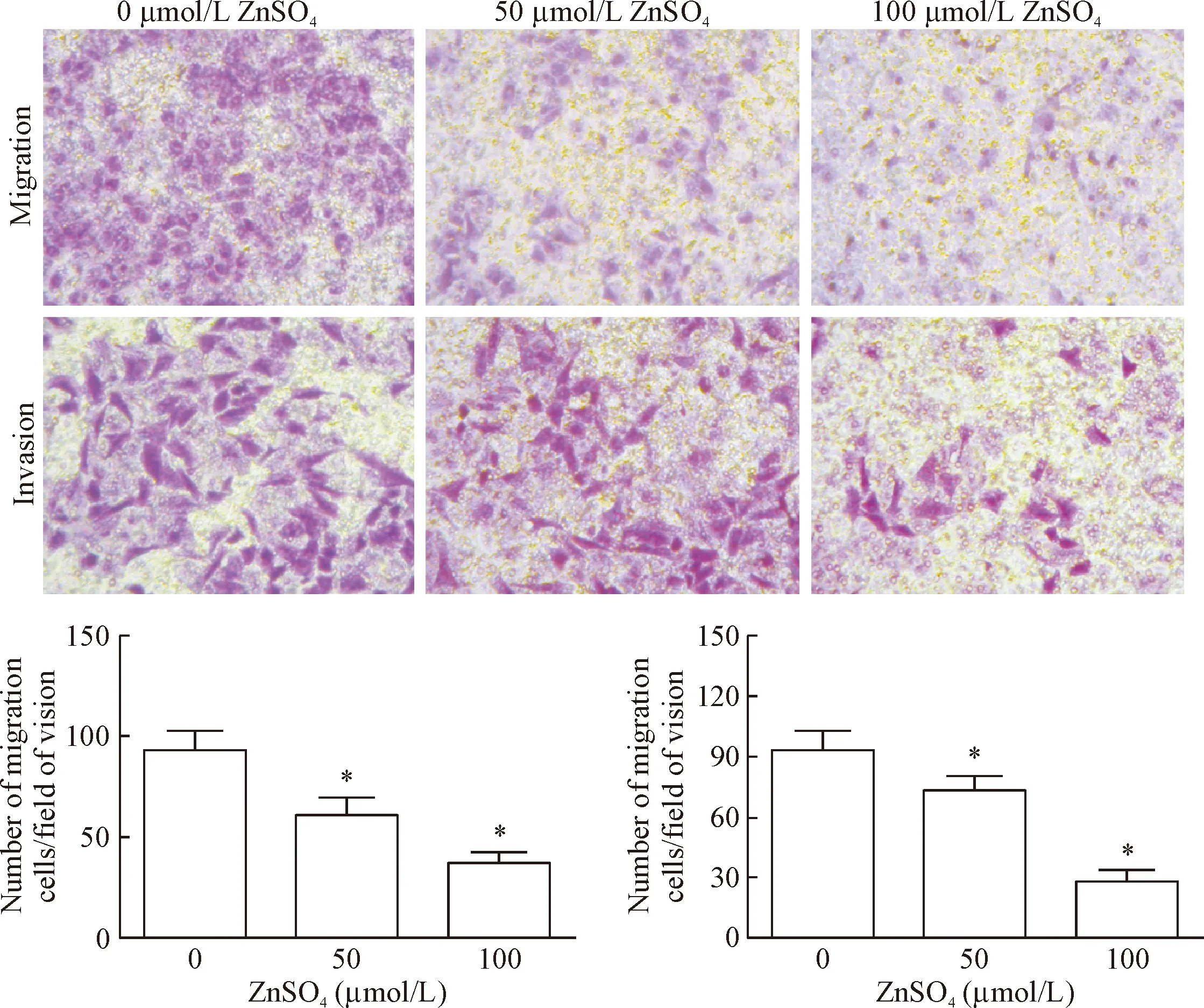
Figure 3. The effect of Zn2+on the migration and invasion abilities of BEL-7404 cells (×200). Mean±SD.n=3.*P<0.05vs0 μmol/L group.
图3锌离子刺激对BEL-7404细胞迁移和侵袭能力的影响
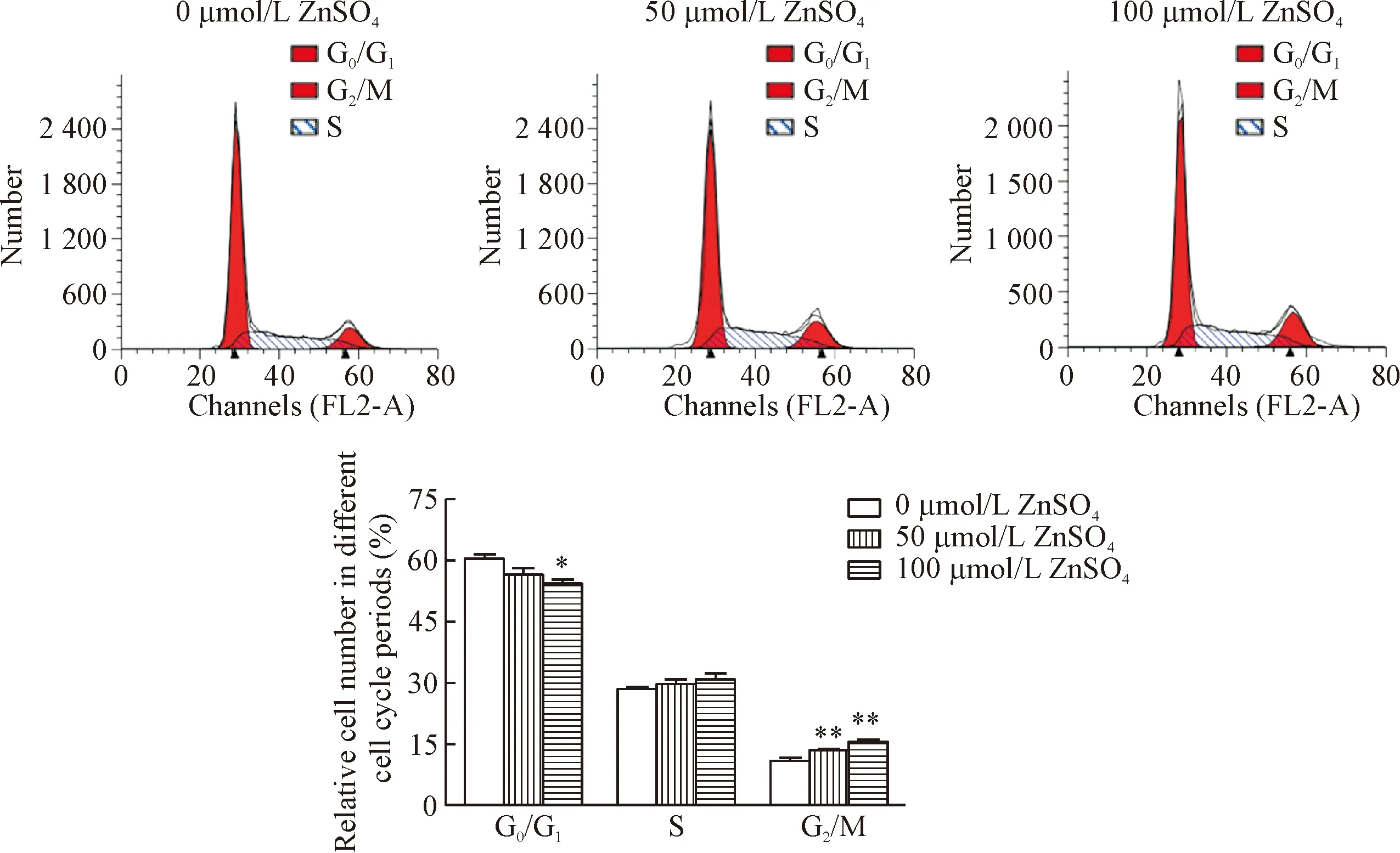
Figure 4. The effect of Zn2+on the cell cycle distribution of BEL-7404 cells. Mean±SD.n=3.*P<0.05,**P<0.01vs0 μmol/L group.
图4锌离子刺激对BEL-7404细胞周期分布的影响
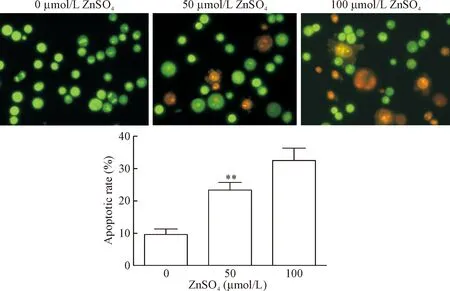
Figure 5. The effect of Zn2+on the cell apoptosis of BEL-7404 cells (×200). A: the images of AO/EB fluorescence staining of the cells stimulated with Zn2+at different concentrations; B: the apoptotic rate of the cells stimulated with Zn2+at different concentrations. Mean±SD.n=3.**P<0.01vs0 μmol/L group.
图5锌离子刺激对BEL-7404细胞凋亡的影响
7 Real-time PCR检测锌离子对BEL-7404细胞白蛋白 mRNA表达的影响
Real-time PCR检测经过硫酸锌预处理48 h的细胞,结果显示随着锌离子浓度升高,细胞白蛋白的mRNA表达水平呈现升高的趋势,100 μmol/L组细胞白蛋白的mRNA表达水平与0 μmol/L组相比较,差异具有统计学意义(P<0.05),见图6。
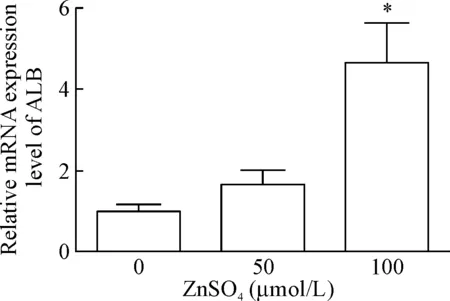
Figure 6. The effect of Zn2+on the mRNA expression of albumin in BEL-7404 cells. GAPDH served as internal control. Mean±SD.n=3.*P<0.05vs0 μmol/L group.
图6锌离子刺激对BEL-7404细胞白蛋白mRNA表达的影响
8 Western blot检测锌离子对BEL-7404细胞白蛋白表达的影响
Western blot检测经过硫酸锌预处理48 h的BEL-7404细胞,结果显示,随着锌离子浓度升高,细胞白蛋白的蛋白表达水平呈现升高的趋势,100 μmol/L组细胞白蛋白的蛋白表达水平与0 μmol/L组相比较,差异具有统计学意义(P<0.05),见图7。
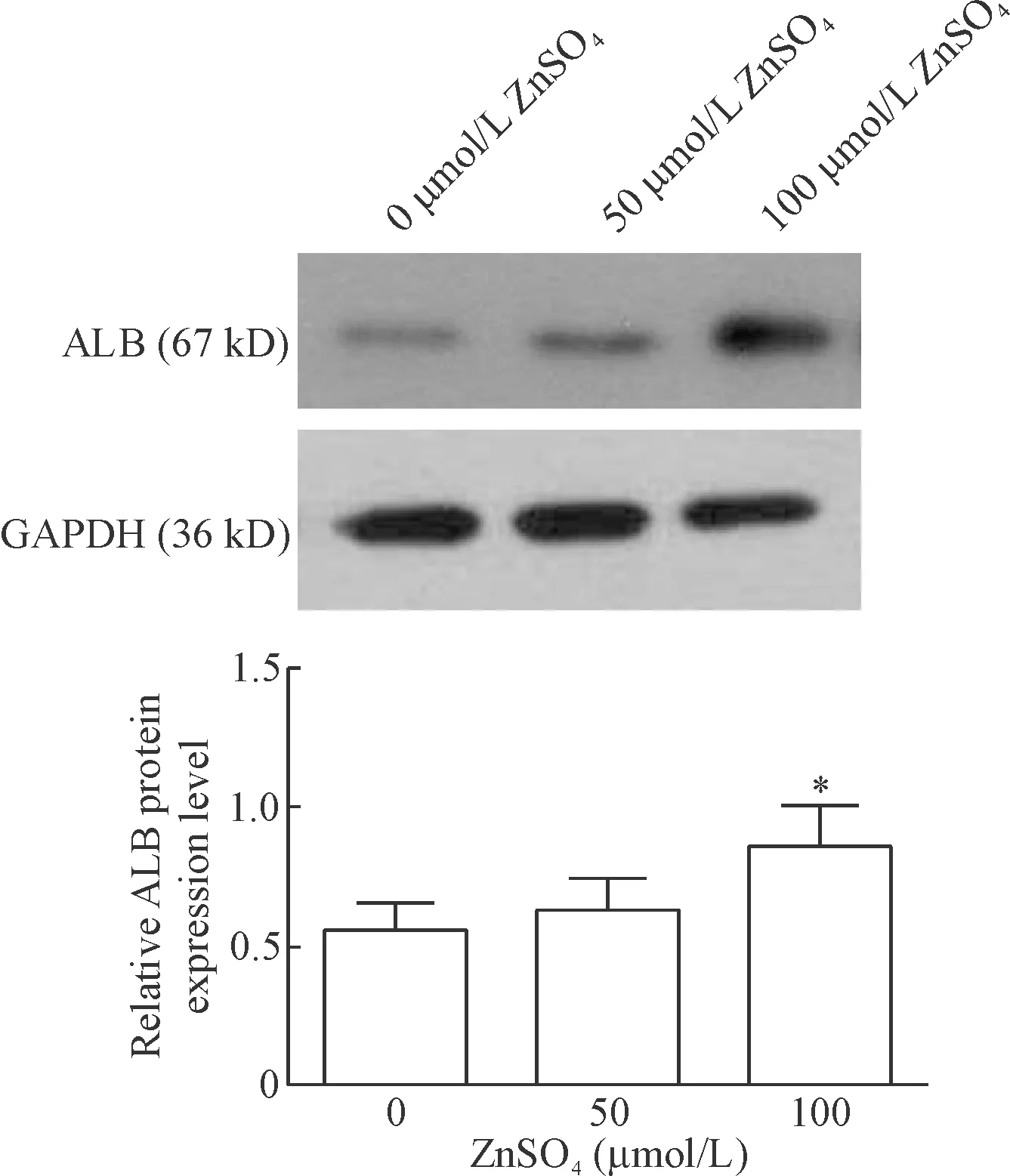
Figure 7. The effect of Zn2+on the protein expression of albumin in BEL-7404 cells. Mean±SD.n=3.*P<0.05vs0 μmol/L group.
图7锌离子刺激对BEL-7404细胞白蛋白表达的影响
讨 论
人体正常的血清锌浓度大约为12~16 μmol/L[2](参考值范围随测定方法的不同而略有起伏)。Poo 等[4]发现,HCC患者的血清锌浓度低于其他消化道疾病或者非肝病患者,提示HCC患者体内存在着低锌的环境;同时,也有研究发现HCC患者癌组织的锌浓度,明显低于癌旁组织与正常对照组肝脏组织的锌浓度[3-7]。血清锌水平的降低可导致HCC患者体内处于缺锌的环境,从而影响肝脏组织锌的含量,而这些生理变化都可能与HCC的发生发展有关。此外,哺乳动物细胞对锌的摄取必须依靠细胞膜上的锌转运蛋白家族——SLC39基因家族。SLC39基因家族编码ZIP蛋白(Zrt-and Irt-like proteins)[8],ZIP蛋白可促进细胞外的锌内流入细胞浆内[9]。zip14基因是SLC39基因家族成员之一,在人类肝脏组织表达丰富,对肝细胞的锌内流起重要作用。研究表明ZIP14在HCC癌组织的表达亦呈现明显下调[7];有学者认为HCC细胞通过下调ZIP14蛋白的表达以减少细胞锌的内流,以营造出一个更适合其增殖和转移的低锌环境[10],提示HCC癌组织锌含量的减少可能参与了疾病的发生发展进程。因此本课题组研究了不同浓度硫酸锌刺激在体外培养环境下对HCC细胞BEL-7404生物学行为的影响,探讨是否可以将锌作为一种补充的治疗手段,用于HCC的治疗中。
TSQ锌离子荧光探针检测结果显示,随着培养液中添加的硫酸锌浓度的增大,细胞被激发出的荧光强度增强,表明进入细胞内的锌离子含量随之增高。通过MTT检测,我们发现BEL-7404细胞存活率随着硫酸锌浓度的升高/或培养时间的延长而降低,且当刺激细胞的硫酸锌浓度达到125 μmol/L时,细胞的存活率最低,提示一定剂量的锌对HCC细胞的活力具有抑制作用。细胞周期分析结果显示硫酸锌刺激细胞处于G2/M期的比例明显增加, G0/G1期的比例减少;同时,AO/EB荧光染色实验提示随着刺激的锌离子浓度升高,BEL-7404的凋亡率也随之升高,提示BEL-7404细胞被阻滞在G2/M期后走向凋亡,这与Wang 等[11]利用硫酸锌刺激人乳腺癌细胞株MDAMB231的研究结果有异曲同工之处。而进一步证明锌离子刺激造成BEL-7404的凋亡及相关机制,还有待我们后续进一步展开研究。同时我们的实验结果发现,随着刺激细胞的锌离子浓度增加,BEL-7404的迁移和侵袭能力明显下降,预处理细胞时分别加入50 μmol/L和100 μmol/L的硫酸锌实验组细胞的迁移和侵袭能力皆随锌离子浓度升高而明显降低。
肝细胞合成白蛋白的能力与细胞分化程度密切相关[12],而HCC患者由于细胞的癌变,肝脏合成白蛋白的能力明显下降。我们的研究发现,BEL-7404细胞白蛋白的mRNA和蛋白的表达量会随着培养环境中硫酸锌浓度的升高而升高,在高浓度锌刺激下表现的尤为突出,提示锌的刺激可能提高HCC细胞的分化程度,有助于降低其恶性表型。
综上所述,本研发现锌离子刺激可抑制HCC细胞的生长、迁移与侵袭能力,诱导细胞凋亡,阻滞细胞周期在G2/M期,并可能降低细胞的恶性表型,以上研究成果的取得为HCC辅助治疗手段的发展提供了新的思路。
[1] Mao X, Kim BE, Wang F, et al. A histidine-rich cluster mediates the ubiquitination and degradation of the human zinc transporter, hZIP4, and protects against zinc cytotoxicity[J]. J Biol Chem, 2007, 282(10):6992-7000.
[2] Rink L, Gabriel P. Zinc and the immune system[J]. Proc Nutr Soc, 2000, 59(4):541-552.
[3] Danielsen A, Steinnes E. A study of some selected trace elements in normal and cancerous tissue by neutron activation analysis[J]. J Nucl Med, 1970, 11(6):260-264.
[4] Poo JL, Rosas-Romero R, Montemayor AC, et al. Diagnostic value of the copper/zinc ratio in hepatocellular carcinoma: a case control study[J]. J Gastroenterol, 2003, 38(1):45-51.
[5] Liaw KY, Lee PH, Wu FC, et al. Zinc, copper, and superoxide dismutase in hepatocellular carcinoma[J]. Am J Gastroenterol, 1997, 92(12):2260-2263.
[6] 易 斌, 陈 宇, 梁湘辉, 等. 肝病患者血清铜、锌含量研究[J]. 湖南医科大学学报, 2002, 27(3):295-296.
[7] Franklin RB, Levy BA, Zou J, et al. ZIP14 zinc transporter downregulation and zinc depletion in the development and progression of hepatocellular cancer[J]. J Gastrointest Cancer, 2012, 43(2):249-257.
[8] Eide DJ. The SLC39 family of metal ion transporters[J]. Pflugers Arch, 2004, 447(5):796-800.
[9] Liuzzi JP, Cousins RJ. Mammalian zinc transporters[J]. Annu Rev Nutr, 2004, 24:151-172.
[10] Costello LC, Franklin RB. The status of zinc in the deve-lopment of hepatocellular cancer: an important, but neglected, clinically established relationship[J]. Cancer Biol Ther, 2014, 15(4):353-360.
[11] Wang YH, Zhao WJ, Zheng WJ, et al. Effects of different zinc species on cellar zinc distribution, cell cycle, apoptosis and viability in MDAMB231 cells[J]. Biol Trace Elem Res, 2016, 170(1):75-83.
[12] Tashiro H, Kawamoto T, Okubo T, et al. Variation in the distribution of trace elements in hepatoma[J]. Biol Trace Elem Res, 2003, 95(1):49-63.
Effects of zinc on biological behavior of hepatocellular carcinoma cell line BEL-7404
ZHENG Jia-ying1, 2, LI Ya-dong1, 2, ZHENG Qing-zhu1, 2, QIU Fu-nan1, 3, WU Yan-an1, 2, HUANG Yi1, 2
(1ProvincialClinicalCollege,FujianMedicalUniversity,2DepartmentofClinicalLaboratory,3DepartmentofHepatobiliarySurgery,FujianProvincialHospital,Fuzhou350001,China.E-mail:hyi8070@126.com)
AIM: To observe the effects of exogenous zinc on the biological behavior of hepatocellular carcinoma (HCC) cell line BEL-7404.METHODSBEL-7404 cells were cultured with zinc sulfate at various concentrations. The intracellular concentration of zinc, cell viability, cell cycle, cell apoptosis and migration and invasion abilities were measured by TSQ fluorescent probe, MTT assay, DNA ploid analysis, acridine orange/ethidium bromide fluorescence staining and Transwell assay, respectively. The mRNA and protein expression levels of albumin in the BEL-7404 cells were determined by real-time PCR and Western blot, respectively.RESULTSWith the elevated concentration of zinc in culture condition, the concentration of zinc in the BEL-7404 cells was increased (P<0.05). The cell viability and migration and invasion abilities were decreased, while the apoptotic rate was increased (P<0.05). The cells in G0/G1phase were decreased, while the cells in G2/M phase were increased. Additionally, the mRNA and protein expression of albumin also increased (P<0.05).CONCLUSIONThe zinc ion inhibits the cell viability as well as migration and invasion abilities, blocks the cells in G2/M phase, and may reduce cell malignant phenotype.
Hepatocellular carcinoma; BEL-7404 cells; Zinc
1000- 4718(2017)12- 2165- 07
2017- 05- 23
2017- 07- 27
福建省科技计划重点项目(No. 2014Y0009);福建省卫生系统中青年骨干人才培养项目(No. 2013-ZQN-JC-2)
△通讯作者 Tel: 0591-88217895; E-mail: hyi8070@126.com
R730.23; R363
A
10.3969/j.issn.1000- 4718.2017.12.009
(责任编辑: 卢 萍, 罗 森)

