山茱萸提取物对大鼠原发性肝癌组织中B7-H6表达的影响
肖鹏 白桦 栗敏 刘桂举 李瑞君 梅家转
山茱萸提取物对大鼠原发性肝癌组织中B7-H6表达的影响
肖鹏 白桦 栗敏 刘桂举 李瑞君 梅家转
目的:探讨山茱萸提取物对原发性肝癌(hepatocellular carcinoma,HCC)大鼠B7-H6表达的影响。方法:选取60只SD大鼠随机分为模型组、苦参碱组和山茱萸组,以二乙基亚硝胺诱发大鼠模型,分别给予苦参碱组和山茱萸组大鼠相应药物灌胃,模型组大鼠给予0.9%NaCl溶液灌胃。计数各组大鼠肝脏表面的癌结节数及其抑瘤率;经H&E染色后观察各组大鼠肝癌组织的病理学改变。应用免疫组织化学法和Western blot法检测模型组、苦参碱组和山茱萸组大鼠肝癌组织中B7-H6的表达。结果:苦参碱组和山茱萸组大鼠的肝癌结节数明显少于模型组(P<0.05);山茱萸组的抑瘤率显著高于苦参碱组(P<0.05)。免疫组织化学结果显示,山茱萸组和苦参碱组肝癌组织中B7-H6的阳性表达显著高于模型组(P<0.05),山茱萸组B7-H6的阳性表达显著高于苦参碱组(P<0.05)。Western blot法结果显示,山茱萸组和苦参碱组B7-H6的蛋白表达显著高于模型组(P<0.05),山茱萸组B7-H6的蛋白表达显著高于苦参碱组(P<0.05)。结论:山茱萸提取物可能通过上调肿瘤组织B7-H6的表达,抑制大鼠肝癌组织的生长。
原发性肝癌 山茱萸提取 苦参碱 SD大鼠 B7-H6
原发性肝细胞肝癌(hepatocellular carcinoma,HCC)在中国恶性肿瘤致患者死亡人数中排名第2位[1]。尽管手术治疗仍为HCC的最有效的治疗方式,但是对于部分无法行手术治疗的HCC患者,特别是晚期HCC患者的治疗一直未取得实质性进展。因此,基因治疗显得尤为重要。NK细胞是重要的抗肿瘤效应细胞,通过其表面的活化性受体识别肿瘤细胞表面对应的配体而行使其杀伤功能。肿瘤细胞表达的这些配体由自身基因编码,通过应激条件在细胞表面过表达,因此被称为应激诱导的识别[2]。NCR3(natural cytotoxicity receptors 3,NCR3)是新近发现的重要NK细胞活化性受体,B7-H6是已知唯一一种膜蛋白形式表达NCR3的配体,B7-H6在正常组织细胞表面不表达,却能在肿瘤细胞表面表达[3]。有研究发现,B7-H6通过与NK细胞表面的活化受体NCR3结合激活并促进NK细胞释放TNFα、IFNγ杀伤靶细胞等[4-5],是NK细胞肿瘤免疫的重要机制之一。有研究表明,山茱萸提取物具有调节免疫、降低氧化应激以及抗肿瘤等作用[6],但其机制尚不明确。本研究通过观察山茱萸提取物对HCC大鼠模型HCC组织中B7-H6表达的影响,探讨了其抑制HCC生长的可能机制。
1 材料与方法
1.1 实验对象
SPF级Sprague Dawley雄性近交系大鼠60只,购自武汉大学实验动物中心[动物生产许可证号为SCXK(鄂)2008-0004],平均体质量为(200±20)g。HCC的HepG2细胞系购自中国科学院上海细胞生物学研究所。
1.2 主要试剂和仪器
山茱萸黄酮提取方法:山茱萸药材粉碎以10倍量95%乙醇回流提取8 h,脱脂冷却抽滤,浓缩,乙醇沉淀除去蛋白质,干燥得到粗提物[7]。苦参碱注射液购自山西振东泰盛制药有限公司(批号:20059335);二乙基亚硝胺(diethylnitrosamine,DEN)购自美国Sigma公司;0.9%氯化钠注射液购自山东鲁抗辰欣药业有限公司(批号:20071011);免疫组织化学检测试剂盒Max VisionTM和EDTA抗原修复液均购自武汉博士德生物工程有限公司;DAB显色剂购自丹麦Dako公司;RIPA buffer购自广州泛思生物科技有限公司;兔抗人B7-H6多克隆抗体购自美国Santa Cruz公司;兔抗人β-actin多克隆抗体购自上海合星生物科技有限公司;辣根过氧化物酶标记的山羊抗兔IgG购自上海酶联生物科技有限公司;BCA蛋白定量试剂盒购自上海研谨生物科技有限公司;四唑硝基蓝(tetranitrobluetetrazolium chloride,NBT)/5-溴-4-氯-3-吲哚基-磷酸盐(5-bromo-4-chloro-3-indolylphosphate,BCIP)染色试剂盒购自北京赛驰生物科技有限公司;凝胶图像处理系统购自上海天能科技有限公司。
1.3 方法
1.3.1 实验分组、动物模型建立及各组的给药方法所有大鼠分笼饲养,各组均给予标准化饲料,自由饮水。实验在通风、25℃、相对湿度为70%的二级生物安全(P2)实验室进行。大鼠随机分为模型组、苦参碱组和山茱萸组,20只/组。3组大鼠均腹腔注射DEN(50 mg/kg)建立HCC模型,1次/d,5次/周,共16周。第17周的首日,将山茱萸提取物60 mg/kg·d给予山茱萸组大鼠灌胃治疗,灌胃容量为0.2 mL/10 g大鼠体质量,1次/d,连续给药2周。将15 mL苦参碱(150 mg)溶入500 mL蒸馏水中,配成质量浓度为300 mg/L的苦参碱溶液,给予苦参碱组大鼠灌胃治疗,灌胃容量为0.2 mL/10 g大鼠体质量,1次/d,连续给药2周。模型组大鼠给予等量0.9%NaCl注射液灌胃。
1.3.2 观察各组大鼠肿瘤的变化 各组大鼠给药结束后24 h脱颈处死,观察各组大鼠的肿瘤生长情况,仔细计数各组肝脏表面的HCC结节数,并且计算各组肿瘤形成率(肿瘤形成率=形成肿瘤的大鼠数/大鼠总数)。仔细剥离大鼠肝肿瘤组织,称量模型组、苦参碱组和山茱萸组的大鼠瘤重,计算各组抑瘤率。抑瘤率=(模型组平均瘤重-山茱萸组或苦参碱组平均瘤重)/模型组平均瘤×100%[5]。
1.3.3 H&E染色观察大鼠肝组织的病理学结构改变 选取各组大鼠的肿瘤组织标本,组织缓冲液冲洗干净,再以3.5%甲醛溶液固定,石蜡包埋,进行4 μm连续切片,常规H&E染色,在光学显微镜下观察各组大鼠HCC组织的病理改变。
1.3.4 应用免疫组织化学法检测各组大鼠HCC组织中B7-H6的表达 选取各组石蜡切片常规脱蜡水化,再以3%过氧化氢溶液抑制内源性过氧化物酶的活性,EDTA抗原修复液进行抗原修复;PBS冲洗,将1:75稀释的兔抗人B7-H6多克隆抗体滴在切片上,放于4℃冰箱中过夜;滴加1:500稀释的辣根过氧化物酶标记的山羊抗兔IgG,在室温条件下反应10 min;使用DAB显色,苏木精对比染色;脱水,并用中性树胶封片。实验以PBS代替一抗作为阴性对照,用已知的阳性切片作为阳性对照。
1.3.5 应用Western blot法检测各组大鼠HCC组织中B7-H6蛋白的表达水平 提取每组大鼠HCC组织,加入1 mL RIPA buffer裂解,于4℃离心5 min,取上清液,考马斯亮蓝法进行蛋白定量。取10 μg/孔的蛋白质进行10%SDS-PAGE,将电泳分离后的蛋白质电转移至硝基纤维膜上并予5%脱脂奶粉封闭1 h,加入1:1 000稀释的兔抗人B7-H6或β-actin(内参照)多克隆抗体,在4℃冰箱中摇晃过夜;次日取出室温下复温30 min,TBST摇床洗涤3次,室温避光孵育荧光二抗,应用Quality One软件分析蛋白表达。
1.3.6 应用Western blot法检测HCC的HepG2细胞B7-H6蛋白的表达水平 取对数生长期HepG2细胞消化,制备细胞悬液,调整细胞浓度为l×104/L,接种于6孔板内(2 mL/孔)。培养24 h后,分3组(模型组、苦参碱组、山茱萸组),再培养24 h。蛋白质浓度用BCA法检测,各样本稀释成统一浓度,进行10%聚丙烯酰胺凝胶电泳,电泳后,转移到硝酸纤维素膜上,按1:1 000稀释B7-H6抗体,在4℃孵育过夜,洗膜后,用1:2 000稀释的二抗孵育2 h,应用Quality One软件分析蛋白表达。
1.4 统计学分析
采用SPSS 15.0软件对结果数据进行统计学分析。计量数据以表示,采用方差分析,组间两两比较采用SNK法;抑瘤率的比较采用χ2检验。以P<0.05为差异具有统计学意义。
2 结果
2.1 各组大鼠的肿瘤形成率、肿瘤结节数、肿瘤质量及抑瘤率的比较
模型组14只大鼠成瘤,苦参碱组和山茱萸组各有14和15只大鼠成瘤。模型组与两组干预组的肿瘤形成率比较,差异无统计学意义(P>0.05)。两组干预组的肿瘤结节数和肿瘤质量均明显低于模型组(P<0.05)。其中以山茱萸组的肿瘤质量最低(P<0.05),其抑瘤率明显高于苦参碱组大鼠(P<0.05,表1)。
2.2 各组大鼠肝组织的病理学改变
H&E染色结果显示,各组大鼠均形成肝细胞肝癌,模型组大鼠肝组织中肝索排列紊乱,肝窦变窄甚至消失,肝小叶内可见大量碎片状坏死,坏死细胞周围伴随增生的纤维细胞和大量炎性细胞浸润,形成数个假小叶,伴有显著的肝细胞再生结节,并可见癌巢生成,癌细胞呈多形性和多角形,细胞核大,核仁明显深染,同时可见多核巨细胞。山茱萸组和苦参碱组大鼠肝组织也有轻度破坏,但与模型组比较,肝细胞变性、坏死均显著减轻,并且癌结节数、癌灶的数目及大小均有明显地减少、缩小,可见细胞体积固缩,有部分细胞裂解,形成大小不一的凋亡小体状结构和凋亡细胞核,染色质浓缩。与苦参碱组比较,山茱萸组大鼠肝组织炎性细胞浸润减轻、癌结节数减少更显著,可见更多凋亡小体(图1)。
2.3 免疫组织化学法检测各组大鼠肝组织中B7-H6蛋白的表达
免疫组织化学法检测显示,苦参碱组和山茱萸组大鼠HCC组织中B7-H6的阳性表达明显高于模型组,山茱萸组大鼠HCC组织中B7-H6的阳性表达率明显高于苦参碱组(图2)。

表1 各组大鼠的肿瘤形成率、肿瘤结节数、肿瘤质量及抑瘤率的比较Table 1 Comparison of the tumor formation rate,tumor nodule number,tumor weight,and tumor inhibition rate of each group
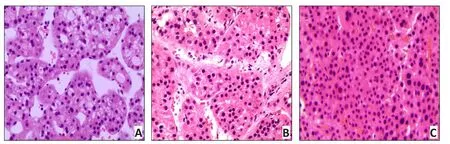
图1 各组大鼠肝组织的病理学改变 (H&E×200)Figure 1 Hematoxylin-eosin staining of pathological changes of liver tissue in each group(H&E×200)
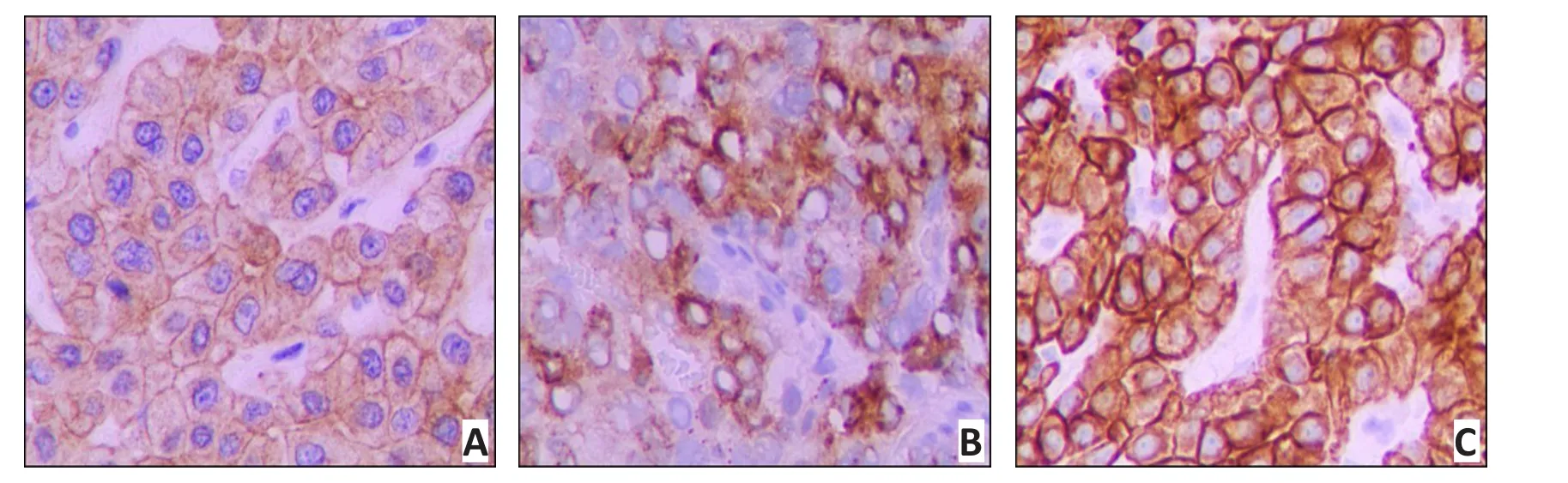
图2 免疫组织化学法检测各组大鼠肝组织中B7-H6蛋白的表达 (IM×200)Figure 2 Expression of B7-H6 protein in liver tissue was detected by immunohistochemistry(IM×200)
2.4 应用Western blot法检测各组大鼠HCC组织B7-H6蛋白的表达
蛋白质印迹法检测结果显示,与模型组大鼠比较,苦参碱组和山茱萸组HCC组织B7-H6蛋白表达明显升高(P<0.05);而与苦参碱组比较,山茱萸组HCC组织中B7-H6蛋白表达明显升高(P<0.05,图3)。
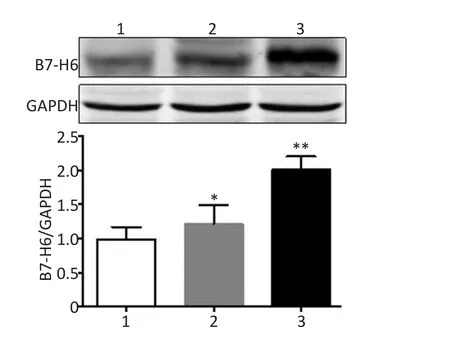
图3 Western blot法检测各组大鼠HCC组织B7-H6蛋白的表达Figure 3 B7-H6 expression in hepatocellular carcinoma tissues was detected by Western blot
检测结果显示,与对照组比较,苦参碱组和山茱萸组HCC细胞B7-H6蛋白表达明显升高(P<0.05);而与苦参碱组比较,山茱萸组HCC细胞中B7-H6蛋白表达明显升高(P<0.05,图4)。
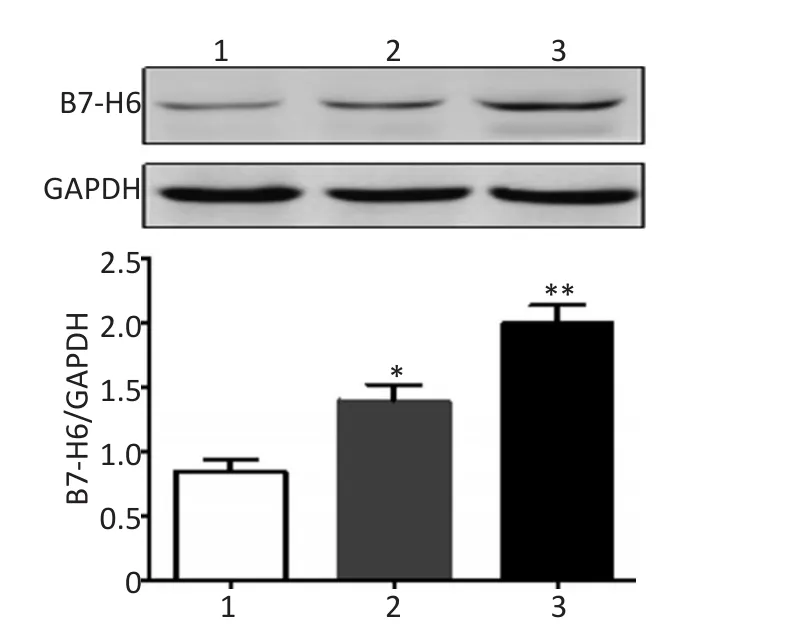
图4 Western blot法检测各组HepG2细胞B7-H6蛋白表达Figure 4 B7-H6 expression in HepG2 cells was detected by Western blot
3 讨论
在恶性肿瘤中,HCC严重威胁人类生命,其发病特点为起病隐匿,患者早期常无明显临床表现,因此大多数患者在出现症状时已无手术时机,而对于这类患者的治疗目前束手无策[8]。近年来采用传统中医药治疗癌症成为研究热点[9]。山茱萸作为临床常用的一味扶正固本的中药,在抗肿瘤方面已早有应用,如《医学衷中参西录》中含有山茱萸的定性汤可以护卫机体,敛阴止汗治疗肿瘤后期的惊悸,气滞血瘀等。近期也有研究表明,山茱萸可以抑制人肺癌细胞的增殖[10],且山茱萸可以调节荷瘤小鼠的免疫状态来发挥抗肿瘤作用[11],但其抗肿瘤的作用机制尚无详细报道。
有研究发现,山茱萸提取物在体内外对Lewis肺癌细胞均有抑制作用,其作用机制与诱导肿瘤细胞的凋亡和干扰细胞周期分布有关[11]。本研究发现两组干预组的肿瘤结节数和肿瘤质量均明显低于模型组,其中以山茱萸组的肿瘤质量最低,其抑瘤率明显高于苦参碱组大鼠。在H&E染色结果方面,苦参碱组与山茱萸组的肝脏病理学变化得到明显的改善,其中以山茱萸组的改善效果最佳。Wang等[10]通过免疫组织化学法发现,山茱萸多糖能够促进Bax的表达,诱导Hela细胞凋亡。本研究通过免疫组织化学法的检测结果显示,苦参碱组和山茱萸组大鼠B7-H6的阳性表达明显高于模型组,山茱萸组B7-H6的阳性表达明显高于苦参碱组。应用Western blot法检测结果显示,与模型组比较,苦参碱组和山茱萸组HCC组织B7-H6蛋白表达明显升高;而与苦参碱组比较,山茱萸组B7-H6蛋白表达明显升高。为了进一步验证山茱萸提取物抑制HCC与共刺激因子B7-H6的表达有关,本研究在体外实验即HCC细胞HepG2中同样发现,与模型组比较,苦参碱组和山茱萸组HCC细胞B7-H6蛋白表达明显升高;而与苦参碱组比较,山茱萸组HCC细胞中B7-H6蛋白表达明显升高。
综上所述,山茱萸提取物可抑制HCC的生长,其可能的机制与共刺激因子B7-H6的表达有关。
[1]EI-Serag HB.Epidemiology of viral hepatitis and hepatocellularcarcinoma[J].Gastroenterology,2012,142(6):1264-1273.
[2]Waldhauer I,Steinle A.NK cells and cancer immunosurveillance[J].Oncogene,2008,27(45):5932-5943.
[3]Pende D,Parolini S,Pessino A,et al.Identification and molecular characterizati-on of NKp30,a novel triggering receptor involved in natural cytotoxicity mediated by human natural killer cells[J].J Exp Med,1999,190(10):1505-1516.
[4]Rusakiewicz S,Nocturne G,Lazure T,et al.NCR3/NKp30 Contributes to Pathogenesis in Primary Sjogren's Syndrome[J].Sci Transl Med,2013,5(195):195ra96.
[5]Matta J,Baratin M,Chiche L,et al.Induction of B7-H6,a ligand for the natural killer cell-activating receptor NKp30,in inflammatory condition[J].Blood,2013,122(3):394-404.
[6]Zhang LT,Yuan ZF,Du YF,et al.Recent development and prospect of Cornus officinalis[J].Chin Trad Herbal Drugs,2004,35(8):116-119.
[7]Li MH.Effects of Active components of cornus officinalis on tumor and senescence cell model[D].Nanjing Univ Chin Medi,Nanjing,2011.
[8]Konmun J,Danwilai K,Nqamphaiboon N,et al.A phaseⅡrandomized double-blind placebo-controlled study of 6-gingerol as an anti-emetic in solid tumor patients receiving moderately to highly emetogenic chemotherapy[J].Medi Oncol,2017,34(4):69.
[9]Wang HY,Li FA.Research status of anti-tumor traditional chinese medicine[J].J Qinghai Medi College,2008,29(4):278-282.
[10]Wang EJ,Jin Yi.Effect of corni fructus polysaccharides on apoptosis and Bcl-2,Bax expression in A549 cells[J].Chin Tradition Pat Medi,2012,34(5):808-811.
[11]Zou PW,Zhao CJ.Study on the anti-tumor effect of polysaccharides from cornus officinalis and its immunologic mechanism[J].Chin Hosp Pharm J,2012,32(1):20-22.
Effect of Fructus Corni extract on B7-H6 expression in primary liver cancer of rats
Peng XIAO,Hua BAI,Min LI,Guiju LIU,Ruijun LI,Jiazhuan MEI
Department of Oncology,Zhengzhou People's Hospital,Zhengzhou 450053,China
Jiazhuan MEI;E-mail:mjzhuan@163.com
Objective:To investigate the effects of Fructus Corni extract on the B7-H6 expression in primary liver cancer cells of rats.Methods:Sixty SD rats were randomly divided into three groups,namely,model,matrine,and Cornus officinalis.The rat model bearing the primary liver cancer was induced by diethylnitrosamine,except for the rats in the control group.The rats in both the matrine and Cornus officinalis groups were fed with matrine and Cornus officinalis.The rats in model groups were fed with 0.9%sodium chloride solution.The number of hepatocellular carcinoma nodules was calculated,and the tumor growth inhibition rate was also calculated.The pathological changes of hepatic tissues in rats of each group were observed by hematoxylin and eosin staining.The expression levels of B7-H6 in these three groups were determined by immunohistochemistry and Western blot.Results:The number of liver nodules of the matrine and Fructus Corni group rats was lower than that of the model group(P<0.05).The tumor inhibition rate of the Cornus group was significantly higher than that of the matrine group(P<0.05).The tumor growth inhibition rate of the Cornus officinalis group was significantly higher than that of the matrine group(P<0.05).Immunohistochemistry showed that the positive expression of B7-H6 in the Cornus officinalis group and the matrine group was significantly higher than that in the model group(P<0.05),and the positive expression of B7-H6 in the Cornus officinalis group was significantly higher than that in the matrine group(P<0.05).Similarly,the protein expression of B7-H6 in the Cornus officinalis and matrine groups was significantly higher than that in the model group(P<0.05)by Western blot,while the protein expression of B7-H6 in the Cornus officinalis group was significantly higher than that in the matrine group(P<0.05).Conclusion:Fructus Corni extract may inhibit the growth of hepatocellular carcinoma through upregulating the B7-H6 expression.
primary hepatocarcinoma,Cornus officinalis extract,matrine,SD rats,B7-H6
10.3969/j.issn.1000-8179.2017.22.376
郑州人民医院肿瘤内科(郑州市450053)
梅家转 mjzhuan@163.com
(2016-12-05收稿)
(2017-08-08修回)
(编辑:郑莉 校对:孙喜佳)

肖鹏 专业方向为肺癌、消化系统肿瘤的综合治疗。
E-mail:zzrmyyxiaopeng@sina.com

