异甘草素增加人脑胶质瘤干细胞放射敏感性的实验研究*
林瑜亮 党莹 孙红军 荔志云
异甘草素增加人脑胶质瘤干细胞放射敏感性的实验研究*
林瑜亮 党莹 孙红军 荔志云
目的:研究异甘草素对胶质瘤干细胞(glioma stem cells,GSCs)放射敏感性的影响及作用机制。方法:无血清培养法提取SHG44人脑GSCs。检测异甘草素和X射线联合运用下GSCs活性和干细胞球形成情况。检测Notch1信号通路、NF-κB和caspase-3的表达情况。结果:采用10 μM异甘草素在8 Gy较高剂量X射线存在的情况下,能够抑制GSCs球的数目和直径(P<0.05)。20 μM异甘草素杀伤GSCs的作用明显,且在4、8 Gy的X射线下联合杀伤GSCs的能力依次增强(P<0.05)。异甘草素干作用48 h后Notch1的表达下调(P<0.05)。4 Gy的X射线照射后,分别于6、24 h,异甘草素干预组P-NF-κB表达逐渐增高(P<0.05),而cleaved caspase-3的表达在X射线照射后的24 h开始升高(P<0.05)。结论:异甘草素能够增加GSCs的放射敏感性,抑制Noch1信号通路,上调NF-κB和caspase-3的表达,参与X射线对GSCs的损伤过程。
异甘草素 胶质瘤干细胞 放射敏感性 Notch1 NF-κB caspase-3
胶质瘤是最常见的神经上皮性颅内肿瘤,约占中枢神经系统恶性肿瘤的80%[1]。目前,胶质瘤的主要治疗方法为确保手术安全范围内最大程度切除肿瘤并联合放疗和化疗,然而高级别胶质瘤5年生存率仍低于 10%[2]。胶质瘤干细胞(glioma stem cells,GSCs)具有自我更新、无限增殖和致瘤的能力,对其一线治疗药物替莫唑胺耐药,同时表现出放射抵抗,是胶质瘤转移复发的根源[1,3]。异甘草素(isoliquiritigenin,ISL)是一种黄酮类化合物,主要来源于甘草,具有抗肿瘤、抗病毒、抗炎、抗氧化、免疫调节、护肝和保护心血管等生物学活性[4]。在前期实验证明,异甘草素能抑制GSCs的增殖,同时增强替莫唑胺的杀伤作用[5]。本研究以SHG44人脑GSCs为研究对象,研究异甘草素对GSCs放射敏感性的影响及机制,进一步为异甘草素治疗胶质瘤提供实验依据。
1 材料与方法
1.1 材料
SHG44人脑胶质瘤细胞株取自ATCC(美国组织培养保藏中心);异甘草素购自上海源叶生物科技有限公司;DAPT购自美国Gene Operation公司;胎牛血清购自以色列BI公司;胰蛋白酶购自美国Sigma公司;DMEM培养基、D-MEM/F-12培养基均购自美国Gibco公司;B27添加剂购自美国Gibco公司;表皮生长因子(EGF)、碱性成纤维生长因子(bFGF)均购自美国PeproTech公司;兔抗人CD133抗体购自中国台湾省Abnova公司;小鼠抗人Nestin抗体、兔抗人Bcl-2抗体、PE标记的兔抗小鼠二抗、FITC标记的山羊抗兔二抗均购自英国Abcam公司;免疫染色封闭液抗荧光淬灭封片液均购自上海碧云天生物科技有限公司;CCK-8试剂盒购自日本Dojindo公司;RIPA细胞裂解液、BCA蛋白定量试剂盒均购自北京Solarbio公司;PVDF膜购自美国Millipore公司;小鼠抗人Hes1抗体、小鼠抗人Notch1抗体、小鼠抗人RBPJK抗体、兔抗人NF-κB抗体、小鼠抗人caspase-3抗体均购自中国台湾省Abcam公司;兔抗人β-actin抗体购自美国Bioworld Technology公司;HRP标记的山羊抗兔二抗购自美国Earthox公司;HRP标记的山羊抗小鼠二抗购自英国Abcam公司;ECL化学发光液购自北京Solarbio公司;悬浮细胞培养板购自中国香港Beaver公司。
1.2 方法
1.2.1 GSCs的培养及鉴定 SHG44人脑胶质瘤细胞在含10%胎牛血清的DMEM培养基中培养至第3代。取对数生长期的贴壁细胞,采用0.25%胰蛋白酶消化1 min;改用无血清神经干细胞培养基D-MEM/F-12(含2%B27、20 μg/L EGF和20 μg/L bFGF)终止消化。1 500 r·min-1离心8 min,弃上清,采用培养基重悬,接种于悬浮细胞培养板6孔板中,隔天补充约1/5新鲜培养基。倒置显微镜下观察GSCs生长,7~9 d传代。
取活力良好的人脑GSCs球,接种于经多聚赖氨酸包被的玻片上。取细胞爬片,37℃晾干,PBS漂洗3次,每次5 min,4%多聚甲醛室温固定15 min。PBS漂洗3次,每次5 min,0.5%Triton-X-100 37℃透膜10 min。PBS漂洗3次,每次5 min,加免疫染色封闭液,室温孵育30 min。滴加稀释的一抗:Nestin(1:200)、CD133(1:200)和Bcl-2(1:100),4℃孵育过夜。PBS漂洗3次,每次5 min,加PE标记的兔抗小鼠二抗(1:100)及FITC标记的山羊抗兔二抗(1:1 000),用DAPI染核,37℃孵育40 min。PBS漂洗3次,每次5 min,封片液封片,荧光显微镜鉴定GSCs表面分子标志物的表达。
1.2.2 异甘草素处理和X射线照射 取第3代GSCs,1 000 r·min-1离心 8 min,弃上清,胰酶消化 5 min。加入无血清神经干细胞培养基终止消化,1 000 r·min-1离心8 min。弃上清,再次用培养基吹打成单细胞悬液,细胞计数板计数;悬浮细胞培养板6孔板每孔接种5.0×104个细胞。各实验组的孔中加入DMSO溶解的异甘草素或DAPT(γ分泌酶抑制剂,用于特异性阻断Notch1信号通路),使异甘草素浓度为0、10、20、40、80、160 μM,DAPT浓度为2.5 μM。异甘草素干预24 h后,室温下对细胞进行X射线照射(21EX型双光子高能直线加速器),剂量率为4 Gy/min,总剂量为0、2、4、6、8、10 Gy。
1.2.3 CCK-8法检测细胞活性 取异甘草素干预和X射线照射后的GSCs,调整密度至2 500个/100 μL,接种到悬浮细胞培养板96孔板中,每组均设4个复孔,培养12、24、48、72 h。加入CCK-8试剂,37℃孵育3 h,使用酶标仪测450 nm处吸光度。
1.2.4 异甘草素和X射线照射后GSCs的形态观察异甘草素干预和X射线照射后的细胞继续在悬浮细胞培养板6孔板中培养,隔日加药。倒置显微镜下随机选取5个视野观察异甘草素和放疗作用至第9 d GSCs球的形成情况,测量干细胞球数量和直径。
1.2.5 应用Western blot法检测Notch1信号通路、NF-κB和caspase-3表达 应用RIPA细胞裂解液提取总蛋白,采用BCA试剂盒进行蛋白定量。以40 μg/孔的上样量进行SDS-PAGE电泳,湿转法转印至PVDF膜上,5%脱脂奶粉室温封闭2 h,加入一抗,4℃孵育过夜。TBST洗涤3次,加入HRP标记的二抗,室温孵育1 h,TBST洗涤3次后,用ECL化学发光液显色,在暗室曝光显影。
1.3 统计学分析
采用SPSS 21.0软件进行统计学分析,实验结果采用表示,组间比较采用单因素方差分析。以P<0.05为差异具有统计学意义。
2 结果
2.1 SHG44GSCs镜下形态和鉴定
本研究前期已经证实,悬浮细胞培养板6孔板为培养GSCs较理想的载体,SHG44人脑GSCs在无血清培养基中呈悬浮克隆球样生长。传代后,GSCs得到纯化。免疫荧光染色鉴定干细胞标记物Nestin、CD133表达呈阳性,癌基因Bcl-2表达呈阳性,细胞克隆球为 GSCs[6]。
2.2 异甘草素和X射线对SHG44人脑GSCs活性的影响
异甘草素和X射线照射12、24、48、72 h后检测细胞活性。异甘草素处理组的细胞活性在72 h后开始呈现剂量依赖性下降(P<0.05)。160 μM异甘草素在12 h就对 GSCs活性产生抑制作用(P<0.05)(图1A)。GSCs暴露于不同剂量X射线后,在同一时间点,各组细胞活性无明显差别,且各组GSCs活性随着时间增加的趋势相同(图1B)。
2.3 异甘草素和X射线对SHG44人脑GSCs成球能力的影响
异甘草素单独作用至第9 d,20~80 μM异甘草素组GSCs球的数量和直径均呈剂量依赖性下降(P<0.01),且在160 μM异甘草素组中未观察到GSCs球,仅有少量单细胞的悬浮GSCs(图2)。
X射线照射后第9 d,各剂量的X射线对GSCs球数目的影响无差异。2 Gy的X射线能够引起GSCs球的直径下降(P<0.05)。4~10 Gy的X射线照射后GSCs球直径下降更明显(P<0.01),但其之间无显著性差异(图3)。
2.4 异甘草素对SHG44人脑GSCs放射敏感性的影响
选取较有代表性的10、20、40 μM的异甘草素浓度,联合4、8 Gy的X射线剂量,从GSCs成球能力的角度评估异甘草素放射增敏的效果。
测量干预后第9 d GSCs球的数目。10 μM异甘草素联合8 Gy高剂量的X射线后降低GSCs球的数量(P<0.05)。20 μM异甘草素联合X射线照射后,GSCs球数量显著下降,且8 Gy较4 Gy下降更明显(P<0.05),这一趋势与DAPT组相似。40 μM异甘草素单独运用就能将GSCs悬浮球的数量抑制在较低的水平,联合X射线照射后没有进一步减少GSCs成球数目(图4A)。
测量干预后第9 d GSCs球的直径。10 μM异甘草素组在接受4 Gy的X射线照射后,GSCs球所形成的直径下降(P<0.05),但更高剂量的X射线照射,未进一步降低GSCs球的直径,这一趋势与对照组和DAPT组类似。20、40 μM异甘草素单独作用下对GSCs球直径的抑制较强,联合X射线照射后未表现出进一步抑制的效果(图4B)。
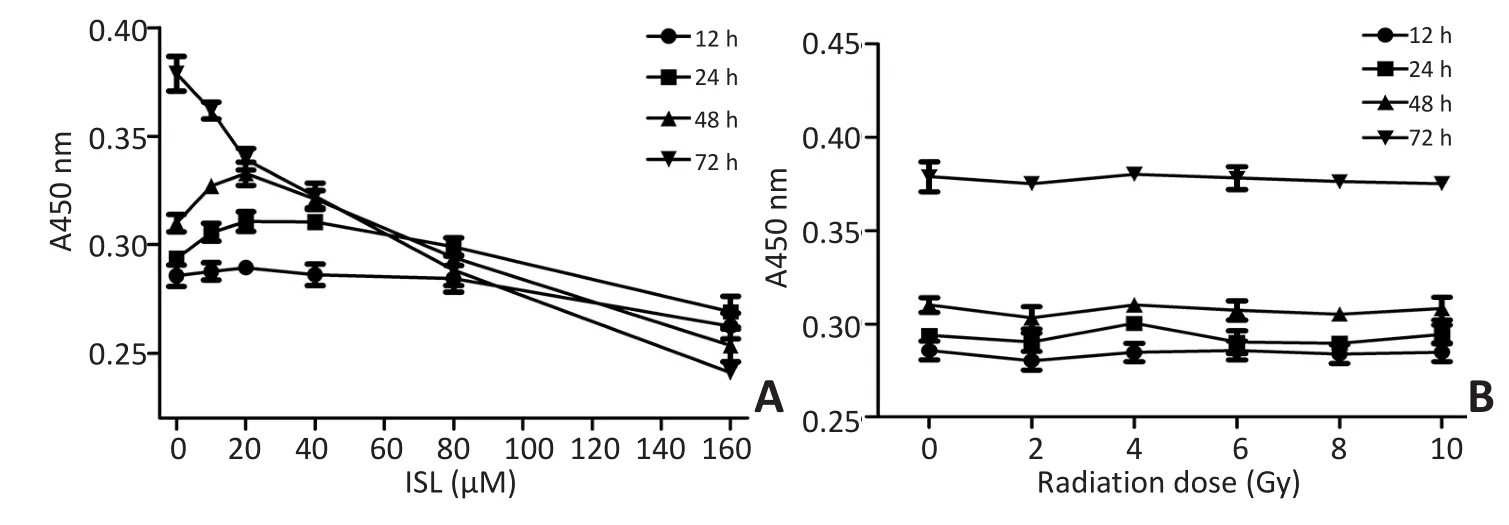
图1 不同浓度异甘草素和不同剂量的X射线对GSCs增殖的影响Figure 1 Effect of isoliquiritigenin and radiation on glioma stem cell growth
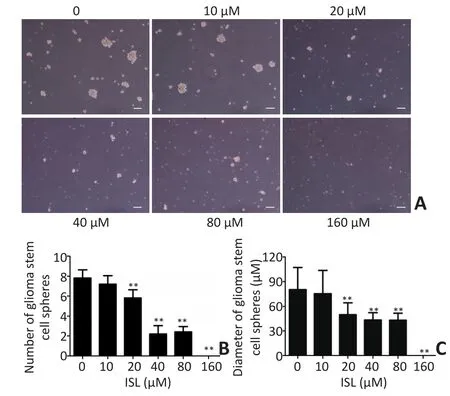
图2 异甘草素对GSCs球数量和直径的影响Figure 2 Effect of isoliquiritigenin on the diameters and numbers of neurospheres

图3 X射线对GSCs球数量和直径的影响Figure 3 Effect of radiation on the diameters and numbers of neurospheres
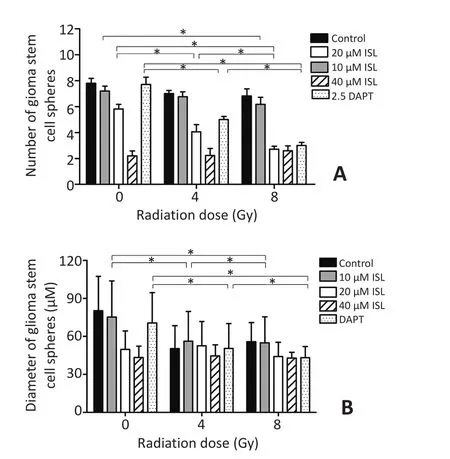
图4 异甘草素对SHG44人脑GSCs放疗敏感性的影响Figure 4 Effect of isoliquiritigenin on the cell radiosensitivity of glioma stem cells
2.5 应用Western blot法分析异甘草素对Notch1信号通路蛋白的表达
Notch1信号通路能够促进GSCs的放射抵抗[7],本研究也观察到运用Notch1通路的特异性阻断剂DAPT能够增加GSCs对X射线照射的敏感性,与异甘草素放射增敏效果相似。选取10、20、40 μM异甘草素处理GSCs 48 h。Notch1(信号通路受体)、RBPJK(转录调节因子)和Hes1(靶基因)的表达在DAPT组和20、40 μM异甘草素组呈剂量依赖性下降(P<0.05,图5)。
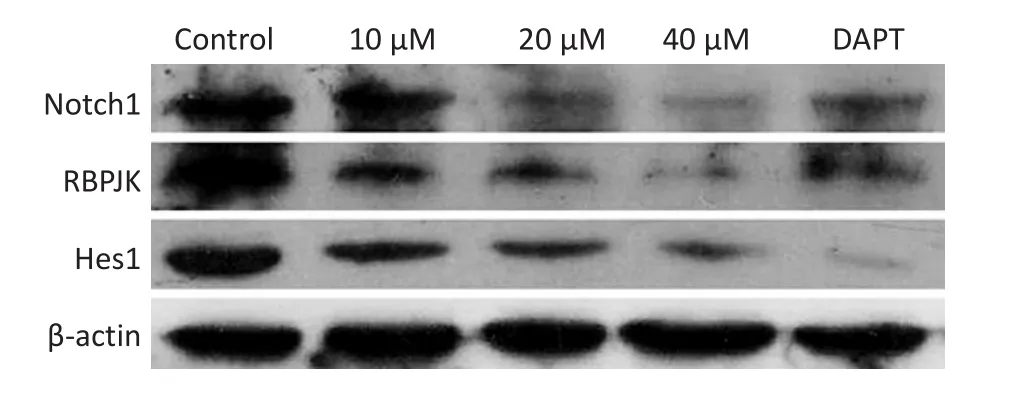
图5 异甘草素对GSCs的Notch1信号通路蛋白表达的影响Figure 5 Effect of isoliquiritigenin on the protein expression levels of Notch1 pathway of glioma stem cells
2.6 应用Western blot法分析放疗后NF-κB和caspase-3的变化
采用20 μM的异甘草素预先处理细胞24 h,然后观察4 Gy的X射线照射后6、24 h的NF-κB和caspase-3的表达情况。
无X射线照射的情况下,各组P-NF-κB表达量均较低。4 Gy的X射线照射后,异甘草素组P-NF-κB比不加异甘草素组高,且24 h进一步升高;异甘草素组cleaved caspase-3表达比不加异甘草素组高(P<0.05),但不随时间变化。未加异甘草素组的cleaved caspase-3在4 Gy的X射线照射后明显增高(P<0.05),但不随时间变化。异甘草素组的cleaved caspase-3在4 Gy的X射线照射后的6 h无明显改变,但在24 h后,进一步升高(P<0.05,图6)。

图6 异甘草素对X射线照射前后GSCs的NF-κB和caspase-3蛋白表达的影响Figure 6 Effect of isoliquiritigenin on the protein expression levels of NF-κB
3 讨论
人脑胶质瘤因为放化疗抵抗,局部复发并不少见。在胶质瘤的临床治疗方案中,通常在术后联合替莫唑胺,每日以2 Gy的X射线外照射,共30次,总量60 Gy,然而此类患者的5年生存率仍低于10%[2]。本研究观察到在72 h内GSCs的活性并不因X射线剂量的增加而改变。X射线能够在一定程度上减小GSCs球的直径,但是成球的数目并未下降,提示GSCs放射抵抗较强。
本研究发现一定浓度的异甘草素在12~48 h内具有促进GSCs向星形细胞和神经元分化的能力[5],在72 h及9 d后,GSCs的活性和成球能力均被异甘草素所抑制。可见短时间内的异甘草素干预改变了GSCs的特性。因此,用异甘草素干预24 h,再联合X射线照射,观察异甘草素对GSCs的放射增敏效果。本研究表明,10 μM的异甘草素对GSCs的直接抑制作用有限,但在8 Gy较高剂量X射存在的情况下,能够增加GSCs放射敏感性,表现为GSCs球数量和直径的下降。20 μM的异甘草素杀伤GSCs作用明显,且在4 Gy的X射线照射时存在较强的增敏作用,在8 Gy的X射线下联合杀伤作用进一步提高。而40 μM以上的异甘草素本身的直接抑制增殖作用较好,增敏效果可能被掩盖。
一些细胞信号通路的异常表达与GSCs的放射抵抗有关。Notch1信号通路参与细胞的增殖、分化和命运决定,参与维持GSCs的特性[8]。在胶质瘤细胞中Notch1信号通路表达上调,与肿瘤进展相关[9]。Notch信号通路能够促进GSCs的放射抵抗[7],因此为降低胶质瘤治疗的靶标之一。本研究结果证实异甘草素能够像DAPT一样有效抑制GSCs的Notch1信号通路的表达,使靶基因Hes1表达下调,通过此途径抑制GSCs的生长,同时增加GSCs对X射线照射的敏感性。
细胞在受到X射线照射后,会引起相应的细胞结构、功能、代谢和分子水平的改变,以应对X射线造成的损伤。NF-κB参与细胞应激、炎症和细胞凋亡等过程,本研究观察到异甘草素的单独运用对GSCs的P-NF-κB蛋白影响较小,但是在X射线照射后,能够在短时间内导致P-NF-κB表达的上调,在24 h表达量显著升高,异甘草素可能通过上调P-NF-κB的表达,影响GSCs在X射线照射后发生损伤和细胞死亡。caspase家族在介导细胞凋亡中发挥作用,其中caspase-3为关键执行分子。本研究提示异甘草素和X射线均能上调GSCs的cleaved caspase-3的表达,但在单一因素作用下表达量随时间变化相对固定。当异甘草素和X射线联合时,GSCs的cleaved caspase-3表达在24 h后出现明显上调,说明caspase-3可能参与异甘草素促进GSCs放射敏感性的调节过程。
综上所述,GSCs对X射线照射具有较强的抵抗性,异甘草素可能通过阻断Notch1通路抑制GSCs的增殖,并增加其放射敏感性。在受到X射线干预后,通过上调NF-κB和caspase-3的表达参与X射线造成的GSCs的损伤过程。深入研究异甘草素对GSCs的放射增敏作用的机制,运用动物实验验证异甘草素的放射增敏效果,并与其他治疗方式相结合,旨在为治疗人脑胶质瘤提供理论基础和新的思路。
[1]Chen J,Li Y,Yu TS,et al.A restricted cell population propagates glioblastoma growth following chemotherapy[J].Nature,2012,488(7412):522-526.
[2]Clarke J,Penas C,Pastori C,et al.Epigenetic pathways and glioblastoma treatment[J].Epigenetics,2013,8(8):785-795.
[3]Schonberg DL,Lubelski D,Miller TE,et al.Brain tumor stem cells:Molecular characteristics and their impact on therapy[J].Mole Asp Medi,2014,(39):82-101.
[4]Peng F,Du Q,Peng C,et al.A review:the pharmacology of isoliquiritigenin[J].Phytother Res,2015,29(7):969-977.
[5]Sun HJ,Lin YL,Dang Y,et al.Effects of isoliquiritigenin in combination with temozolomide on cell proliferation of SHG44 human brain glioma stem cells[J].Chin J Neur Surg Dis Res,2016,15(5):405-409.[孙红军,林瑜亮,党莹,等.异甘草素联合替莫唑胺对SHG44人脑胶质瘤干细胞增殖的影响[J].中华神经外科疾病研究杂志,2016,15(5):405-409.]
[6]Sun HJ,Li ZY.Comparison of different culture methods for SHG44 human brain glioma stem cells with serum-free medium[J].J Int Neur Neur Surg,2016,43(3):193-197.[孙红军,荔志云.不同无血清培养方式提取SHG44人脑胶质瘤干细胞的比较研究[J].国际神经病学神经外科学杂志,2016,43(3):193-197.]
[7]Wang J,Wakeman TP,Lathia JD,et al.Notch promotes radioresistance of glioma stem cells[J].Stem Cells,2010,28(1):17-28.
[8]Platonova N,Lesma E,Basile A,et al.Targeting notch as a therapeutic approach for human malignancies[J].Curr Pharm Des,2016:221-227.
[9]Li J,Cui Y,Gao G,et al.Notch1 is an independent prognostic factor for patients with glioma[J].J Surg Oncol,2011,103(8):813-817.
Isoliquiritigenin promotes the radiosensitivity of human glioma stem cells
Yuliang LIN,Ying DANG,Hongjun SUN,Zhiyun LI
Department of Neurosurgery,Lanzhou General Hospital of the PLA Lanzhou Military Area Command,Lanzhou 730050,China
Zhiyun LI;E-mail:lizhiyun456@163.com
Objective:To investigate the influence of isoliquiritigenin on the radiosensitivity of glioma stem cells and demonstrate the potential underlying mechanism.Methods:Glioma stem cells were isolated from SHG44 human glioma cells by serum-free medium.Cell proliferation abilities were detected after isoliquiritigenin treatment and radiotherapy by using Cell Counting Kit-8.The formation of glioma stem cell spheres was observed using an inverted microscope.The protein expression levels of Notch1 signal pathway,NF-κB,and caspase-3 were examined by Western blot analysis.Results:Isoliquiritigenin(10 μM)inhibited the formation of tumorspheres at 8 Gy radiation(P<0.05).Isoliquiritigenin(20 μM)exerted evident growth inhibitory effect on glioma stem cells.Isoliquiritigenin pretreatment combined with 4 or 8 Gy radiation reduced the cell radioresistance significantly(P<0.05).The protein expression levels of Notch1 in the isoliquiritigenin and DAPT groups were lower than those of the control at 48 h after isoliquiritigenin treatment(P<0.05).The protein expression levels of P-NF-κB began to increase at 6 and 24 h after 4 Gy radiation with isoliquiritigenin pretreatment(P<0.05).Isoliquiritigenin pretreatment combined with 4 Gy radiation increased the protein expression level of cleaved caspase-3 at 24 h after radiation compared with that of the isoliquiritigenin treatment alone(P<0.05).Conclusion:Isoliquiritigenin may downregulate Notch1 signal pathway and affect different aspects of cell stress and death,including NF-κB-and caspase-3-associated processes,thereby promoting the radiosensitivity of glioma stem cells.
isoliquiritigenin,glioma stem cells,radiosensitivity,Notch1,NF-κB,caspase-3
10.3969/j.issn.1000-8179.2017.22.402
兰州军区兰州总医院神经外科(兰州市730050)
*本文课题受甘肃省重点研发计划(社会发展类)项目(编号:17YFIFA136)资助
荔志云 lizhiyun456@163.com
This work was supported by the Key Program for Research and Development of Gansu Province(No.17YF1FA136)
(2017-04-05收稿)
(2017-08-16修回)
(编辑:杨红欣 校对:孙喜佳)

林瑜亮 专业方向为颅内肿瘤的基础与临床研究。
E-mail:linyuliang318@163.com

