初诊肺癌患者多次化疗外周血免疫相关指标动态变化的研究*
尤朵 陈亚楠 杨如 许芝山 路平 钟根深
初诊肺癌患者多次化疗外周血免疫相关指标动态变化的研究*
尤朵①②陈亚楠①杨如①许芝山①路平②钟根深①
目的:探索免疫治疗与化疗相结合的有利切入点,为临床免疫治疗介入提供试验依据。方法:收集2015年11月至2016年12月新乡医学院第一附属医院初诊的23例肺癌患者,全部患者均完成连续5个周期的化疗,采用流式细胞术方法检测化疗过程中患者外周血免疫相关指标如CD4+T细胞、CD8+T细胞、CD19+B细胞和CD16+、CD56+、NK细胞比率,T细胞表面共信号分子PD-1、PD-L1、CD137、CTLA-4、CCR-4、LAG-3以及细胞因子表达情况。分析多周期过程中,上述指标动态变化趋势。结果:在肺癌患者多个周期的化疗过程中,机体CD8+T淋巴细胞、CD19+B淋巴细胞和CD16+、CD56+、NK细胞水平下调,CD4+T淋巴细胞数量增加,差异具有统计学意义(P<0.05);T细胞表面共抑制分子PD-1、CTLA-4和CCR-4随治疗进行表达下调,差异具有统计学意义(P<0.05)。结论:肺癌患者在多个周期的化疗中,实施淋巴细胞亚群数量及T细胞表面共抑制分子监测具有重要意义,化疗中后期针对免疫检查点高表达患者,联合应用PD-1抗体、PD-L1抗体、CTLA-4抗体或CCR-4抗体可能具有更优的治疗效果。
免疫治疗 T细胞表面共信号分子 肺癌 多个周期的化疗
肺癌已成为全世界范围内发病率和死亡率居首位的恶性肿瘤,每年新发病例约160万,其总体治愈率<20%,其中晚期患者5年生存率不到5%,非小细胞肺癌(non-small cell lung cancer,NSCLC)晚期患者给予标准含铂两药联合化疗,其中位总生存期(median overall survival,mOS)仅10个月[1-2]。从免疫学的角度分析,肿瘤的发生发展是肿瘤细胞与免疫系统之间相互对抗博弈的过程[3]。随着科学研究工作的不断进展,免疫治疗与化疗的相结合也逐渐成为关注的重点。
化疗或放疗作用对免疫系统的作用很复杂:一方面提高肿瘤抗原的表达和抗原表位的增加,增强肿瘤免疫原性,通过树突状细胞呈递,活化T细胞功能;另一方面通过上调肿瘤细胞表面多种抑制分子、诱导Treg细胞分化、表观遗传修饰等多种途径抑制T细胞功能[4]。化疗或放疗在打破肿瘤免疫壁垒的同时,通过联合应用免疫治疗,可在杀伤肿瘤细胞的同时,启动机体抗肿瘤免疫,以期达到更优的治疗效果[5]。
机体内免疫功能评价的重要指标包括免疫细胞的变化,特别是淋巴细胞、淋巴细胞总体数量及其亚群数量变化代表机体不同的免疫格局呈现[6];T淋巴细胞表面存在抑制性与刺激性共信号分子,统筹协调T淋巴细胞功能与活性,是机体抗肿瘤免疫的关键环节[7];细胞因子参与人体多项重要的生理病理变化,作为肿瘤与免疫环境之间的信息载体,是肿瘤微环境的重要组成成分[8]。
基于化疗对机体免疫功能的复杂影响,通过动态观察肺癌患者化疗过程中外周血淋巴细胞亚群、T淋巴细胞表面共信号分子、细胞因子等相关免疫指标的变化,可以藉此评价化疗过程中机体免疫功能状况变化趋势,有助于为临床免疫治疗介入提供试验依据,其最终目的在于为个体化免疫治疗策略的制定提供可能的研究方法与理论支持。
1 材料与方法
1.1 病例资料
1.1.1 患者一般特征 收集2015年11月至2016年12月新乡医学院第一附属医院初诊的23例肺癌患者,患者详细临床病理资料见表1。患者中位年龄为59(38~76)岁,13例(56.5%)患者为男性,病理类型为腺癌13例(56.5%),中晚期患者22例(95.7%),单纯化疗患者15例(65.2%),化疗联合其他治疗方式患者8例(34.8%)。
1.1.2 主要仪器和试剂 FACSCalibur购自美国BD公司;离心机购自美国Thermo公司;Cytometric Bead Array购自美国BD公司;Human Th1/Th2/Th17A和Cytokine Kit均购自美国BD公司;anti-human CD3、anti-human CD4、anti-human CD8、anti-human CD19、anti-human CD16和anti-human CD56抗体均购自美国eBioscience公司。anti-human PD-1、anti-human PD-L1、anti-human CTLA-4、anti-human LAG-3、anti-human CCR-4和anti-human CD137抗体均购自美国Biolegend公司。

表1 入组患者临床病理资料Table 1 Clinical and pathological data of patients enrolled in the group
1.2 方法
1.2.1 研究设计 本研究为前瞻性临床研究。入组标准:1)初治的经病理学确诊的肺恶性肿瘤,病理分类诊断方法参照2017年美国国立综合癌症网络(NCCN)肺恶性肿瘤病理分类标准;2)ECOG评分≤2分;3)有客观可测量的肿瘤病灶;4)肝、肾、骨髓功能基本正常;5)预期生存期>3个月。排除标准:1)既往恶性肿瘤病史;2)严重感染性疾病、肝病、血液系统疾病、自身免疫性疾病、免疫缺陷病等严重影响免疫功能的疾病;3)其他未控制的严重性内科疾患;4)同时采用其他试用药物或正在参与其他临床试验。
1.2.2 病例收集 最终统计分析病例共23例(31.94%),集齐连续5个周期化疗前外周血液标本,其余病例失访、中间标本缺失或截至统计日期前未达5个周期化疗。本研究经新乡医学院第一附属医院伦理学员会批准,患者和其家属均知情同意。
1.2.3 淋巴亚群分析 淋巴细胞亚群取2个流式管,分别标记A和B,各加入100 μL抗凝全血,A管加入10 μL CD3+/CD4+/CD8+/CD45+抗体,B 管加入 10 μL CD3+/CD16+/CD56+/CD19+抗体,分别混匀,室温避光孵育20 min;各加入500 μL溶血素,混匀,室温避光10 min,2 h内上机检测。
1.2.4 PD-1、PD-L1等免疫检测分析 检测CD4+T、CD8+T细胞中PD-1、PD-L1、CTLA-4、LAG-3、CCR-4和CD137的表达水平取14个流式管,分别标记CD4+、CD4+PD-1+、CD4+PD-L1+、CD4+CTLA-4+、CD4+LAG-3+、CD4+CCR-4+、CD4+CD137+、CD8+、CD8+PD-1+、CD8+PD-L1+、CD8+CTLA-4+、CD8+LAG-3+、CD8+CCR-4+和 CD8+CD137+,每个管加抗凝全血100 μL,然后加入相应标记的抗体各10μL,混匀,室温避光孵育20min,各加入500μL溶血素,混匀,室温避光10 min;离心弃上清,PBS洗涤一遍后重悬,2 h内上机检测。
1.2.5 Th1/Th2/IL17A细胞因子检测 检测相关细胞因子根据Cytometric Bead Array(CBA)Human Th1/Th2/Th17 Cytokine Kit说明书提供的方法处理样本,然后上机检测细胞因子IL-2、IFN-γ、IL-4、IL-6、IL-10、TNF-α和IL-17A。
1.3 统计学分析
采用SPSS 20.0软件进行统计学分析。所有计量数据均采用表示,两组间的比较采用独立样本t检验。以P<0.05为差异具有统计学意义。
2 结果
2.1 外周血常规变化趋势
5个周期化疗过程中外周血白细胞、中性粒细胞、淋巴细胞、血小板、血红蛋白的水平明显较前下降,差异具有统计学意义(P<0.05,表2)。
2.2 外周血生化指标变化
5个周期化疗过程中外周血生化水平变化不明显,差异无统计学意义(P>0.05,表3)。
2.3 淋巴细胞细胞亚群变化趋势
CD8+T淋巴细胞、CD19+B淋巴细胞和CD16+CD56+NK细胞水平下调,CD4+T淋巴细胞水平显著增加,差异具有统计学意义(P<0.05,图1)。
2.4 CD4+T细胞表面免疫检测点表达变化
CD4+T淋巴细胞表面PD-1表达明显上调,PDL1表达明显下调,差异具有统计学意义(P<0.05),CTLA-4、LAG-3、CCR-4和CD137表达整体变化不显著(P>0.05,图2)。
2.5 CD8+T细胞表面免疫检测点表达变化
CD8+T淋巴细胞表面PD-1、CTLA-4和CCR-4表达上调,PD-L1表达水平下调,差异具有统计学意义(P<0.05);CD137整体表达无显著性差异(P>0.05,图3)。
2.6 细胞因子变化趋势
外周血相关细胞因子(IL-2、IFN-γ、IL-4、IL-6、IL-10、TNF-α和IL-17A)整体表达无显著性差异(P>0.05,图4)。
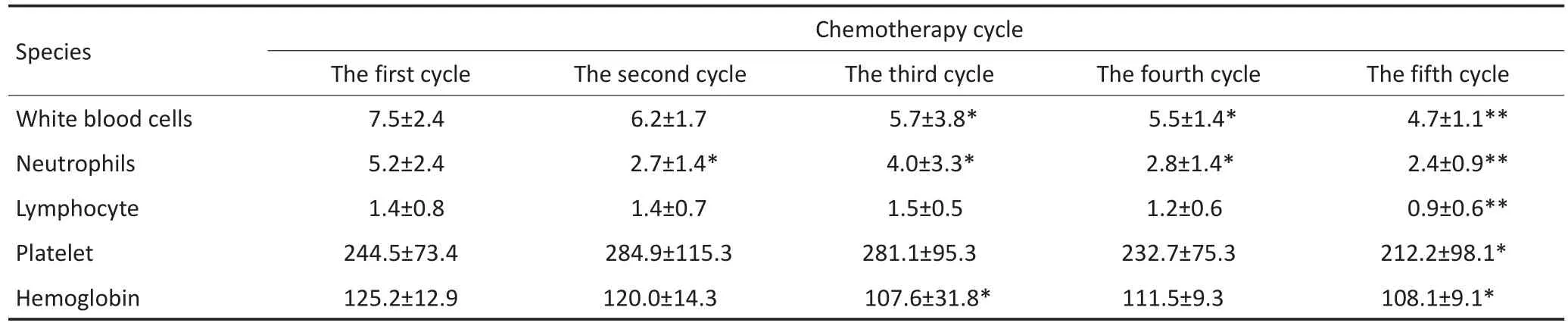
表2 多个周期的化疗前外周血常规变化趋势Table 2 Changes in peripheral blood routine in the pretreatment of chemotherapeutic treatment
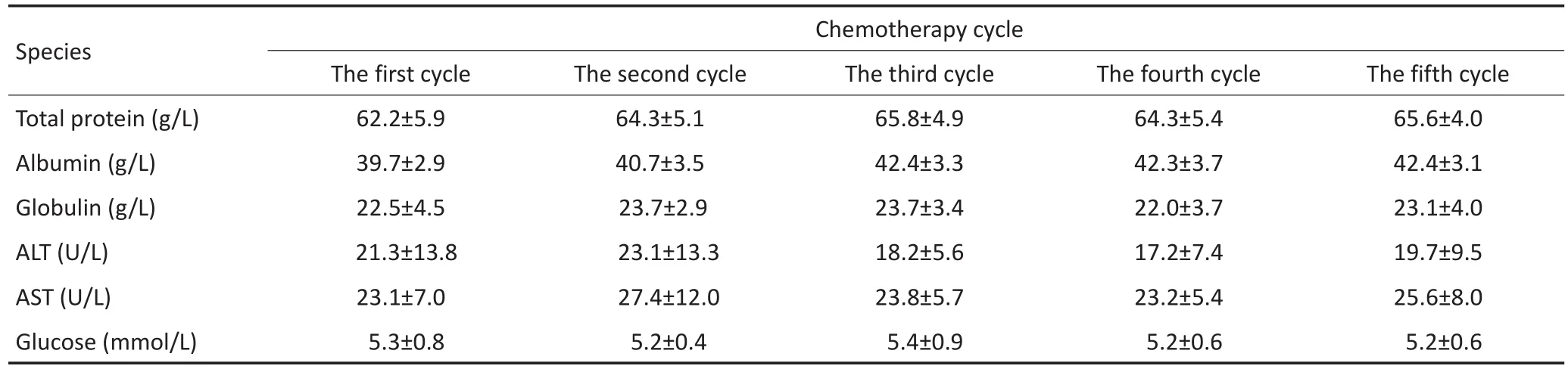
表3 多个周期的化疗前外周血生化指标变化Table 3 Statistical analysis of peripheral blood biochemical changes in the pretreatment of chemotherapeutic treatment
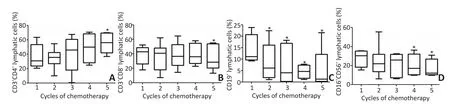
图1 淋巴细胞亚群的变化趋势Figure 1 Variation in lymphocyte subgroups
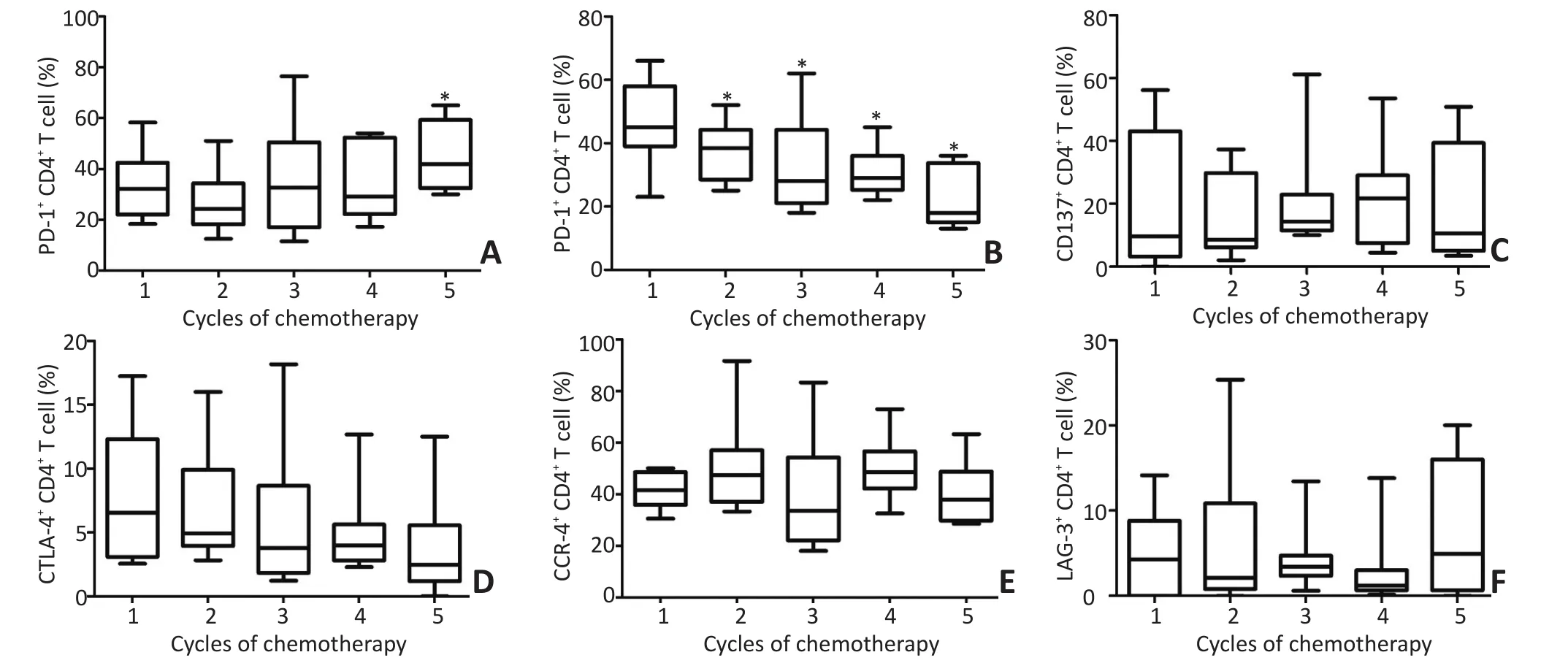
图2 CD4+T淋巴细胞表面相关免疫检查点变化趋势Figure 2 Expression of immune checkpoints in CD4+T cell surface
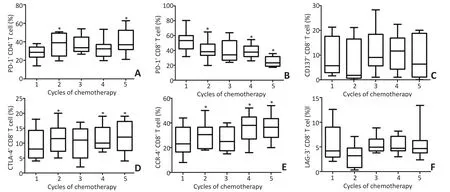
图3 CD8+T淋巴细胞表面相关免疫检查点变化趋势Figure 3 Expression of immune checkpoints in CD8+T cell surface
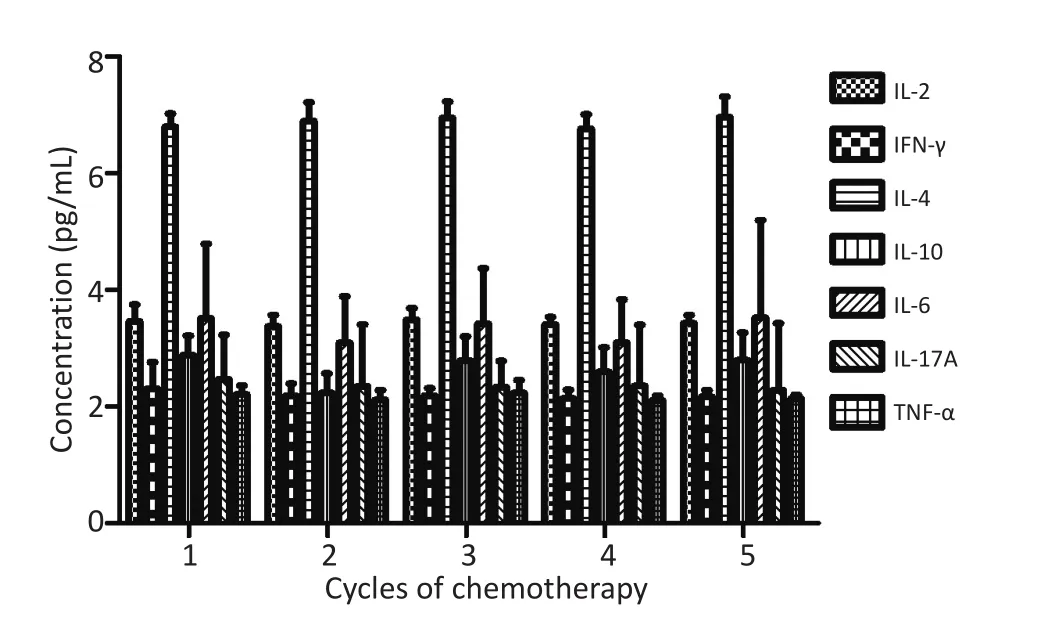
图4 细胞因子变化趋势Figure 4 Changes in cytokines
3 讨论
3.1 外周血常规、生化指标变化趋势
随着化疗,白细胞、中性粒细胞、淋巴细胞、血小板、血红蛋白水平显著下降,提示骨髓抑制作用逐渐增强,且不能恢复到同比化疗之前水平,与现有临床研究结果相符[9]。治疗中监测血常规变化,有助于评估骨髓再生功能,选择合适治疗时机。血生化影响不显著,提示无肝肾基础疾病患者,应用目前化疗方案对于肝肾功能相对安全。
3.2 肺癌患者多次化疗中外周血淋巴细胞亚群变化趋势
化疗药物对免疫细胞的杀伤作用,可造成免疫细胞比例和数量异常,改变机体免疫格局[4]。本研究采取每个周期化疗前采血,排除化疗药物对免疫细胞的一过性杀伤作用。动态观察5个周期(约120 d)的治疗过程发现,肺癌患者化疗中机体免疫细胞数量变化体现在CD8+T细胞、CD19+B细胞和CD16+CD56+NK细胞水平下调,而CD4+T淋巴细胞水平整体增加。CD8+T细胞是抗肿瘤免疫的主要效应细胞[10],其水平下调提示化疗过程中,机体抗肿瘤免疫处于逐渐受抑状态;CD4+T细胞又称为辅助性T细胞,其具有辅助免疫功能,亦可诱导分化Treg细胞负性调节免疫,对机体免疫调节具有双向作用[11],进一步细分CD4+T细胞亚型数量变化,特别是Treg细胞变化趋势,有助于更准确地评估机体免疫功能走势。CD19+B细胞是体液免疫的主要效应细胞,可作为抗原提呈细胞呈递抗原、分泌抗肿瘤抗体及相关细胞因子等途径正向调控抗肿瘤免疫应答[12],其数量下降是机体整体免疫应答不充分的一种表现。NK细胞又称为自然杀伤细胞,通过直接杀伤及分泌多种细胞因子来发挥作用,是抗肿瘤免疫的第一道防线[13],CD16+CD56+NK细胞水平整体呈下调趋势,提示机体固有免疫功能缺失。化疗过程中,对不同免疫细胞亚群的变化监测有助于评估机体免疫功能状况,更有针对性地选择应用化疗及免疫治疗。同时,免疫细胞数量的减少与机体抗肿瘤免疫无能密切相关。在治疗过程中,通过检测特定免疫细胞缺失情况,针对性外源性补足抗肿瘤免疫所需免疫细胞,可能获得在化疗基础上更优的治疗效果。
3.3 外周血T淋巴细胞表面检测点表达变化
T淋巴细胞作为抗肿瘤免疫的主要效应细胞,其表面的共抑制或共刺激分子提供的共信号,决定了T细胞免疫应答的最终效应[14]。随治疗过程进展,CD4+T细胞表面PD-1表达上调,CD8+T细胞表面PD-1、CTLA-4和CCR-4表达上调,提示免疫调控负向倾斜。且在T细胞介导免疫逃逸过程中,CD8+T细胞可能比CD4+T细胞起到更为重要的作用。PD-L1作为与PD-1结合的主要配体,可高表达于多种肿瘤组织,通过与PD-1的结合,介导肿瘤细胞免疫逃逸[15]。CD4+、CD8+T细胞表面的PD-L1表达下调,有研究报道,T细胞表面PD-L1的高表达与NSCLC应用表皮生长因子受体酪氨酸激酶抑制剂的疗效呈负相关[16],推测T细胞表面PD-L1的动态变化,可能也是一种反映机体T细胞免疫调控的指标。然而,T细胞表面PD-L1表达与肿瘤细胞表面PD-L1表达是否相关,呈哪种相关关系,需要同时检测相应时段肿瘤局部组织或浸润细胞表面PD-L1的表达情况。下一步通过动物实验,进行T细胞表面PD-L1的表达与肿瘤组织细胞表面PD-L1表达相关性分析,有可能提供一种实时动态监测机体PD-1/PD-L1信号通路变化的可行思路。
研究结果显示,在化学药物一线治疗肺恶性肿瘤细胞过程中,实施协同共抑制分子PD-1/PD-L1、CTLA-4和CCR-4监测具有重要意义,在化疗周期中,针对免疫检查点高表达的患者,联合应用PD-1、PD-L1、CTLA-4或CCR-4抗体可能具有在化疗基础上更优的治疗效果。
3.4 肺癌患者多个周期化疗中外周血细胞因子表达变化
本研究显示,外周血相关细胞因子(IL-2、IFN-γ、IL-4、IL-6、IL-10、TNF-α和IL-17A)整体表达无显著性差异。考虑可能与不同肿瘤的不同发展阶段、人体免疫系统的复杂性以及入组对象、细胞因子测量等差异相关,提示外周血细胞因子检测可能缺乏特异性。鉴于细胞因子的多向性行为特征,获取肿瘤局部裂解液进行细胞因子检测能更为准确反映肿瘤微环境的变化。
综上所述,本研究通过监测临床肺癌患者多个周期化疗过程中相关免疫指标的变化,提示实施淋巴细胞亚群数量及T细胞表面共抑制分子监测具有重要意义,化疗中后期针对免疫检查点高表达患者,联合应用PD-1、PD-L1、CTLA-4或CCR-4抗体可能具有在更优的治疗效果。尽管标本量相对局限,结论亟需大规模的临床论证,但相关结果亦可为将来的肺癌临床免疫治疗提供试验依据,具有一定的临床参考价值。
[1]Siegel RL,Miller KD,Jemal A.Cancer statistics,2016[J].CA J Clin,2016,66(1):7-30.
[2]Sateia HF,Choi Y,Stewart RW,et al.Screening for lung cancer[J].Seminar in Oncol,2017,44(1):74-82.
[3]Gasparri ML,Ruscito I,Taghavi K,et al.The Immunobiology of cancer:from tumor escape to cancer immunoediting towards immunotherapyin gynecologic oncology[M].Mole Oncol:underlying mechanisms and translational advancements.springer international publishing,2017:193-204.
[4]Chacon JA,Schutsky K.The impact of chemotherapy,radiation and epigenetic modifiers in cancer cell expression of immune inhibitory and stimulatory molecules and anti-tumor efficacy[J].Vaccines,2016,4(4):43.
[5]Seyedin SN,Schoenhals JE,Lee DA,et al.Strategies for combining immunotherapy with radiation for anticancer therapy[J].Immun,2015,7(9):967.
[6]Li J,Shi DP.Correlation study of lung cancer and T-lymphocyte subgroup[J].China Lung Dis J,2015,8(2):110-112.[李军,石殿鹏.肺癌与T淋巴细胞亚群相关性研究[J].中华肺部疾病杂志电子版,2015,8(2):110-112.]
[7]Zhi WW,Sun chao,Wang SZ.Progress research on tumor immunotherapy of targeted T cell co-signal[J].Pharmac Pro,2015,(9):659-665.[支旺旺,孙超,王淑珍.靶向T细胞共信号的肿瘤免疫治疗研究进展[J].药学进展,2015,(9):659-665.]
[8]Lippitz BE.Cytokine patterns in patients with cancer:a systematic review[J].The Lancet Oncol,2013,14(6):e218-e228.
[9]Wang CJ,Ji XY.Adverse reactions of chemotherapy drugs in tumor[J].Mod Oncol Medi,2006,14(10):1321-1323[王传金,纪秀英.肿瘤化疗药物的不良反应[J].现代肿瘤医学,2006,14(10):1321-1323.
[10]Calì B,Molon B,Viola A.Tuning cancer fate:the unremitting role of host immunity.[J].Open Biol,2017,7(4).
[11]Miceli MC,Parnes JR.Role of CD4 and CD8 in T cell activation and differentiation[J].Adv Immun,1993,53(53):59-122.
[12]Pieper K,Grimbacher B,Eibel H.B-cell biology and development[J].J Alle Clin Immun,2013,131(4):959-971.
[13]Vivier E,Tomasello E,Baratin M,et al.Functions of natural killer cells[J].Nat Immu,2008,9(5):503-510.
[14]Chen L,Flies DB.Molecular mechanisms of T cell co-stimulation and co-inhibition.[J].Nat Rev Immun,2013,13(4):227-42.
[15]Pardoll DM.The blockade of immune checkpoints in cancer immunotherapy[J].Nat Rev Cancer,2012,12(4):252-64.
[16]Meniawy TM,Lake RA,Mcdonnell AM,et al.PD-L1 on peripheral blood T lymphocytes is prognostic in patients with non-small cell lung cancer(NSCLC)treated with EGFR inhibitors[J].Lung Cancer,2016,(93):9.
Profiling the dynamic changes of PBMC immune-related indicators in patients with lung cancer after chemotherapy cycles
Duo YOU1,2,Yanan CHEN1,Ru YANG1,Zhishan XU1,Ping LU2,Genshen ZHONG1
1Lab of Cancer Biotherapy;2Department of Oncology,First Affiliated Hospital of Xinxiang Medical University,Weihui 453100,China
Genshen ZHONG;E-mail:zhonggs@xxmu.edu.cn
Objective:To explore the optimal time point for combining chemotherapy and immunotherapy and provide an experimental basis for immunotherapy intervention in clinical.Methods:Twenty-three lung cancer patients who completed five chemotherapy cycles between November 2015 and December 2016 in the First Affiliated Hospital of Xinxiang Medical University were enrolled in this study.Numbers of T lymphocyte subsets,B lymphocytes,and NK lymphocytes in peripheral blood were counted.Expression levels of T lymphocyte co-suppression molecule and cytokines in the peripheral blood mononuclear cell were detected using flow cytometry to analyze the dynamic changes of such indicators from one cycle to five cycles of chemotherapy.Results:Significant decreases in the levels of CD8+T lymphocytes,CD19+B lymphocytes,and CD16+CD56+NK cells and an increase in CD4+T lymphocytes were observed in the course of multi-cycle chemotherapy for patients with lung cancer.Differences were statistically significant(P<0.05).The co-suppression molecular expression of PD-1,CTLA-4,and CCR-4 with T lymphocytes was downregulated,and the differences were significant(P<0.05).Conclusion:Profiling the dynamic changes of lymphocyte subsets and the expression of T lymphocyte co-suppression molecule are significant in multiple chemotherapy cycles for patients with lung cancer.In the later stage,the combined application of PD-1,PDL1,CTLA-4,or CCR-4 antibody may exert good therapeutic effects for patients with a high expression level of related immune checkpoints.
immunotherapy,T lymphocyte surface co-signaling molecules,lung cancer,multi-cycle chemotherapy
10.3969/j.issn.1000-8179.2017.22.642
①新乡医学院第一附属医院生物治疗实验室(河南省卫辉市453100);②新乡医学院第一附属医院肿瘤二科
*本文课题受国家自然科学青年基金项目(编号:81201765)、河南省高校重点科研项目(编号:15A320063)、新乡医学院研究生科研创新支持计划项目(编号:YJSCX201509Z)和河南省骨干青年教师培养计划项目(编号:2016GGJS-105)资助
钟根深 zhonggs@xxmu.edu.cn
This study was supported by the National Natural Science Foundation for Youth of China(No.81201765),the Key Scientific Research Projects for Higher Education of Henan Province(No.15A320063),and the Graduate Student Support of Scientific Research Innovation Projects of Xinxiang Medical University(No.YJSCX201509Z)and Young Backbone Teachers Fellowship in Henan Province(2016GGJS-105)
(2017-06-07收稿)
(2017-08-29修回)

尤朵 专业方向为消化道和胸部肿瘤的内科综合治疗。
E-mail:870332870@qq.com

