PD0332991在套细胞淋巴瘤细胞集落形成中的作用*
王芳 张新伟
·基础研究·
PD0332991在套细胞淋巴瘤细胞集落形成中的作用*
王芳①②张新伟①
目的:探讨细胞周期蛋白依赖性激酶4/6(cyclin-dependent kinases 4/6,CDK4/6)靶向抑制剂PD0332991在套细胞淋巴瘤(mantle cell lymphoma,MCL)集落形成中的作用及机制。方法:采用流式细胞术检测PD0332991对MCL细胞周期的影响;应用Western blot法检测PD0332991处理后MCL细胞Rb蛋白和磷酸化Rb(phosphorylated retinal blastoma,p-Rb)蛋白的表达水平;采用集落形成实验检测PD0332991、米托蒽醌及双药联合对MCL细胞集落形成能力的影响。结果:采用流式细胞术研究证实PD0332991使G0/G1期MCL细胞明显增多,而S期细胞明显下降,导致细胞的G0/G1期阻滞。应用Western blot法检测显示PD0332991对Rb蛋白表达无影响,但能明显下调磷酸化Rb蛋白的水平。集落形成实验显示PD0332991可抑制MCL细胞集落形成,并增强米托蒽醌对MCL集落形成的抑制作用。结论:CDK4/6靶向抑制剂PD0332991可通过抑制MCL细胞Rb蛋白磷酸化,导致细胞的G0/G1期阻滞,增强米托蒽醌抑制MCL集落形成的能力。
套细胞淋巴瘤 细胞周期蛋白依赖性激酶6 细胞周期阻滞 PD0332991 集落形成
套细胞淋巴瘤(mantle cell lymphoma,MCL)是一种较为罕见具有独立的临床、生物学及分子遗传学特点的B细胞非霍奇金淋巴瘤,对标准治疗方案临床缓解期短、预后差,中位总生存期(median overall survival,mOS)仅为4~5年[1-3]。因此,进一步研究MCL发病机制,寻找新的治疗靶标并探索新的治疗方案对其治疗具有重要意义。本课题组前期研究工作提示,肿瘤微环境中的基质细胞滤泡树突状细胞(follicular dendritic cells,FDCs)与MCL细胞共培养后,可直接下调miR-548m的水平并上调CDK6的表达,且CDK6-3'UTR是miR-548m的直接作用靶点,FDCs通过FDCs-miR-548m-CDK6轴调节MCL细胞集落形成能力[4]。近年来研究发现,细胞周期调控异常导致的细胞过度增殖是人类肿瘤发生的重要机制之一,CDK4/6作为细胞周期的重要调控因子,其过表达与多种肿瘤的发生密切相关。目前,以CDK4/6为靶点的肿瘤治疗展现出广泛的治疗前景[5-8]。本研究旨在探讨CDK4/6靶向抑制剂PD0332991在MCL集落形成中的调节机制,并进一步明确CDK6在MCL中的作用机制,为CDK4/6靶向抑制剂PD0332991在MCL治疗提供理论依据。
1 材料与方法
1.1 材料
1.1.1 细胞系 MCL细胞系Jeko-1由美国Moffitt癌症中心提供,Granta-519细胞由天津医科大学肿瘤医院生物技术研究室提供。
1.1.2 主要试剂 胎牛血清、PRMI-1640均购自美国Gibco公司,胰酶购自日本Taraka公司,PD0332991购自美国Selleck公司,小鼠抗人β-actin单克隆抗体购自美国Santa Cruz Biotechnology公司,兔抗人Rb单克隆抗体购自美国Cell Sigalling Technology公司,兔抗人磷酸化Rb单克隆抗体购自美国Cell Sigalling Technology公司,抗兔IgG、HRP-linked抗体、抗鼠IgG、HRP-linked抗体均购自北京中杉金桥生物技术有限公司,Brdu试剂盒购自美国BD公司。
1.2 方法
1.2.1 细胞培养 MCL细胞系Jeko-1细胞常规培养于含20%胎牛血清的1640培养液中。MCL细胞系Granta-519细胞常规培养于含10%胎牛血清的1640培养液中。
1.2.2 Brdu/7-AAD流式细胞术检测细胞周期 将MCL细胞铺于24孔板中,每孔约1×105个细胞,加入药物,于37℃5%CO2孵箱培养24 h;之后向培养液中掺入Brdu 1mmol/L,同时将不加Brdu作为阴性对照;继续培养12h后收集细胞于离心管中,经固定破膜、渗透、再固定后离心弃上清,加入DNA酶,37℃孵育1 h并离心弃上清;然后加入Brdu抗体50 μL,室温孵育20 min,离心弃上清;加入20 μL 7-AAD染总DNA,重悬细胞后1 h内用流式细胞仪测定结果。
1.2.3 应用Western blot法检测 收集细胞,通过细胞裂解液RIPA裂解、提取总蛋白,测定浓度。SDS-PAGE凝胶电泳分离,电转移至PVDF印迹膜,封闭,分别滴加Rb蛋白抗体、磷酸化Rb蛋白抗体进行孵育,PBST洗膜后,加入二抗室温孵育,PBST洗膜后用化学发光法显影。
1.2.4 集落形成试验 将MCL细胞与甲基纤维素培养基按1:10的体积比进行混合,并分别加入PD0332991、米托蒽醌、PD033299和米托蒽醌,并设置阴性对照。用连有16号无菌针头的3 mL无菌注射器取1.1 mL细胞混合液放至35 mm的平皿里,轻轻倾斜并晃动平皿以使培养基铺匀,置于37℃含5%CO2、95%湿度的孵箱中培养14 d后计数集落数。
1.3 统计学分析
采用SPSS 19.0软件进行统计学分析。数据采用表示,两组定量资料的比较采用独立样本t检验,两组以上定量资料的比较采用单因素方差分析,相关分析采用Spearman相关分析。以P<0.05为差异具有统计学意义。
2 结果
2.1 CDK4/6靶向抑制剂PD0332991导致MCL细胞G0/G1期阻滞
本研究前期实验证明,肿瘤基质细胞通过FDCsmiR-548m-CDK6轴调节MCL细胞集落形成能力,CDK6是MCL治疗的一个潜在靶点[4]。基于上述研究,本研究进一步探讨CDK4/6靶向抑制剂PD0332991在MCL集落形成调节中的机制。首先,采用PD0332991分别处理MCL细胞系Jeko-1和Granta-519细胞24 h,并应用Brdu/7-AAD流式细胞术检测其对MCL细胞周期变化。研究结果发现,PD0332991使Jeko-1和Granta-519细胞的G0/G1期细胞数目明显增多,而S期细胞数目明显下降,从而导致细胞的G0/G1期阻滞,且差异具有统计学意义。然而对G2+M期细胞和细胞直接凋亡作用有限(图1,表1,2)。

图1 流式细胞术分别检测Jeko-1和Granta-519细胞周期变化Figure 1 Jeko-1 and Granta-519 cell cycle distribution was measured using flow cytometry assay

表1 PD0332991对Jeko-1细胞周期分布的影响Table 1 Effect of PDO332991 on cell cycle of Jeko-1 cells

表2 PD0332991对Granta-519细胞周期分布影响Table 2 Effect of PD0332991 on cell cycle of Granta-519 cells
2.2 CDK4/6靶向抑制剂PD0332991抑制MCL Rb蛋白磷酸化
上述实验证实CDK4/6靶向抑制剂PD0332991导致Jeko-1和Granta-519细胞G0/G1期周期阻滞,为了明确PD0332991是否通过Rb蛋白磷酸化导致上述现象,本研究应用Western blot法进一步检测PD0332991对Granta-519和Jeko-1细胞中Rb蛋白及磷酸化Rb(p-Rb)蛋白的影响。将Granta-519和Jeko-1两种细胞系分别用PD0332991处理24 h后,收集细胞提取蛋白,应用Western blot法检测Rb蛋白和p-Rb蛋白的表达水平。PD0332991对Rb蛋白表达无明显影响,但却能显著下调p-Rb蛋白的水平,即PD0332991通过抑制Rb蛋白磷酸化从而导致细胞的G1期阻滞(图2)。

图2 应用Western blot法检测证明PD0332991对Rb蛋白表达无影响,但明显下调p-Rb蛋白水平Figure 2 Western blot confirmed that PD0332991 exerted no effect on Rb protein but suppressed levels of phosphorylated Rb protein
2.3 CDK4/6靶向抑制剂PD0332991增强米托蒽醌对MCL集落形成能力的抑制作用
先前研究已经证实,CDK6在MCL的发生发展及肿瘤耐药中发挥着重要作用(图3)[4,9-13]。本课题组进而研究了CDK4/6靶向抑制剂PD0332991及其联合米托蒽醌对比米托蒽醌单药对MCL集落形成能力的影响。将采用甲基纤维素培养基培养的Granta-519细胞分为4组,每组3个样本,其中分别加入PD0332991、米托蒽醌、PD0332991和米托蒽醌,并设置阴性对照组,培养14 d后计数集落数目。统计4组集落数目如下,对照组为(55.75±7.93),PD0332991组为(37.75±3.77),米托蒽醌组为(32.00±3.16),PD0332991+米托蒽醌联用组为(17.00±3.27)。本研究证实PD0332991和米托蒽醌均能抑制MCL集落形成能力,且相对于对照组差异均具有统计学意义(P<0.05)。此外,米托蒽醌联合PD0332991相对于米托蒽醌组,集落数目更少,且差异具有统计学意义(P<0.05,图4)。

▶图3 CDK6在MCL发病机制中的关键作用Figure 3 Critical role of CDK6 in pathogenesis of MCL
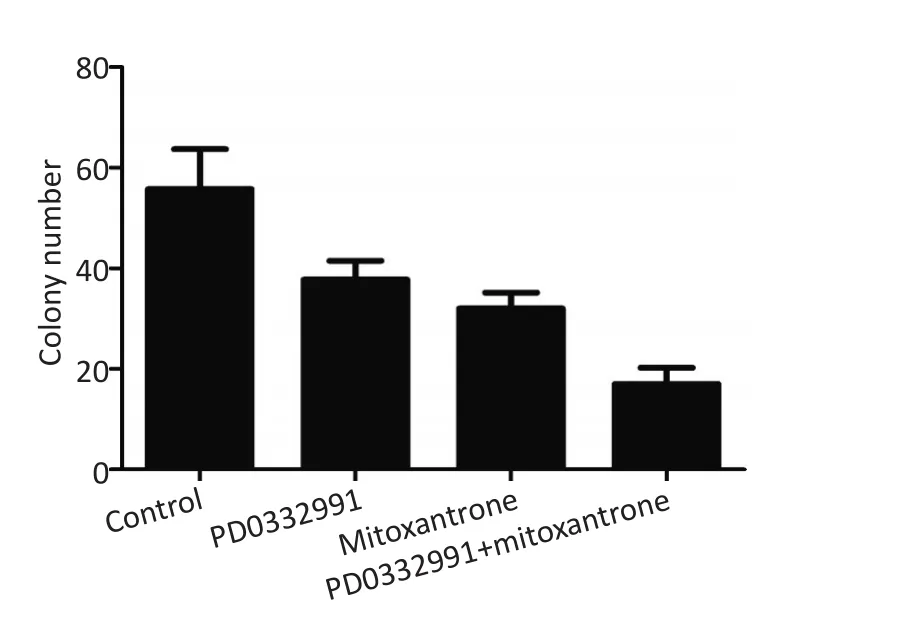
图4 集落形成实验检测PD0332991、米托蒽醌及双药联合对MCL集落形成能力的影响Figure 4 Colony forming assay was performed to test the role of PD0332991 and mitoxantrone and their combination on colony forming activity in MCL
3 讨论
MCL具有独特的免疫表型和临床特点,多数存在t(11;14)(q13;q32)和cyclin D1过表达,兼具弥漫大B细胞淋巴瘤(diffuse large B cell lymphoma,DLBCL)的侵袭性和低度恶性淋巴瘤的不可治愈性,其对标准治疗方案临床缓解期短,预后不良,mOS较短[14]。虽然,多数MCL患者存在cyclin D1过表达,但转基因小鼠证实单纯cyclin D1过表达并不能导致淋巴瘤的发生[15]。作为一种肿瘤异质性疾病,MCL的发生发展需要多个因素的参与[16-17]。本课题组先前研究发现,肿瘤微环境中的基质细胞FDCs能够明显抑制MCL中miR-548m表达,从而导致c-myc和HDAC6的表达增加,并且miR-548m本身受c-myc负调控,从而形成miR-548m和c-myc环路,进一步导致c-myc上调、miR-548m减少,而且过表达miR-548 m或直接抑制HDAC6能够减少HBL-2的集落形成[9]。该研究结果表明,FDCs可通过调节MCL的miR-548m和c-myc环路,造成c-myc持续表达、miR-548m减少、HDAC6上调,MCL细胞增殖。此外,本研究证实CDK6是miR-548m的作用靶点,FDCs通过下调miR-548m表达,上调CDK6表达,促进MCL集落形成能力,FDCs通过FDCs-miR-548m-CDK6轴调节MCL细胞集落形成能力[4]。另外,研究发现CDK6是miR-29和miR-34a的特异性靶点,且其表达水平与患者的预后密切相关,并受c-myc表达调控,miR-29和miR-34a可能通过CDK6参与MCL的发生和发展[10-12]。本研究进一步证实,c-myc通过HDAC3(组蛋白去乙酰化酶3)募集SUZ12(多梳蛋白)和EZH2(多梳基因抑制复合物2的关键组成蛋白)抑制miR-29表达,促进CDK6表达,参与MCL的发生和发展[11]。上述原因导致MCL过表达CDK6,从而协同cyclin D1引起Rb蛋白磷酸化,使转录因子E2F的释放使细胞由G1期进入S期,从而促进MCL细胞增殖[11,13]。上述研究表明,肿瘤微环境中的 FDCs与MCL细胞接触后激活肿瘤细胞的c-myc和miR-548m环路,导致c-myc过表达,进而影响miR-548m、miR-29和miR-34a等miRNAs表达,造成CDK6等蛋白过表达,协同cyclin D1引发Rb磷酸化,促进肿瘤增殖、减少凋亡,导致肿瘤进展和耐药。
鉴于CDK6在MCL发病机制中的重要作用,有关其抑制剂在MCL治疗中的研究也越来越受到关注[18]。本研究进一步探索了CDK4/6靶向抑制剂PD0332991在MCL治疗中的作用及其可能的作用机制。综上所述,本研究证实CDK4/6靶向抑制剂PD0332991通过抑制Rb蛋白磷酸化,导致MCL细胞G0/G1期阻滞,抑制MCL集落形成,并增强米托蒽醌对MCL集落形成能力的抑制作用。该研究进一步丰富了MCL发生发展的机制,揭示了CDK4/6抑制剂PD0332991在MCL集落形成中的作用,为MCL的治疗提供新的思路和理论依据。
[1]Chen R,Sanchez J,Rosen ST.Clinical management updates in mantle cell lymphoma[J].Oncology,2016,30(4):353-360.
[2]Cheah CY,Seymour JF,Wang ML.Mantle cell lymphoma[J].J Clini Oncol Offic J Am Soci Clin Oncol,2016,34(11):1256-1269.
[3]Vose JM.Mantle cell lymphoma:2015 update on diagnosis,riskstratification,and clinical management[J].Am J Hemat,2015,90(8):739-745.
[4]Wang F,Zhang XW,Zhang YZ,et al.The role of FDCs-miR-548m-CDK6 axis on clonogenicity in mantle cell lymphoma[J].Chin J Clin Oncol,2014,41(18):1175-1179.[王芳,张新伟,张翼鷟,等.FDCs-miR-548m-CDK6轴在套细胞淋巴瘤集落形成中的研究[J].中国肿瘤临床,2014,41(18):1175-1179.]
[5]Wei L,Leibowitz BJ,Wang X,et al.Inhibition of CDK4/6 protects against radiation-induced intestinal injury in mice[J].J Clin Inv,2016,126(11):4076-4087.
[6]Konecny GE.Cyclin-dependent kinase pathways as targets for women's cancer treatment[J].Curr Opin Obste Gynec,2016,28(1):42-48.
[7]Clark AS,Karasic TB,DeMichele A,et al.Palbociclib(PD0332991)-a selective and potent cyclin-dependent kinase inhibitor:a review of pharmacodynamics and clinical development[J].JAMA Oncol,2016,2(2):253-260.
[8]Dong YN,Zhang XW,Wei F.Research advances in the mechanism and role of CDK6 in tumorigenesis[J].Chin J Clin Oncol,2015,42(19):973-977.[董一楠,张新伟,魏枫.CDK6导致肿瘤的机制研究进展[J].中国肿瘤临床,2015,42(19):973-977.]
[9]Lwin T,Zhao X,Cheng F,et al.A microenvironment-mediated cmyc/miR-548m/HDAC6 amplification loop in non-Hodgkin B cell lymphomas[J].J Clin Inv,2013,123(11):4612-4626.
[10]Navarro A,Clot G,Prieto M,et al.microRNA expression profiles identify subtypes of mantle cell lymphoma with different clinicobiological characteristics[J].Clin Cancer Res:An Offic J Am Associ Cancer Res,2013,19(12):3121-3129.
[11]Zhang X,Zhao X,Fiskus W,et al.Coordinated silencing of MYC-mediated miR-29 by HDAC3 and EZH2 as a therapeutic target of histone modification in aggressive B-Cell lymphomas[J].Cancer cell,2012,22(4):506-523.
[12]Chang TC,Yu D,Lee YS,et al.Widespread microRNA repression by Myc contributes to tumorigenesis[J].Nat Gene,2008,40(1):43-50.
[13]Zhao JJ,Lin J,Lwin T,et al.microRNA expression profile and identification of miR-29 as a prognostic marker and pathogenetic factor by targeting CDK6 in mantle cell lymphoma[J].Blood,2010,115(13):2630-2639.
[14]Rajabi B,Sweetenham JW.Mantle cell lymphoma:observation to transplantation[J].Ther Adv Hemat,2015,6(1):37-48.
[15]Katz SG,Labelle JL,Meng H,et al.Mantle cell lymphoma in cyclin D1 transgenic mice with Bim-deficient B cells[J].Blood,2014,123(6):884-893.
[16]Zhang J,Jima D,Moffitt AB,et al.The genomic landscape of mantle cell lymphoma is related to the epigenetically determined chromatin state of normal B cells[J].Blood,2014,123(19):2988-2996.
[17]Campo E,Rule S.Mantle cell lymphoma:evolving management strategies[J].Blood,2015,125(1):48-55.
[18]Leonard JP,LaCasce AS,Smith MR,et al.Selective CDK4/6 inhibition with tumor responses by PD0332991 in patients with mantle cell lymphoma[J].Blood,2012,119(20):4597-4607.
The role of PD0332991 in clonogenicity of mantle cell lymphoma cells
Fang WANG1,2,Xinwei ZHANG1
1Department of Immunology,Tianjin Medical University Cancer Institute and Hospital;National Clinical Research Center for Cancer;Key Laboratory of Cancer Prevention and Therapy,Tianjin;Tianjin's Clinical Research Center for Cancer;Key Laboratory of Cancer Immunology and Biotherapy,Tianjin 300060,China;2Department of Radiation Oncology,Affiliated Hospital of Hebei University,Baoding 071000,China
Xinwei ZHANG;E-mail:zhangxinwei@tjmuch.com
Objective:To investigate the function and mechanism of cyclin-dependent kinase 4/6(CDK4/6)inhibitor PD0332991 on clonogenicity of mantle cell lymphoma(MCL)cells.Methods:The effect of PD0332991 on MCL cell cycle distribution was assessed by flow cytometry;Western blot was used to test expression level of Rb protein and phosphorylated Rb protein in MCL after treatment with PD0332991;colony forming assay was performed to test the role of PD0332991 and mitoxantrone and their combination on colony forming activity in MCL.Results:Flow cytometry revealed that PD0332991 can increase G0/G1 phase MCL cells and significantly decrease S phase cells,leading to G0/G1 cell arrest.Western blot confirmed that PD0332991 exerted no effect on Rb protein expression but suppressed levels of phosphorylated Rb protein.Colony forming assay showed that PD0332991 significantly suppressed colony formation and enhanced the effect of mitoxantrone on colony forming activity in MCL.Conclusion:This study revealed that CDK4/6 inhibitor PD0332991 induced G0/G1 cell arrest and increased the effect of mitoxantrone on MCL clonogenicity by suppressing levels of phosphorylated Rb protein.
mantle cell lymphoma,cyclin-dependent kinases 6,cell cycle arrest,PD0332991,colony formation
10.3969/j.issn.1000-8179.2017.22.754
①天津医科大学肿瘤医院生物技术研究室,国家肿瘤临床医学研究中心,天津市肿瘤防治重点实验室,天津市恶性肿瘤临床医学研究中心,天津市肿瘤免疫与生物治疗重点实验室(天津市300060);②河北大学附属医院放射治疗科
*本文课题受国家科技支撑计划项目(编号:2015BAI12B12)资助
张新伟 zhangxinwei@tjmuch.com
This work was supported by National Science and Technology Support Plan Projects(No.2015BAI12B12)
(2017-07-04收稿)
(2017-09-13修回)
(编辑:孙喜佳 校对:杨红欣)

王芳 专业方向为恶性肿瘤免疫及放射治疗。
E-mail:tumor@aliyun.com

