IL-17单克隆抗体的制备与鉴定
桑锋锋,高 洋,张洪杰,朱伟英,王 毅,陈德坤
(西北农林科技大学动物医学院,陕西杨凌 712100)
IL-17单克隆抗体的制备与鉴定
桑锋锋,高 洋,张洪杰,朱伟英,王 毅,陈德坤*
(西北农林科技大学动物医学院,陕西杨凌 712100)
为制备山羊IL-17单克隆抗体,诱导重组菌 rIL-17-pET32a-TransB(DE3)表达山羊IL-17重组蛋白(rIL-17),纯化后免疫BALB/c小鼠,取免疫合格的小鼠脾细胞与SP2/0骨髓瘤细胞进行细胞融合,采用间接ELISA方法筛选阳性克隆细胞株。对获得的杂交瘤细胞进行染色体组型分析,并对其分泌的IL-17单克隆抗体进行抗体特异性、抗体类别等分析。结果显示,成功获得了纯化的山羊IL-17原核表达产物;筛选到1株能特异性分泌山羊IL-17单克隆抗体的杂交瘤细胞株-B6,其分泌的单克隆抗体亚型为IgG1,抗体轻链为κ。
山羊;IL-17单克隆抗体;杂交瘤细胞;酶联免疫吸附试验
白细胞介素17(IL-17)是一种主要由IL-17+淋巴细胞产生的细胞因子,它通过诱导IL-6、IL-8和TNFα等细胞因子的释放,募集中性粒细胞至炎症部位,介导清除炎症部位的病原微生物。因此,IL-17在机体抵抗细胞外寄生菌如大肠杆菌、鼠类柠檬酸杆菌、白色念珠菌等的感染中发挥着重要作用[1-3]。进一步的研究指出,IL-17在抗病毒感染中也发挥着重要作用[4]。不仅如此,IL-17也是机体病理性炎症反应的关键性介导者[5]。目前,有关IL-17在山羊机体抗感染免疫、山羊炎症反应中的作用还很不清楚。本研究开展山羊IL-17单克隆抗体研发,以期为IL-17在山羊疾病中发挥的作用机理研究提供有力的工具。
1 材料与方法
1.1 材料
1.1.1 实验动物和细胞 雌性Balb/c小鼠,6周龄~8周龄,购自第四军医大学实验动物中心;山羊rIL-17-pET-32a-TransB(DE3)重组菌,cIL-17-pEGFP-N1质粒,SP2/0细胞,西北农林科技大学动物医学院兽医免疫学实验室保存。
1.1.2 主要试剂与仪器 完全弗氏佐剂、不完全弗氏佐剂、小鼠抗体亚型鉴定试剂盒、异丙基-β-D-硫代半乳糖苷(IPTG)为Sigma公司产品;HRP标记羊抗鼠IgG购自北京博奥森生物技术有限公司;TMB显色液购自天根生化科技有限公司;Ni-NTA琼脂糖凝胶镍柱购自北京全士金生物技术有限公司;酶标仪为Bio-Rad公司产品;酶标板为Castor公司产品。
1.2 方法
1.2.1 rIL-17蛋白的诱导表达及纯化 将重组菌在Amp+/kan+的LB固体培养基上划板复苏,挑取单个菌落扩大培养,收集菌体,10 000 r/min 离心1 min,用PBS重悬菌体,在冰水上超声破碎至澄清,12 000 r/min离心30 min,收集上清。取上清过镍柱,用80 mmol/L咪唑洗脱杂蛋白,500 mmol/L咪唑洗脱目的蛋白。收集目的蛋白,进行SDS-PAGE鉴定并测定浓度。
1.2.2 IL-17的真核表达 将cIL-17-pEGFP-N1及pEGFP-N1分别转染293T细胞,培养72 h后,收集细胞上清。
1.2.3 动物免疫 取4只7周龄雌性Balb/c小鼠,将抗原按50 μg/只的剂量与等体积的弗氏佐剂充分乳化后腹部皮下多点注射,每隔2周加强免疫一次。第3次免疫7 d后,摘眼球法采集免疫小鼠血清,此为免疫血清(阳性血清)。另采集未免小鼠血清,作为阴性血清。
1.2.4 小鼠血清效价的检测 3次免疫后第7天,尾静脉采血,按照实验室之前建立的ELISA检测方法测定小鼠血清效价,选择抗体效价大于1∶50 000的小鼠,尾静脉注射50 μg/只的水剂抗原冲击免疫,3 d后进行细胞融合[6]。ELISA方法操作如下:用pH9.6、0.1 mol/L碳酸盐缓冲液稀释抗原终浓度为10 μg/mL,4℃包被12 h;50 g/L脱脂奶粉37℃封闭1 h;小鼠血清用PBST进行 1∶102、1∶103、1∶104、1∶105稀释,100 μL/孔,37℃孵育1 h;羊抗小鼠IgG酶标二抗1∶5 000稀释,100 μL/孔,37℃孵育1 h;TMB显色15 min,2 mol/L硫酸终止反应,置于酶标仪,读取OD450nm值。待测孔OD450nm值(P)比阴性对照孔OD450nm值(N)大于或等于2.1(即P/N≥2.1)时,待测孔判为阳性孔。
1.2.5 细胞融合与筛选 取免疫小鼠脾细胞与SP2/0瘤细胞参照文献[6]方法进行细胞融合,用间接ELISA法进行筛选。有限稀释法克隆3次后,逐级扩大培养并冻存。
1.2.6 单克隆抗体制备及特异性鉴定 采用小鼠腹腔诱导腹水制备单克隆抗体[7],同时对杂交瘤细胞培养上清及小鼠腹水与293T细胞分泌的IL-17、pEGFP-N1空载体真核转染培养上清K进行间接ELISA试验。
1.2.7 杂交瘤细胞染色体组型分析 重悬生长状态良好的杂交瘤细胞,1 000 r/min离心10 min,弃去上清,加入含终浓度0.2 μg/mL秋水仙素的新鲜培养基培养2 h;1 000 r/min离心8 min,弃上清,加入37℃预热的0.075 mol/L KCl溶液8 mL,低渗处理20 min;加入2 min先配置的固定液(甲醇∶冰醋酸=3∶1),预固定2 min;弃上清,加入8 min固定液,静止固定20 min,1 000 r/min离心8 min,弃上清(固定)。固定好的细胞悬液视细胞多少留下0.5 mL~1 mL的固定液,悬浮细胞,在-20℃预冷的载玻片上垂直滴加1~2点,自然阴干。Gimsa法染色20 min后油镜镜检[8]。
1.2.8 单克隆抗体亚型鉴定 采用Sigma公司的Mouse Monoclonal Antibody Isotyping Kit进行鉴别。取杂交瘤细胞及小鼠腹水,用pH7.2的PBS做1∶10稀释;取稀释液200 μL加入试验管中,室温静止30 s,将Isotrip胶体金试纸插入管底,10 min后取出,观察结果。
1.2.9 单克隆抗体稳定性试验 将杂交瘤细胞连续传代3次并冻存后复苏,取细胞培养上清进行ELISA检测抗体效价确定其稳定性。
2 结果
2.1 山羊rIL-17蛋白的表达及纯化
山羊rIL-17蛋白的分子质量大约为33 ku~35 ku,经镍柱纯化,SDS-PAGE电泳结果如图1,纯化后的蛋白分子质量约为34 ku,与理论值相符,目的蛋白纯度高,杂蛋白较少。蛋白浓度为2 mg/mL。
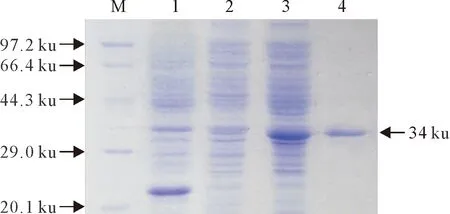
M.蛋白分子质量标准 ; 1.空载体诱导表达上清; 2.重组菌未诱导表达上清; 3.未纯化的山羊rIL-17; 4.纯化的山羊rIL-17
M.Protein molecular weight Marker; 1.Soluble products of the induced PET 32a expressing vector; 2.Soluble products of the no-induced recombinant expressing cells (unpurified); 3.The unpurified goat IL-17 protein; 4.The purified goat IL-17 protein
图1纯化rIL-17蛋白的SDS-PAGE检测结果
Fig.1 SDS-PAGE detection of purified rIL-17 protein
2.2 三免后Balb/c小鼠血清抗体水平ELISA检测结果
三免后第7天,对小鼠断尾采血,进行ELISA检测血清效价,2号小鼠和4号小鼠的血清抗体效价在30 000左右,1号小鼠和3号小鼠的血清抗体效价在60 000左右,取1号小鼠脾脏制备脾细胞悬液进行细胞融合。
2.3 杂交瘤细胞的筛选
冲击免疫后,取小鼠脾脏制备脾细胞悬液与SP2/0瘤细胞融合,以重组IL-17蛋白、pET-32a融合标签蛋白(包括Trx·Tag、S·Tag、His·Tag)为包被抗原,通过间接ELISA筛选到2株(B6,H8)识别重组IL-17蛋白的单克隆抗体(表1)。

表1 抗山羊rIL-17单克隆抗体的筛选结果
2.4 杂交瘤细胞的特异性鉴定
以293T细胞分泌的IL-17(F)、空载体转染的293T细胞培养上清k为包被抗原,通过间接ELISA方法,检测发现在这2株单抗中有1株(B6)能特异性识别293T细胞表达的IL-17,对k不识别(表2)。
2.5 杂交瘤细胞染色体数目分析
SP2/0细胞染色体数目为62~68条,而正常小鼠脾细胞的染色体数目为40条,所得杂交瘤细胞的染色体数目应为102~108条。抗山羊rIL-17单克隆抗体杂交瘤细胞的染色体数目为104条,符合融合后细胞的染色体数目。
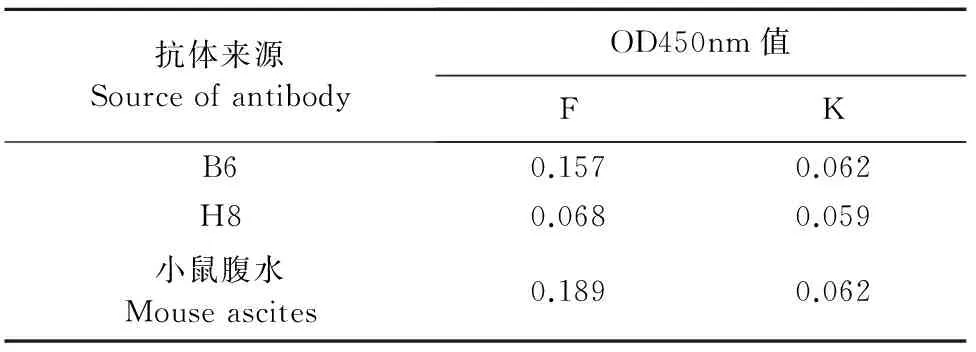
表2 抗山羊rIL-17单克隆抗体的特异性检测结果

图2 杂交瘤细胞染色体数目分析
2.6 单克隆抗体亚型的鉴定
B6株单抗经Mouse Monoclonal Antibody Isotyping Kit 检测后,确定其抗体亚型为IgG1,轻链类型为κ。

图3 杂交瘤细胞亚型鉴定
2.7 单抗稳定性试验检测
将阳性杂交瘤细胞B6株连续传代3次,冻存复苏后ELISA检测细胞上清抗体效价,结果基本不变,说明杂交瘤细胞B6株具有一定的稳定性。
3 讨论
IL-17作为一种主要的炎症因子,可以诱导多种与炎症相关的细胞因子、趋化因子及抗菌肽的产生,在机体的宿主防御过程中发挥重要作用。本研究以原核表达的山羊rIL-17为抗原,免疫Balb/c小鼠,进行细胞融合,获得能分泌特异性识别原核表达的山羊rIL-17抗体的杂交瘤细胞。同时,该细胞株分泌的抗体能特异性识别293T细胞分泌的IL-17,表明本研究获得了能特异性识别山羊IL-17的单克隆抗体,对后续羊口疮、山羊乳房炎、羊痘等疾病的相关研究奠定了基础。
制备山羊IL-17单克隆抗体,对IL-17蛋白的要求较高。纯化的天然IL-17无论用于免疫还是包被抗原都是最理想的抗原,但是天然的IL-17表达量低,纯化难度较大,可行性较差。用原核表达的山羊rIL-17为免疫抗原,主要基于其可大量获得,纯化简单[9]。但由于原核表达载体标签蛋白的表达,其分子质量与天然IL-17蛋白分子质量大小差距不大,免疫小鼠可激活针对标签蛋白B细胞表位的B细胞 ,这加大了后续单抗的筛选工作量。本试验在用原核表达的rIL-17筛选的基础上,进一步用293T细胞分泌的IL-17复筛,减少了工作量,筛选到一株能同时识别原核表达及真核转染IL-17的细胞株。但这株杂交瘤分泌的单抗对山羊IL-17是否具有中和作用,有待进一步验证。
SP2/0骨髓瘤细胞在传代培养过程中,会出现部分细胞返祖的现象,因此,在进行细胞融合前,用8-AG处理SP2/0骨髓瘤细胞,以维持瘤细胞对HAT选择培养基的均一敏感状态。在成功融合的杂交瘤细胞中,能够分泌抗体的细胞一般生长较慢,没有竞争优势,可能会随着传代次数的增加而丢失,因此,融合后应尽快对阳性孔内杂交瘤细胞进行克隆化处理,制备单一的细胞群体。
染色体是基因的载体,当两种不同性状的细胞融合后,染色体数目及形态都可能发生变化,一般在数目上接近两种亲本细胞染色体数目的总和。杂交瘤细胞染色体的稳定对于维持其增殖能力、分泌特异性抗体十分重要[10]。正常小鼠的染色体数目是40条,SP2/0骨髓瘤细胞的染色体数目是62~68条,新生成的杂交瘤细胞的染色体数目应为102~108条,本研究通过染色体组型分析,发现分泌山羊IL-17抗体的杂交瘤细胞的染色体数目为104条,说明细胞融合成功,两种细胞的染色体融合在一起,产生了新的遗传性状。
[1] Porcherie A,Gilbert F B,Germon P,et al.IL-17A is an important effector of the immune response of the mammary gland toEscherichiacoliinfection[J].J Immunol,2016,196(2):803-812.
[2] Yu J J,Ruddy M J,Conti H R,et al.The Interleukin-17 receptor plays a gender-dependent role in host protection againstPorphyromonasgingivalis-induced periodomtal bone loss[J].Infect Immun,2008,76(9):4206-4213.
[3] Bar E,Whitney P G,Moor K,et al.IL-17 regulates systemic fungal immunity by controlling the functional competence of NK cells[J].Immunity,2014,40(1):117-127.
[4] 郭小芹,韩根成,黎 燕.IL-17/IL-17R信号转导机制及功能的研究进展[D].国际免疫学杂志,2012,35(6):416-421.
[5] Song X,Zhu S,Shi P,et al.IL-17RE is the functional receptor for IL-17C and mediates mucosal immunity to infection with intestinal pathogens [J].Nat Immunol,2011,12(12):1151-1158.
[6] 朱立平,陈学清.免疫学常用试验方法[M].北京:人民军医出版社,2000:23-25.
[7] Gosling J P.Immunoassays A Practical Approach[M].America:Oxford University Press.2000:41.
[8] 孙晓林,景志忠.猪带绦虫六钩蚴4 5W-4BX抗原单克隆抗体的制备及鉴定[D].甘肃兰州:甘肃农业大学,2008.
[9] 朱玉贤.现代分子生物学[M].北京:高等教育出版社,2007.
[10] 蒋 琳,苏彩霞,沈心亮.抗一戊型肝炎病毒单克隆抗体的研制和应用[J].中华预防医学杂志,1998,32(3):174-176.
PreparationandIdentificationofMonoclonalAntibodiesagainstGoatInterleukin-17
SANG Feng-feng,GAO Yang,ZHANG Hong-jie,ZHU Wei-ying,WANG Yi,CHEN De-kun
(CollegeofVeterinaryMedicine,NorthwestA&FUniversity,Yangling,Shaanxi,712100,China)
To prepare IL-17 monoclonal antibody (IL-17 McAb) of goat,the expression vector rIL-17-PET32a-TransB (DE3) was constructed to express the goat IL-17 recombinant protein,then the BALB/c mice were immunized with the purified goat rIL-17.The spleen of immunized mouse was fused with myeloma cell line SP2/0,and the positive hybridoma clones were screened by indirect ELISA.Then chromosome karyotype analysis was performed on hybridoma cells,and the antibody specificity and subtype analyses of the secreted monoclonal antibody of IL-17 were performed.The results showed that the prokaryotic expression product of purified goat IL-17 was obtained successfully,and one hybridoma cell,B6,was screened out,which could produce the monoclonal antibody and specifically identify the eukaryotic expression product of IL-17.The antibody subtype of McAb was IgG1and the light chain was kappa.
goat; IL-17 monoclonal antibody; hybridoma cells; ELISA
2017-02-28
陕北白绒山羊主要疫病防控关键技术研究与示范(2015KTTSNY04-04)
桑锋锋(1989-),女,山东滨州人,硕士研究生,主要从事兽医病原学与免疫学研究。*
S852.4
A
1007-5038(2017)11-0052-04