鸡海马结构传入纤维的脑干及小脑起始核—HRP逆行示踪法
张集祥,孔 雪,王 军,王政富,陈 芳,赵海全,刘为民
(佛山科学技术学院,广东佛山 528231)
鸡海马结构传入纤维的脑干及小脑起始核—HRP逆行示踪法
张集祥,孔 雪,王 军,王政富,陈 芳,赵海全,刘为民*
(佛山科学技术学院,广东佛山 528231)
研究鸡海马结构的传入纤维在脑干及小脑内的起始核。将40%辣根过氧化物酶(HRP)水溶液注入鸡左端脑海马结构,逆行追踪投射到海马结构的纤维在脑干和小脑内的起始核。结果在脑干的浅小细胞核(SPC)、圆下核(SRt)、蔡氏区(AVT)和小脑的第Ⅰ~Ⅹ叶浦肯野细胞层内均出现被标记的神经元。初步表明上述部位为端脑海马结构的起始核。
鸡;海马结构;辣根过氧化物酶;逆行追踪;起始核
传统观念认为,海马结构作为边缘系统的一部分,在学习、记忆、情绪、内脏活动中扮演着重要角色。O'Keefe J在1978年发表了其代表作“Hippocampal place unites in the freely moving rat:Why they fire where they fire”,标志着人们对海马结构的认识有了突破性进展,从而认识到海马结构在动物体的空间认知和空间记忆方面发挥着重要作用[1]。继O'Keefe J在海马发现“位置细胞”后,人们又相继发现“网络细胞”和“边缘细胞”,它们都存在于海马结构内,在动物行为中发挥着定位系统的作用[2]。
在禽类,已经有较多的报道表明海马结构在功能、细胞构筑、纤维联系、神经递质和神经调节诸方面与哺乳动物有许多相似之处,特别是在空间导航和空间记忆方面[3-4]。几十年来,学者们对禽类海马结构的纤维联系的研究较多的是在鸽子和斑雀上进行的,对鸡的研究仍待补充。本实验室前期曾采用DiI注射海马结构,结果发现在端脑的副高纹状体、内侧隔核、古纹状体、带核和后背外侧区出现标记神经元,但除了在端脑内发现标记神经元外,脑干和小脑等均未发现标记神经元[5]。为此,本试验应用辣根过氧化物酶(HRP)逆行追踪法进一步示踪脑干和小脑的起始核,以便全面了解鸡海马结构的传入联系。
1 材料与方法
1.1 材料
1.1.1 实验动物 2月龄~3月龄粤禽黄鸡20只,雌雄不拘,体重约1.0 kg~1.5 kg,均购自佛山种鸡场。
1.1.2 主要试剂 多聚甲醛购自天津百世化工有限公司;戊二醛购自天津大茂化学试剂厂;水合氯醛(分析纯)购自天津科密欧化学试剂有限公司;辣根过氧化物酶(horseradish peroxidase,HRP,RZ=3,SigmaⅣ型)、硝普钠(亚硝基铁氰化钠,sodium nitroferricyanide)、四甲基联苯胺(3,3′,5,5′-四甲基联苯胺,TMB)均购自Sigma-Aldrich公司。
1.1.3 主要仪器 江湾Ⅰ型C小动物脑立体定位仪,上海奥尔科特生物科技有限公司产品;KD-500型推拉式三用切片机,KD-Ⅳ电脑快速制冷器,浙江科迪仪器设备有限公司产品;1 μL微量进样器,上海光正医疗仪器有限公司产品;Tiger显微图像分析系统,暨南大学组织与胚胎学教研室研制。
1.2 方法
HRP逆行追踪,按2 mL/kg经腹腔注射10%水合氯醛溶液进行全麻,将动物固定于江湾Ⅰ型C小动物脑立体定位仪,外科方法开颅,将已吸取40% HRP水溶液的玻璃微针(内径20 μm~40 μm)固定于立体定位仪的电极夹持器上,在正中矢状面(以矢状窦判定)稍偏左侧的部位向端脑海马进针[6],注射量0.6 μL,留针15 min后缝合创口。术后存活3 d,按Mesulam(1982)[7]方法灌注固定,取端脑两半球、小脑和脑干,翌日制冰冻连续切片,片厚40 μm。切片经TMB成色,自然干燥后中性红复染,脱水、透明、中性树脂封片后显微镜观察,拍照。
2 结果
2.1 注射点位置
德国学者Redies C[8]和西班牙学者Suárez J[9]将鸡的海马结构划分为6个部分,分别为海马(hippocampus,Hp)、旁海马内侧区(medial subdivision of parahippocampus,APHm)、旁海马中间内侧区(medial part of the intermediate subdivision of parahoppocampus,APHim)、旁海马中间外侧区(lateral part of the intermediate subdivision of parahoppocampus,APHil)、旁海马外侧区(lateral part of parahippocampus,APHl)以及后背外侧区(area corticoidea dorsolateralis,CDL)。本试验将HRP注射左侧海马结构,注射点选择在旁海马中间区(intermediate subdivision of parahoppocampus,APHi)和内侧区之间,以往进针点的数据为:在鸡左脑离原点左0.5 mm,前后4 mm~8 mm处注射,注射角度为向正中矢状面倾斜3°,进针1.5 mm左右。本试验的注射点较为理想,注射点位于在APHi与APHm之间(图1)。
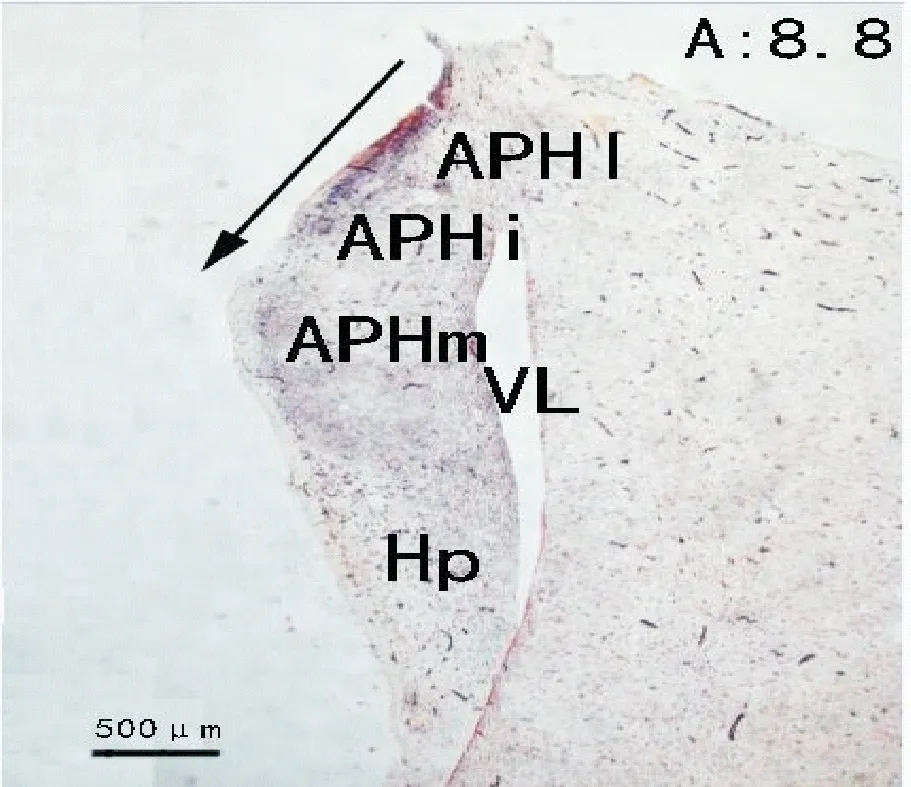
距“0”点向前8.8 mm,黑色箭头示注射方向及深度。Hp为海马;APHm为旁海马内侧区;APHi为旁海马中间区;APHl为旁海马外侧区;VL为侧脑室
At the level of 8.8 mm anterior to the zero point,the black arrowhead showed the injection direction and depth.Hp is hippocampus; APHm is medial subdivision of parahippocampus; APHi is intermediate subdivision of parahippocampus; APHl is lateral part of parahippocampus; VL is lateral ventrical
图1左侧端脑海马结构内HRP注射点(中性红染色,40×)
Fig.1 The injection site of HRP in the left telencephalon
(Stained with neutral red,40×)
2.2 间脑内标记神经元
脑干内双侧浅小细胞核可见少量标记神经元,胞内标记颗粒较大且密集(图2C);注射侧圆下核可见大量标记神经元,胞内分布大量细小的标记颗粒(图2D);注射侧蔡氏区可见少数标记细胞,胞内标记颗粒分布稀疏且细小(图2E)。
2.3 小脑内标记神经元
鸡小脑内Ⅰ~Ⅹ叶皮质的浦肯野细胞层中均发现被逆行标记的浦肯野细胞,其中Ⅷ、Ⅸ、Ⅹ叶的标记细胞最多,标记细胞以对侧较多,细胞内标记颗粒针点状密集分布(图3)。
3 讨论
3.1 海马结构与脑干的纤维联系
已知哺乳类海马结构可从5个感觉系统(嗅觉、视觉、听觉、体感和三叉神经感觉)接收间接信息,其中间脑是主要的传入途径之一。在脑干中,海马结构接收来自浅小细胞核(nucleus superficialis parvicellularis,SPC)、外侧下丘脑区(regio lateralis hypothalami,LHy)、后线核(nucleus lineariscaudalis,LC)和乳头体区的传入[10],同时也接收源自蓝斑核(locus ceruleus,LoC)和蔡氏区(area ventralis,Tsai,AVT)的儿茶酚胺能传入纤维,来自LC的传入纤维属于5-羟色胺能。另外,丘脑旁正中内核(nucleus paramedianus internus thalami,PMI)和圆下核(nucleus subrotundus,SRt)的纤维也可投射到旁海马。在本试验在鸡的间脑SPC、AVT和SRt均可观察到逆标神经元,说明海马结构接收来自这些区域的投射,而AVT和SRt同是高阶的内脏感觉系统的一部分,这佐证了禽类海马结构与哺乳动物的海马结构一样属于边缘系统的一部分,与内脏活动有密切的联系。然而,虽然国外学者Casini在鸽子的海马结构注射HRP也在SPC上发现标记神经元,但他在以往的研究中认为SPC仅仅向副高纹状体投射而已,其通过纤维联系将体表感觉传入副高纹状体中,而SPC与海马结构的联系未见其阐明原因。在研究小脑与海马结构的联系时发现,小脑有向丘脑背中前腹核(nucleus dorsalisintermedius ventralis anterior,DIVA)的直接投射,但是DIVA却向副高纹状体投射而非海马结构。而DIVA正好位于SPC腹侧,两个核团相距较近,是否存在DIVA向SPC的投射,值得探讨。如果是,则小脑就有了向海马投射的清晰的神经通路,其通路可能为“小脑→DIVA→SPC→海马结构”,但这仍需通过试验进一步证明。
3.2 海马结构与小脑的纤维联系
通常认为小脑向端脑的投射是间接的,即由浦氏细胞发出纤维到达小脑深核,换元后投向丘脑腹前核或腹外侧核(VA/VL),再换元后投射到大脑皮质的运动区和运动前区,全程经过了三级神经元。袁文菊等[11]曾在小脑注射HRP逆行追踪海马结构向小脑的直接投射,在端脑海马结构出现标记细胞,而本试验将HRP注射海马结构后在小脑浦肯野细胞层可发现大量的逆标细胞,说明不仅仅有小脑向海马的直接投射,而且存在海马向小脑的直接投射,形成小脑与海马结构的投射环路。传统的观点认为正常成年哺乳动物端脑与小脑之间不存在直接投射,仅存在间接投射,但若试验性地去除某些小脑的传入纤维的起始核,则可出现端脑向小脑的直接投射。这表明在小脑传入投射的靶核上存在着某种竞争机制,且随着发育而逐渐稳定下来。在动物的幼年时期,中枢神经系统尚未完善,存在不同来源神经投射的相互竞争[12]。朱宁等[13]研究表明海马结构的神经联系在发育过程中不断地清除出生后大量的异常的神经联系,从而达到神经系统的高效性,避免冗余和错误建设。本试验采用2月龄~3月龄的小鸡发现小脑浦氏细胞直接投射到海马结构,表明可能是一种幼年期的现象,至于在成年动物中是否仍然存在这种投射,有待进一步研究。
A.脑干内标记神经元(黑点)出现的区域,距“0”点向前6.0 mm;B.脑干内标记神经元(黑点)出现的区域,距“0”点向前3.6 mm;C.浅小细胞亚核内标记神经元(中性红染色,400×);D.圆下核内标记神经元(中性红染色,400×);E.蔡氏区内标记神经元(中性红染色,400×)。黑色箭头示标记神经元;SPC为浅小细胞亚核;SRt为圆下核;AVT为蔡氏区;Ru为红核;NⅢ为动眼神经
A.The labeled neurons (dots) in different regions in the brainstem,at the level of 6.0 mm anterior to the zero point; B.The labeled neurons (dots) in different regions in the brainstem,at the level of 3.6 mm anterior to the zero point; C.The labeled neurons in the nucleus superficialis parvicellularis(Stained with neutral red,400×); D.The labeled neurons in the nucleus subrotundus(Stained with neutral red,400×); E.The labeled neurons in the area ventralis(Stained with neutral red,400×).The black arrowhead showed the labeled neurons; SPC.Nucleus superficialis parvicellularis; SRt.Nucleus subrotundus; AVT.Area ventralis(Tsai); Ru.Nucleus ruber; NⅢ.Nervus oculomtorius
图2 HRP注射左端海马结构后脑干内标记神经元
Fig.2 The labeled neurons in the brainstem after injection of HRP in the left horseradish peroxidase

A.小脑内标记神经元(黑点)出现的区域;B.小脑内被标记的浦肯野细胞(中性红染色,400×);C.高倍镜(油镜)下的被标记的浦肯野细胞(中性红染色,1 000×)。黑色箭头示被标记的浦肯野细胞
A.The labeled neurons(dots)in different regions in the cerebellum; B.The labeled purkinje cells in the cerebellum(stained with neutral red,400×); C.The higher magnification(oil immersion objective)of the labeled Purkinje cells in the cerebellum(stained with neutral red,1 000×).The black arrowhead showed the labeled Purkinje cells
图3 HRP注射左端海马结构后小脑内标记神经元
Fig.3 The labeled neurons in the cerebellum after injection of HRP in the left horseradish peroxidase
本实验室前期曾采用DiI注射海马结构,结果发现除了在端脑内发现标记神经元外,脑干和小脑等均无标记神经元出现[5]。采用DiI作为逆行示踪剂,能够灵敏地在活体试验中短距离内示踪出中枢内的传入神经元,但其却不擅长在活体试验中进行长距离的逆行标记[14]。本文采取HRP作为逆行示踪剂,能有效地避免这个问题。虽然通过将HRP注射到海马结构初步了解其传入纤维在脑干和小脑中的起始核,但其具体的传入路径仍有待研究,而且研究禽类的神经投射在某些方面也对哺乳动物的研究起一定的推进作用,尤其在小脑与海马结构上,本实验室还将进一步研究禽类的海马结构与小脑的神经纤维联系及其路径。
[1] O'Keefe J,Conway D H.Hippocampal place units in the freely moving rat:Why they fire where they fire [J].Exp Brain Res,1978,31:573-590.
[2] Hitier M,Besnard S,Smith P F.Vestibular pathways involved in cognition [J].Front Integ Neurosci,2014,8:59.
[3] Bingman V P,Bagnoli P,Ioal P,et al.Homing behavior of pigeons after telencephalica blations[J].Brain Behav Evol,1984,24:94-108.
[4] Bingman V P,Ioal P,CasiniG,et al.Impaired retention of preoperatively acquired spatial reference memory in homing pigeons following hippocampal ablation[J].Behav Brain Res,1987,24:147-156.
[5] 李少焕,鲁 林,刘为民,等.鸡海马结构传入纤维的端脑起始核DiI法研究[J].动物医学进展,2010,31(12):32-36.
[6] 王 娟,刘为民,梁梓森,等.辣根过氧化物酶逆行标记鸡小脑向海马结构的直接投射[J].解剖学杂志,2009,32(3):374-376.
[7] 鞠 躬,万选才,董文新.神经解剖学方法[M].北京:人民卫生出版社,1985:95-99.
[8] Redies C,Medina L,Puelles L.Cadherin expression by embryonic divisions and derived gray matter structure in the telencephalon of the chicken [J].J Comp Neurol,2001,438:253-285.
[9] Suárez J,Dávila J C,RealM,et al.Calcium-binding proteins,neuronal nitric oxide synthase,and GABA help to distinguish different pallial areas in the developing and adult chicken.I.hippocampal formation and hyperpallium [J].J Comp Neurol,2006,497:751-771.
[10] Atoji Y,Wild J M.Fiber connections of the hippocampal formation and septum and subdivisions of the hippocampal formation in the pigeon as revealed by tract tracing and Kainic acid lesions [J].J Comp Neurol,2004,475:426-461.
[11] 袁文菊.禽类海马结构直接投射于小脑各叶的神经元定位—辣根过氧化物酶(HRP)逆行追踪法研究[D].河南农业大学,2008.
[12] Kandler K,Friauf E.Pre- and postnatal development of efferent connections of the cochlear nucleus in the rat [J].J Comp Neurol,1993,328:161-184.
[13] 朱 宁.几种与神经可塑性有关的分子在出生后小鼠和鸣禽脑内的动态表达[D].北京师范大学,2006.
[14] 凯赛尔江·多来提,古丽美热·艾买如拉,廖礼彬,等.DiI对鱼类视觉传导通路的形态学研究[J].现代生物医学进展,2013,26:5012-5015.
BrainstemandCerebellarOriginsofAfferentFiberstoHippocampalFormationinChicken:byRetrogradeTracingwithHRP
ZHANG Ji-xiang,KONG Xue,WANG Jun,WANG Zheng-fu,CHEN Fang,ZHAO Hai-quan,LIU Wei-min
(FoshanUniversity,Foshan,Guangdong,528231,China)
To clarify the brainstem and cerebellum original nuclei of afferent fibers to the hippocampal formation in chicken,40% horseradish peroxidase (HRP) was injected into the hippocampal formation of the left telencephalon in chickens for retrograde tracing the origins of afferent fibers from the brainstem and cerebellum to the hippocampal formation.The labeled neurons appeared in nucleus superficialis parvicellularis (SPC),nucleus subrotundus (SRt) and area ventralis of Tsai (AVT) of the brainstem and Purkinje cells in the cerebellar cortex of the foliumⅠ-Ⅹ of the cerebellum.It indicated that all the parts mentioned above are the original nuclei to the hippocampal formation in chicken.
chicken; hippocampal formation; HRP; retrograde tracing; original nuclei
2017-03-06
国家自然科学基金项目(31372389)
张集祥(1991-),男,广东潮州人,硕士研究生,主要从事基础兽医学研究。*
S852.16
A
1007-5038(2017)11-0033-04