浓缩型双黄连口服液临床药效学试验
吴苑滢,杨 剑,曾 芸,韦英益,胡庭俊*
(广西大学动物科学技术学院,广西南宁 530005)
浓缩型双黄连口服液临床药效学试验
吴苑滢1,杨 剑1,曾 芸1,韦英益1,胡庭俊1*
(广西大学动物科学技术学院,广西南宁 530005)
通过浓缩型双黄连口服液的临床药效试验探讨该药物制剂临床的疗效并评价其安全性,为浓缩型双黄连口服液的临床应用提供依据。将风热感冒患鸡900只,随机分3组,分别为浓缩型双黄连口服液试验组、双黄连口服液对照组、空白对照组,连续4 d给药,停止给药后继续观察7 d,记录试验期间鸡的临床表现、体温、体重,并于第11天测定血清免疫及生化指标。结果显示,浓缩型双黄连口服液对鸡感冒发热治疗的有效率、治愈率与双黄连口服液比较差异无统计学意义(P>0.05)。浓缩型双黄连口服液、双黄连口服液的治愈率均显著高于空白对照组(P<0.05)。证实浓缩型双黄连口服液对鸡的风热感冒疾病具有较好的治疗效果。
浓缩型双黄连口服液;临床试验;鸡
双黄连口服液是由金银花、黄芩、连翘3种中药制成的中药方剂,具有清热解毒、辛凉解表之功效,兽医临床上主要用于预防和治疗宠物、畜禽感冒发热及呼吸道疾病等[1]。双黄连口服液对常见的流感病毒、腺病毒、脊髓灰质炎病毒和麻疹病毒等有一定疗效。李京玉等用不同浓度双黄连口服液进行了人工感染10日龄SPF鸡胚的新城疫强毒抑杀试验,结果表明双黄连口服液具有较强抗病毒的作用;并且通过建立内毒素注射造成模型家兔发热,对双黄连口服液的解热功能进行了较为深入的研究,发现双黄连口服液具有明显的解热和抗炎功效[2]。近年来养殖业发展迅猛,集约化程度提高后也带来了饲养空间中的氨气含量增加和灰尘数量增加等环境因素;机体的呼吸系统长时间暴露在高浓度的氨气之下,可导致呼吸道黏膜纤毛退化,黏液分泌增多;此外,纤毛的退化脱落,则会导致气管和肺对病原菌的清除率降低,使出现呼吸道疾病和气囊炎的几率增加,空气中大密度的灰尘则往往成为各种病原的载体[3]。接种疫苗是控制呼吸道疾病的重要措施,但疫苗接种后会引起机体应激性的免疫接种反应,导致机体抵抗力下降,鸡群中存在免疫抑制病毒、大肠埃希菌和支原体感染[4]。鸡的呼吸道感染疾病及条件性病原引起的发热是生产实践中重要的威胁,本试验使用的浓缩型双黄连口服液为纯中药复方制剂,其是在《中国兽药典》收录的双黄连口服液工艺配方的基础上进行研发而成。本临床试验旨在进一步验证该药物制剂对鸡感冒发热的临床疗效并评价其安全性。
1 材料与方法
1.1 材料
1.1.1 供试药物及对照药物 供试药物:浓缩型双黄连口服液:中试产品,生产批号:20140201,规格:3.0 g/mL,100 mL/瓶,由河南牧翔动物药业有限公司中试生产,有效期2年。
对照药物:双黄连口服液,产品批准文号:兽药字(2013)160225030,生产批号:14090308,规格:1.5 g/mL,100 mL/瓶,由河南牧翔动物药业有限公司生产,有效期2年。
血清免疫生化试剂盒:血清溶菌酶试剂盒、SOD活力试剂盒、酸性磷酸酶试剂盒、GSH含量试剂盒、总抗氧化能力试剂盒、总蛋白试剂盒,均购自南京建成生物工程研究所。
1.1.2 试验用鸡 试验鸡品种为桂香鸡,雌性,900只。饲料为自配的雏鸡饲料,试验地点为广西国有钦廉林场。
免疫程序为:1日龄时肌肉注射鸡马立克病疫苗,7日龄时点眼滴鼻鸡新城疫Ⅳ系疫苗,14日龄时点眼滴鼻鸡传染性法氏囊弱毒疫苗;18日龄时呼吸型、肾型、腺胃型传染性支气管炎油乳剂灭活苗肌肉注射,22日龄时中毒株法氏囊炎疫苗饮水给予;27日龄时新城疫活疫苗肌肉注射和鸡痘灭活苗翅膀下穿刺接种。
发病原因:鸡为自然发病。由于天气突变、饲养管理不善等原因导致鸡发病。
临床表现及诊断:根据鸡的临床发病症状,选取鸡用于试验。试验鸡于50日龄时出现风热感冒的症状。病鸡主要表现为体温升高、精神沉郁,食欲下降,不愿走动,羽毛松乱,张口呼吸,饮水量增加,鸡体表现脱水症状,鸡冠变暗红色,咳嗽清亮等疑似感冒发热的症状。根据临床表现初步判定为为风热感冒。试验前病鸡均未给任何药物治疗。
1.2 方法
1.2.1 试验动物分组及处理 发病鸡随机分为3组,每组300只,分别为浓缩型双黄连口服液试验组、双黄连口服液药物对照组、空白对照组。
1.2.2 给药方法 按下表1所列的要求给药。在停药后对鸡只的临床表现进行跟踪观察,观察时间持续至停药后第7 d。
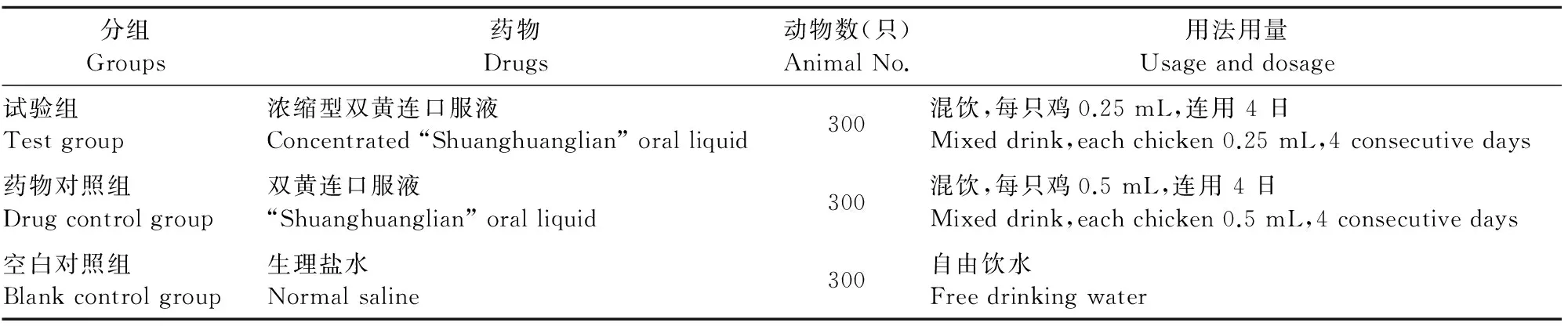
表1 试验动物分组及处理
1.2.3 临床疗效的观察 ①观察时间。用药期间及停止给药后继续观察7 d,共11 d。②临床症状及记录。试验期间,每天观察并记录鸡的临床表现,如精神、食欲、呼吸道症状,记录饮水量等。观察期间,对死亡病例逐只剖检,观察记录肺脏等器官的病理变化。③体温。用药前、用药后第4 d,每组试验鸡随机抽取10只测量体温(肛温),计算各组平均体温,比较用药后鸡的体温变化。④体重。用药前、用药后第11 d,每组试验鸡随机抽取30只称重,计算各组平均体重,求出用药期间各组鸡的增重率。⑤血清免疫及生化指标。用药后第11 d,每组试验鸡随机抽取30只采血,测定血清溶菌酶的水平、超氧化物歧化酶(super oxide dimutese,SOD)活力、酸性磷酸酶水平、谷胱甘肽(glutathione,GSH)含量、总抗氧化能力、总蛋白浓度,比较用药后鸡血清上述指标水平的变化。
1.2.4 疗效评价标准 治愈:停止给药后继续观察7 d,临床症状消失,精神及采食情况恢复正常判为治愈。每组治愈鸡数占每组试验鸡数的百分比为治愈率。
有效:停止给药后继续观察7 d,临床症状减轻,精神及采食情况没有恢复到发病前的状态判为有效。每组有效鸡数占每组试验鸡数的百分比为有效率。
无效:停止给药后继续观察7 d,临床症状无改善者判为无效,无效鸡数占每组试验鸡数的百分比为无效率。
1.2.5 疗效综合判定 主要依据药物应用后临床症状消失等指标,对该药物的疗效做出评定。
1.2.6 数据分析与处理 采用SPSS18.0统计软件进行统计分析,计量资料采用t检验或方差分析,P<0.05为差异显著,P<0.01为差异极显著。计数资料采用χ2检验。
2 结果
2.1 浓缩型双黄连口服液的治疗效果
经统计学分析,浓缩型双黄连口服液对鸡感冒发热治疗的有效率、治愈率与双黄连口服液比较差异无统计学意义(P>0.05)。浓缩型双黄连口服液、双黄连口服液的治愈率均显著高于空白对照组(P<0.05)。
给予临床推荐剂量的浓缩型双黄连口服液3 d后与自然发病的空白对照组比较,发病鸡的病情减轻,精神以及食欲好转,夜间观察咳嗽减少。用药后第5 d,浓缩型双黄连口服液组试验鸡的精神状态明显好转,临床症状明显减轻。夜间观察仅有零星咳嗽声。给药后第11 d观察,各用药组试验鸡的精神状态基本恢复正常,采食和饮水恢复正常。
双黄连口服液的治疗效果与浓缩型双黄连口服液治疗效果相当。给药后第11 d观察,各用药组试验鸡的精神状态基本恢复正常,空白对照组试验鸡夜间有咳嗽声,部分鸡出现不同频率的甩头现象。结果表明,浓缩型双黄连口服液对鸡感冒发热治疗效果明显,可用于鸡感冒发热的治疗。用法用量为:混饮,每只鸡0.25 mL,连用4日。双黄连口服液的疗效结果见表2。
2.2 浓缩型双黄连口服液对鸡体温的影响
鸡的正常体温范围与品种等因素有关。据该养殖场日常测定结果,桂香鸡正常体温范围在40.0℃~41.0℃之间。由表3可以看出,用药前各组鸡的平均体温范围均为41.7℃~41.8℃范围内,根据临床表现确定为感冒发热;用药后第4 d,双黄连口服液药物对照组和浓缩型双黄连口服液试验组的体温均明显下降,与空白对照组比较,分别为差异显著(P<0.05)和极显著(P<0.01)。而用药后第4 d,双黄连口服液药物对照组和浓缩型双黄连口服液试验组鸡的体温差异不显著(P>0.05)。
2.3 浓缩型双黄连口服液对鸡体重的影响
于用药前和试验结束时对每组试验鸡随机抽取30只分别称重。由表4可见,空白对照组增重率为45.32%,浓缩型双黄连口服液试验组、双黄连口服液药物对照组试验鸡的增重率分别为46.31%、47.95%,但与空白对照组比较差异无统计学意义(P>0.05)。浓缩型双黄连口服液试验组、双黄连口服液药物对照组试验鸡的相对增重率分别为102.19%、105.80%。

表2 双黄连口服液对鸡感冒发热的治疗效果
注:与空白对照组比较,*P<0.05为差异显著。“#”表示自愈。
Note:Compared with blank control group,*P<0.05 significant difference.“#”self-healing.

表3 各试验组鸡的体温变化
注:“*”表示与空白对照组比较,差异显著(P<0.05);“**”表示差异极显著(P<0.01)。
Note:Compared with blank control group,“*”significant difference(P<0.05);“**”very significant difference(P<0.01).
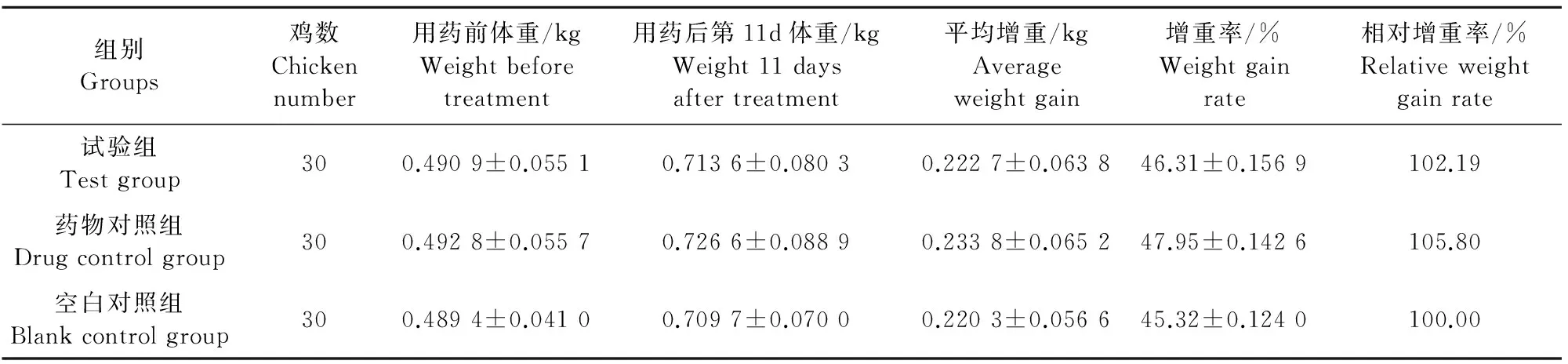
表4 各试验组鸡的体重变化
2.4 浓缩型双黄连口服液对鸡血清溶菌酶水平的影响
由表5可以看出,用药后第11 d,双黄连口服液药物对照组和浓缩型双黄连口服液试验组的血清溶菌酶含量均呈现一定程度的升高,与空白对照组比较,差异分别为显著和极显著(P<0.05和P<0.01);浓缩型双黄连口服液试验组鸡血清溶菌酶水平与双黄连口服液药物对照组比较差异不显著(P>0.05)。
2.5 浓缩型双黄连口服液对鸡血清SOD活力的影响
由表6可以看出,相较于空白对照组,双黄连口服液药物对照组和浓缩型双黄连口服液试验组的血清总SOD活力均发生一定程度的下降,但较空白对照组,差异均不显著(P>0.05);浓缩型双黄连口服液试验组下降幅度较小,与双黄连口服液药物对照组差异不显著(P>0.05)。
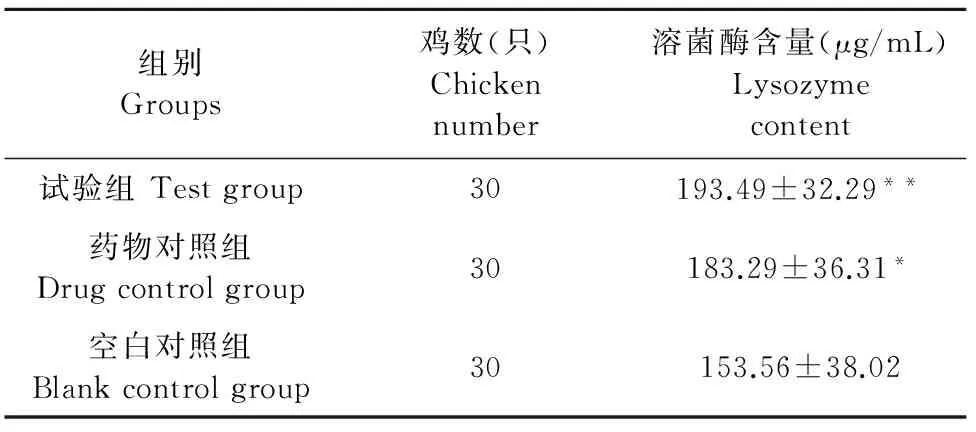
表5 用药后第11 d鸡血清溶菌酶含量测定结果
注:“*”表示与空白对照组比较,差异显著(P<0.05);“**” 表示差异极显著(P<0.01)。
Note:Compared with blank control group,“*”significant difference(P<0.05);“**”very significant difference(P<0.01).

表6 各试验组鸡血清总SOD活力测定结果
注:“*”表示相对于空白对照组,差异显著;“**”表示相对于空白对照组,差异极显著;“#”表示相对于药物对照组,差异显著;“##”表示相对于药物对照组,差异极显著。
Note:Compared with blank control group,“*”significant difference,and“**”very significant difference; compared with drug control group“#”significant difference,and “##”very significant difference.
2.6 浓缩型双黄连口服液对鸡血清酸性磷酸酶活力的影响
由表7可以看出,相较于空白对照组,双黄连口服液药物对照组的血清酸性磷酸酶升高,但差异不显著(P>0.05);浓缩型双黄连口服液试验组的血清酸性磷酸酶降低,差异不显著(P>0.05);相较于双黄连口服液药物对照组,浓缩型双黄连口服液试验组的血清酸性磷酸酶降低,差异极显著(P<0.01)。
2.7 浓缩型双黄连口服液对鸡血清GSH含量的影响
由表8可以看出,相较于空白对照组,双黄连口服液药物对照组和浓缩型双黄连口服液试验组的血清GSH含量均发生一定程度的升高;相较于空白对照组,前者差异不显著(P>0.05),后者差异极显著(P<0.01);相较于双黄连口服液药物对照组,浓缩型双黄连口服液试验组的血清GSH含量差异极显著(P<0.01)。

表7 各试验组鸡血清酸性磷酸酶测定结果
注:“*”表示相对于空白对照组,差异显著;“**”表示相对于空白对照组,差异极显著;“#”表示相对于药物对照组,差异显著;“##”表示相对于药物对照组,差异极显著。
Note:Compared with blank control group,“*”significant difference,and“**”very significant difference; compared with drug control group“#”significant difference,and “##”very significant difference.

表8 各试验组鸡血清GSH含量测定结果
注:“*”表示相对于空白对照组,差异显著;“**”表示相对于空白对照组,差异极显著;“#”表示相对于药物对照组,差异显著;“##”表示相对于药物对照组,差异极显著。
Note:Compared with blank control group,“*”significant difference,and“**”very significant difference; compared with drug control group“#”significant difference,and “##”very significant difference.
2.8 浓缩型双黄连口服液对鸡血清总抗氧化能力的影响
由表9可以看出,相较于空白对照组,双黄连口服液药物对照组和浓缩型双黄连口服液试验组的血清总抗氧化能力分别微小的升高和降低,但差异均不显著(P>0.05);相较于双黄连口服液药物对照组,浓缩型双黄连口服液试验组的血清总抗氧化能力下降,但差异不显著(P>0.05)。
2.9 浓缩型双黄连口服液对鸡血清总蛋白浓度水平的影响
由表10可以看出,相较于空白对照组,双黄连口服液药物对照组和浓缩型双黄连口服液试验组的血清蛋白浓度均发生一定程度的下降,但差异均不显著(P>0.05);浓缩型双黄连口服液试验组与双黄连口服液药物对照组差异也不显著(P>0.05)。

表9 各试验组鸡血清总抗氧化能力测定结果
注:“*”表示相对于空白对照组,差异显著;“**”表示相对于空白对照组,差异极显著;“#”表示相对于药物对照组,差异显著;“##”表示相对于药物对照组,差异极显著。
Note:Compared with blank control group,“*”significant difference,and“**”very significant difference; compared with drug control group“#”significant difference,and “##”very significant difference.

表10 各试验组鸡血清总蛋白浓度测定结果
注:“*”表示相对于空白对照组,差异显著;“**”表示相对于空白对照组,差异极显著;“#”表示相对于药物对照组,差异显著;“##”表示相对于药物对照组,差异极显著。
Note:Compared with blank control group,“*”significant difference,and“**”very significant difference; compared with drug control group“#”significant difference,and “##”very significant difference.
3 讨论
双黄连口服液收载于《中国兽药典》,由金银花、黄芩、连翘3味中药组合而成,其具有清热解毒、辛凉解表的功效。本试验通过临床研究证明,双黄连口服液对血液生理生化指标有显著的影响,可增加溶菌酶的活性,提高机体抗氧化能力,对风热感冒引起的发热鸡群起到明显的降温作用。曾林等研究了双黄连对大鼠血清溶菌酶活性的影响,注射双黄连5 d后,大鼠血清中溶菌酶含量试验组和对照组比较,相差极显著,结果表明,双黄连激活血清中溶菌酶是其抗菌作用机理之一[5]。李霁伟等从抗氧化的作用途径探讨双黄连对缺血再灌注肝脏损伤大鼠的治疗,证明双黄连能提高肝脏内相关抗炎、抗氧化机制,从而减轻肝的损伤程度[6]。在临床中主要用于细菌和病毒感染引起的感冒发热、咳嗽、咽痛、上呼吸道感染、流行性感冒、气管炎、轻型肺炎、扁桃体炎等病症,其疗效在许多文献上都有报道[7-12]。现代药理研究证明双黄连制剂对多种病原微生物具有抑制作用,并能降低毛细血管的通透性、减少渗出,具有抗炎、抗过敏作用,还可增强机体产生α-干扰素能力,可显著地增强细胞免疫和体液免疫作用,对病毒也具有较强的抑制作用,并能中和细菌产生的内毒素,同时具抗感染及免疫调节双重作用[13]。但是临床上双黄口服液相关不良反应的报道也时有出现,多见于哺乳动物,禽类报道较少,主要以过敏反应最为常见;现代研究报道证明,这与双黄连口服液中的黄芩苷和黄芩素等有关[14-17]。
临床药效试验显示浓缩型双黄连口服液对鸡感冒发热具有较好的疗效,有效率、治愈率分别为98.67%和97.67%。双黄连口服液对鸡感冒发热的疗效与浓缩型相当,有效率、治愈率分别为98%和97%。浓缩型双黄连口服液能使发病鸡的体温下降,并能提高鸡血液中溶菌酶水平,提高鸡非特异性免疫力,达到治疗鸡感冒发热的效果。浓缩型双黄连口服液组、双黄连口服液组试验鸡的相对增重率分别为102.19%和105.80%。依据双黄连口服液治疗效果和鸡体温、血清溶菌酶等免疫及生化指标变化情况,表明浓缩型双黄连口服液在治疗效果方面略高于双黄连口服液。本试验通过对血液中溶菌酶的测定,解释了双黄连口服液治疗发热感冒的可能性机制,为实践生产应用提供了数据支持。
浓缩型双黄连口服液是在《中国兽药典》收录的双黄连口服液工艺配方的基础上进行研发而成。临床药效学试验结果显示通过对感冒发热的鸡进行治疗性临床试验,证实浓缩型双黄连口服液对鸡感冒发热具有较好的疗效,至停药后第7 d病鸡群的整体状况有了极大的改善,推荐浓缩型双黄连口服液治疗鸡感冒发热的临床应用用法用量为混饮,每只鸡0.25 mL,连用4日。
[1] 杨海涵,房春林,周小平.兽用双黄连制剂药学研究进展[J].兽医导刊, 2009(7):5-6.
[2] 李京玉,李玉香,宋爱军,等.中草药双黄连口服液抗病毒效果研究[J].畜牧与饲料科学,2008,29(6):10-12.
[3] 胡 宁.浅谈鸡的慢性呼吸道病[J].北方牧业,2006(14):19.
[4] 武冠华,卢雪敏.鸡多病因呼吸道疾病原因分析与防制[J].北方牧业,2010(10):19.
[5] 曾 林,付兴伦,贾世玉.双黄连对大鼠血清溶菌酶活性的影响[J].中兽医学杂志,1999(1):1-2.
[6] 李霁伟,王 磊,孙千红,等.双黄连对大鼠肝缺血再灌注损伤的保护机制[J].昆明医科大学学报,2011,32(10):19-23.
[7] 杨 美.黄芩药理作用研究进展[J].医学理论与实践,2012,25(19):2359-2360.
[8] 李湘潋,申新田,雷一鸣,等.双黄连口服液抗H5N1禽流感病毒活性部位的筛选[C].中国药理学会抗炎免疫药理专业委员会成立30周年纪念大会暨2012年学术年会.2012.
[9] 李 波.双黄连口服液解热抗炎实验30例[J].中国中医药现代远程教育,2014(8):160-165.
[10] 郭中华,刘伟伟,张冰冰,等.双黄连口服液(儿童型)治疗感冒临床研究[J].中国现代药物应用,2014(23):109-110.
[11] 吴 潇,祁明浩.双黄连口服液联合头孢呋辛酯治疗细菌性呼吸道感染的临床观察[J].中国药房,2016(12):1621-1623.
[12] 崔喜红,马彩云,崔伟丽,等.双黄连口服液对急性上呼吸道感染患儿炎性应激状态的影响研究[J].中华医院感染学杂志,2016(11):2584-2586.
[13] 贾 静.双黄连口服液的临床应用评价[J].中国医院用药评价与分析,2013,13(2):110-112.
[14] 王 刚,张天镇,马新燕.口服双黄连口服液引起严重过敏反应1例[J].医药前沿,2014(22):216.
[15] 雷小宝,陈 洁.双黄连口服液不良反应1例报道[J].实用中医药杂志,2009,25(8):566-567.
[16] 郭玉娟,刘 明.双黄连口服液不良反应临床分析[J].实用药物与临床,2007,10(3):177.
[17] 田锋奇.黄芩苷的致过敏作用机制[D].郑州大学,2007.
ClinicalEfficacyofConcentratedShuanghuanglianOralLiquid
WU Yuan-ying1,YANG Jian1,ZENG Yun1,WEI Ying-yi1,HU Ting-jun1
(CollegeofAnimalScienceandTechnology,GuangxiUniversity,Nanning,Guangxi,530005,China)
The clinical trial of concentrated Shuanghuanglian oral liquid was performed to evaluate its clinical efficacy and safety,and to provide basis for clinical application of the concentrated Shuanghuanglian oral liquid.The 900 chickens were randomly divided into 3 groups:concentrated Shuanghuanglian oral liquid test group,Shuanghuanglian oral liquid control group,and blank control group.The animals were treated with the drugs in 4 consecutive days,then the clinical signs were observed in the following 7 days.The clinical manifestations,body temperature and body weight of the chickens were recorded during the experiment and biochemical parameters were measured on Day 11.The results showed that concentrated Shuanghuanglian oral liquid was effective for the treatment of cold fever in chickens,and the cure rate was not statistically significant when compared with Shuanghuanglian oral liquid (P>0.05).The cure rate of the concentrated Shuanghuanglian oral liquid or Shuanghuanglian oral liquid was significantly higher than that of blank control group(P<0.05)respectively.In brief,the concentrated Shuanghuanglian oral liquid had a good curative effect on anemopyretic cold in chickens.
concentractedShuanghuanglianoral liquid; clinical trial; chicken
2017-04-08
国家自然科学基金项目(31560708); 广西大学兽医学研究生联合培养基地建设项目(20160976)
吴苑滢(1994-),女,广西贵港人,硕士研究生,主要从事兽医药理与毒理学研究。 *
S859.3
A
1007-5038(2017)11-0126-06