益生菌对柔嫩艾美耳球虫感染鸡保护效果研究
曹建文,王宏伟,张雪飞,谷 振,周变华
(河南科技大学动物科技学院,河南洛阳 471000)
益生菌对柔嫩艾美耳球虫感染鸡保护效果研究
曹建文,王宏伟*,张雪飞,谷 振,周变华
(河南科技大学动物科技学院,河南洛阳 471000)
接种柔嫩艾美耳球虫(E.tenella)孢子化卵囊和益生菌,以血便记分、存活率、体增重和抗球虫指数为指标,探讨益生菌的抗球虫活性。在接种第7天后检测结果显示,益生菌抗球虫指数为137,能降低球虫感染鸡的血便记分,减轻鸡盲肠组织病理学结构的损伤,提高球虫感染鸡体增重和存活率,提示益生菌可以辅助应用于临床球虫病的防治。
益生菌;柔嫩艾美耳球虫;鸡;抗球虫指数;盲肠
鸡球虫病是由艾美耳属球虫引起的一种肠道寄生原虫病[1]。本病呈全球性分布,在养禽业中普遍存在且死亡率高,严重阻碍了养禽业的发展[2]。鸡球虫的生活史包括体外和体内两个时期,三个生殖阶段。孢子生殖阶段一般在体外有充足的氧气和水分的环境下进行,而裂殖生殖阶段和配子生殖阶段在体内进行。其中裂殖生殖阶段球虫可对宿主肠道造成严重的病理学损伤[1,3-4]。鸡柔嫩艾美耳球虫病是因鸡感染柔嫩艾美耳球虫(Eimeriatenella)所致的一种以盲肠病变为主的原虫病。目前鸡柔嫩艾美耳球虫病主要依靠药物预防,由于球虫耐药性的产生,迫切需要寻求新的抗球虫方法[1,3-4]。益生菌是一类定植于人和动物肠道内,具有改善宿主肠道微生态平衡、发挥有益作用的活性微生物[5]。大量的研究证实,益生菌具有维持动物消化道黏膜菌群平衡,抵御病原微生物入侵,产生抗菌物质及营养成分,改善肠道黏膜免疫功能的作用[5-7]。在动物生产中添加益生菌,可有效提高动物的生长性能,为动物机体提供营养,提高饲料消耗率,增强动物免疫能力,预防及治疗疾病[7-9]。本研究通过建立鸡E.tenella感染模型,通过口服接种益生菌,探究了益生菌对E.tenella感染鸡的保护作用。
1 材料与方法
1.1 材料
1.1.1 试验用鸡 200只1日龄海兰褐商品代蛋公雏购自洛阳公华禽业有限公司。试验在河南科技大学试验牧场进行。试验期间执行严格的消毒制度,确保试验在无球虫环境下饲养。
1.1.2 试验用球虫卵囊和益生菌E.tenella孢子化卵囊,由河南科技大学动物科技学院兽医药理学实验室保存。益生菌由河南科技大学环境与畜产品安全河南省高校重点开放实验室保存。枯草芽胞杆菌,每克2 000亿菌数,有效物质含量99.0%;鼠李糖乳杆菌,每克1 000亿菌数,有效物质含量98.0%。酵母菌,每克200亿菌数,有效物质含量高达99.0%。试验前进行益生菌的活化,并将其稀释到10×使用浓度,备用。
1.2 方法
1.2.1 实验动物分组 在实验鸡饲养至14日龄时,选取80只体重均匀的鸡(100 g±3.76 g),按体重随机分为4组,每组20只。分别为对照组、益生菌组、感染组、感染加益生菌组。
1.2.2 球虫感染和处理方法 分组完成后,各组进行如下处理(表1)。试验期间注意观察各组鸡的精神状况、血便排出及死亡情况,并做相关记录,试验期为7 d。
1.2.3 抗球虫效果评价 在试验处理第7天时,各组鸡称重后,进行扑杀,采集盲肠组织,进行盲肠病变记分,采集盲肠内容物进行卵囊OPG的测定,衡量抗球虫ACI值。同时采用40 mL/L的多聚甲醛对盲肠组织进行固定,HE染色观察盲肠结构的变化。
相对增重率 = 益生菌组或者感染组增重/对照组增重×100%
增重=试验平均末重—试验平均初重
盲肠病变值按Johnson和Reid的0~4分标准对盲肠病变记分[10],盲肠病变值 = 盲肠病变平均记分×10。
粪便记分按Morehouse和Baron的标准进行[11]。
存活率=1-死亡率(仅为球虫感染导致的死亡)。
死亡率=试验开始鸡的数量—试验末期鸡的数量/试验开始鸡的数量×100%
卵囊值的测定,取各组盲肠内容物,充分混匀、称重,用麦氏比浊法计数每克粪便的卵囊数(OPG),按表2换算成卵囊值。

表1 试验分组及处理

表2 OPG值与卵囊值的换算
抗球虫指数ACI值 =(相对增重+存活率)—(病变值+卵囊值),ACI在120以下为无效;在120~160为低效;在160~180为中效;在180以上为高效。
1.2.4 盲肠组织切片的观察 采集鸡盲肠组织,4%多聚甲醛固定后,制备组织切片,然后进行苏木精和伊红染色,显微镜下进行形态学的观察。
2 结果
2.1 临床症状
感染组病鸡,初期精神不振,闭目呆立,羽毛蓬松,双翅下垂,食欲不振,感染第4天可见血便排出。感染加益生菌组相对感染组有所好转,鸡喜采食,血便得到控制。
2.2 益生菌对柔E.tenella感染鸡血便记分的影响
由表3可知,感染组从第4天开始排出血便,试验期平均血便记分为2.5。同时也出现死亡情况。感染加益生菌组排血便情况有所减轻,平均血便记分为1.25。
2.3 益生菌对E.tenella感染鸡存活率的影响
如表4所示,感染组从第4天开始,出现鸡只死亡情况。感染组和感染加益生菌组鸡存活率分别为65%和85%,益生菌的添加显著降低了球虫感染鸡的死亡率。
2.4 益生菌对E.tenella感染鸡体重的影响
由表5所知,感染E.tenella后鸡生长发育明显受到了抑制,平均增重为67.7 g,相对增重率为67.7%,与感染组相比,益生菌的添加提高了鸡的平均增重。
2.5 益生菌抗E.tenella感染效果研究
由表6可知,对照组,益生菌组,感染组和感染加益生菌组抗球虫指数依次为200、203.9、55.8和137.0,说明益生菌的抗球虫感染效果为低效。

表3 不同处理组血便记分

表4 不同处理组鸡死亡情况
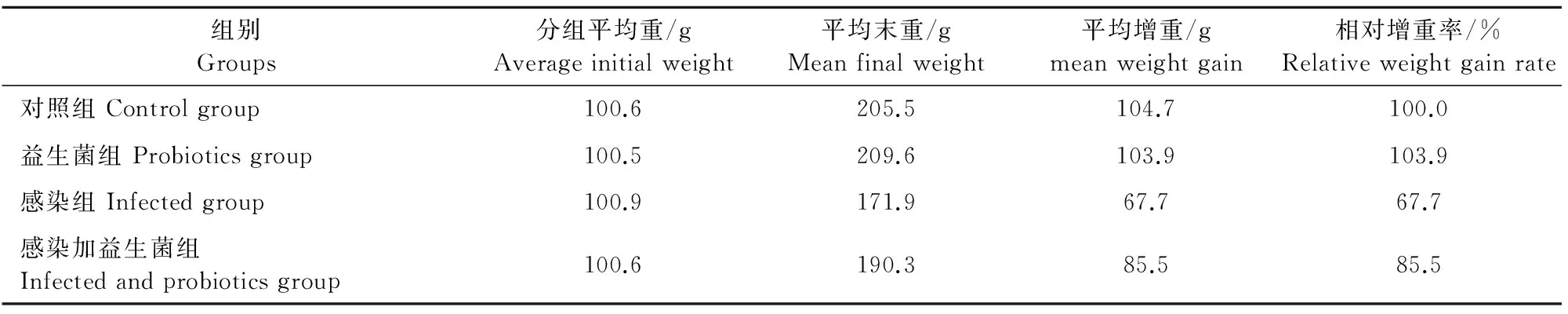
表5 各组鸡体重和体增重
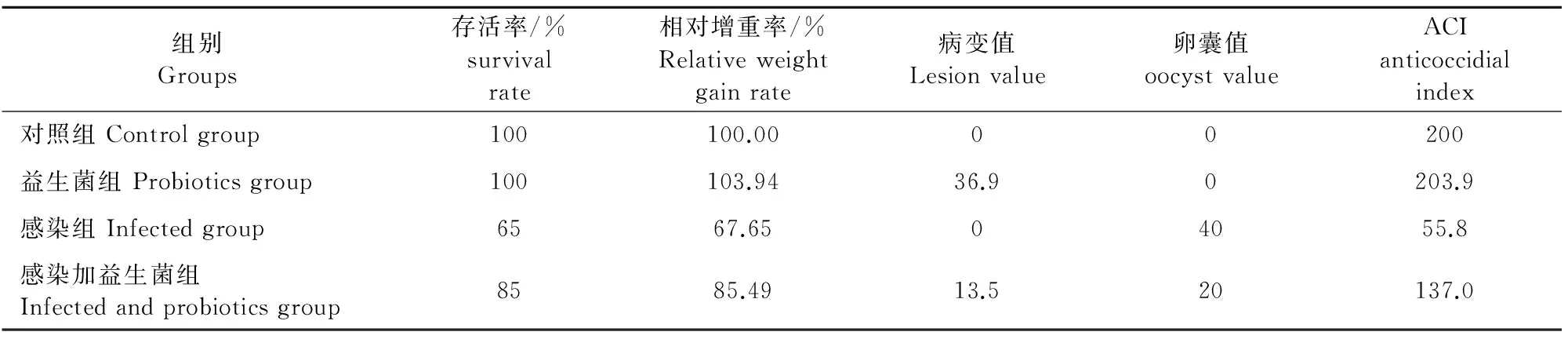
表6 抗球虫指数
2.6 益生菌对E.tenella感染鸡盲肠组织结构的影响
对照组(图1A1,A2和A3)和益生菌(图1B1、B2和B3)处理组鸡盲肠结构正常,肠腺和黏膜结构完整,肠绒毛排列井然有序,未见明显的异常变化。E.tenella感染组鸡盲肠结构严重受损,肠固有层出血,肠黏膜脱落,肠腔内充满脱落的肠黏膜及血凝块,随处可见散在的球虫卵囊(图1C1,C2和C3)。感染加益生菌组鸡盲肠结构基本完整,肠黏膜和肠腺结构清晰可见,肠黏膜下层有明显的出血斑,血块内有散在的球虫卵囊(图1D1,D2和D3)。
3 讨论
鸡球虫病是严重危害养鸡业的疾病之一,常呈暴发性流行[1-3]。目前该病已被美国农业部列为对禽类危害最严重的五大疾病之一。鸡柔嫩艾美耳球虫病,是因E.tenella寄生于鸡盲肠引起的一种原虫病[4]。本病分布很广,主要对2周龄~9周龄的雏鸡造成危害,发病率高达50%~70%,病死率为20%~30%,严重时高达80%以上[12]。成年鸡感染E.tenella后病死率较低,但会造成体重和产蛋率下降等现象[2]。本研究通过口服接种E.tenella孢子化卵囊复制球虫感染模型,感染组在接种后第4天时鸡出现死亡现象,死亡率为35%。感染加益生菌组与感染组相比降低了鸡的死亡率,说明益生菌的添加显著提高了球虫感染鸡的存活率。
肠道是机体接触各类病原微生物、食物毒素和药物等有害物质的直接部位,是病原入侵的重要途径。完整的肠道屏障是防止肠道内有害物质和病原体进入机体,维持机体内环境稳态的重要屏障[6,13]。当肠道的正常结构受损时,肠道中的病原微生物和内毒素便可突破肠黏膜屏障,进入血液引起消化系统甚至全身性疾病。大量研究表明,临床上许多疾病的发生,发展与转归都与肠道屏障损伤有关[14-15]。本研究中,E.tenella感染组鸡盲肠结构严重受损,肠壁固有层呈弥散性出血,肠腺组织模糊不清,肠黏膜脱落,肠腔内充满脱落的肠黏膜及血凝块,且在肠腔内随处可见散在的球虫卵囊。感染加益生菌组鸡盲肠黏膜和肠腺结构清晰可见,肠黏膜下层有局限性出血,与感染组相比,鸡盲肠结构趋于完整。提示添加益生菌可改善E.tenella造成的病理形态学损伤,改善鸡的肠道微环境。

A1、A2和A3为对照组;B1、B2和B3为益生菌组;C1、C2和C3为感染组;D1、D2和D3为感染加益生菌组。
A1,A2 and A3 are from the control group,B1,B2 and B3 are from the probiotics group,C1,C2 and C3 are from the infected group,and D1,D2 and D3 are from the infected and probiotics group.
图1鸡盲肠组织结构的变化
Fig.1 Histooathological changes of cecal tissues in chickens
E.tenella在鸡盲肠中繁殖,引起鸡盲肠结构受损,导致肠消化吸收功能紊乱和体液流失,必然增加肠道内条件性致病菌的发病率[16]。王琪等报道E.tenella感染可以显著的增加鸡肠炎沙门菌感染的机率,而且混合感染对肠道菌群造成的影响要比单独感染更为明显[16-17]。本研究中添加益生菌虽然只显示出低效抗球虫作用,但是改善了E.tenella所致的盲肠病理形态学变化,显著提高了感染鸡的存活率和平均增重,这可能是因为添加的益生菌在鸡肠道内产生的抗菌物质及营养成分维持了鸡消化道黏膜菌群的平衡,改善了肠道黏膜免疫功能,进而发挥了抗球虫作用。这一研究为益生菌抗球虫研究提供新的思路。
[1] Zhou B H,Wang H W,Zhao Z S,et al.A novel serine/threonine protein phosphatase type 5 from second-generation merozoite ofEimeriatenellais associated with diclazuril-induced apoptosis [J].Parasitol Res,2013,112(4):1771-1780.
[2] 林雨鑫,孙明明,戴国俊,等.鸡抗球虫的研究进展[J].中国畜牧兽医,2014,41(8):210-214.
[3] Tian E J,Zhou B H,Wang X Y,et al.Effect of diclazuril on intestinal morphology and SIgA expression in chicken infected withEimeriatenella[J].Parasitol Res,2014,113(11):4057-4064.
[4] Zhou B H,Liu L L,Liu J,et al.Effect of diclazuril on the bursa of Fabricius morphology and SIgA expression in chickens infected withEimeriatenella[J].Korean J Parasitol,2015,53(6):675-682.
[5] 陈忠秀,李嘉文,赵 扬,等.益生菌的应用现状和发展前景[J].中国微生物学杂志,2016,28(4):493-497.
[6] 郄素会,潘 颖,高丽洁.益生菌对肠道黏膜免疫的调节作用[J].临床合理用药,2016,9(5):197-181.
[7] 洪奇华,宋 娟,胡彩红,等.纤维寡糖和益生菌对热应激肉鸡肠屏障功能的影响[J].动物营养学报,2014,26(8):2240-2245.
[8] 周 萌,张乃峰,董晓丽,等.益生菌对断奶仔猪生长性能、免疫器官指数及肠道pH的影响[J].动物营养学报,2014,26(2):445-452.
[9] 林 谦,戴求仲,宾石玉,等.饲料添加益生菌与酶制剂对黄羽肉鸡生长性能的影响及相关机理[J].动物营养学报,2012,24(24):1955-1965
[10] Morehouse N F,Baron R R.Coccidiosis:evaluation of coccidiostats by mortality,weight gains,and fecal scores [J].Exp Parasitol,1970,28(1):25-29.
[11] Johnson J,Reid W M.Anticoccidial drugs:leision scoring techniques in battery and floor-pen experiments with chickens [J].Exp Parasitol,1970,28(1):30-36.
[12] 赵 蕾,于新友,王金良,等.鸡球虫疫苗研究现状[J].动物医学进展,2011,32(8):98-103
[13] 田 锋,王新颖.肠道菌群与固有免疫[J].外科理论与实践,2016,21(1):79-82
[14] Zhou Y,Xu X,Yu B,et al.Characterization of in vitro effects of microcystin-LR on intestinal epithelial cells [J].Environ Toxicol,2016,doi:10.1002/tox.22375.
[15] Weil L,Sun B,Chang M X,et al.Effects of cyanobacterial toxin microcystin-LR on the transcription levels of immune-related genes in grass carpCtenopharyngodonidella[J].Environ Biol Fish,2009,85(3):231-238.
[16] 王 琪,崔 宁,王方昆,等.柔嫩艾美耳球虫与肠炎沙门菌混合感染对雏鸡盲肠菌群的影响[J].中国兽医学报,2016,36(12):2081-2085.
[17] 秦泽荣,孔繁瑶,荒川皓.柔嫩艾美耳球虫感染鸡肠炎沙门氏菌混合感染的增强作用[J].中国农业大学学报,1998,3(增刊):25-31.
ProtectiveEffectofProbioticsagainstEimeriatenellaInfectioninChickens
CAO Jian-wen,WANG Hong-wei,ZHANG Xue-fei,GU Zhen,ZHOU Bian-hua
(CollegeofAnimalScienceandTechnology,HenanUniversityofScienceandTechnology,Luoyang,Henan,471000,China)
To study the potential effect of probiotics on chickens infected withEimeriatenella,chickens were vaccinated withE.tenellasporulated oocysts and probiotics.The anticoccidial activity of probiotics was evaluated by determining the anticoccidial index,bloody diarrhea score,survival rate and body weight gain in chickens.On the 7thday postinfection,chickens were slaughtered after weighing.The cecal tissues were collected for the histopathological observation by using HE staining.The results showed that anticoccidial index of probiotics was 137,belonging to low efficient anticoccidial agent.But probiotics can decrease bloody diarrhea score in coccidial infected chickens,reduce the histopathological lesions of ceca in chickens,improve chicken body weight gain and survival rate.It can be recommended for the prevention and treatment of clinical coccidiosis.
probiotics;E.tenella; chicken; anticoccidial index; cecum
2017-03-24
国家自然科学基金项目(31101855);河南科技大学SRTP项目(2011046)
曹建文(1992-),男,山西朔州人,硕士研究生,主要从事临床兽医学的研究。*
S852.723
A
1007-5038(2017)11-0037-05