猫疱疹病毒Ⅰ型PCR检测方法的建立与初步应用
李 航,刘俊平,关平原,雷 宇,李 志
(1.内蒙古农业大学兽医学院,内蒙古呼和浩特 010018;2.内蒙古呼和浩特市动物卫生监督所,内蒙古呼和浩特 010020)
猫疱疹病毒Ⅰ型PCR检测方法的建立与初步应用
李 航1,刘俊平*,关平原*,雷 宇2,李 志3
(1.内蒙古农业大学兽医学院,内蒙古呼和浩特 010018;2.内蒙古呼和浩特市动物卫生监督所,内蒙古呼和浩特 010020)
建立猫疱疹病毒Ⅰ型(FHV-1)PCR检测方法,应用于临床样品中FHV-1的快速检测。根据猫疱疹病毒Ⅰ型的gI基因序列设计了一对特异性引物,以疑似猫疱疹病毒Ⅰ型感染猫的眼鼻分泌物总DNA为模板,建立了PCR检测方法,对所建立的方法进行特异性、敏感性和重复性验证,并对26份临床样本进行检测。结果表明,所建立的PCR诊断方法与犬细小病毒(CPV)、犬瘟热病毒(CDV)、绵羊肺炎支原体(M.ovis)、牛支原体(M.bovis)、牛疱疹病毒Ⅰ型(BHV-1)均无交叉性反应,最低检测DNA模板浓度为3.23×103copies/μL。对26份临床病例进行检测,阳性率61.54%。说明建立的FHV-1 PCR检测方法具有特异性强、敏感度高、方便快捷等优点,适合于临床FHV-1感染的快速检测。
猫;猫疱疹病毒Ⅰ型;PCR检测
猫鼻气管炎又称猫病毒性鼻气管炎(Feline viral rhinotracheitis,FVR)或猫传染性鼻气管炎,该病的病原是疱疹病毒科、α疱疹病毒亚科、水痘属中猫疱疹病毒Ⅰ型 ( Feline herpesvirus type 1,FHV-1)[1]。该病可引起猫科动物急性、高度接触性上呼吸道疾病,主要侵害幼猫,发病率达100%,病死率约50%,是目前已知最重要的猫呼吸道疾病之一[2]。自1957年Crandell R A于美国首次在患病幼猫体内分离得到FHV-1后,世界各地相继分离到该病毒,我国也多次发现疑似病例并分离到病毒[3-5]。血清学调查表明,20世纪90年代我国猫群中即有FHV-1感染[6]。该病毒具有高度种属特异性,只感染猫科动物,相关研究表明该病毒可感染野猫、猎豹、东北虎等野生猫科动物,对野生动物保护造成严重危害。2012年-2014年我国相继报道了东北虎、华南虎感染该病并致死的案例[7-8]。目前,我国FHV-1发病率呈现逐年上升趋势,多次发现临床疑似病例[6]。但兽医临床还仅依靠传统诊断方法,诊断结果不准确,实验室诊断方法也主要靠病毒分离和血清学方法,虽有较准确的结果,但周期长,费用高。PCR检测技术是目前诊断FHV-1较为理想的手段,因PCR方法具有基因组特定片段的靶向作用,能证实黏膜拭子中含有病毒DNA片段,故此PCR诊断方法被认为是诊断该病的“金标准”[9]。
本研究旨在通过设计特异性引物,建立特异、敏感、便捷的FHV-1 PCR检测方法,为FVR的临床诊断和检疫提供技术手段。
1 材料与方法
1.1 材料
1.1.1 主要试剂 血液/细胞、组织基因组DNA快速提取试剂盒(离心柱型)购自天根(北京)生化科技有限公司;d NTP Mixture 50×TAE 电泳缓冲液、Premix ExTaq、DNA Marker DL 2 000、Amp、PMD19-T载体、大肠埃希菌感受态DH5α、PCR产物的纯化回收试剂盒、重组质粒小量提取试剂盒均购自宝生物工程(大连)有限公司;琼脂糖凝胶购自Promega公司;其他常规试剂均为国产分析纯。
1.1.2 病料来源 疑似猫疱疹病毒Ⅰ型感染的猫鼻分泌物和眼分泌物由内蒙古农业大教学兽医院提供,犬细小病毒(CPV)、犬瘟热病毒(CDV)等均由内蒙古农业大学兽医学院动物传染病学实验室提供。
1.2 方法
1.2.1 引物设计与合成 根据GenBank中注册的FHV-1 C-27毒株基因登录号FJ478159.2,选择gI基因作为靶基因,借助Premier5.0软件,设计一对引物。上游引物为gIF:5′-GTCGACATGTCGTCGATAGCCTTC-3′;下游引物为gIR:5′-AAGCTTGGTTTCTTCGTTAATTACGG-3′,将引物序列送至生工生物工程(上海)股份有限公司进行引物合成。用ddH2O将引物进行稀释,引物终浓度为10 pmol/μL,置-20℃保存备用。
1.2.2 主要试剂制备 LB(Luria Bertani)液体培养基:称取10 g Tryptone,5 g Yeast Extract,10 g NaCl,加入到500 mL蒸馏水中,搅拌均匀,用5 mol/L NaOH调pH至7.0~7.2之间,将其定容至1 L体积,121℃高压灭菌25 min,取出后4℃保存。LB(Luria Bertani)固体培养基:在LB液体培养基中加入15 g/L的琼脂,121℃高压灭菌25 min,待其冷却至50℃左右,加入10 mg/mL的AMP至终浓度为100 μg/mL将其倒入培养皿中制成平板培养基。待完全凝固后利用封口膜封口,置于4℃冰箱保存备用。50×TAE缓冲液:称取Tris 121 g,EDTA-2Na 18.6 g至400 mL蒸馏水中,充分均匀后加入57.1 mL醋酸并混匀,定容至500 mL体积,常温保存备用。使用时用蒸馏水稀释成1×TAE使用。
1.2.3 提取模板DNA 将疑似病例的眼、鼻分泌物置于含有1 mL 9 g/L盐水的1.5 mL离心管中,利用DNA快速提取试剂盒按要求进行DNA提取,提取产物,置-20℃冰箱进行保存。
1.2.4 PCR扩增目的片段及产物检测 制备25 μL PCR反应体系:12.5 μL Mix,9.5 μL ddH2O,模板、上下游引物各1 μL。循环参数为:94℃ 5 min,94℃ 30 s,55.4℃ 45 s,72℃延伸30 s,共35个循环,最后72℃延伸10 min。将扩增产物取出8 μL置10 g/L的琼脂糖凝胶(20 mL 1×TAE,2 μL核酸染料,0.2 g琼脂粉。)110 V,电泳30 min,在紫外凝胶成像分析系统(WD-9413A型)中观察条带位置,以DNA Marker DL 2 000为参照进行判读。将阳性电泳结果的DNA样本,置-20℃保存。
1.2.5 阳性样本gI基因克隆
1.2.5.1 目的片段回收及载体连接 将1.2.4试验中阳性目的片段进行DNA凝胶回收纯化,步骤参照PCR 产物纯化回收试剂盒说明书。将纯化后的PCR产物与PMD-19T载体进行连接。连接反应体系:胶回收产物4 μL,PMD-19T 1 μL,Solution I 5 μL,共计10 μL。将上述各组分混匀后置于16℃水浴4 h后取出放置4℃过夜连接(12 h~15 h)。
1.2.5.2 重组质粒转化及提取 将连接产物转化至DH5α大肠埃希菌感受态,加入LB液体培养基37℃、200 r/min摇菌1 h,低速离心弃上清液。将剩余部分加入含Amp的LB固体平板培养基上并均匀涂布开,置于37℃温箱培养14 h。挑取培养基上单个白色菌落接种于3.5 mL Amp抗性的LB液体培养基中,将接种后的培养基置于37℃、200 r/min摇床培养14 h。利用重组质粒小量提取试剂盒将连接转化后的质粒进行质粒DNA提取。将提取产物作为DNA模板,ddH2O为阴性对照,应用已建立的PCR反应体系及参数,进行常规PCR扩增。对扩增产物进行10 g/L琼脂糖凝胶电泳鉴定。选取阳性质粒送北京华大基因科技股份有限公司测序,将测序结果与已知序列进行比对,从而确定检测准确性。将阳性质粒置于-20℃冰箱内保存备用。
1.2.6 阳性质粒浓度的计算 将1.2.5.2所得阳性重组质粒利用NanoDrop2000超微量分光光度计(ND2000)测定260 nm与280 nm波长下的OD值,判断其纯度,如纯度达标按照以下公式转换成质粒的拷贝数copies/μL=(6.02×1023)×(质粒浓度ng/μL×10-9)/( 质粒的总长度DNA length×660)。
1.2.7 特异性试验 用已建立的PCR方法,以1.2.5.2中所得阳性重组质粒为阳性模板,ddH2O作为阴性对照,分别对犬细小病毒(CPV)、犬瘟热病毒(CDV)、羊支原体(M.ovis)、牛支原体(M.bovis)、牛疱疹病毒Ⅰ型(BHV-1)病毒样品进行PCR检测,对扩增产物进行琼脂糖凝胶电泳观察有无目的条带出现,以检测PCR方法的特异性。
1.2.8 敏感性试验 将制备好的阳性质粒用ddH2O进行10倍倍比稀释(101~1011),将稀释后的阳性质粒分别作为DNA模板,进行PCR扩增,扩增产物进行琼脂糖凝胶电泳结果,观察并记录,确定所建立PCR方法对阳性重组质粒最低检测浓度以检验该方法的敏感性。
1.2.9 重复性试验 将阳性质粒及同一批次的PCR反应试剂、引物以及6份阳性DNA样本(2份为一组)冻存于-20℃,并在1、2、3月后进行复检,检测该方法的稳定性。
1.2.10 临床样本检测 对临床疑似病例的眼鼻分泌物提取总DNA,方法参照1.2.3。利用已建立的PCR检测方法对送检的26份(编号L1~L26)眼鼻分泌物进行检测,汇总和分析检测结果。
1.2.11 临床阳性样本PCR产物测序 将PCR产物送至北京华大基因科技股份有限公司测序,并对序列与NCBI标准序列进行对比分析,验证准确性。
2 结果
2.1 重组质粒gI基因序列测定结果
对克隆所得阳性质粒送至北京华大基因科技股份有限公司测序,测序所得的FHV-1的gI基因序列片段通过DNAStar软件进行序列拼接。结果显示,gI基因全长1 155 bp,包含一个完整的开放阅读框,编码384个氨基酸,编码蛋白分子重量约为43 ku,与预测结果一致。对所克隆的阳性质粒利用DNAStar 软件中的Meg Align Clustal W 方法与FHV-1分离株相应基因核苷酸进行同源性对比分析。核苷酸同源性比对结果显示,1号阳性质粒gI基因与FHV-1各分离株相应基因核苷酸同源性在99.7%以上(图1)。

1.本试验克隆样本,2~8.FHV-1国际分离株1.Clone sample ,2-8.FHV-1 strains
2.2 阳性质粒拷贝数计算
根据公式质粒的拷贝数copies/μL = (6.02×1023)×(质粒浓度ng/μL×10-9)/( 质粒的总长度DNA length×660)可对阳性质粒进行计算。结果显示阳性质粒拷贝数为3.23×1010copies/μL。
2.3 特异性试验结果
应用已优化好的PCR反应条件对犬细小病毒(CPV)、犬瘟热病毒(CDV)、绵羊肺炎支原体(M.ovis)、牛支原体(M.bovis)、牛疱疹病毒Ⅰ型(BHV-1)病毒样品DNA进行PCR检测。结果显示本试验对犬细小病毒(CPV)、犬瘟热病毒(CDV)、绵羊肺炎支原体(M.ovis)、牛支原体(M.bovis)、牛疱疹病毒Ⅰ型(BHV-1)病毒样品DNA进行PCR扩增未见目的条带,证明该方法具有良好的特异性(图2)。
2.4 敏感性试验
将1.2.5.2所得阳性质粒用ddH2O做10倍倍比稀释(101~1011),并作为DNA模板,运用优化好的PCR反应程序进行扩增。对PCR产物进行琼脂糖凝胶电泳鉴定,并观察目的条带情况。根据2.2质粒浓度计算结果确定质粒模板最低检测量,判断所建立的PCR方法灵敏性。结果显示,在对质粒稀释107倍后可见目的条带,相应DNA模板浓度为3.23×103copies/μL(即最低可检测136.5 fg/μL的目标DNA)证明该引物敏感性较强可作为诊断引物(图3)。
2.5 重复性试验
将冻存的6份样阳性样本分别于1~3月后利用已建立的PCR方法进行复检。结果显示6个样本在冻存1~3月后利用已建立的PCR反应条件进行扩增均可扩增出1 155 bp目的条带与2号阳性对照条带在同一位置(图4)。
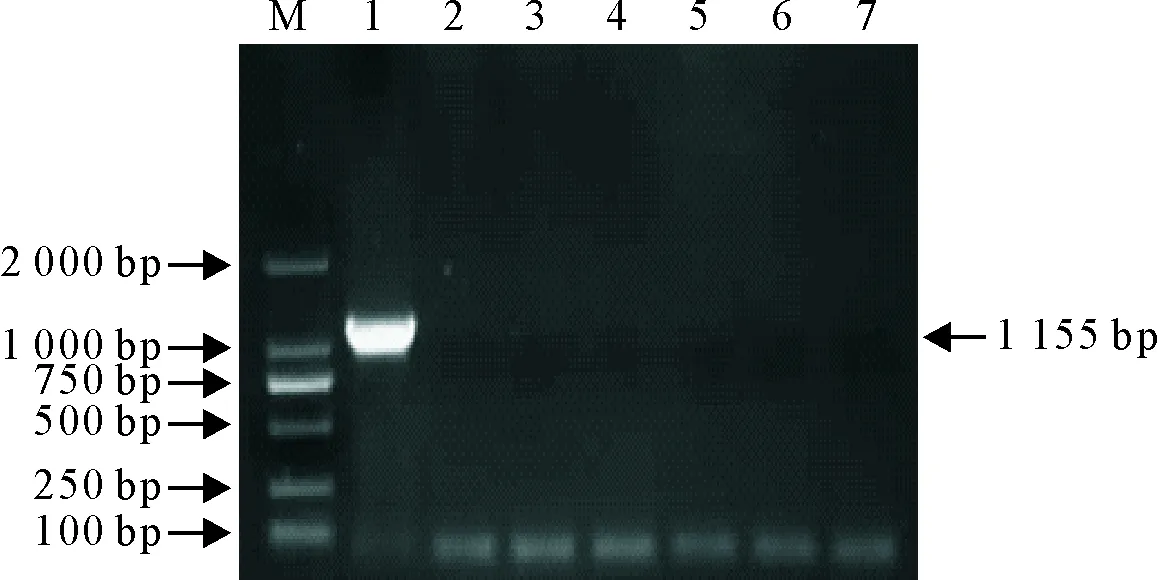
M.DNA 标准DL 2 000 ;1.标准阳性质粒;2.阴性对照;3.犬细小病毒;4.犬瘟热病毒;5.绵羊肺炎支原体;6.牛支原体;7.牛疱疹病毒Ⅰ型
M:DNA Marker DL 2 000;1.Positive control;2.Negative control;3.CPV;4.CDV;5.M.ovis;6.M.bovis;7.BHV-1
图2 PCR特异性试验
Fig.2 The spicificity test of the PCR
2.6 临床初步应用
应用已建立的PCR诊断方法对送检的26份临床疑似病例眼鼻分泌物(编号L1~L26)进行PCR检测(图5)。由图5A可知L1~L3样本、L5样本、L10~L12样本、L14样本、L15样本扩增出1 155 bp特异性目的条带与预期结果一致。判定L1~L3、L5、L10~L12、L14、L15为阳性结果。由图 5B可知L17样本、L19~L23样本、L25样本扩增出1 155 bp特异性目的条带与预期结果一致。判定L17、L19~L23、L25样本为阳性结果。
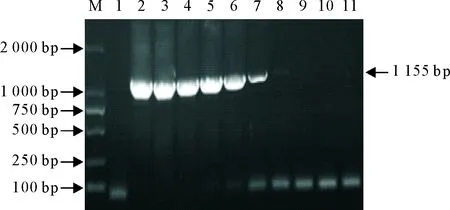
M.DNA 标准DL 2 000;1.阴性对照;2~11.101倍稀释~1011倍稀释
M.DNA Marker DL 2 000;1.Negative control;2-11.101dilution-1011dilution
图3 FHV-1常规PCR敏感性试验结果
Fig.3 Sensitivity test results of the conventional PCR of FHV-1
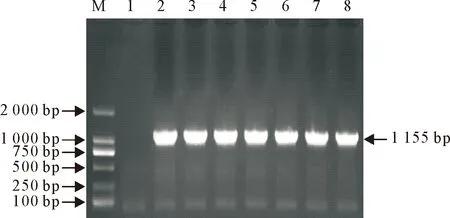
M.DNA 标准DL 2 000 ;1.阴性对照;2.阳性对照;3~4.冻存1个月样本;5~6.冻存2个月样本;7~8.冻存3个月样本
M.DNA Marker DL 2 000;1.Negative control;2.Positive control;3-4.Samples cryopreserved for 1 month;5-6.Samples cryopreserved for 2 month;7-8.Samples cryopreserved for 3 month
图4重复性试验结果
Fig.4 Repetitivity test results
2.7 检测结果
将检测为阳性的PCR产物送至北京华大基因科技股份有限公司测序,并对序列与GenBank标准序列进行对比,结果表明其同源性皆在99%以上。证实本试验所测定的阳性结果为FHV-1感染。
3 讨论
猫病毒性鼻气管炎(FVR)的病原是猫疱疹病毒Ⅰ型(FHV-1),是目前已知的危害性较强的猫科动物上呼吸道疾病[1]。该病具有发病率高死亡率高的特点,幼年猫易感且病死率高,成年猫也可感染但病死率低。但当继发及其他疾病感染时也可造成死亡,康复后成为潜伏感染动物[10]。自1957年美国首次报道FHV-1后世界各地相继分离出该病毒,2010年我国首次报道从患猫眼、鼻分泌物中分离出FHV-1[11]。由于感染FHV-1的猫在康复后均可携带FHV-1,在免疫能力下降时病毒可再度活化并向外界排毒,这对该病的防治造成了很大困难[12]。目前,兽医临床只能通过较为复杂繁琐的实验室诊断来确诊该病。然而PCR诊断方法具有敏感性好、特异性强方便快捷等优点。因此,本研究旨在建立适用于临床检测的具有特异强、敏感高、方便快捷的PCR诊断方法。本研究根据GenBank登录的FHV-1标准序列设计针对gI引物建立PCR检测方法。本研究以疑似患猫病毒性鼻气管炎患猫的眼鼻分泌物总DNA为模板,利用所建立的PCR方法成功扩增出1 155 bp目的条带,将目的DNA纯化后克隆出FHV-1 gI全基因,并制备了标准阳性质粒。将阳性质粒序列与GenBank登录的FHV-1各国分离株进行序列比对其同源性在99.7%以上,对所建立的PCR敏感性试验表明最低检测DNA模板浓度为3.23×103copies/μL。本试验与2010年林颖[13]等针对FHV-1 gD基因所建立的PCR诊断方法,以及屈哲[14]等于2011年针对FHV-1 TK基因所建立的PCR诊断方法相比有着更高的敏感性。特异性试验表明在1 155 bp可出现单一特异性目的条带证明该方法具有高度灵敏性和特异性可用于临床样本检测。本试验对26份临床疑似病例样本进行检测,阳性结果16份,阳性率为61.54%。这一结果低于2010年刘宝山[15]所报道的86.7%阳性率,也低于2014年王吉[16]所报道的66.7%阳性率。分析原因可能是本试验所采集病料均来自内蒙古呼和浩特地区,对于本病在呼和浩特地区的流行情况尚无相关报道,不排除本病在呼和浩特地区流行率较其他地区低的可能性。本研究证明可从感染FHV-1的猫眼、鼻分泌物中检测到FHV-1。对临床样本检测为阳性的PCR产物送至生物公司测序并与GenBank中FHV-1序列进行比对结果显示同源性均为99%证实了检测结果的准确性。本研究所建立的PCR诊断方法具有特异性强、敏感性高、准确性高等优点,适用于临床样本的检测。

M.DNA 标准DL 2 000 ;1.阴性对照;2.阳性对照;A:3~17.L1号样本~L15号样本;B:3~13.L16号样本~L26号样本M.DNA Marker DL 2 000;1.Negative control;2.Positive control;A:3-17.L1-L15 samples;B: 3-13.L16-L26 samples
[1] Jane E.Pediatric Feline Upper Respiratory Disease[J].Vet Clin North Am Small Anim Pract,2014,44(2):331-342.
[2] Craig E.Infectious diseases of the dog and cat[M].Saunders,2011:346-357.
[3] Crandell R A,Maurer F D.Isolation of a feline virus associated with intranuclear inclusion bodies[J].Proceed Soc Exp Biol Med,1958,97(3):487-490.
[4] 刘 健,李 鑫,徐 锋,等.猫传染性鼻气管炎病毒的分离与鉴定[J].中国动物传染病学报,2016,24(1):22-26.
[5] Glenna F.Pneumonia and gastritis in a cat caused by feline herpesvirus-1[J].Can Vet J.2016,57(2):147-150.
[6] 张 丽,冯向辉,孙 明.猫病毒性鼻气管炎研究进展[J].黑龙江畜牧兽医,2013,13(26):22-24.
[7] 肖建雄,单 芬,黄嘉欣,等.东北虎和华南虎源传染性鼻气管炎病毒的PCR检测和序列分析[J].野生动物,2013,34(3):146-151.
[8] 孙贺廷.藏羚羊传染性胸膜肺炎和华南虎鼻气管炎的首次确诊与流行病学研究[D].东北林业大学,2014.
[9] Wang J,Liu L,Wang J,et al.Recombinase polymerase amplification assay-A simple,fast and cost-effective alternative to real time PCR for specific detection of feline herpesvirus-1[J].PLoS One,2017,12(1):1-8.
[10] Mcgregor G F,Sheehan K,Simko E.Pneumonia and gastritis in a cat caused by feline herpesvirus-1[J].Can Vet J,2016,57(2):147-150.
[11] 张 硕,李纯玲,汪葆明,等.猫疱疹病毒Ⅰ型的分离与鉴定[J].实验动物科学,2010,27:21-25.
[12] Henzel A,Lovato L T,Weiblen R.Epidemiological status of felid herpesvirus type-1 and feline calicivirus infections in Brazil[J].Ciência Rural,2015,45(6):1042-1049.
[13] 林 颖,刘宝山,任会军,等.猫传染性鼻气管炎PCR检测方法的建立[J].现代畜牧兽医,2010(8):71-73.
[14] 屈 哲,徐镔蕊,睢艳平,等.猫病毒性鼻气管炎PCR检测方法的建立与应用[J].中国兽医杂志,2011,47(5):25-26.
[15] 刘宝山,林 颖,尹荣焕,等.猫疱疹病毒1型 PCR检测方法的建立[J].畜牧与兽医,2010,42(1):74-76.
[16] 王 吉,付 瑞,卫 礼,等.猫疱疹病毒Ⅰ型PCR检测方法的建立及初步应用[J].中国病毒病杂志,2014(3):192-197.
EstablishmentandPreliminaryApplicationofPCRforDetectionofFelidHerpesvirus
LI Hang,LIU Jun-ping,GUAN Ping-yuan,LEI Yu ,LI Zhi
(1.CollegeofVeterinaryMedicine,InnerMongoliaAgriculturalUniversity,Hohhot,InnerMongolia,010018,China;2.InstituteofHohhotAnimalHealthInspection,Hohhot,InnerMongolia,010020,China)
This study aimed to establish a PCR diagnostic method to feline herpesvirus-1 (FHV-1),which provided a quick test to the clinical specimen.This study designed a pair of specific primers based on the gl genetic sequence of FHV-1,the template used in PCR was the total DNA extracted from occulonasal discharge of cats with suspicious FHV-1 infection.Then,we carried out test to 26 clinical specimen for the specificity,sensitivity,and repeatability.The result showed that the PCR test had no cross reaction with canine parvovirus,cainine distemper virus,Mycoplasmaovis,Mycoplasmabovis.The lowest DNA template test concentration was 3.23×103copies/μL.The positive rate was 61.54%.As a result,this test had high specificity and sensitivity,and can be used to detect clinical infections with FHV-1.
cat; Feline herpesvirus type 1; PCR detection
2017-04-16
李 航(1993-),男(蒙古族),吉林梨树人,硕士研究生,主要从事兽医麻醉学研究。*
S852.659.1
A
1007-5038(2017)11-0086-05