信号肽对木聚糖酶在马克斯克鲁维酵母中分泌表达的影响
吴 玥,周峻岗,2,吕 红,2
(1. 复旦大学 生命科学学院 遗传工程国家重点实验室,上海 200438;2. 上海工业菌株工程技术研究中心,上海200438)
信号肽对木聚糖酶在马克斯克鲁维酵母中分泌表达的影响
吴 玥1,周峻岗1,2,吕 红1,2
(1. 复旦大学 生命科学学院 遗传工程国家重点实验室,上海 200438;2. 上海工业菌株工程技术研究中心,上海200438)
马克斯克鲁维酵母(Kluyveromycesmarxianus)是一种新型的非常规酵母,具有生长快、分泌能力强、安全性高等优势.在酵母表达系统中,分泌信号肽不仅介导了外源蛋白沿着正确途径分泌到胞外,也在蛋白质翻译后加工等方面发挥了重要作用.本文分别研究了酿酒酵母α-Factor信号肽和克鲁维酵母菊粉酶信号肽对耐热木聚糖酶在马克斯克鲁维酵母中的分泌表达影响.工程菌摇瓶发酵72h后,在含有菊粉酶信号肽和α-Factor信号肽的工程菌株的发酵上清中,木聚糖酶酶活分别为318.91U/mL和117.90U/mL,表明马克斯克鲁维酵母表达木聚糖酶时,菊粉酶信号肽介导的蛋白分泌表达效果优于α-Factor信号肽.重组表达木聚糖酶最适反应条件是pH 5.5和65℃,在75℃处理1h后,该酶的剩余酶活保留73%以上.在5L发酵罐中,重组菌高密度发酵72h,木聚糖酶酶活高达157757U/mL,结果表明,马克斯克鲁维酵母表达系统在工业酶领域中应用具有非常广阔的前景.
木聚糖酶; 马克斯克鲁维酵母; 信号肽; 高效表达
植物细胞壁的主要成分为纤维素和半纤维素,这些物质是自然界中重要的可再生能源.半纤维素的核心组分是木聚糖,并连接了甘露糖、半乳糖等糖基组分,形成一种高度异构的杂聚糖,自然状态下难以分解,因此不能得到有效利用.木聚糖酶(Xylanase)是一类能够特异降解木聚糖的酶类,主要分为3类: (1) β-1,4-D-内切木聚糖酶(EC3.2.1.8): 主要作用方式为内切,使木聚糖或长链木寡糖主链内部的β-1,4 糖苷键断裂,水解为木二糖、木三糖等低聚寡糖;(2) β-1,4-D-外切木聚糖酶(EC3.2.1.92): 作用于木聚糖或木寡糖的非还原端,水解产物为木糖[1];(3) β-木糖苷酶(EC3.2.1.37).我们所说的木聚糖酶一般是指β-1,4-D-内切木聚糖酶[2].依据序列及结构特征,木聚糖酶可以归类到糖基水解酶家族5、7、8、10、11、26、30和43(http:/www.cazy.org/fam/acc_GH.html),其中家族10和11木聚糖酶的研究较为深入,它们的底物特异性较低,能够水解侧链修饰的木聚糖[3].
木聚糖酶可广泛应用于食品、造纸、饲料、生物燃料、污水处理和农业废弃物处理等方面[4-6].自然环境中产木聚糖酶的细菌、真菌、酵母、植物以及昆虫十分丰富,迄今为止已从降解半纤维素的微生物中分离鉴定出许多特性优良的木聚糖酶产生菌,已报道的木聚糖酶基因达400多种,而且大部分产木聚糖酶的微生物为嗜温性微生物[4],其中,曲霉属Aspergillus和木霉属Trichoderma被认为是产木聚糖酶最具潜力的菌种.迄今为止,已成功表达木聚糖酶基因的微生物有伯克霍尔德菌属Burkholderiasp.[7], 短小芽胞杆菌Bacilluspumilus[8-9],链霉菌属Streptomyces[10-11], 黑曲霉Aspergillusniger[12], 嗜热拟青霉Paecilomycesthermophila[13],长梗木霉Trichodermalongibrachiatum[14],疏绵状嗜热丝孢菌Thermomyceslanuginosus[15].
马克斯克鲁维酵母K.marxianus是一种新型的食品安全级酵母,已通过美国GRAS(Generally Regarded as Safe)和欧洲QPS(Qualified Presumption of Safety)安全认证[16-17].马克斯克鲁维酵母具有生物量高、生长快、耐高温、可利用多种碳源等特性,在工业领域有很大的应用潜力[18-19].构建和改造酵母表达系统是提高外源基因分泌表达能力的关键因素之一.其中,信号肽直接影响着新合成蛋白质的分泌效率.在酵母中,小分子多肽或蛋白的分泌表达一般采用酿酒酵母α-factor信号肽[20],而在克鲁维酵母中,菊粉酶信号肽也是一种高效的蛋白分泌信号肽.本研究将α-factor信号肽和菊粉酶信号肽分别用于在马克斯克鲁维酵母中表达木聚糖酶基因,分析这两种信号肽对马克斯克鲁维酵母分泌表达木聚糖酶的影响,从而为马克斯克鲁维酵母表达系统的完善和木聚糖酶的工业化应用奠定基础.
1 材料与方法
1.1 材 料
1.1.1 菌株和质粒
大肠杆菌EscherichiacoliDH5α、马克斯克鲁维酵母菌株K.marxianusFim-1(ura3Δ)、质粒pUKDN118、质粒pPIC9K-C60A-G201C(含有融合有α-Factor的木聚糖酶基因XYN)均为本实验室保存.
1.1.2 主要试剂
实验中所用Phanta Max Super-Fidelity DNA Polymerase购于南京诺唯赞生物科技有限公司;QuickCutTMSpeⅠ、QuickCutTMSacⅡ等购于TaKaRa;1kb plus DNA Ladder和Prestained Protein Ladder购于Thermo Fisher Scientific公司;Gibson Assembly®Master Mix购自New England Biolab公司;小量质粒抽提试剂盒、DNA凝胶回收试剂盒购于杭州新景生物试剂开发有限公司;阿拉伯木聚糖购于Megazyme公司;桦木木聚糖购于Sigma-Aldrich公司.其他试剂均为国产分析纯.
1.1.3 培养基
YEPD培养基(1L): Glucose 20g;Polypeptone 20g;Yeast extract 10g;115℃高压灭菌15min.
YD培养基(1L): Glucose 40g;Yeast extract 20g;115℃高压灭菌15min.
SD-Ura-培养基(1L): Yeast nitrogen base w/o amino acids 6.7g;Glucose 20g;agar 20g;115℃高压灭菌15min.
合成培养基(1L): Glucose 5g;(NH4)2SO45g;MgSO4·7H2O 0.5g;KH2PO43g;ethylene diaminetetra acetic acid(EDTA) 15mg;ZnSO4·7H2O 4.5mg;MnCl2·7H2O 1mg;CoC12·6H2O 0.3mg;CuSO4·5H2O 0.3mg;Na2MoO4·2H2O 0.4mg;CaC12.2H2O 4.5mg;FeSO4·7H1O 3mg;H3BO31mg;KI 0.1mg;biotin 0.1mg;Ca-pantothenate 1mg;nicotinic acid 1mg;115℃高压灭菌15min.
1.2 方法
1.2.1 含不同信号肽木聚糖酶马克斯克鲁维酵母工程菌的构建
以Neocallimastixpatriciarum来源的XYN的质粒为模板,利用引物Inu-xyn-F(5’-TACAAGAGA GACGGTCCGCGGCAAAGTTTCTGTAGTTCAGC)和Inu-xyn-R(5’-AGCTTGCGGCCTTAACTAGTATC-ACCAATGTAAACCTTTG),PCR扩增获得XYN片段,然后采用PCR扩增的方法,将菊粉酶信号肽序列(atgaagttagcatactccctcttgcttccattggcaggagtcagtgcttcagtgatcaattacaagaga, 69bp)融合在XYN的5’端,而融合α-Factor信号肽序列(atgagatttccttcaatttttactgcagttttattcgcagcatcctccgcattagctgctccagtcaacactacaacagaagatgaaacggc-acaaattccggctgaagctgtcatcggttactcagatttagaaggggatttcgatgttgctgttttgccattttccaacagcacaaataacgggttattgtttataaatacta-ctattgccagcattgctgctaaagaagaaggggtatc, 242bp)的XYN片段的PCR扩增则采用引物α-Factor-xyn-F(5’-TT-TTTTTGTTAGATCCGCGGATGAGATTTCCTTCAATTTT)和α-Factor-xyn-R(5’-AGCTTGCGGCCTTAAC-TAGTATCACCAATGTAAACCTTTG),扩增产物通过常规分子生物学方法[21]分别克隆到KM表达载体pUKDN118(中国发明专利申请201510562564),构建含XYN的重组KM菊粉酶信号肽分泌表达载体pUKD-Inu-xyn和α-Factor信号肽分泌表达载体pUKD-α-Factor-xyn.通过马克斯克鲁维酵母化学转化[22],将两种表达载体分别转入K.marxianusFim-1(ura3Δ),用SD-Ura-平板进行转化子的筛选,利用引物Inu-xyn-F和Inu-xyn-R、α-Factor-xyn-F和α-Factor-xyn-R,对SD-Ura-平板上形成的转化子进行PCR扩增鉴定,并送上海杰李生物技术有限公司测序.
1.2.2 重组马克斯克鲁维酵母工程菌的木聚糖酶表达分析
挑取鉴定阳性的重组菌株单克隆于50mL YEPD液体培养基中,30℃,220r/min,摇床培养72h,吸取一定体积的菌液测定细胞内和上清中的木聚糖酶的酶活.木聚糖酶的活性测定采用二硝基水杨酸(DNS)法[23],100μL 50mmol/L醋酸钠缓冲液(pH 5.5)稀释的酶液与100μL 2%木聚糖溶液混合,60℃反应10min,立即加入200μL DNS,沸水浴反应10min,冷却后在570nm处测定吸光度,并以木糖作标准曲线进行木聚糖酶的定量,1酶活单位(U)定义为每分钟水解产生1μmol还原糖[24].
1.2.3 马克斯克鲁维酵母重组表达的木聚糖酶性质分析
木聚糖酶的最适反应pH测定: 以50mmol/L的醋酸钠缓冲液(pH 3.5~7.0)稀释木聚糖酶酶液,然后加入等体积的2%木聚糖溶液,60℃反应10min后用DNS法测定木聚糖酶活力.
木聚糖酶的最适反应温度测定: 以50mmol/L的醋酸钠缓冲液(pH 5.5)稀释木聚糖酶酶液,然后加入等体积的2%木聚糖溶液,分别在45,50,55,60,65,70,75,80℃下进行酶促反应,测定其木聚糖酶的活力.
pH稳定性的测定: 采用50mmol/L的醋酸钠缓冲液pH 3.5,4.0,4.5,5.0,5.5,6.0,6.5,7.0,60℃处理木聚糖酶酶液1h后,用最适pH缓冲液适当稀释后,测定其木聚糖酶活力.
温度稳定性测定: 将酶液分别在45,50,55,60,65,70,75,80℃水浴中处理1h,冷却后测定其木聚糖酶活力.
重组木聚糖酶水解木聚糖的产物分析: 将5μL木聚糖酶酶液与95μL 2%的木聚糖溶液混合,65℃分别反应0.5h,1h,2h后,取4μL点在60 F254硅胶上,采用正丁醇/乙醇/水(体积比5∶3∶2)为展开剂进行薄层层析(TLC),展开1~2次后吹干,喷上显色剂(5% H2SO4+95% ethanol),110℃烘烤5min显色.
1.2.4 重组木聚糖酶马克斯克鲁维酵母工程菌的高密度发酵
将重组木聚糖酶马克斯克鲁维酵母工程菌在新鲜的SD-URA-培养基进行活化,然后挑取单克隆接种于150mL合成培养基中,30℃,摇床培养36h.将种子液按1∶10接种于装有1.5L培养基的5L发酵罐中,发酵罐参数设置为: 温度30℃,罐压0.01Mpa,溶氧控制在30%左右,搅拌速度200~800r/min.当葡萄糖消耗完全后进行补料,补料流速30mL/h,发酵周期控制在72~96h,发酵周期测定菌体密度和木聚糖酶的产量.
1.2.5 木聚糖酶的糖基化分析
采用在线软件NetNGlyc(http:∥www.cbs.dtu.dk/services/NetNGlyc/)预测木聚糖酶氨基酸序列中糖基化位点.利用EndoglycosidaseH(EndoH)进行马克斯克鲁维酵母表达的木聚糖酶的去糖基化分析,酶切反应过程如下: 取5μL重组酶液、1μL 10×Glycoprotein Denaturing Buffer和4μL ddH2O,混匀后100℃水浴10min;加入2μL 10×Glyco Buffer3、3μLEndoH、5μL ddH2O,37℃水浴1h,反应结束后进行SDS-PAGE分析.
2 结 果
2.1 含不同信号肽的耐热木聚糖酶分泌表达酵母工程菌的构建
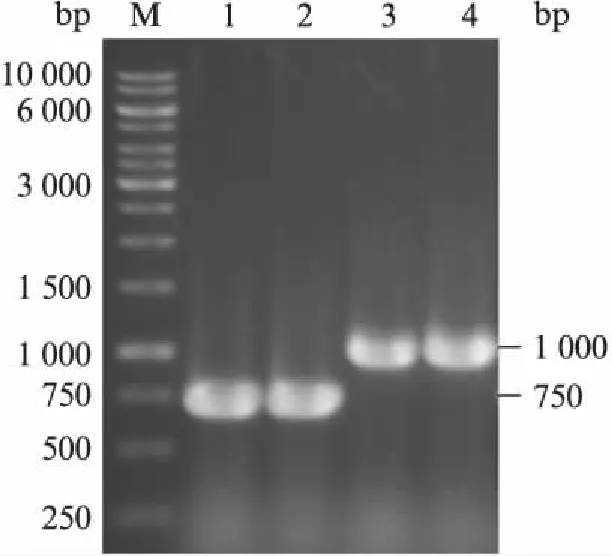
图1 重组菌转化子的PCR鉴定Fig.1 PCR validation of the Ura+transformantsM: 1kb DNA ladder;1,2: Fim-1/pUKD-Inu-xyn;3,4: Fim-1/pUKD-α-Factor-xyn.
以含木聚糖酶基因的SEQ ID No.1序列(中国发明专利申请CN200810200060)为模板[25],采用PCR扩增的方法,将酿酒酵母α-Factor信号肽的编码核苷酸序列和菊粉酶信号肽编码序列融合在XYN的5’端,扩增产物通过常规分子生物学方法克隆到KM表达载体pUKDN118(中国发明专利申请201510562564),构建含有α-Factor信号肽和菊粉酶信号肽的耐温木聚糖酶重组表达载体.重组表达载体分别转化马克斯克鲁维酵母表达宿主菌K.marxianusFim-1(ura3Δ),用SD-Ura-平板筛选转化子.提取转化子的基因组,利用引物Inu-xyn-F和Inu-xyn-R、α-Factor-xyn-F和α-Factor-xyn-R进行PCR鉴定,若扩增产物约分别为750bp和1000bp的克隆,既为重组表达木聚糖酶的马克斯克鲁维酵母工程菌(图1),其中α-Factor信号肽融合表达木聚糖酶的工程菌命名为Fim-1/pUKD-α-Factor-xyn,而菊粉酶信号肽融合表达的工程菌则命名为Fim-1/pUKD-Inu-xyn.
2.2 两种重组木聚糖酶酵母工程菌分泌表达水平的比较
Fim-1/pUKD-α-Factor-xyn和Fim-1/pUKD-Inu-xyn分别接种于50mL YD培养基中,摇床培养72h后检测发酵液上清和细胞内木聚糖酶酶活,结果如表1所示,两株木聚糖酶重组菌的胞内与发酵上清液中均检测到木聚糖酶的表达,但上清中的酶活远高于胞内,分泌效率均在99%以上.结果表明,在马克斯克鲁维酵母中,α-Factor信号肽和菊粉酶信号肽都能引导重组蛋白分泌到胞外,但菊粉酶信号肽融合表达木聚糖酶的表达量高于α-Factor信号肽,上清中的酶活达318.91U/mL.

表1 不同信号肽融合表达的重组菌发酵胞内与胞外木聚糖酶酶活Tab.1 The amount of intracellular and extracellular xylanase produced by the recombinant strains
2.3 重组木聚糖酶的酶学性质
利用不同pH缓冲液(3.5~7.0),测定了木聚糖酶的最适反应pH值,结果表明: 木聚糖酶的最适反应pH为5.5,在pH 5.0~6.0范围内酶活力均在80%以上;在pH 3.5~4.5和pH 6.5~7.0范围内,酶的活性明显下降(图2(a)).
在50mmol/L的醋酸钠pH 5.5缓冲液中,测定不同反应温度对木聚糖酶的影响,结果表明: 木聚糖酶的最适反应温度为65℃;温度提高到80℃,相对酶活力下降至76%;温度低于50℃,则相对酶活力低于50%(图2(b)).
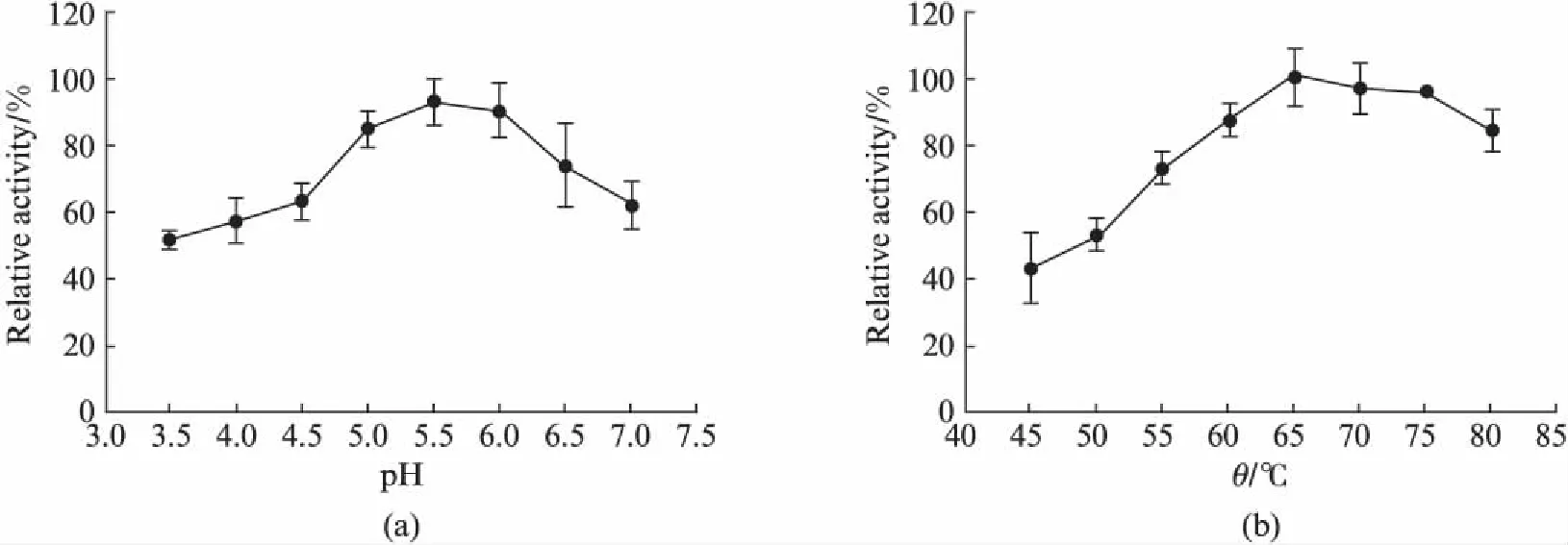
图2 木聚糖酶的(a)最适反应pH和(b)最适反应温度Fig.2 (a) The optimum pH and (b) temperature of xylanase
将发酵上清液分别在不同pH缓冲液(3.5~7.0)中60℃处理1h后,在最适反应条件下测定木聚糖酶的剩余酶活力,以酶活力最高的为对照,设为100%.结果表明: 木聚糖酶在pH 5.0~7.0范围内较稳定,处理1h后残余酶活力保持在70%以上;但pH 3.5~4.5条件下木聚糖酶的稳定性较差(图3(a),见第450页).
将发酵上清液分别在不同温度(45~80℃)下水浴处理1h,在最适反应条件下测定木聚糖酶的剩余酶活力,以酶活力最高的为对照,设为100%.结果表明: 木聚糖酶在45~70℃范围内较稳定,剩余酶活均保持在84%以上;75℃处理1h时,剩余酶活仍有73%;而80℃处理1h后,剩余酶活仅为29%(图3(b)).
比较马克斯克鲁维酵母和大肠杆菌表达的木聚糖酶的最适反应条件,发现马克斯克鲁维酵母和大肠杆菌表达的木聚糖酶的最适反应温度都在65℃左右,最适反应pH值也都在5.5左右,说明马克斯克鲁维酵母表达的木聚糖酶与在大肠杆菌表达系统中表达该酶的变化趋势一致,具有较高的催化活性[25].
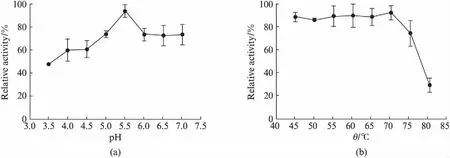
图3 木聚糖酶的(a)pH稳定性和(b)热稳定性Fig.3 (a) The pH stability and (b) thermostability of xylanase
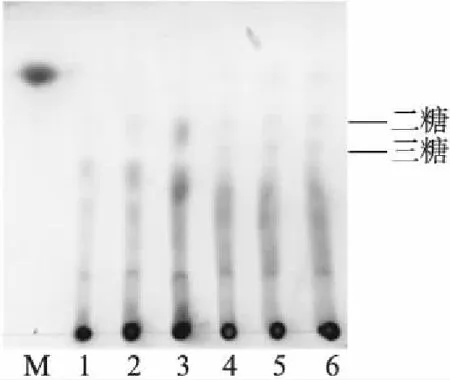
图4 木聚糖水解产物的薄层层析分析Fig.4 TLC analysis of the xylan hydrolysatesM: 木糖;1: 桦木木聚糖水解30min;2: 桦木木聚糖水解1h;3: 桦木木聚糖水解2h;4: 阿拉伯木聚糖水解30min;5: 阿拉伯木聚糖水解1h;6: 阿拉伯木聚糖水解2h.
分别以阿拉伯木聚糖和桦木木聚糖为底物进行水解,薄层层析分析结果表明: 木聚糖能够被水解为木二糖、木三糖以及更高聚合度的木寡糖,并且有少量木糖产生(图4),说明该木聚糖酶主要通过内切方式,使木聚糖主链内部的β-1,4糖苷键断裂,水解为木二糖、木三糖等低聚寡糖.桦木木聚糖是直链型木聚糖,侧链没有修饰,而阿拉伯木聚糖中存在高度阿拉伯糖修饰,阿拉伯糖与木糖的比例约为38∶62,由此说明,重组木聚糖酶对侧链修饰的木聚糖也有较高的水解活性.
2.4 不同信号肽木聚糖酶重组菌株的高密度发酵
发酵72h后两株重组菌的细胞生长进入稳定期,菌体密度OD600都在240左右,Fim-1/pUKD-Inu-xyn重组菌的细胞干重达到90g/L,而Fim-1/pUKD-α-Factor-xyn重组菌的细胞干重为87g/L.发酵过程重组菌的产酶水平检测表明,Fim-1/pUKD-Inu-xyn在合成培养基中发酵72h,木聚糖酶产量高达157757U/mL,表达水平是摇瓶发酵产量的约500倍,而α-Factor信号肽融合表达的重组菌Fim-1/pUKD-α-Factor-xyn的产酶量明显低于Fim-1/pUKD-Inu-xyn,酶活仅为76377U/mL,说明在马克斯克鲁维酵母表达宿主K.marxianusFim-1ura3Δ中,采用菊粉酶信号肽表达木聚糖酶的效率更高(图5).
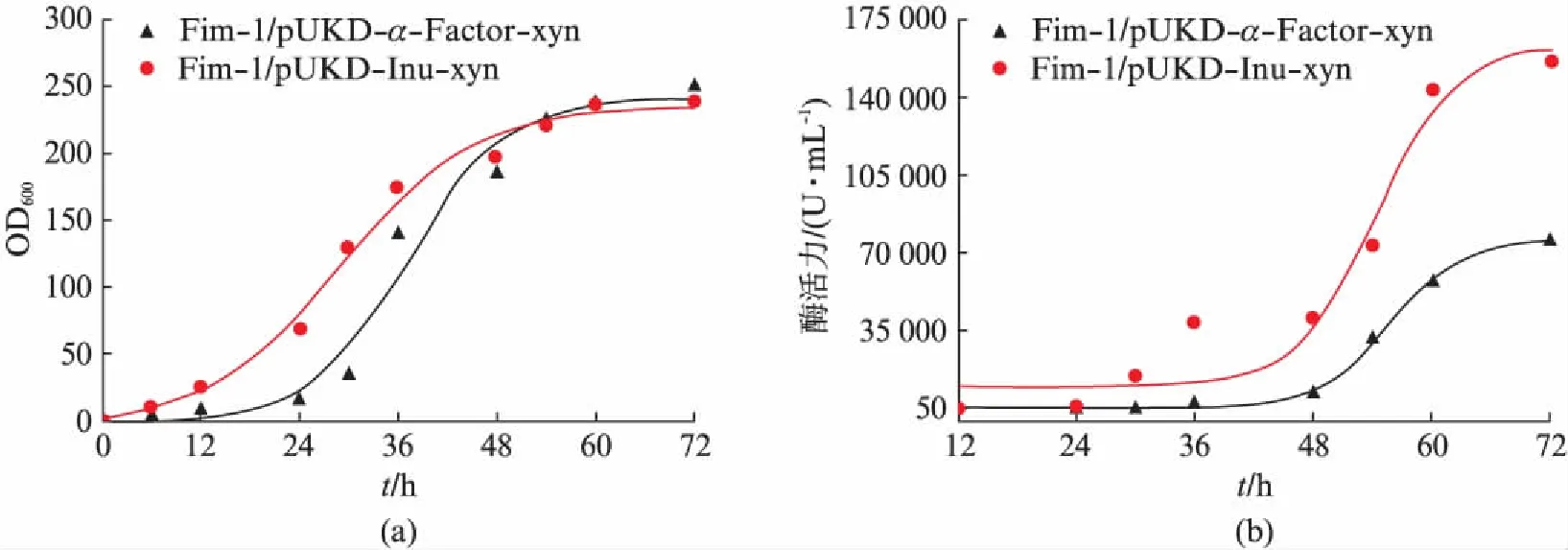
图5 重组菌株发酵过程的生长曲线和产酶曲线Fig.5 The cell growth and supernatant xylanase during the fermentation of the recombinant strains(a) 发酵过程中的细胞生长曲线;(b) 木聚糖酶的产酶曲线.
发酵过程中的发酵液上清SDS-PAGE电泳检测发现,两种信号肽介导的分泌表达木聚糖酶的分子量存在明显差异,α-Factor信号肽融合表达的木聚糖酶的蛋白大小分布在25~100kDa之间,其中大部分重组蛋白的分子量位于35~70kDa范围内,而菊粉酶信号肽融合表达的木聚糖酶的蛋白大小分布在25~170kDa之间,大部分重组蛋白的分子量位于55~170kDa之间(图6).
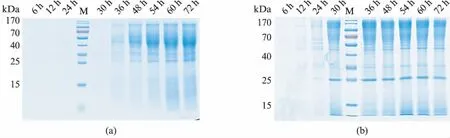
图6 重组菌株高密度发酵的上清的SDS-PAGE检测Fig.6 SDS-PAGE analysis of xylanase secretory expression during the high-density fermentation(a) Fim-1/pUKD-α-Factor-xyn不同发酵时间的上清液;(b) Fim-1/pUKD-Inu-xyn不同发酵时间的上清液.
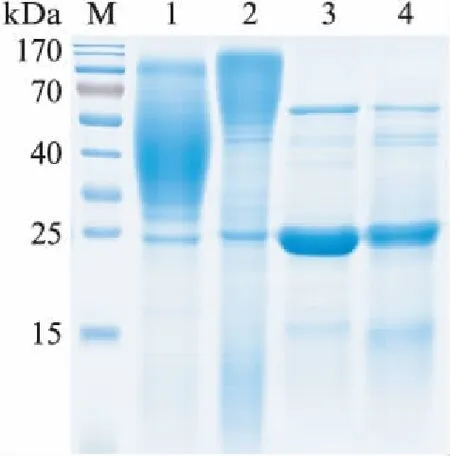
图7 马克斯克鲁维酵母重组表达的木聚糖酶去N-糖基化分析Fig.7 Analysis for deglycosylation of the recombinant xylanase from K.marxianusM. PageRuler Prestained Protein Ladder;1. Fim-1/pUKD-α-Factor-xyn发酵液上清;2. Fim-1/pUKD-Inu-xyn发酵液上清;3. 去糖基化酶Endo H处理后的Fim-1/pUKD-α-Factor-xyn发酵液上清;4. 去糖基化酶Endo H处理后的Fim-1/pUKD-Inu-xyn发酵液上清.
通过在线软件NetNGlyc对木聚糖酶的氨基酸序列N-糖基化位点进行分析,发现木聚糖酶分子内有两个潜在N-糖基化位点,分别位于37位和88位的天冬酰胺上.利用New England Biolabs公司的去糖基化酶EndoH,分别对Fim-1/pUKD-Inu-xyn和Fim-1/pUKD-α-Factor-xyn重组表达的木聚糖酶蛋白进行去糖基化处理.与未处理前的发酵液上清相比,两株马克斯克鲁维酵母表达的重组蛋白上层弥散的蛋白条带明显减少,而25kDa大小的蛋白条带明显变浓(图7),并且该条带大小与木聚糖酶理论分子量一致.去糖基化分析结果表明,重组木聚糖酶蛋白条带出现弥散是由于不同程度的N-糖基化修饰引起的;此外,与α-Factor信号肽相比,菊粉酶信号肽介导的蛋白分泌过程糖基化程度较高.
3 讨 论
在蛋白质表达系统中,宿主菌的生长特性、蛋白翻译后修饰机制、蛋白质折叠与分泌途径等对外源基因的分泌表达能力具有重要影响[26-27].马克斯克鲁维酵母是真核生物中生长最快的生物,具有生物量高、生长快、耐高温、可利用多种碳源等特性,因此在重组蛋白工业生产中具有非常广阔的开发与应用前景[28-31].本研究利用新型的马克斯克鲁维酵母表达系统,实现了耐温木聚糖酶的高效表达,发酵72h产酶量达157757U/mL.在毕赤酵母表达系统中,来源于Aspergillusniger、Aspergillususamii和Trichodermareesei木聚糖酶的重组表达水平分别是10035U/mL、58792U/mL和130000nkat/mL(约7800U/mL)[32-34],因此,马克斯克鲁维酵母表达木聚糖酶的产量高、发酵周期短,在木聚糖酶的工业化生产中更有优势.
在酵母中表达外源蛋白时,分泌信号肽的选择对于分泌蛋白表达水平和修饰至关重要.Murasugi等[35]比较了α-factor信号肽和PHO1信号肽引导人重组肝素结合细胞因子在毕赤酵母中的分泌效率,以α-factor信号肽的分泌效率更高,是PHO1信号肽的140倍.Pal[20]等利用α-factor信号肽在毕赤酵母中分泌表达hGM-CSF,也获得了非常好的分泌效果.本研究以木聚糖酶为目的蛋白,构建了木聚糖酶重组分泌表达载体,两种信号肽切割的位点都是Lys-Arg,在分泌过程中被酵母细胞中的蛋白酶Kex2切除形成成熟的木聚糖酶蛋白.在本研究中,我们比较了酿酒酵母α-factor信号肽和克鲁维酵母菊粉酶信号肽在马克斯克鲁维酵母中介导的分泌表达效果,发现两种信号肽都能有效地将翻译后的木聚糖酶蛋白转运至胞外,但菊粉酶信号肽介导木聚糖酶的分泌表达量相对较高,由此说明在马克斯克鲁维酵母中,不同信号肽介导的蛋白分泌效率的差异,可能与信号肽自身的结构有关.此外,我们还发现不同的信号肽引导的目的蛋白翻译后的糖基化修饰过程也存在明显差异,菊粉酶信号肽介导木聚糖酶分泌表达过程的N-糖基化程度明显高于α-factor信号肽,这种过度糖基化与重组蛋白的生物活性、蛋白分泌效率是否相关还需进一步研究.因此,在表达外源蛋白时,对于分泌信号肽的偏好性不同,需要根据宿主菌自身的特性选择合适的分泌信号肽.
[1] BEG Q K, KAPOOR M, MAHAJAN L,etal. Microbial xylanases and their industrial applications: A review [M].ApplMicrobiolBiotechnol, 2001,56(3/4): 326-338.
[2] 方洛云,邹晓庭,许梓荣.木聚糖酶基因的分子生物学与基因工程 [J].畜禽业,2002(02): 2-3.
[3] HENRISSAT B, BAIROCH A. New families in the classification of glycosyl hydrolases based on amino acid sequence similarities [J].BiochemJ, 1993,293(3): 781-788.
[4] POLIZELI M L, RIZZATTI A C, MONTI R,etal. Xylanases from fungi: Properties and industrial applications [J].ApplMicrobiolBiotechnol, 2005,67(5): 577-591.
[5] SUBRAMANIYAN S, PREMA P. Application of probiotics in the dairy industry: The long way from traditional to novel functional foods [J].CritRevBiotechnol, 2002,22(1): 33-64.
[6] 慕娟,问清江,党永,等.木聚糖酶的开发与应用 [J].陕西农业科学,2012(1): 111-115.
[7] MOHANA S, SHAH A, DIVECHA J,etal. Xylanase production byBurkholderiasp. DMAX strain under solid state fermentation using distillery spent wash [J].BioresourTechnol, 2008,99(16): 7553-7564.
[8] BATTAN B, SHARMA J, DHIMAN S S,etal. Enhanced production of cellulasefree thermostable xylanase byBacilluspumilusASH and its potential application in paper industry [J].EnzymeMicrobTechnol, 2007,41(6/7): 733-739.
[9] POORNA C A, PREMA P. Production of cellulase-free endoxylanase from novel alkalophilic thermotolerantBacilluspumilusby solid-state fermentation and its application in wastepaper recycling [J].BioresourTechnol, 2007,98(3): 485-490.
[10] WANG S L, YEN Y H, SHIH I L,etal. Production of xylanases from rice bran byStreptomycesactuosusA-151 [J].EnzymeMicrobTechnol, 2003,33(7): 917-925.
[11] NINAWE S, KAPOOR M, KUHAD R C. Purification and characterization of extracellular xylanase fromStreptomycescyaneusSN32 [J].BioresourTechnol, 2008,99(5): 1252-1258.
[12] DOBREVA G T, PISHTIYSKI I G, STANCHEV V S,etal. Optimization of nutrient medium containing agricultural wastes for xylanase production byAspergillusnigerB03 using optimal composite experimental design [J].BioresourTechnol, 2007,98(14): 2671-2678.
[13] YAN Q J, WANG L, JIANG Z Q,etal. A xylosetolerant β-xylosidase fromPaecilomycesthermophila: Characterization and its co-action with the endogenous xylanase [J].BioresourTechnol, 2008,99(13): 5402-5410.
[14] AZIN M, MORAVEJ R, ZAREH D. Production of xylanase byTrichodermalongibrachiatumon a mixture of wheat bran and wheat straw: Optimization of culture condition by Taguchi method [J].EnzymeMicrobTechnol, 2007,40(4/5): 801-805.
[15] LI X T, JIANG Z Q, LI L T,etal. Characterization of a cellulase-free, neutral xylanase fromThermomyceslanuginosusCBS 288.54 and its biobleaching effect on wheat straw pulp [J].BioresourTechnol, 2005,96(12): 1370-1379.
[16] FONSECA G G, HEINZLE E, WITTMANN C,etal. The yeastKluyveromycesmarxianusand its biotechnological potential [J].AppliedMicrobiologyandBiotechnology, 2008,79(3): 339-354.
[17] URIT T, LÖSER C, WUNDERLICH M,etal. Formation of ethyl acetate byKluyveromycesmarxianuson whey: Studies of the ester stripping [J].BioprocessBiosystEng, 2011,34(5): 547-559.
[18] LANE M M, MORRISSEY J P.Kluyveromycesmarxianus: A yeast emerging from its sister’s shadow [J].FungalBiolRev, 2010,24(1/2): 17-26.
[19] RODICIO R, HEINISCH J J. Yeast on the milky way: Genetics, physiology and biotechnology ofKluyveromyceslactis[J].Yeast, 2013,30(5): 165-177.
[20] PAL Y, KHUSHOO A, MUKHERJEE K J. Process optimization of constitutive human granulocyte-macrophage colony-stimulating factor(hGM-CSF) expression inPichiapastorisfed-batch culture [J].ApplMicrobiolBiotechnol, 2006,69(6): 650-657.
[21] GIBSON D G, YOUNG L, CHUANG R Y,etal. Enzymatic assembly of DNA molecules up to several hundred kilobases [J].NatureMethods, 2009,6,343-345.
[22] ADAMS A, GOTTSCHLING D E, KAISER C A,etal. Methods in yeast genetics: A cold spring harbor laboratory course manual [J].ColdSpringHarborLaboratoryCoursePress, 1994,8(24): 2939-3110.
[23] MILLER G L. Use of Dinitrosalicylic acid reagent for determination of reducing sugar [J].AnalChem, 1959,31(3): 426-428.
[24] 王晓丹,郭丽琼,赵力超,等.木聚糖酶酶活性测定方法及酶活性单位定义 [J].食品与发酵工业,2009(9): 128-131.
[25] YOU C, HUANG Q, XUE H,etal. Potential hydrophobic interaction between two cysteines in interior hydrophobic region improves thermostability of a family 11 xylanase fromNeocallimastixpatriciarum[J].BiotechBioeng, 2010,105(5): 861-870.
[26] DOHERTY A J, ASHFORD S R, BRANNIGAN J A. A superior host strain for the over-expression of cloned genes using the T7 promoter based vectors [J].NucleicAcidsRes, 1995,23(11): 2074-2075.
[27] CUDNA R E, DICKSON A J. Endoplasmic reticulum signaling as a determinant of recombinant protein expression [J].BiotechnologyandBioengineering, 2003,81(1): 56-65.
[28] WEN T, LIU F, HUO K,etal. Cloning and analysis of the inulinase gene fromKluyveromycescicerisporusCBS4857 [J].WorldJournalofMicrobiologyandBiotechnology, 2003,19(4): 423-426.
[29] ZHANG J, YUAN H, WEN T,etal. Cloning of theKcURA3 gene and development of a transformation system forKluyveromycescicerisporus[J].ApplMicrobiolBiotechnol, 2003,62(4): 387-391.
[30] KONDO K, MIURA Y, SONE H. High-level expression of a sweet protein, monellin, in the food yeastCandidautilis[J].NatBiotechnol, 1997,15(5): 453-457.
[31] CAI X P, ZHANG J, YUAN H Y,etal. Secretory expression of heterologous protein inKluyveromycescicerisporus[J].ApplMicrobiolBiotechnol, 2005,67(3): 364-369.
[32] WANG J, LI Y, LIU D. Improved production ofAspergillususamiiendo-β-1,4-Xylanase inPichiapastorisvia combined strategies [J].BiomedResInt, 2016,2016(2): 1-9.
[33] LI Y Y, ZHAONG K X, HU A H,etal. High-level expression and characterization of a thermostable xylanase mutant fromTrichodermareeseiinPichiapastoris[J].ProteinExprPurif, 2015,108: 90-96.
[34] FANG W, GAO H, CAO Y,etal. Cloning and expression of a xylanase xynB fromAspergillusnigerIA-001 inPichiapastoris[J].JBasicMicrobiol, 2014,54: 190-199.
[35] MURASUGI A, TOHMA-AIBA Y. Comparison of three signals for secretory expression of recombinant human midkine inPichiapastoris[J].BiosciBiotechnolBiochem, 2001,65(10): 2291-2293.
EffectofSignalPeptideonSecretoryExpressionofXylanaseinKluyveromycesmarxianus
WUYue1,2,ZHOUJungang1,2,LÜHong1,2
(1.StateKeyLaboratoryofGeneticEngineering,SchoolofLifeSciences,FudanUniversity,Shanghai, 200438,China;2.ShanghaiEngineeringResearchCenterofIndustrialMicroorganisms,Shanghai, 200438,China)
As a new type of non-conventional yeast,Kluyveromycesmarxianusis the fastest growing eukaryote with strong secretion and high safety. In yeast, secretory signal peptide plays an important role in mediating the heterologous proteins into the post-translational modifications, such as glycosylation, which is important for the synthesis of correctly folded and active form, and also to secrete them. In this study, we employed two secretory signal peptides, including α-Factor signal peptide fromSaccharomycescerevisiaeand inulinase signal peptide fromK.marxianus, to compare the secretion efficiency of the thermostable xylanase. The xylanase activity in the supernatant produced by the recombinant strains Fim-1/pUKD-Inu-xyn and Fim-1/pUKD-α-Factor-xyn was 318.91 U/mL and 117.90 U/mL, respectively, indicating that the secretion efficiency of inulinase signal peptide was higher than that of α-factor signal peptide. The optimum pH and temperature of xylanase was pH 5.5 and 65℃, respectively, and incubated at 75℃ for 1h, the residual activity was more than 73%. In a 5L fermentor, the expression level of xylanase reached 157757U/mL. Our results showed that theK.marxianusexpression system has a very broad application prospect in industrial enzyme field.
xylanase;Kluyveromycesmarxianus; signal peptide; high expression
0427-7104(2017)04-0446-09
2016-11-21
国家高技术研究发展计划项目(2013AA102803B,2014AA093511);上海市科委基地项目(13DZ2252000)
吴 玥(1991—),女,硕士研究生;吕 红,女,教授,通信联系人,E-mail: honglv@fudan.edu.cn.
Q36,Q814
A

