输血传播病毒PCR-DHPLC检测技术的建立及初步应用
, ,, , ,
·论著·
输血传播病毒PCR-DHPLC检测技术的建立及初步应用
杨春华,廖芸,罗秋红,孙思扬,夏彪,祝建新
目的应用聚合酶链式反应(PCR)结合变性高效液相色谱(DHPLC)技术检测输血传播病毒。方法根据输血传播病毒的核酸序列特点设计特异性引物进行PCR,将扩增产物进行DHPLC检测分析,以验证方法的灵敏度、特异性、重复性,同时进行临床检测的初步应用。结果以乙型肝炎病毒、丙型肝炎病毒、戊型肝炎病毒进行特异性试验,无交叉反应,具有较好的特异性;重复性良好;灵敏度可达1.0×101拷贝/反应。分别应用实时荧光PCR法、普通PCR法及本文所建立的PCR-DHPLC法同时检测32份血清样本,发现有17份样本实时荧光PCR阳性,17份样本PCR-DHPLC阳性,15份普通PCR阳性。结论本文建立的PCR-DHPLC法具有特异、敏感、重复性好等优点,可用于输血传播病毒感染的分子流行病学调查。
输血传播病毒;PCR-DHPLC;实时荧光PCR
Torque Teno virus首次发现于1997年,其存在于输血后感染肝炎(非甲-戊型)的病人血清中,因此该病毒被命名为输血传播病毒,曾一度被认为这是一种新型肝炎病毒,对人引起不同程度的肝损伤[1]。之后,各国科研人员陆续于在不同的哺乳动物体内发现该病毒[2],证实其是一种人兽共患病。输血传播病毒可通过多种途径传播,在人群中感染率较高,各国学者经过大量研究证明,输血传播病毒像戊型肝炎病毒一样呈全球流行分布[3]。该病毒确切的致病机理尚不明确,不过大部分研究认为其可能与肝脏疾病、肺部疾病及血液疾病相关[4]。
输血传播病毒是指环病毒科(Anelloviridae)的成员,无囊膜,是一种单股负链环状小DNA病毒,病毒粒子为二十面体,直径30~32 nm[1]。在氯化铯(CsCl)溶液、粪便、胆汁中的浮密度约为1.31~1.35 g/cm3,在蔗糖中的浮密度稍低,为1.26 g/mL[1-3]。基因组大小为2.8 kb~3.9 kb,基因组长度因病毒感染宿主不同而略有差异[5]。输血传播病毒变异率极高,无论是在核苷酸水平还是氨基酸水平,各毒株序列之间都有着广泛的多样性[6],但其非编码区的核酸序列却相对保守,这些特点给研究人员提供了检测该病毒并进行分型的可能性。
当前,对于病毒的检测应用较为广泛的有基于血清的酶联免疫吸附试验法(ELISA),基于核酸的PCR类方法。有研究人员根据输血病毒核酸片段进行克隆并原核表达蛋白建立ELISA方法,众所周知,ELISA简单、成本低,适合大规模样本检测,但灵敏度稍差。近年来应用越来越普遍的PCR类方法逐渐成为了病毒检测的主流技术。PCR方法因其具有快速、敏感、方便等优点,近年来发展较快,在各个领域都有着广泛的应用,但普通PCR存在着容易出现假阳性且极易产生交叉污染等弊端[7-8]。为解决这些弊端,研究人员建立了多重PCR技术、实时荧光定量PCR (Real time PCR),多重PCR技术是在同一反应体系中加入多对引物扩增多个基因片段,通过与标准重组质粒的对比对目的基因进行分型,从而达到检测的目的[7],但产物分析工作量大、耗时、耗力;在PCR技术基础上建立的实时荧光定量PCR技术,在普通PCR反应体系中引入一条带荧光标记的核酸探针,规避了PCR反应假阳性高的弊端,在实际工作中越来越广泛,但仍有一定的局限性,比如带荧光标记的探针成本高、保存时间有限等[8]。PCR结合变性高效液相色谱法是将PCR方法与变性高效液相色谱技术相结合产生的新型PCR类检测技术,其流程是将样品进行PCR扩增后,应用变性高效液相色谱进行扩增产物的分析,该方法能够识别具有个别核苷酸差别的核酸序列,从而快速识别病原。本研究通过对输血传播病毒核酸序列的精确分析,设计引物进行扩增,结合变性高效液相色谱技术检测扩增产物,分析方法的特异性、灵敏度,并与其他常规检测方法进行比对,建立了输血传播病毒的PCR-DHPLC检测新技术。
1 材料与方法
1.1样品 本实验室留存血清样本32份。
1.2 仪器和试剂
1.2.1主要仪器 全自动核酸抽提纯化仪(Mag NA LC2.0,瑞士Roche公司),基因扩增仪(Veriti,美国ABI公司),实时荧光定量PCR扩增仪(C1000TM,美国BioRad公司),变性高效液相色谱(简称DHPLC,美国Transgenomic公司),低温高速离心机。
1.2.2主要试剂 三乙胺乙酰盐(TEAA,色谱纯)购自Transgenomic公司,乙腈(色谱纯)购自Thermo Fisher公司;高保真KOD-plus-DNA聚合酶、Taq DNA聚合酶和dNTPs(东洋纺生物科技有限公司,上海);病毒总核酸提取试剂(Mag NA Pure LC总核酸分离试剂盒);DNA纯化回收试剂盒、限制性内切酶、T4 DNA连接酶、质粒小提试剂盒等购自宝生物工程(大连)有限公司。其它常规试剂均由本实验室提供。
1.2.3引物的设计与合成 运用Primer 5.0软件(加拿大Premier公司)分析输血传播病毒的核酸序列,并进行引物设计。上游引物为5′-GGTTCAGGAGGCTCAATTTGG-3′,下游引物为5′-TTTGAATTTAACGGTTTTCAGTCTTC-3′,预期片段大小为90 bp。
上述引物以及文中用于克隆及方法验证的引物均由生工(上海)有限公司合成。
1.3 试验方法
1.3.1病毒核酸的提取及质粒标准模板的制备 取经过实验室间验证的本实验室留存的阳性血清样本,用核酸抽提纯化系统提取总核酸,用50 μL无RNase水溶解,保存于-20 ℃冰箱备用。以提取的总核酸为模板,用引物对5′-ACCCAAATTGGAGATCAAGGTAT-3′和5′-TATCCGGTTTGCCTCGACTCTT-3′[10]进行第一轮扩增,目的片段1 563 bp,用引物对5′-CCACCAAATACCTACACGCAGTC-3′和5′-CCTTAGGGTTCCACG-CGCTAATG-3′[10]进行第二轮扩增,目的片段1 397 bp,将两轮扩增后的PCR产物构建重组质粒并进行PCR、酶切鉴定,经鉴定正确后送宝生物公司测序。
1.3.2检测用引物筛选与反应体系优化 从GenBank下载所有靶基因的序列,用Primer 5.0进行序列比对,基于TTV非编码区核酸序列保守的特点,在非编码区截取最一致的序列设计PCR-DHPLC检测用引物对N1和N2。调整引物浓度、引物用量、Taq酶、Mg2+浓度和退火温度等,摸索出PCR最佳反应条件和反应体系。
PCR反应体系(25 μL): 上下游引物(10 μmol/L)各1 μL、模板DNA 5 μL、DNTPs(10 mmol/L)2 μL、高保真KOD-plus-DNA聚合酶(5 U/μL)0.2 μL、10倍PCR缓冲液2 μL、加水25 μL。
PCR反应条件:94 ℃ 7 min;94 ℃ 30 s,53.5 ℃ 45 s,72 ℃ 30 s,40个循环;72 ℃ 10 min,反应结束后4 ℃保存反应产物。
1.3.3DHPLC分析条件 上样量:PCR产物3 μL;DHPLC缓冲液:缓冲液A为0.1% mmol/L TEAA;缓冲液B为0.1% mmol/L TEAA;流动相:缓冲溶液A浓度为 52.2%,缓冲溶液B浓度为 47.8%;流速:0.65 mL/min;色谱柱:C18 DNA色谱柱(4.6 mm×50 mm,粒度3 μm);柱温:52 ℃;检测器:荧光检测器(光源:150W Xenon 灯;激发谱带宽:15 nm;发射谱带宽:15.7 nm;检测灵敏度:波长350 nm积分3 s)。
1.3.4特异性试验 取本实验室留存的乙型肝炎病毒(HBV)、丙型肝炎病毒(HCV)、戊型肝炎病毒(HEV)阳性血清,用核酸抽提纯化系统提取总核酸,用50 μL无RNase水溶解,与1.3.1中制备的质粒标准品分别进行PCR-DHPLC检测,以PBS为阴性对照,进行PCR-DHPLC检测的特异性分析。
1.3.5重现性试验 取一个经PCR、实时荧光PCR、PCR-DHPLC分析均为阳性的血清样品,将该样品分成6份,分别提取病毒总核酸,按照1.3.2扩增条件和1.3.3分析条件进行试验,记录出峰时间及峰值,验证方法的重现性。
1.3.6灵敏度试验 将1.3.1中制备的质粒标准品进行10倍梯度稀释,按照1.3.2扩增条件和1.3.3分析条件进行试验,确定能够检测出的模板最低拷贝数。
1.3.7验证试验与应用 从本实验室留存的血清样本32个,用自动核酸提取仪器提取总核酸,应用Real-time PCR法[11]、普通PCR法[12]及本研究建立的PCR-DHPLC法同时检测,对比检测结果,分析方法之间的差异。
2 结 果
2.1特异性试验 取乙型肝炎病毒(HBV)、丙型肝炎病毒(HCV)、戊型肝炎病毒(HEV)核酸与1.3.1中制备的质粒标准品分别进行PCR扩增及DHPLC过柱分析,检测结果证明仅TTV结果为阳性,DHPLC分析中出现扩增吸收峰;HBV、HCV和HEV未在相应的位置出现扩增吸收峰,结果均为阴性,见图1。结果表明:本试验设计PCR-DHPLC检测引物可以特异性检测TTV,与乙HBV、HCV、HEV无交叉反应。

1. TTV 2-4. 乙型肝炎病毒、丙型肝炎病毒、戊型肝炎病毒1: TTV; 2-4: HBV, HCV, HEV图1 PCR-DHPLC检测TTV的特异性Fig.1 Specialty detection of PCR-DHPLC for TTV
2.2重现性试验 取一个经PCR、实时荧光PCR、PCR-DHPLC检测均为阳性的血清样品,分成6份,分别作为模板进行PCR-DHPLC,分析方法的重现性,结果见图2,在重复样品之间出峰时间和峰型基本重叠,阴性对照(PBS溶液)的检测结果为阴性。
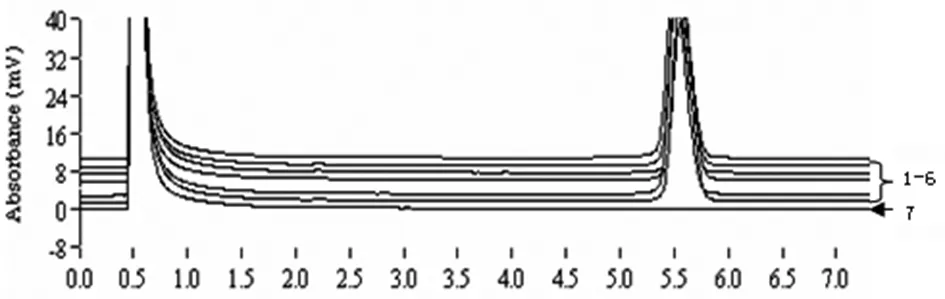
1-6. TTV 7. PBS1-6: TTV; 7: PBS图2 PCR-DHPLC检测 TTV的重现性Fig.2 Repeatability detection of PCR-DHPLC for TTV
2.3灵敏度试验 将1.3.1中制备的质粒模板进行10倍梯度稀释,稀释后浓度分别为1×107,1×106,1×105,1×104,1×103,1×102,1×101和1拷贝/μL,以此模板进行PCR-DHPLC。结果见表1,由表中可以看出,PCR-DHPLC检测输血传播病毒的灵敏度可达到10个拷贝/μL。
表2 质粒标准品PCR-DHPLC检测结果
Tab.2 Test results of plasmid standards by PCR-DHPLC

稀释梯度aDilutiongradienta检测结果Testresults第1梯度(1×107拷贝/μL)+第2梯度(1×106拷贝/μL)+第3梯度(1×105拷贝/μL)+第4梯度(1×104拷贝/μL)+第5梯度(1×103拷贝/μL)+第6梯度(1×102拷贝/μL)+第7梯度(1×101拷贝/μL)+第8梯度(1拷贝/μL)-
a:各个相邻梯度之间的稀释倍数为10。
Note:a,The dilution ratio between each successive gradient is 10
2.4验证试验与应用 将32份血清样本提取总核酸,用引物对5′-CGAATGGYWGAGTTTWYGCCGC-3′和5′-GCCCGAATTGCCCCTWGACTKCG-3′及探针FAM-CTCCGGCACCCGCCCAG-VIC进行实时荧光PCR[11]检测、用引物对5′-GTAAGTGCACTTCCGAATGGCTGAG-3′和5′-AGCCCGAATTGCCCCTTGAC-3′以及5′-AGTTTTCCACGCCCGTCCGCAGC-3′和 5′-GCCAGTCCC-GAGCCCGAATTGCC-3′进行常规PCR[12]检测,同时用本试验所建立的PCR-DHPLC法进行检测,试验设立阳性对照(以质粒标准品)和阴性对照各2份 (以PBS溶液),样品编号分别为P1、P2和N1、N2。试验结果如表3所示,常规PCR有15份样本为TTV核酸阳性;实时荧光PCR有17份样本TTV核酸阳性,PCR-DHPLC法检测结果与实时荧光PCR法结果一致。
表3 PCR-DHPLC方法与常规PCR、Real-time PCR方法比较
Tab.3 Comparison of the detected results of normal PCR, real-time PCR and PCR-DHPLC

样品Sample常规PCRNormalPCRReal⁃timePCRPCR⁃DHPLC样品Sample常规PCRNormalPCRReal⁃timePCRPCR⁃DHPLCP1+++N1---P2+++N2---1---17---2+++18+++3+++19+++4+++20+++5---21---6---22+++7-++23---8+++24---9---25---10---26---11---27-++12+++28+++13---29---14+++30+++15+++31---16+++32+++
注:“+”代表结果阳性,“-”代表结果阴性。
Note: “+” represents positive results, “-” represents negative results
3 讨 论
当前对于输血传播病毒的检测主要是基于血清学诊断方法和PCR技术。血清学诊断方法指利用抗原或抗体来进行检测的体外免疫反应。Catherine将TTV核酸序列的ORF1 C-末端序列进行原核表达构建重组蛋白,通过Western和ELISA来检测人血清中的TTV抗体[13]。随后,有学者将输血传播病毒核酸序列ORF2的部分区域进行原核表达构建重组蛋白,并以此作为抗原,建立了酶联免疫吸附试验(ELISA)检测方法[7],方法简便,但TTV的基因群和基因型众多,各型之间交叉反应严重,使得ELISA未能在医学检验中大范围应用。
PCR是分子生物学中的一种常见技术,在医学检验中应用很广,尤其是在感染性疾病中病原的检验。变性高效液相色谱(DHPLC)是将单链构象多态性和变性梯度凝胶电泳相结合的基础上发展而来的杂合双链检测技术,利用离子对反相液相色谱进行核酸片段的分离及分析,可检测单碱基替代及小片段核苷酸的插入或缺失。在传染病病原的检验中,利用DHPLC技术的这一特点, 与PCR技术相结合应用,达到快速检测的目的,PCR-DHPLC可同时检测上百个样品,可实现高通量检测,是一种对致病微生物检测的有效方法,并且已经在快速检验中应用。目前, 国内已建立了多种病原微生物的PCR-DHPLC检测技术,如猪繁殖与呼吸综合征病毒[17]、克雷伯氏菌[18]、阪崎肠杆菌等[19]。本研究应用PCR-DHPLC技术检测TTV,要同时考虑PCR和DHPLC两者对检测效果的影响。而其中应用PCR检测TTV成功的关键因素是引物的设计和样品的处理。本研究在进行引物设计时考虑到TTV具有高度基因变异性的特点[14],未选择以前研究人员经常选用的ORF1的N22区,而是选择ORF2上游核酸序列保守区,该区域可以检测TTV的不同基因群和基因型[15-16]。同时考虑到血清样本中含有大量的杂蛋白和其他物种DNA,采用基于磁珠吸附原理的自动核酸提取设备提取核酸,从试验结果来看,有效保证了样品核酸的纯度。DHPLC对检测的影响因素主要是过柱条件的摸索,本研究通过大量的试验最后获得了最佳条件。
本研究针对输血传播病毒建立了特异、灵敏、高通量的PCR-DHPLC检测方法,为该病毒的快速诊断奠定基础。将该方法初步用于临床样本的检测中,其灵敏度与Real-time PCR相当,低达10个拷贝/μL,而且能够检测出常规PCR检测不出的样本。同时,PCR-DHPLC法可以自动取样,检测每个样品只需要8 min左右。DHPLC与其他检测DNA突变方法最大不同在于,它能够纯化DNA片断。利用本研究建立的PCR-DHPLC检测方法,可用于输血传播病毒的流行病学调查,同时也为该病毒在人体内的感染及分布等相关研究提供了新的技术手段。
[1] Nishizawa T, Okamoto H, Konishi K, et al. A novel DNA virus (TTV) associated with elevated transaminase levels in posttransfusion hepatitis of unknown etiology[J]. Biochem Biophys Res Communi, 1997, 241: 92-97. DOI:10.1006/bbrc.1997.7765
[2] Zhuang H. Research status and prospect of TT virus [J].Chin J Inter Med,1999,38(11):727-728.(in Chinese)
庄辉.TT病毒的研究现状及展望 [J].中华内科杂志,1999,38(11):727-728.
[3] Okamoto H, Takahashi M, Nishizawa T, et al. Genomic characterization of TT viruses (TTVs) in pigs, cats and dogs and their relatedness with species-specific TTVs in primates and tupaias[J]. J Genomic Virol, 2002, 83: 1291-1297. DOI: 10.1099/0022-1317-83-6-1291
[4] Zheng H, Ye L, Fang X, et al. Torque teno virus (SANBAN isolate) ORF2 protein suppresses NF-kappa B pathways via interaction with IkappaB kinases[J]. J Virol, 2007, 81: 1917-11924. DOI: 10.1128/JVI.01101-07
[5] Biaqini P. Classification of TTV and related viruses (Anelloviruses)[J]. Curr Topics Microbiol Immunol, 2009, 331: 21-33
[6] Okamoto H, Nishizawa T, Ukita M. A novel unenveloped DNA virus (TT virus) associated with acute and chronic non-A to G hepatitis.[J]. Intervirology,1999, 42(2-3):196-204. DOI: 24961
[7] Li Y, Xiao J. Research progress of TTV detection methods[J]. Chongqing Med, 2006, 35(18):1718-1720.(in Chinese)
李阳,肖洁. TTV 检测方法研究进展 [J].重庆医学, 2006, 35(18):1718-1720.
[8] Yang CH, Sun SY,Sun J, et al.Development and application of real-time PCR for detection of the Torque teno sus virus[J].Chin J Vet Sci,2017, 37(6): 999-1006. (in Chinese)
杨春华,孙思扬,孙洁,等.猪细环病毒实时荧光PCR检测技术的建立及应用 [J]. 中国兽医科学, 2017, 37(6): 999-1006.
[9] Kekarainen T, Lopezsoria S, Segale J. Detection of swine Torque teno virus genogroups 1 and 2 in boar sera and semen[J]. Theriogenology, 2007, 68: 966-971. DOI: 10.1016/j.theriogenology.2007.07.010
[10] Wang MM, Zhou YJ, Chen ZY, et al. Identification and survey of torque teno virus in pigs in china[J]. Chin J Prevent Vet Med, 2009, 31 (10): 751-755.(in Chinese)
王礞礞, 周艳君, 陈宗艳,等. 我国猪群中TTV 的鉴定及其分子流行病学分析[J]. 中国预防兽医学报, 2009, 31 (10): 751-755.
[11] Brassard J, Gagen M J, Houde A, et al. Development of a real-time TaqMan PCR assay for the detection of porcine and bovine Torque teno virus[J]. J Appl Microbiol, 2010, 108: 2191-2198. DOI: 10.1111/j.1365-2672.2009.04624.x
[12] Okamoto H, Takahashi M, Nishizawa T, et al. Marked genomic heterogeneity and frequent mixed infection of TT virus demonstrated by PCR with primers from coding and noncoding regions[J]. Virology, 1999, 259(2): 428-436. DOI: 10.1006/viro.1999.9770
[13] Ott C, Duret L, Chemin I, et al. Use of a TT virus ORF1 recombinant protein to detect anti-TT virus antibodies in human sera[J]. J General Virol, 2000, 81: 2949-2953. DOI: 10.1099/0022-1317-81-12-2949
[14] Vignolini T, Macera L, Antonelli G, et al. Investigation on torquetenovirus (TTV) microRNA transcriptomeinvivo[J]. Virus Res, 2016, 124: 3457-3463. DOI: 10.1016/j.virusres.2016.03.003
[15] Focosi D, Antonelli G, Pistello M, et al. Torquetenovirus: the human virome from bench to bedside[J]. Clin Microbiol Infect, 2016, 22(7): 589-593. DOI: 10.1016/j.cmi.2016.04.007
[16] Haloschan M, Bettesch R, Görzer I, et al. TTV DNA plasma load and its association with age, gender, and HCMV IgG serostatus in healthy adults[J]. Age (Dordr),2014, 36(5):9716-9723. DOI: 10.1007/s11357-014-9716-2[17] Yang CH,Zhu JX, Zhong Y, et al.Development and application of PCR-DHPLC assays for detection of the porcine reproductive and respiratory syndrome virus[J].Chin J Vet Sci,2012,32(2):167-171. (in Chinese)
杨春华, 祝建新, 钟毅, 等. 猪繁殖与呼吸综合征病毒PCR-DHPLC检测新技术的建立及应用[J].中国兽医学报,2012, 32(2):167-171.
[18] Yang CH, Cao JJ, Zhong Y, et al.Construction of identification ofKlebsiellapneumoniaein milk and diary product with PCR-DHPLC[J]. Microbiol Chin, 2010,37(12):1805-1810. (in Chinese)
杨春华, 曹际娟, 钟毅, 等. 乳及乳制品中肺炎克雷伯氏菌PCR-DHPLC检测新技术的建立[J]. 微生物学通报, 2010,37(12):1805-1810.
[19] Yang CH, Cao JJ, Gui JX, et al. Construction of identification ofEnterobactersakazakiiin milk and diary product with PCR-DHPLC[J]. Microbiol Chin, 2008, 35 (11): 1845-1849. (in Chinese)
杨春华, 曹际娟, 桂家祥, 等. 乳及乳制品中阪崎肠杆菌PCR-DHPLC检测新技术的建立[J]. 微生物学通报, 2008, 35 (11): 1845-1849.
DevelopmentandpreliminaryapplicationofPCR-DHPLCassaysfordetectionoftheTorqueTenovirus
YANG Chun-hua,LIAO Yun,LUO Qiu-hong,SUN Si-yang,XIA Biao,ZHU Jian-xin
(JiangxiEntry-ExitInspectionamp;QuarantineBureau,Nanchang330002,China)
In order to identify the Torque Teno virus (TT virus), a PCR-DHPLC assay was performed in this study. Primers specific were selected according to the characteristics of TT virus nucleic acid sequence to conduct PCR, and PCR products assayed by DHPLC. We analyzed the sensitivity, specificity, repeatability of PCR-DHPLC and applied it preliminarily on clinical detection. The specific testing was performed with TTV, HBV, HCV and HEV, no cross reaction were found, and the PCR-DHPLC assays we developed had good specification and nice repeatability. Sensitivity analysis showed that the developed PCR-DHPLC assays could detect 1.0×101copy/μL. Then we detected 32 serum samples by this method, real-time PCR and normal PCR at same time. The results showed that 17 TTV positives results could be observed by PCR-DHPLC for 32 samples, it is consistent with real-time PCR test results and 15 positive by normal RT-PCR. PCR-DHPLC assays showed nice specification, sensitivity, repeatability, and could be used in epidemiological investigation.
Torque Teno virus; DHPLC; real-time PCR
10.3969/j.issn.1002-2694.2017.11.006
江西省科技计划项目(No.20151BBF60048)资助
中华人民共和国江西出入境检验检疫局,南昌 330038
Email: ellenyung@foxmail.com
R373.2
A
1002-2694(2017)11-0979-05
Supported by the Jiangxi Science and Technology Project(No.20151BBF60048)
2017-05-12编辑王晓欢

