多房棘球蚴LDH基因的克隆表达及免疫原性研究
,,,,
·论著·
多房棘球蚴LDH基因的克隆表达及免疫原性研究
何顺伟1,李洪清2,李晓燕2,赵瑞雪2,魏晓星1
目的克隆表达青海省多房棘球蚴(Echinococcusmultilocularis, Em)乳酸脱氢酶(lactatedehydrogenase, LDH)基因,鉴定EmLDH重组蛋白的免疫原性,初步评价其免疫诊断价值。方法采用RT-PCR方法克隆EmLDH基因,将其连接入pET15b表达载体中,构建重组表达质粒pET15b-EmLDH,转化至E.coliRosetta(DE3)感受态细胞进行诱导表达。通过SDS-PAGE检测重组蛋白的表达形式,Ni-IDA 树脂亲和层析纯化重组蛋白。通过Western blotting法鉴定EmLDH重组蛋白的免疫原性,ELISA法检测泡型包虫病患者(57例)、囊型包虫病患者(33例)和正常人(50例)血清,初步评价EmLDH重组蛋白的免疫诊断效果。结果成功克隆了EmLDH基因并表达纯化出相应的重组蛋白。Western blotting结果显示,EmLDH重组蛋白可被泡型和囊型包虫病患者血清识别,而不被正常人血清识别。ELISA结果显示,EmLDH重组蛋白对泡型和囊型包虫病患者血清的诊断敏感性分别为84.21%和84.85%。结论EmLDH重组蛋白具有较高的免疫原性,对包虫病具有较好的免疫诊断价值。
多房棘球蚴;LDH基因;克隆;表达;免疫原性
多房棘球绦虫是一种可引起人兽共患病的寄生虫,集中分布于北半球高纬度地区[1]。由其幼虫侵染机体引起的泡型包虫病对人体健康和畜牧业发展危害极大,是许多国家和地区严重的公共卫生问题之一[2-3]。快速灵敏的诊断方法对该病的防治十分重要。免疫诊断是包虫病临床诊断研究的一项重要内容,选择适宜的特异性抗原是决定包虫病免疫诊断准确性的关键[4-5]。目前,利用基因工程技术筛选和鉴定棘球蚴特异性抗原是包虫病免疫诊断研究的主要方向[6-8]。本研究以青海省多房棘球蚴原头节cDNA为模板克隆EmLDH基因,表达纯化EmLDH重组蛋白,通过Western blotting法鉴定该蛋白的免疫原性和ELISA法初步评价其免疫诊断价值,为后续基于EmLDH蛋白的包虫病免疫诊断的研究奠定基础。
1 材料与方法
1.1 材料
1.1.1标本来源Em原头节取自青海西宁地区经感染Em的小鼠完整包囊,无菌条件下抽吸囊液,分离原头节,PBS缓冲液清洗干净后于-80 ℃保存。泡型包虫病患者血清(57例)和囊型包虫病患者血清(33例)取自青海省各大医院。所有患者均经快速免疫诊断试剂盒及影像学诊断确诊或手术确诊。正常人血清(50例)取自医院健康体检者。
1.1.2主要试剂 2×Taq PCR MasterMix、D2000 DNA Marker、TIANScript RT Kit、6×DNA loading buffer、普通琼脂糖凝胶DNA回收试剂盒、pGM-T连接试剂盒、DH5α感受态细胞、快速质粒小提试剂盒、GeneGreen核酸染料均购自北京天根公司。TRIzol○RLS Reagent、SDS-PAGE凝胶制备试剂盒、辣根过氧化物酶标记(HRP)的羊抗人IgG(HRP-IgG)、DAB底物显色液试剂盒、ELISA终止液、ELISA包被液(1×)、1×PBST、抗体稀释液(普通型)、单组分TMB显色液、5% BSA封闭液、Difco Skim Milk脱脂奶粉均购自上海索莱宝公司;pET15b原核表达载体、Rosetta(DE3)感受态细胞、非预染蛋白marker、包涵体溶解液、5×protein loading buffer、PVDF膜、Ni-IDA琼脂糖蛋白纯化试剂盒均购自上海生工公司。NdeI/XhoI限制性内切酶、考马斯亮蓝染色试剂盒(常规法)均购自碧云天生物科技研究所。
1.2 方法
1.2.1目的基因克隆和测序 参照GenBank上公布的细粒棘球蚴EgLDH基因(GenBank:No.HM748917.1)设计引物,其中上游引物序列为:5′-CGCCATATGTCTGTGGAGGGGTTGTTG-3′,下游引物序列为:5′-CCGCTCGAGTCACCACTTGATGCCTGCGATAATC-3′(下划线部分为NdeI/XhoI酶切位点,两端为保护性碱基),扩增片段大小为996 bp,由上海生工公司合成。
使用TRIzol法提取原头节总RNA,按TIANScript RT Kit操作说明反转录成cDNA,并以此为模板进行PCR扩增。扩增体系(20 μL):上、下游引物(10 μmol/L)及cDNA 模板各1 μL,2×Taq PCR MasterMix 10 μL,ddH2O 7 μL。扩增条件:94 ℃预变性5 min;94 ℃变性30 s,63 ℃退火 30 s,72 ℃延伸1 min,35个循环;72 ℃终延伸10 min。PCR产物于1%琼脂糖凝胶电泳检测后回收。随后将目的片段与pGM-T载体连接,转化入DH5α感受态细胞,涂布于含氨苄青霉素的LB平板上37 ℃过夜培养。挑取单克隆经双酶切及菌液PCR鉴定正确后,将阳性菌液送上海生工公司测序。
1.2.2重组质粒的构建和鉴定 将回收纯化的EmLDH基因的PCR产物同pET15b表达载体分别用NdeI和XhoI双酶切,电泳检测酶切产物并切胶回收目的基因片段和线性化的表达载体。将回收产物连接构建重组表达载体pET15b-EmLDH,转化至E.coliRosetta (DE3) 感受态细胞中,涂布于含氨苄青霉素(50 μg/mL)和氯霉素(34 μg/mL)的LB平板上37 ℃培养过夜。挑取单克隆经双酶切及质粒PCR鉴定正确后送测序。
1.2.3重组蛋白的表达和纯化 将重组菌按1∶100的比例接种到含氨苄青霉素和氯霉素的5 mL LB液体培养基中37 ℃振荡培养。当菌液吸光度OD600值达0.6时,加入终浓度为0.5 mmol/L的IPTG,分别于20 ℃诱导过夜,37 ℃诱导4 h。吸取1 mL菌液8 000 r/min离心收集菌体,加入500 μL PBS缓冲液悬浮菌体,超声破碎,12 000 r/min离心分别收集上清和沉淀,沉淀用500 μL包涵体溶解液溶解。分别从各组中取40 μL样品和10 μL 5×protein loading buffer混匀,沸水浴10 min,取10 μL混合液进行SDS-PAGE电泳,浓缩胶浓度为5%,分离胶浓度为12%,初步确定蛋白表达形式。
大量诱导重组表达菌株,将重组菌液按1∶100的比例接种到含氨苄青霉素和氯霉素的3 L LB液体培养基中,37 ℃振荡培养。当菌液吸光度OD600值达0.6时,加入终浓度为0.5 mmol/L的IPTG,20 ℃诱导过夜。8 000 r/min离心收集菌体。加入1 mL PBS缓冲液悬浮菌体,冰浴中超声破碎菌体,12 000 r/min 4 ℃离心收集上清进行纯化目的蛋白。按照Ni-IDA琼脂糖树脂的操作说明纯化收集重组蛋白,用SDS-PAGE进行检测。
1.2.4重组蛋白的Western Blotting分析 将纯化的EmLDH重组蛋白经SDS-PAGE电泳分离后,电转移至PVDF膜上。将膜剪成条状浸泡于5%脱脂奶粉溶液37 ℃封闭2 h,PBST溶液洗膜3次,5 min/次。分别与多房棘球蚴病患者、细粒棘球蚴病患者和健康人血清(1∶200)结合反应,4 ℃过夜。次日PBST溶液洗膜3次,5 min/次,加入羊抗人IgG-HRP(1∶1 500)抗体37 ℃摇床孵育2 h。PBST溶液洗膜3次,10 min/次,加入新配制的DAB溶液37 ℃显色5 min,加入蒸馏水终止反应。
1.2.5重组蛋白的ELISA检测 使用ELISA法检测收集的57例泡型包虫病患者血清、33例囊型包虫病患者血清和50例正常人血清。用纯化的EmLDH重组蛋白(10 μg/mL)包被酶标板,100 μL/孔,4 ℃过夜。次日,PBST溶液洗板3次,加封闭液100 μL/孔,37 ℃封闭1 h。PBST溶液洗板3次,加血清(1∶100),100 μL/孔,37 ℃温育2 h。PBST溶液洗板3次,加羊抗人IgG-HRP(1∶1 000),100 μL/孔,37 ℃温育2 h。PBST溶液洗板3次,加TMB显色液,100 μL/孔,37 ℃避光显色15 min。加终止液,450 μL/孔,终止反应,置酶标仪测定吸光度(A490)值。以50例正常人血清的吸光度均值+2倍标准差作为阳性判断值。应用SPSS 11.0软件对实验结果进行整理和统计分析。
2 结 果
2.1目的基因的克隆和测序 PCR产物经电泳检测后出现目的条带,与预期片段大小相符(图1)。将测序结果输入到GenBank进行Blast比对,与EgLDH基因(GenBank:No.HM748917.1)同源性为99%,确定扩增产物为EmLDH基因。
2.2重组质粒的构建和鉴定 构建的重组质粒pET15b-EmLDH经NdeI和XhoI双酶切鉴定后,进行电泳检测出现清晰的酶切片段(图2)。测序比对后确定插入片段为目的基因,表达载体构建正确。
2.3重组蛋白的表达和纯化 SDS-PAGE电泳检测蛋白表达结果显示(图3),EmLDH原核表达载体在大肠杆菌中正确表达出目的蛋白,且EmLDH重组蛋白在上清和沉淀中均有表达。镍柱纯化后的目的蛋白经电泳检测显示(图4),条带单一,清晰明亮。
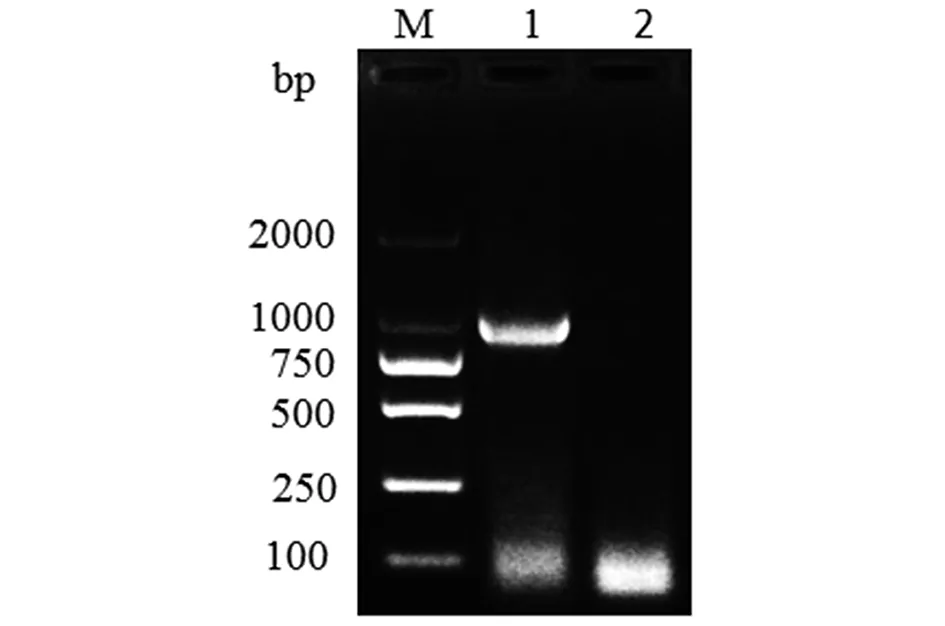
M:DNA标志物(D2000);1:目的条带 2:阴性对照M:DNA marker(D2000); 1: Target band 2: Negative control图1 EmLDH基因的PCR扩增Fig.1 PCR amplication of EmLDH gene
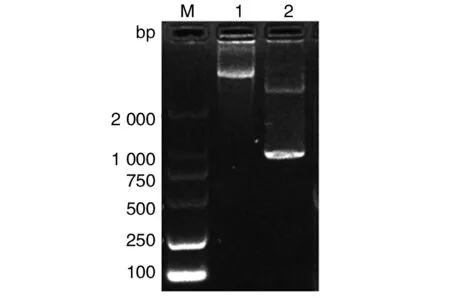
M:DNA标志物(D2000);1:未酶切重组质粒2:重组质粒双酶切M:DNA marker (D2000); 1: recombinant pET15b-EmLDH plasmid 2: recombinant pET15b-EmLDH plasmid digested by NdeI and XhoI图2 重组质粒pET15b-EmLDH的酶切鉴定Fig.2 Identification of the pET15b-EmLDH plasmid by digestion with restriction enzymes
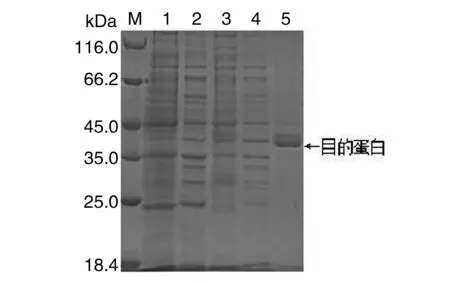
M:蛋白标志物;1:诱导前菌体总蛋白;2:20 ℃沉淀;3:20 ℃上清;4:37 ℃沉淀;5:37 ℃上清M: Protein marker; 1:Total bacteria protein before induction; 2: 20 ℃ Precipitation;3: 20 ℃ Supernatant; 4: 37 ℃ Precipitation; 5: 37 ℃ Supernatant图3 EmLDH表达产物的SDS-PAGE分析Fig.3 SDS-PAGE analysis of the expression product from EmLDH
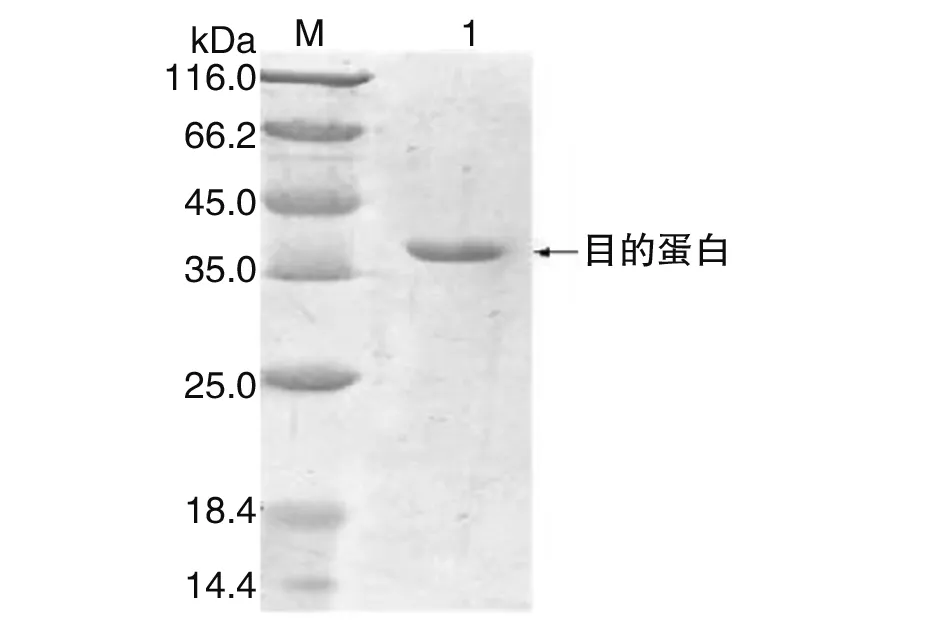
M:蛋白质标志物;1:纯化的EmLDH重组蛋白M: Protein Marker; 1: Purified EmLDH recombinant protein图4 纯化的EmLDH重组蛋白的SDS-PAGE分析Fig.4 SDS-PAGE analysis of the purified EmLDH recombinant protein
2.4重组蛋白的Western Blotting分析 Western Blotting结果表明(图5),纯化的EmLDH重组蛋白能被泡型包虫病患者和囊型包虫病患者血清特异性识别,在约38 kDa处出现深色显色带,与正常人血清无反应。

M:蛋白质标志物;1:泡型包虫病患者血清;2:囊型包虫病患者血清;3:正常人血清M:Protein Marker;1:Serum samples from alveolar echinococlosis patients;2:Serum samples from cystic echinococcosis patients; 3: Serum samples from healthy persons图5 纯化的EmLDH重组蛋白的Western Blotting分析Fig.5 Western Blotting analysis of the purified EmLDH recombinan protein
2.5重组蛋白的ELISA检测 ELISA检测结果显示(表1),EmLDH重组蛋白对泡型包虫病和囊型包虫病患者血清的诊断敏感性分别为84.21%(41/57)和84.85%(28/33)。
表1 EmLDH重组蛋白的ELISA检测结果
Tab.1 ELISA detection result of EmLDH recombinant protein

检测病例Cases例数No.ofcases阳性数No.ofpositive阳性率/%Positiverate/%多房棘球蚴病患者Alveolarechinococcosis574184.21细粒棘球蚴病患者Cysticechinococcosis332884.85正常人Healthypersons5000
3 讨 论
多数寄生虫在宿主体内主要是通过无氧糖酵解途径来获取能量。作为糖酵解途径的末端酶,LDH对寄生虫的生存至关重要,尤其是寄生在宿主肠道部位的寄生虫,LDH的表达量升高,经常被认为是抗虫药物良好的的作用靶点[9-11]。众多研究表明,LDH同样是寄生虫病的潜在诊断抗原分子。李雪峰等[12]使用OptiMal-IT金标层析快速检测试剂盒评估疟原虫乳酸脱氢酶Mab的特异性和敏感性,发现该试剂盒在疟疾诊断和鉴别诊断中具有快速、简便、特异性强、敏感性高的特点,可用于疟疾的快速诊断。吕刚等[13]通过对日本血吸虫SjLDH基因进行克隆表达和生物活性鉴定,发现SjLDH重组蛋白具有较强的免疫活性和酶活性。黄江等[14]通过对牛带绦虫亚洲亚种成虫LDH基因进行克隆表达和免疫原性分析发现,TaLDH重组蛋白能和受感染的猪血清和患者血清发生免疫反应,认为TaLDH蛋白可能是免疫诊断分子。杜武英等[15]通过对猪带绦虫LDH基因进行克隆表达和免疫原性分析发现,TsLDHA能够识别被重组蛋白免疫的SD大鼠血清、感染猪带绦虫的病人血清和猪血清,提示该蛋白具有较好的免疫原性和免疫反应性,是潜在的诊断抗原。2010年,Lu等[16]通过细粒棘球绦虫EgLDH基因进行克隆,发现EgLDH基因全长1 233 bp,包含996 bp的开放阅读框,编码331个氨基酸;生物信息学预测显示该蛋白包含3个跨膜域和4个主要的抗原表位,提示EgLDH为抗原蛋白,具有一定的免疫原性。
本研究从多房棘球蚴原头节中扩增出了EmLDH基因完整的编码区序列,同EgLDH基因进行同源性比对发现相似度达99%。通过原核表达和镍柱层析我们获得了纯化的EmLDH重组蛋白。Western blotting结果显示,泡型和囊型包虫病患者血清可与纯化的EmLDH重组蛋白发生特异性结合,而与正常人血清无反应,表明人体感染多房棘球蚴和细粒棘球蚴后,血清中产生了LDH蛋白的抗体,EmLDH蛋白具有良好的免疫原性,为抗原蛋白。ELISA结果显示,EmLDH重组蛋白不仅与泡型包虫病患者血清发生反应,也能识别囊型包虫病患者血清,并且两者诊断敏感性相当。EmLDH蛋白不能单独对两型包虫病进行区分,但可与其它多房棘球蚴特异性抗原联合应用来对两型包虫病进行鉴别诊断。此外,EmLDH蛋白同血吸虫病、猪肉绦虫病和弓形虫病等患者血清之间是否存在交叉反应,以及EmLDH蛋白作为多房棘球蚴有效抗原的基本条件和诱导宿主产生的特异性免疫应答,仍需要进一步实验证实。
本次研究表明多房棘球蚴LDH蛋白具有良好的免疫原性和潜在的免疫诊断价值,为后续多房棘球蚴LDH蛋白的免疫原性研究和应用提供基础资料。
[1] Deplazes P, Rinaldi L, Alvarez Rojas CA, et al. Global distribution of alveolar and cystic echinococcosis[J]. Adv Parasitol, 2017, 95: 315-493. DOI: 10.1016/bs.apar.2016.11.001
[2] Lass A, Szostakowska B, Myjak P, et al. Fresh fruits, vegetables and mushrooms as transmission vehicles forEchinococcusmultilocularisin highly endemic areas of Poland: reply to concerns[J]. Parasitol Res, 2016, 115(9): 3637-3642. DOI: 10.1007/s00436-016-5149-4
[3] Vuitton DA, Demonmerot F, Knapp J, et al. Clinical epidemiology of human AE in Europe[J]. Vet Parasitol, 2015, 213(3-4): 110-120. DOI: 10.1016/j.vetpar.2015.07.036
[4] Zhao L, Zhang X, Zhang ZZ, et al. Advances in diagnostic techniques and vaccine prevention of hydatid disease[J]. Bull Dis Control Prev, 2013, 28(2): 84-87. (in Chinese)
赵莉, 张旭, 张状志, 等. 包虫病诊断技术与预防疫苗的研究进展[J]. 疾病预防控制通报, 2013, 28(2): 84-87.
[5] Cai HX, Guan YY, Wu WP. Advances in research on diagnosis of alveolar echinococcosis[J]. J Pathog Biol, 2012, 7(4): 311-315. (in Chinese)
蔡辉霞,官亚宜,伍卫平. 多房棘球蚴病诊断研究进展[J]. 中国病原生物学杂志, 2012, 7(4): 311-315.
[6] Wang CY. Study on recombinant antigen ofEchinococcusmultilocularis[J]. Parasit Dis (Foreign Medical Sci), 2001, (6): 247-251. (in Chinese)
王昌源. 多房棘球绦虫重组抗原研究[J]. 国外医学(寄生虫病分册), 2001, (6): 247-251.
[7] Nunnari G, Pinzone MR, Gruttadauria S, et al. Hepatic echinococcosis: clinical and therapeutic aspects[J]. World J Gastroenterol, 2012, 18(13): 1448-1458. DOI: 10.3748/wjg.v18.i13.1448
[8] Maimantiyiming GLPL, Mamuti WLM. Advances in research on antigens for use in serodiagnosis of echinococcosis[J].J Pathol Biol, 2011, 6(4): 297-300, 314. (in Chinese)
古力帕丽·麦曼提依明, 吾拉木·马木提. 包虫病血清学诊断抗原研究进展[J]. 中国病原生物学杂志, 2011, 6(4): 297-300+314.
[9] Camemn A, Read J, Tranter R, et al. Identification and activity of a series of azole-based compounds with lactate dehydrogenase directed anti-malarial activity[J]. J Biol Chem, 2004, 279: 31429-31439. DOI: 10.1074/jbc.M402433200
[10] Conners R, Schambach F, Read J, et al. Mapping the binding site for gossypol-like inhibitors ofPlasmodiumfalciparumlactate dehydrogenase[J]. Mol Biochem Parasitol, 2005, 142: 137-148. DOI: 10.1016/j.molbiopara.2005.03.015
[11] Lu G, Hu XC, Huang C, et al. The effect of gossypol, praziquantel and artemether onrecombinant lactate dehydrogenase fromSchistosomajaponicum[J]. Chin J Parasitol Parasit Dis, 2007, 25(5): 401-405. (in Chinese)
吕刚, 胡旭初, 黄灿, 等. 棉子酚、吡喹酮、蒿甲醚对重组日本血吸虫乳酸脱氢酶的作用[J]. 中国寄生虫学与寄生虫病杂志, 2007, 25(5): 401-405.
[12] Li XF, Hung KS, Zhu YY, et al. Application of monoclonal antibody to lactate dehydrogenase ofPlasmodiumspp in diagnosis of malaria and assessment of therapeutic effect[J]. Chin Trop Med, 2006, 6(10): 1743-1744,1749. (in Chinese)
李雪峰, 黄科生, 朱燕燕, 等. 疟原虫乳酸脱氢酶Mab在疟疾诊断和疗效考核上的应用[J]. 中国热带医学, 2006, 6(10): 1743-1744,1749.
[13] Lu G, Hu XC, Huang C, et al. Prokaryotic expression, purification and identification of lactate dehydrogenase fromSchistosomejaponicum[J]. Chin J Public Health, 2007, 23(10): 1242-1244. (in Chinese)
吕刚, 胡旭初, 黄灿, 等. 日本血吸虫乳酸脱氢酶原核表达、纯化及鉴定[J]. 中国公共卫生, 2007, 23(10): 1242-1244.
[14] Huang J, Hu XC, Wu X, et al. Cloning and prokaryotic expression of malate dehydrogenase gene of taenia saginata asiatica and immunogenicity analysis of the recombinant protein[J]. Chin J Parasitol Parasit Dis, 2008, 26(4): 268-271. (in Chinese)
黄江, 胡旭初, 吴璇, 等. 牛带绦虫亚洲亚种乳酸脱氢酶基因的克隆表达及免疫原性分析[J]. 中国寄生虫学与寄生虫病杂志, 2008, 26(4): 268-271.
[15] Du WY, Huang J, Hu XC, et al. Sequence analysis, cloning expression and immunogenicity analysis of lactate dehydrogenase gene fromTaeniasolium[J]. Chin J Zoonoses, 2010, 26(3): 246-251. (in Chinese)
杜武英, 黄江, 胡旭初, 等. 猪带绦虫乳酸脱氢酶基因的序列分析、克隆表达和免疫学分析[J]. 中国人兽共患病学报, 2010, 26(3): 246-251.
[16] Lu G, Lu Y, Li L, et al. Identification and bioinformatics analysis of lactate dehydrogenase genes fromEchinococcusgranulosus[J]. Asian Pacific J Trop Med, 2010, 3(10): 757-761.
CloningandprokaryoticexpressionofLDHgeneinEchinococcusmultilocularisandimmunogenicityresearchoftherecombinantprotein
HE Shun-wei1, LI Hong-qing2, LI Xiao-yan2, ZHAO Rui-xue2, WEI Xiao-xing1
(1.DepartmentofEcologically-environmentEngineering,QinghaiUniversity,Xininig810016,China;2.TheAffiliatedHospitalofQinghaiUniversity,Xininig810016,China)
The present study aimed to clone and express the EmLDH gene ofEchinococcusmultilocularisin Qinghai Province, identifying immunogenicity of EmLDH recombinant protein and evaluating its immune diagnostic value preliminarily. EmLDH genes were cloned by RT-PCR technology and linked into pET15b vector. Recombinant expression pET15b-EmLDH vectors were constructed and transformed intoE.coliRosetta (DE3) competent cells. Recombinant proteins were induced and expressed. Expression forms of recombinant proteins were detected by SDS-PAGE. Recombinant proteins were purified by affinity chromatography of Ni-IDA resin. Immunogenicity of recombinant proteins was identified by Western blotting. Serum samples from patients with alveolar echinococcosis (57 cases), cystic echinococcosis (33 cases), and healthy persons (50 cases) were examined by ELISA, which evaluated preliminarily immune diagnosis effect of EmLDH recombinant proteins. Results showed that EmLDH gene was cloned successfully and the recombinant proteins were expressed and purified. Results of Western blotting showed EmLDH recombinant proteins were recognised by serum samples from patients with alveolar echinococcosis and cystic echinococcosis, but not by serum samples from healthy persons. Results of ELISA showed that diagnostic sensitivities of EmLDH recombinant protein reacted with serum samples from patients with alveolar echinococcosis and cystic echinococcosis were 84.21% and 84.85% respectively. EmLDH recombinant proteins ofEchinococcusmultilocularishave high immunogenicity and good immune diagnostic value for echinococcosis.
Echinococcusmultilocularis; LDH gene; cloning; expression; immunogenicity
Wei Xiao-xing, Email: weixiaoxing@tsinghua.org.cn
10.3969/j.issn.1002-2694.2017.11.004
青海省科技项目(No. 2016-ZJ-746)资助
魏晓星,Email:weixiaoxing@tsinghua.org.cn
1.青海大学生态环境工程学院,西宁 810016;
2.青海大学附属医院,西宁 810016
Email: heshunwei1219@foxmail.com
R383.3
A
1002-2694(2017)11-0967-05
Supported by the Science and Technology Project of Qinghai Province (No.2016-ZJ-746)
2017-03-23编辑王晓欢

