猪流感H3N2型病毒特异性sIgA抗体分泌规律研究
,, , ,, ,,
·论著·
猪流感H3N2型病毒特异性sIgA抗体分泌规律研究
白昀1,2,舒采松3,甘源1,倪博1,2,华利忠1,吴猛1,邵国青1,冯志新1
目的研究不同品种猪应答猪流感病毒感染,呼吸道分泌特异性sIgA抗体的分泌规律,以及针对不同抗原蛋白sIgA抗体的分泌差异。方法将猪流感病毒A/swine/Nanjing/51/2010(H3N2)滴鼻感染试验猪(1×107TCID50/mL,2 mL/头),采集感染后21 d内不同时间点的鼻拭子样品,用M1、NS1和PB1三种重组蛋白分别建立的间接ELISA方法检测特异性sIgA抗体,并分析其分泌规律及差异。结果显示针对3种重组蛋白的特异性sIgA抗体在整个检测周期内,分泌规律相似,差异无统计学意义,均表现为感染后第5 d特异性sIgA抗体水平迅速升高,第14 d达到高峰,随后开始逐渐下降。在不同品种猪之间,仅巴马猪分泌抗PB1蛋白的sIgA抗体在第14 d和21 d时高于二元猪(Plt;0.05),而抗M1和抗NS1蛋白的sIgA抗体在两种品种猪之间无统计学差异(Pgt;0.05)。结论初步探索了猪在感染猪流感病毒后特异性sIgA黏膜抗体的分泌规律,为进一步研究SIV黏膜抗体诊断试剂奠定基础。
猪流感病毒;间接ELISA;sIgA抗体
猪流感病毒(Swine Influenza virus, SIV)为A型流感病毒,属RNA病毒,猪感染可出现食欲下降、发热、咳嗽、打喷嚏、流鼻涕、精神萎靡等症状,比较常见的亚型有H1N1和H3N2。猪是流感病毒基因重排的“混合器”和流感变异毒株产生的“孵化器”,在人类流感和其他动物流感的研究和控制中具有重要地位[1]。因此建立SIV快速、特异、敏感的检测技术用于该病感染的实时、早期监测具有重要的公共卫生意义。本研究从机体应答病原感染的首道屏障切入,监测SIV感染后,猪呼吸道黏膜针对病毒各抗原蛋白产生特异性黏膜sIgA抗体的分泌规律,评价不同品种猪对SIV感染,以及对不同抗原蛋白产生黏膜免疫反应的差异性,为进一步研究SIV黏膜抗体诊断试剂奠定了基础。
1 材料和方法
1.1病毒、细胞与载体 猪流感病毒A/swine/Nanjing/51/2010(H3N2),MDCK细胞,表达载体pET-32a(+)均由江苏省农业科学院兽医研究所实验室保存。
1.2试验动物 30日龄巴马猪5头和48日龄二元仔猪(长白×梅山)5头,由南京洲邦生物科技有限公司提供;猪流感血清抗体HI检测呈阴性;自由饮水和采食。
1.3主要试剂 His标签蛋白纯化试剂盒购自MACHEREY-NAGEL公司,辣根过氧化物酶(HRP)标记羊抗猪IgA购自BETHYL公司,其他化学试剂均为进口或国产分析纯。
1.4.1引物设计与合成 根据GenBank数据库中流行毒株的M1、NS1和PB1基因蛋白编码序列片段,进行同源性比较分析,选择保守序列设计引物。在上游引物引入EcoR I酶切位点,下游引物引入SalI或HindIII酶切位点(表1)。引物由南京金斯瑞生物科技有限责任公司合成。
表1 猪流感病毒的基因片段引物设计
Tab.1 PCR amplification primes of gene segments of SIV H3N2

目的片段Gene上游引物Forwardprimer下游引物Reverseprimer限制性内切酶Restrictionenzymes预期长度/bpExpectedlength/bpM1CCGGAATTCACGTATGTTCTCTCCCAAGCTTCACTTGAATCGEcoRIHindIII752NS1CCGGAATTCAGTTTCCAGGCCCAAGCTTTCAAACTTTTGACEcoRIHindIII690PB1GGGGAATTCATGGAACAGGAA⁃CAGGATCCCGTCGACTCAGTTTGTCCACCCT⁃TGEcoRISalI273
1.4.2病毒RNA的提取 取收获的SIV H3N2病毒液200 μL加入900 μL病毒裂解液TRIzol Reagent,颠倒混匀,室温裂解15 min后,加200 μL氯仿,振荡混匀室温静置15 min;12 000 r/min低温离心15 min,吸取上清与等量的异丙醇混匀,室温放置20 min; 12 000 r/min低温离心15 min后弃上清,用预冷的75%乙醇洗涤一次,置37 ℃温箱烘干;用50 μL H2O溶解即为病毒RNA。
1.4.3RT-PCR扩增 以猪流感H3N2病毒RNA为模板,用Takara的M-MLV RTase反转录体系进行反转录,反应程序:42 ℃,1 h;95 ℃,5 min。反应结束后直接用产物cDNA进行PCR扩增,反应体系:10×PCR缓冲液2.5 μL,MgCl2(25 mmol/L)1.5 μL,dNTPs(各2.5 mmol/L)2.0 μL,引物(25 pmol/μL)各1.0 μL,Taq DNA聚合酶(5 U/μL)0.2 μL,cDNA模板2 μL,灭菌双蒸水补至25 μL。反应条件为95 ℃变性5 min;94 ℃变性30 s,45~62 ℃退火45 s,72 ℃延伸1 min,共30个循环;最后72 ℃延伸10 min。扩增产物经1.0%琼脂糖凝胶电泳鉴定。
1.4.4重组表达质粒的构建 将经过胶回收纯化的PCR产物和pET-32a(+)表达载体分别经对应的限制性内切酶(表1)双酶切,片段经1.5%琼脂糖凝胶电泳回收后进行连接,连接产物经热冲击法转化入E.coliBL21,经氨苄青霉素LB平板初筛,挑取单菌落于含有氨苄青霉素的LB培养基中,180 r/min振摇37 ℃培养过夜,小量抽提质粒,用对应的限制性内切酶进行双酶切及PCR鉴定。
1.4.5重组蛋白的表达 将测序正确的工程菌按2%的量接种于含氨苄青霉素的LB 培养基中,振荡培养至OD600值为0.4~0.6,加IPTG至终浓度为1 mmol/L,16 ℃诱导表达20 h。收集菌体,对菌体蛋白进行SDS-PAGE分析并用His标签蛋白纯化试剂盒对其纯化后分装保存备用。
1.4.6重组蛋白的Western blotting分析 采用文献[2]的方法进行重组蛋白进行Western blotting分析。重组蛋白及阴性对照(空表达质粒菌体蛋白)先经12% SDS-PAGE电泳分离,再经半干式电印迹转移至硝酸纤维素膜上,4 ℃封闭过夜,与1∶100稀释的猪流感高免血清反应2 h,洗涤3次,加入辣根过氧化物酶标记的羊抗猪IgG作用1 h,洗涤3次,DAB(3, 3-二氨基联苯胺)显色,观察,拍照。
1.5 猪流感病毒的人工感染
政府部门应该进一步转变发展理念,充分重视农业发展对促进本地区经济发展的作用,通过不断加强农田水利工程建设力度,可以在饮水和输水环节有效控制水资源浪费与不合理的丢失。节水灌溉工程在施工建设进程中,要结合实际情况,积极应用先进的施工技术、节水材料,配置完善的输水管道,确保工程施工质量过关,不存在开裂下渗问题。定期对节水灌溉工程开展养护管理,提高工程运行质量,使得水资源能够得到更加高效科学的使用。
1.5.1病毒的扩增 待MDCK细胞贴壁80%~90%时弃去细胞培养液,用病毒生长液(opti-MEM,0.5 μg/mL TPCK-胰酶)洗涤2次,每次5 mL;然后每瓶细胞加入8~10 mL病毒生长液和0.2 mL病毒液(HA为log29),CO2培养箱37 ℃培养96~120 h收获病毒液,定期观察病毒生长状况。若见大量细胞细胞核碎裂则表示大部分细胞已经被病毒感染,可以收获病毒液;将收获的病毒液反复冻融2次,混匀分装1 mL/支,-70 ℃存放备用。取冻存后的病毒液进行TCID50测定,按Reed-Muench两氏法计算结果。
1.5.2人工感染 将试验猪分为感染组和对照组,其中感染组包括3头巴马猪和3头二元仔猪,对照组包括2头巴马猪和2头二元仔猪。用猪流感病毒A/swine/Nanjing/51/2010(H3N2)按1×107TCID50/mL滴鼻接种感染组试验猪,每头接种2 mL;用PBS滴鼻接种对照组试验猪,每头接种2 mL。在接种前和接种后1、3、5、7、10、14和21 d采集所有试验猪的鼻拭子样品,用间接ELISA方法检测其中M1、NS1和PB1蛋白的特异性sIgA抗体。
1.6鼻拭子样品的采集和处理 将棉签斜着插入猪鼻孔,轻轻转动棉签,使猪打3~5下喷嚏,取出棉签放入含有鼻拭子浸泡液的EP管中,2~8 ℃浸泡2 h,取出棉签,10 000 r/min离心5 min,收集上清置—20 ℃保存备用。
1.7猪流感病毒的特异性sIgA抗体ELISA检测
取纯化后的M1、NS1和PB1融合表达蛋白分别以1 μg/mL的浓度包被酶标板,100 μL/孔;2~8 ℃过夜后弃去包被液,经PBST洗涤3次(每次5 min)后,每孔加入200 μL 5% BSA溶液,37 ℃封闭2 h;弃去封闭液,洗涤5次,每孔加入100 μL待检鼻拭子上清样品,37 ℃孵育2 h弃去,洗涤5次后加入1∶40 000的HRP标记羊抗猪IgA抗体,100 μL/孔,37 ℃孵育30 min后弃去;再用PBST洗涤5次,TMB避光显色5 min,以2 mol/L硫酸终止反应,在酶标仪上测定OD450nm值。
1.8特异性sIgA抗体的分泌规律检测与数据分析
分别以融合表达蛋白M1、NS1和PB1的特异性sIgA-ELISA抗体检测OD450nm值绘制分泌曲线,用软件GraphPad Prism 5进行差异性分析。
2 结 果
2.1重组融合蛋白的表达 试验结果表明,经诱导表达,pET-32a(+)-M1、pET-32a(+)-NS1和pET-32a(+)-PB1融合蛋白在菌体上清中均存在表达。融合蛋白大小分别约为42 kDa、40 kDa和30 kDa,与理论值接近。经过HIS标签的蛋白纯化试剂盒纯化后的融合蛋白浓度分别为1.373 mg/mL、1.255 mg/mL和0.430 mg/mL。(见图1:A,B,C)
表达产物经SDS-PAGE电泳后的蛋白条带转移到硝酸纤维素膜上进行Western blotting免疫印迹,结果显示,M1、NS1和PB1融合蛋白分别在40 kDa、40 kDa和30 kDa大小左右的位置出现一个清晰的特异性反应条带。由此证明,表达的目的蛋白均能与猪流感高免血清发生特异性结合,具有反应原性,有作为检测抗原的潜力,可以用于后续实验研究。(见图1:D)
2.2猪流感病毒的特异性sIgA抗体检测结果 经M1、NS1和PB1融合表达蛋白作为包被抗原,用间接ELISA方法检测猪鼻拭子上清中的特异性sIgA抗体,结果显示,3种重组蛋白的特异性sIgA抗体在整个检测周期内,除抗M1的sIgA抗体在感染后第1 d相比抗NS1和PB1的sIgA抗体低(Plt;0.05)外,其它时间段分泌规律相似,均表现为感染后第5 d开始,特异性sIgA抗体水平迅速升高,第14 d达到高峰,随后开始逐渐下降(图2)。
2.3巴马猪和二元猪感染猪流感H3N2后sIgA抗体分泌差异比较 如图3显示,整个监测周期内,抗M1和抗NS1蛋白的sIgA抗体在两种品种猪之间无统计学差异(Pgt;0.05),sIgA抗体分泌水平趋势基本一致。而巴马猪分泌抗PB1蛋白的sIgA抗体在第14 d和第21 d时高于二元猪(Plt;0.05)。

A:SDS-PAGE analysis of recombinant protein M1; B:Identification SDS-PAGE analysis of recombinant protein NS1; C:SDS-PAGE analysis of recombinant protein PB1. 1: Uninduced pET-32a(+); 2: Induced pET-32a(+); 3: Uninduced engineering bacteria; 4: Induced engineering bacteria; 5: Supernatant of lysis after induce; 6: Sediment after induce;7: Purified protein; M: Protein Marker.D:Western-blot analysis of recombinant protein M1、NS1 and PB11: pET-32a(+)-M1-BL21; 2: pET-32a(+)-NS1-BL21; 3: pET-32a(+)-PB1-BL21.图1 猪流感M1、NS1、PB1重组蛋白表达和鉴定Fig.1 Expression and identification of SIV recombinant proteins M1, NS1 and PB1

A:the kinetics of sIgA antibody secretions against NS1、M1 and PB1 proteinsB:the kinetics of sIgA antibody secretion against NS1 proteinC:the kinetics of sIgA antibody secretion against M1 proteinD:the kinetics of sIgA antibody secretion against PB1 protein图2 SIV H3N2 sIgA抗体分泌规律(* Plt;0.05)Fig.2 Secretion rule of SIV H3N2 sIgA antibodies (* Plt;0.05)
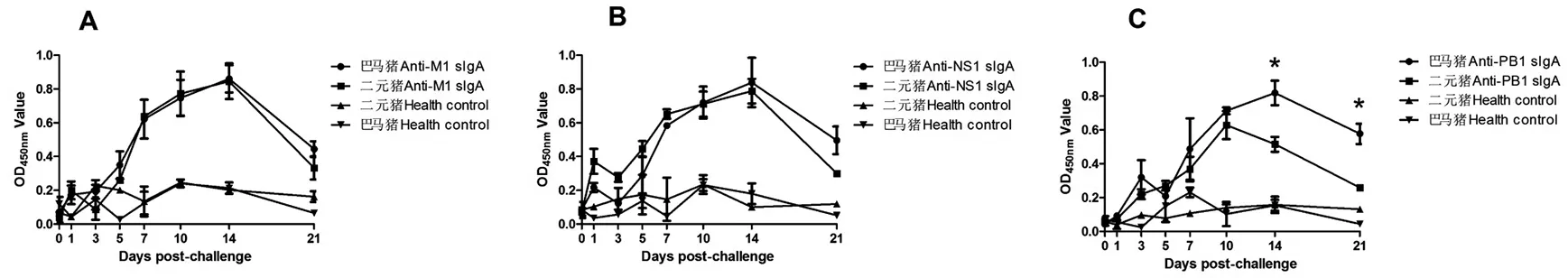
A. the kinetics of sIgA antibody secretions against M1 protein between two different breeds;B. the kinetics of sIgA antibody secretions against NS1 protein between two different breeds;C. the kinetics of sIgA antibody secretions against PB1 protein between two different breeds图3 巴马猪和二元猪H3N2 sIgA抗体水平差异(* Plt;0.05)Fig.3 Difference of sIgA antibody levels between Bama suckling pigs and cross pigs (Meishan×Landrace) (* Plt;0.05)
3 讨 论
对于以呼吸道感染为主的猪流感病毒来说,黏膜免疫系统是抵御病毒的第一道防线,它不仅具有一般性的屏障作用,还参与机体的体液免疫和细胞免疫过程[3],是执行局部特异性免疫功能的主要场所。其中分泌型免疫球蛋白A (secretory immunoglobulinA,SIgA) 是黏膜表面最重要的抗体,它能有效地阻止病原体黏附于黏膜表面,抵御病原体的感染和入侵[4]。sIgA是机体黏膜抵抗感染的重要因素,也是多种黏膜疾病的诊断和评价的重要指标。Chicubo等[5]将霍乱毒素B亚单位(CTB)和牛血清白蛋白(BSA)混合后由鼻腔免疫小鼠,产生高水平的BSA特异性血清和黏膜IgA抗体应答;袁军等[6]用鼠伤寒沙门氏菌SOD 滴鼻免疫小鼠,能形成较好的局部黏膜应答和全身性应答。在流感病毒方面,也有大量的报道用黏膜IgA抗体作为感染或免疫的检测指标。Jung等[7]用TCID50为2×106剂量SIV弱毒疫苗经鼻内免疫3周龄仔猪,结果表明sIgA抗体在感染后第7 d达到最大量,第2周开始下降。刘史婷等[8]分别用流感全病毒蛋白抗原经喷鼻免疫小鼠,一周后在肺泡灌洗液中检测到较低的特异性sIgA抗体。吴仁蔚等[9]使用流感病毒HA1和M2重组蛋白联用免疫佐剂去免疫鸡在第14 d检测到了鼻黏膜中分泌大量的sIgA抗体。由于免疫抗原及检测抗体的不同,所报道的流感sIgA抗体分泌情况略有不同,本研究拟在同等条件下,比较猪应答SIV感染后分泌抗SIV不同蛋白的sIgA抗体的差异,为建立SIV黏膜诊断方法中靶标抗原的筛选奠定基础。
猪流感病毒由8个基因节段编码10个功能蛋白,我们在本试验中先期选择了3个基因比较保守区段进行蛋白的表达与检测。M1蛋白是SIV的基质蛋白,与病毒粒子装配和RNA转运相关,基因序列保守,具有型特异性,是流感病毒分型的依据之一,在流感病毒中含量最丰富[10]。NS1蛋白为非结构型蛋白和毒力因子,常利用其突变株制备弱毒疫苗,都具有良好的抗原性[11]。PB1蛋白形成转录酶和复制酶复合物,参与病毒转录和复制。在建立间接ELISA检测方法时,我们统一了3种方法的反应条件,以期能在相同的条件下比较3种蛋白作为检测原的差异。试验结果显示,经猪流感弱毒株A/swine/Nanjing/51/2010(H3N2)感染试验猪,抗M1和抗NS1蛋白的sIgA抗体水平在感染后第1 d就显著高于对照组的特异性sIgA抗体水平,sIgA抗体分泌高峰期主要集中于第3~10 d,大约在第14 d附近达到抗体分泌最大量,随后逐渐下降。从试验猪感染SIV后针对各蛋白产生的黏膜抗体差异来看,M1、NS1和PB1三种表达蛋白的sIgA抗体变化差异无统计学意义(Pgt;0.05),其中Anti-PB1蛋白sIgA抗体水平稍低。这可能是因为扩增的PB1基因略小,表达蛋白抗原性稍差的原因。另外,Western blot试验结果也显示,当相同含量的M1、 NS1和PB1表达蛋白与SIV高免血清作用时,SIV高免血清与M1和NS1表达蛋白的反应条带要比SIV高免血清与PB1表达蛋白的反应条带明亮,也说明其抗原反应原性的差异。
本研究同时比较了不同品种猪应答SIV感染的差异性。二元猪(长白×梅山)在感染SIV后的第7 d开始出现微热、食欲下降和轻微咳嗽及部分拉稀现象,症状持续2~3 d。与Blaskovic等[12]报道的通过鼻内接种断奶仔猪,在4 d内所有试验猪均出现典型临床症状的结果推迟了3 d左右。这可能与其采用了较大的感染剂量(107.5EID50/mL,2.5 mL/鼻孔)和毒株的毒力差异有关。而巴马猪在感染A/swine/Nanjing/51/2010(H3N2)后一直没有出现典型临床症状,而抗M1、NS1和PB1融合表达蛋白的sIgA抗体分泌水平基本与二元猪一致,这可能是相比于二元猪,巴马猪具有性野早熟,适应性和抗病能力强等特点有关[13-15]。
对SIV的血清学诊断,目前所有商品化试剂盒均采用从血清中检测IgG抗体,而这种方法存在诸多弊端,主要表现为费时间、费人工、对猪的应激性大。而检测呼吸道黏膜抗体中的特异性sIgA只需要采集呼吸道黏液或鼻拭子样本即可,相比血样采集更为方便快捷,无针化采样也适应于的动物福利的要求。本试验对猪感染SIV后产生的特异性sIgA抗体分泌规律进行了研究,为进一步研究SIV黏膜抗体检测试剂盒提供数据支持,同时也为猪流感抗体水平监测和猪流感防控提供一定的参考依据。
[1] Liu DF,Liu M, Liu CG, et al.Cloning and phylogenetic analysis of the entire gene of an H1N1 subtype swine influenza virus isolated from Guangdong Province [J]. Chin J Virol, 2008, 24(5): 396-401. DOI: 10. 13242/ j. cnki. bingduxuebao. 001938 (in Chinese)
刘大飞,刘明,刘春国,等.H1N1亚型猪流感病毒广东分离株全基因克隆及其遗传演化分析[J].病毒学报,2008, 24(5):396-401.
[2] Wang JZ, Fan M. Handbook of protein technology [M]. Beijing: Science Press, 2002:166-188. (in Chinese)
汪家政, 范明. 蛋白质技术手册[M]. 北京:科学出版社, 2002:166-188.
[3] Hinkula J, Walther-Jallow L, Lauren A,et al. Neutralizing activity and cellular immune responses induced in mice after immunization with apoptotic HIV-1 /murine leukemia virus infected cells[J]. Vaccine, 2009, 27(46): 6424-6431. DOI: 10. 1016/ j. vaccine. 2009. 06. 016
[4] Hansen J, Gulati A, Sartor RB. The role of mucosal immunity and host genetics in defining intestinal commensal bacteria [J]. Curr Opin Gastroenterol, 2010, 26(6): 564-571. DOI:10. 1097/ MOG. 0b013e32833f1195
[5] Chikubo K, Isaka M, Yasuda Y. Recombinant choleratoxin B subunit acts as an adjuvant for the mucosal and systemic responses of mice to mucosally co-administered bovine serum albumin[J]. Vaccine, 1998, 16(1): 150-155. DOI: 10.1016/s0264-410x(97)00194-1
[6] Yuan J,Yang ZJ,Ling TY. Diversity of antibody-mediated immunity with salmonella typhimurium SOD in mouse vaccinated by different routes [J]. Immunological J, 2002, 18(16): 437-439. DOI: 10.13431/j. cnki.immunol.j.20020133 (in Chinese)
袁军,杨志军,凌天翼.鼠伤寒沙门氏菌SOD不同途径免疫小鼠的效果观察[J].免疫学杂志,2002,18(16): 437-439.
[7] Jung K, Ha Y, Chae C. Pathogenesis of swine influenza virus subtype H1N2 infection in pigs [J]. J Comparat Pathol, 2005, 132(2): 179-184. DOI: 10. 1016/ j. jcpa. 2004. 09. 008
[8] Liu LT. Preliminary study on influenza mucosal vaccine [D]. Yangling:Northwest Aamp;F University, 2007. (in Chinese)
刘吏婷. 流感黏膜疫苗的初步研究[D]. 杨凌:西北农林科技大学, 2007.
[9] Wu RW. Study on mucosal immunization of recombinant proteins of avian influenza virus and development of NP-ELISA detecting antibodies against avian influenza virus [D]. Wuhan:Huazhong Agricultural University, 2006. (in Chinese)
吴仁蔚. 禽流感病毒重组蛋白粘膜免疫研究及 NP-ELISA 抗体检测方法的建立[D]. 武汉:华中农业大学, 2006.
[10] Cheung TK, Poon LL. Biology of influenza a virus [J]. Annals New York Acad Sci, 2007, 1102(1): 1-25. DOI: 10. 1196/ annals. 1408. 001
[11] Solórzano A, Webby RJ, Lager KM, et al. Mutations in the NS1 protein of swine influenza virus impair anti-interferon activity and confer attenuation in pigs[J]. J Virol, 2005, 79(12): 7535-7543. DOI:10. 1128/ JVI. 79. 12. 7535-7543. 2005
[12] Holmgren J, Czerkinsky C. Mucosal immunity and vaccines[J]. Nat Med, 2005, 11: S45-S53. DOI: 10. 1038/ nm1213
[13] Liu JF, Wang LX, Zhang Y, et al. Research progress of porcine interferon gene and its application prospect in disease resistance breeding [J]. North Anim Husb, 2007,5: 8. (in Chinese)
刘剑锋,王立贤,张沅,等. 猪干扰素基因研究进展及其在抗病育种中的应用展望[J]. 北方牧业, 2007,5:8.
[14] Chen XX, Zhao XM. Application and consideration of miniature pig model in medicine field [J]. J Fujian Univ Tradit Chin Med, 2010, 20(4): 67-69. DOI: 10. 13261/ j.cnki.jfutcm. 002372 (in Chinese)
陈学习, 赵晓梅. 小型猪动物模型在医药学领域的研究应用与思考[J]. 福建中医药大学学报, 2010, 20(4): 67-69.
[15] Pang LL, Zhang HY, Yang GL. Application of Chinese Bama minipigs in medical research [J]. Acta Lab Anim Sci Sin, 2014, 22(1): 94-98. DOI: 10. 3969/ j. Issn. 1005-4847. 2014. 01. 020 (in Chinese)
庞琳琳,张会永,杨关林.巴马小型猪在医学研究中的应用进展[J].中国实验动物学报, 2014, 22(1): 94-98.
SpecificsIgAantibodiesagainstswineinfluenzavirusH3N2infection
BAI Yun1,2, SHU Cai-song3, GAN Yuan1, NI Bo1,2, HUA Li-zhong1, WU Meng1, SHAO Guo-qing1, FENG Zhi-xin1
(1.InstituteofVeterinaryMedicine,JiangsuAcademyofAgriculturalSciences/KeyLaboratoryofAnimalDiseasesDiagnosticandImmunology,MinistryofAgriculture,Nanjing210014,China;2.KeyLaboratoryofFoodQualityandSafetyofJiangsuProvince/StateKeyLaboratoryBreedingBase,Nanjing210014,China;3.NanjingAgriculturalUniversity,Nanjing210095,China)
To study different breed pigs reply the swine flu virus infections, specific antibody of sIgA secretion regularity of respiratory tract and the differences of sIgA antibody according to different antigen proteins were detected. A/swine/Nanjing/51/2010(H3N2) was intranasally infected pigs (1×107TCID50/mL and 2 mL/pig), and then the nasal swab samples were collected at different time points within 21 days after infection. M1, NS1 and PB1 recombinant protein, respectively, were used to establish indirect ELISA method for detecting specific antibody of sIgA, and to analyze its secretion regularity. Results displayed that there was no significant difference among three kinds of recombinant protein in the whole test, characterizing by specificity sIgA antibody levels rising rapidly after 5 infection days and reaching peak at day 14, then began to decline. Among different varieties of pigs, sIgA antibody production of PB1 protein in Obama group was significantly higher than that in binary pigs at 14th and 21st day (Plt;0.05). It had no significant difference between M1 group and the NS1 group (Pgt;0.05). This experiment preliminary explores the secretion regularity of specificity sIgA antibody after infected swine flu virus, which laid a foundation for further study of SIV mucosal antibody diagnostic reagents.
swine influenza virus; indirect ELISA; sIgA antibodies
Feng Zhi-xin, Email: fzxjaas@163.com
10.3969/j.issn.1002-2694.2017.11.002
江苏省农业科技自主创新资金项目(No.CX(14)2040)
冯志新,Email:fzxjaas@163.com
1.江苏省农业科学院兽医研究所 农业部兽用生物制品工程技术重点实验室,南京 210014;
2.省部共建国家重点实验室培育基地—江苏省食品质量安全重点实验室,南京 210014;
3.南京农业大学,南京 210095
S852.4
A
1002-2694(2017)11-0956-06
Supported by the Independent Innovation Fund of Jiangsu Agricultural Science and Technology(No.CX(14)2040)
2017-03-08编辑王晓欢

