猪戊型肝炎病毒SYBR GreenⅡ荧光定量RT-PCR检测方法的建立与应用
,,,,, ,2,,2
·论著·
猪戊型肝炎病毒SYBR GreenⅡ荧光定量RT-PCR检测方法的建立与应用
李幽幽1,龚双燕1,李小璟1,毛汐语1,邓益超1,朱玲1,2,徐志文1,2
目的建立一种快速检测猪戊型肝炎病毒(HEV)的方法。方法针对HEVORF2基因保守序列设计1对引物,基于SYBR Green Ⅱ染料,建立了检测HEV的实时荧光定量RT-PCR方法。结果该方法只能对猪戊型肝炎病毒检测到荧光,对猪繁殖与呼吸综合征病毒、猪瘟病毒、猪流行性腹泻病毒、猪嵴病毒、猪传染性胃肠炎病毒、猪轮状病毒均不能检测到荧光信号,特异性好;检测HEV时,在4.10×102~4.10×108拷贝/μL内具有良好的线性关系,灵敏度可以达到1.00×102拷贝/μL,扩增相关系数为0.996,扩增产物的熔解温度为84.0 ℃±0.1 ℃,该检测方法组内变异系数为0.83%~0.94%,组间变异系数为0.83%~0.94%,重复性较好。利用该方法对临床61份来自四川各地的猪肠内容物进行检测,检出9份阳性,且与常规PCR检测方法的阳性符合率为100%。结论建立的针对HEV的荧光定量RT-PCR有效可行,对HEV的临床检测和进一步研究奠定了基础。
猪戊型肝炎病毒;SYBR GreenⅡ;荧光定量RT-PCR
HEV属于肝炎病毒科(HepeviridaeFamily)肝炎病毒属(Hepevirus),是单股正链无囊膜的RNA病毒,呈球形,直径32~34 nm,核衣壳呈二十面体立体对称。基因组长约7.2 kb,由3个开放式阅读框架组成。HEV分为4个主要基因型[1],HEV-1主要分布在亚洲和非洲国家;HEV-2见于墨西哥和尼日利亚;HEV-3分布于美国和欧洲国家[2],但近年来发现也存在与日本、韩国、中国大陆和中国台湾;HEV-4主要分布于中国、日本和越南。我国存在的主要是1型和4型[3-5]。
该病毒的主要传播途径是粪口传播,即通过饮用被污染的水和食用被污染的食物而感染[6-8]。食用未煮熟的感染HEV的动物组织或内脏也可能导致食源性感染[9-10],除此之外,母婴传播[11-12]、输血传播[13-15]也是重要的传播途径。孕妇感染HEV可导致流产或死亡,病死率高达20%-30%。HEV还分布于多种动物中,并可在人与猪之间相互传播,是人类健康和养猪业的重要病原[16-17]。
目前,国内外对HEV的检测方法各异,例如ELISA、PCR等常规检测方法,但是对于HEV含量低的样品以及处理过程中易产生抑制物等因素,均限制了HEV的早期临床诊断。因此,本研究基于SYBR Green Ⅱ染料,建立用于HEV检测的荧光定量RT-PCR方法,以期达到灵敏性高、可定量、操作便利和成本相对较低等特点的检测目的。
1 材料与方法
1.1病毒 猪繁殖与呼吸综合征病毒(PRRSV)、猪瘟病毒(CSFV)、猪流行性腹泻病毒(PEDV)、猪嵴病毒(PKoV)、猪传染性胃肠炎病毒(TGEV)、猪轮状病毒(ProVA)、猪戊型肝炎病毒(HEV)阳性病料均由四川农业大学动物生物技术中心保存。
1.2主要试剂 DL2000DNA Marker,SYBR Green Premix E×TaqⅡ,2×TaqPLR Master Mix均购自天根生化科技(北京)有限公司;DNA凝胶回收试剂盒、pMD19-T载体、质粒抽提试剂盒等均购自宝生物工程(大连)有限公司产品。
1.3引物的设计与合成 将10株来自不同地区猪戊型肝炎病毒代表株的全基因序列利用软件进行同源性分析,选出高度保守的核酸区域为ORF2基因,针对保守区设计一对引物分别是HEV-F: 5′-ATTTCGTCGGCTGGAGGT-3′, HEV-R : 5′-ACGGGACTCACCAAGATCAATA-3′。预期扩增目的片段大小为150 bp。引物由生工生物工程(上海)股份有限公司合成。
1.4HEV重组质粒标准品的制备 使用胶回收试剂盒对得到的PCR产物进行回收纯化,将回收产物与pMD19-T Vector(Simple)连接,将连接产物转化至DH5α感受态细胞。用质粒DNA提取试剂盒提取质粒。将鉴定为阳性的重组质粒送至生工生物工程(上海)股份有限公司进行测序。在NCBI上对测序结果进行比对,分析结果表明该阳性重组质粒与试验预期相符,可作为HEV荧光定量RT-PCR的阳性标准品。将获取的阳性标准品用超微量紫外可见分光光度计测定浓度,经计算其DNA浓度为4.10×1010拷贝/μL,置于-20 ℃保存。
使用胶回收试剂盒对得到的PCR产物进行回收纯化,将回收产物与pMD19-T Vector(Simple)连接,将连接产物转化至DH5α感受态细胞。用质粒DNA提取试剂盒提取质粒。将鉴定为阳性的重组质粒送至生工生物工程(上海)股份有限公司进行测序。在NCBI上对测序结果进行比对,分析结果表明该阳性重组质粒与试验预期相符,可作为HEV荧光定量RT-PCR的阳性标准品。将获取的阳性标准品用超微量紫外可见分光光度计测定浓度,经计算其DNA浓度为4.10×1010拷贝/μL,置于-20 ℃保存。
1.5标准曲线实验 分别使用两步法和三步法对该方法的循环数进行优化。对退火温度在53 ℃、54 ℃、55 ℃、56 ℃、57 ℃、58 ℃、59 ℃、60 ℃进行优化。
用双蒸水将阳性标准品进行10倍倍比稀释,取7个浓度梯度的阳性标准品作为模板(4.10×102-4.10×108拷贝/μL),按照优化的反应条件进行扩增,观察扩增曲线,标准曲线由荧光定量PCR仪自动生成。
1.6敏感性试验 用双蒸水将阳性标准品进行10倍倍比稀释,采用浓度为4.10×102~4.10×108拷贝/μL的阳性标准品作为模板,分别用建立的荧光定量RT-PCR与常规RT-PCR对标准品进行检测,对比两种检测方法的敏感性。常规RT-PCR反应条件为:95 ℃预变性5 min,94 ℃ 40 s,53 ℃ 30 s,72 ℃ 40 s,35个循环;72 ℃延伸5 min。
1.7重复性试验 将阳性标准品稀释成3个稀释度(4.10×103、4.10×105、4.10×107拷贝/μL),用所建立的荧光定量RT-PCR对样品分别进行3次重复检测,进行组内重复性试验;对获得的阳性标准品做组间的重复性试验,在相同反应条件下,利用该方法每间隔1周对其进行3次独立的检测,检验该方法的重复性。
1.8特异性试验 用已建立的荧光定量RT-PCR同时对PRRSV,CSFV,TGEV,PKoV,PEDV、ProVA和HEV进行检测,验证其特异性。
1.9荧光定量RT-PCR对临床样品的检测 将采自四川省成都、绵阳、眉山、遂宁、乐山、雅安等规模化猪场的61份猪粪便用PBS稀释至2g/mL的浓度,离心后取上清用Trizol法提取样品总RNA,按照已优化的体系和条件,用已建立的荧光定量RT-PCR和常规PCR对样品进行检测。
2 结 果
2.1优化的检测条件 经过对两步法、三步法的循环数和退火温度的优化后,最佳反应体系为25 μL:SYBR Primix E×TaqTM12.5 μL,上、下游引物(20 μmol/L)各1.2 μL,模板2 μL,水补足至25 μL。经验证该反应最佳条件为:95 ℃ 30 s;95 ℃ 5 s,53 ℃ 30s,72 ℃ 30 s;进行39个循环。熔解曲线:95 ℃ 5 s,60 ℃以每秒升高0.5 ℃的速度,直至升温到95 ℃。
2.2标准曲线分析 用建立的荧光定量RT-PCR检测各浓度梯度的HEV阳性标准品时,所得到的标准曲线显示,在4.10×102~4.10×108拷贝/μL之间有良好的线性关系,标准曲线的斜率是-3.497,y轴截距是38.649,其相关系数为0. 996,符合试验预期(图1)。

图1 HEV实时荧光定量RT-PCR的标准曲线Fig.1 The standard curve of real-time RT-PCR for detection of HEV
2.3熔解曲线分析 对熔解曲线进行分析,结果显示在熔解温度Tm= 84.0 ℃±0.1 ℃处呈现特异性峰值,没有引物二聚体和非特异性产物(图2)。
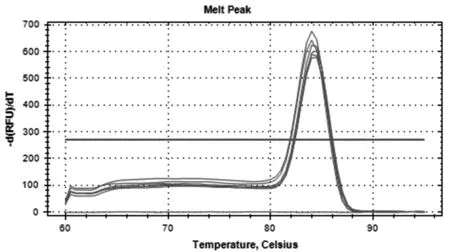
图2 HEV实时荧光定量RT-PCR的溶解曲线Fig.2 The melting curve of real-time RT-PCR for detection of HEV
2.4敏感性试验 对常规PCR与已建立的荧光定量RT-PCR进行敏感性比较,结果显示常规RT-PCR可检测的最低病毒浓度为4.10×104拷贝/μL (图3);而荧光定量RT-PCR可检测到的最低病毒浓度为4.10×102拷贝/μL,灵敏度可以达到4.10×102拷贝/μL(图4)。结果证明,荧光定量RT-PCR的敏感性比常规RT-PCR提高了100倍。

M:DL2000DNA Marker;1-7:The plasmid concentrations are from 4.10×108~4.10×102 copies/μL,respectively;8:Negative control图3 HEV常规PCR的敏感性试验Fig.3 Sensitivity test of conventional PCR for detection of HEV

1-7:The plasmid concentrations are from 4.10×108~4.10×102 copies/μL,respectively;8:Negative control图4 实时荧光定量RT-PCR的敏感性试验Fig.4 The sensitivity test of real-time RT-PCR
2.5重复性试验 用已建立的实时荧光定量RT-PCR对3个不同稀释浓度的阳性标准品进行重复性检测,在相同反应条件下分别进行3次试验,检验该方法的重复性,并计算变异系数(表1)。结果显示,组内变异系数小于1.0%,组间变异系数小于1.0%,表明所建立的荧光定量RT-PCR具有较好的重复性。
表1 SYBR Green Ⅱ荧光定量RT-PCR的组内、组间重复性试验结果
Tab.1 Intra-assay and Inter-assay reproducibility test of the SYBR Green Ⅱ real-time PCR

样品浓度(拷贝/μL)Concentrationofstandardplasmid(copies/μL)n组内变异实验Intra⁃assayvariability组间变异实验Inter⁃assayvariabilityCt值平均值AverageofCt变异系数CV(%)Ct值平均值AverageofCt变异系数CV(%)103314.26±0.020.8314.09±0.080.83105320.30±0.040.9221.40±0.410.92107328.50±0.130.9428.44±0.370.94
2.6特异性试验 按照已建立的实时荧光定量RT-PCR方法对PRRSV,CSFV,TGEV,PKoV,PEDV、ProVA和HEV反转录后所获得的cDNA进行检测,结果显示只有HEV阳性样本能够扩增出曲线(图5),证明所建立的方法具有很强的特异性。
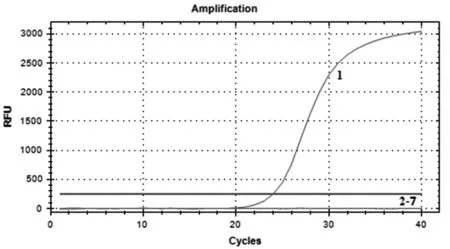
1:Amplification curve of HEV2-7:Amplification curve ofPRRSV,CSFV,TGEV,PKoV,PEDV and ProVA图5 HEV实时荧光定量RT-PCR的特异性试验Fig.5 Specificity test of real-time RT-PCR for detection of HEV
2.7荧光定量RT-PCR对临床样品的检测 按照已建立的荧光定量RT-PCR对临床采集的61份疑似HEV发病猪的肠内容物进行检测,同时用常规RT-PCR进行检测,对两种检测方法的结果进行比较。荧光定量RT-PCR检测结果显示,61份样本中有9份为HEV阳性(Ct值为11.26-28.82)。常规RT-PCR只检测到了6份HEV阳性样本。两种检测方法所检出的阳性病料符合率为100%(表2)。
表2 猪肠内容物样品检测结果
Tab.2 Intestinal contents sample testing results

样品Sample检测方法TestmethodHEV阳性样品编号HEVpositivesamplenumber61份猪肠内容物61samplesofin⁃testinalcontents常规RT⁃PCRConventionalRT⁃PCR18,19,25,29,33,39荧光定量RT⁃PCRReal⁃timeRT⁃PCR9,18,19,25,28,29,33,39,55
3 讨 论
光定量PCR主要有两大类,分别为探针类和染料类。荧光定量PCR和常规PCR比较,荧光定量PCR更为快速,并有较高的敏感性和特异性,除此之外,还能够显著减少试验过程当中的污染。近年来,也有多个关于利用探针法检测HEV的报道[18-19],探针法的优点是可以通过探针提高反应收集荧光信号的特异性,只有与探针相结合的区域发生扩增才能够被接收到荧光信号,能够提前对反应条件进行优化;缺点是合成探针成本高。而这种染料法比探针法更经济。它不仅可以完成溶解曲线,而且可以分析所有产物的Tm值,缺点是与探针法相比特异性略差,但本研究中的溶解曲线呈现的是单一特异性峰,并且在特异性试验中显示只特异性扩增HEV,说明本研究中建立的SYBR Green Ⅱ染料法的特异性很高,我们选择SYBR Green Ⅱ染料法建立针对HEV的荧光定量检测方法,能够满足临床诊断的需求。
HEV是一种人兽共患病病原,该病的流行主要发生在亚洲,非洲及墨西哥等发展中国家。猪感染HEV的情况在世界上所有的猪场都普遍存在。研究表明,猪是HEV的主要贮存宿主,感染的猪一般有短暂的病毒血症,持续1-2周。我国猪场中HEV的感染情况也很普遍,有研究者对我国20个省、直辖市和民族自治区的120个规模化猪场的8626头保育猪的血清进行检测,结果发现抗HEV抗体阳性率高达83.4%,被调查的每个猪场中均出现了HEV感染的情况,说明HEV感染在我国猪场是极为严重的[20]。猪自然感染HEV一般不出现明显的临床症状,所以建立一种灵敏度高、操作方便并且成本低的检测方法迫在眉睫。目前,已建立的检测方法以巢式RT-PCR最为常用。但是,巢式RT-PCR操作步骤繁琐,导致检测时间增长,不能及时得出检测结果。所以,本研究建立了灵敏度高、程序简单并且成本低的HEV SYBR GreenⅡ荧光定量RT-PCR。
近年来,关于HEV荧光定量的方法的应用的研究主要针对浙江,吉林,河北和北京等地。2016年刘敏等人对中国15个省市自治区和直辖市的HEV分布情况进行调查分析,但是有些地区的HEV分布情况还没有被调查,其中包括西南地区,如四川、云南、贵州、西藏和重庆等地[21]。至今对于四川地区的猪源HEV的发病情况还没有相关报道,本研究中针对HEV的ORF区域设计引物,利用建立的荧光定量方法对四川省的HEV发病率情况进行初步分析,为该地区HEV的预防工作提供了数据支持。本试验对采自四川省成都、绵阳、眉山、遂宁、乐山、雅安地区规模化猪场的61份猪肠内容物进行检测,其中9份样品呈阳性,阳性率为14.75%;常规RT-PCR检测结果中,有6份呈阳性,阳性率为9.8%,与荧光定量RT-PCR检测的阳性结果符合率为100%,结果显示本研究中建立的荧光定量RT-PCR对样品的检出率高于常规PCR。本研究建立了SYBR GreenⅡ荧光定量RT-PCR对HEV的检测方法,该方法具有灵敏性高、特异性强、可定量等优点,为HEV的临床诊断起到了很好的指示作用,为我国相关研究者对HEV的进一步研究奠定基础。
[1] Schlauder GG, Mushahwar IK. Genetic heterogeneity of hepatitis E virus[J]. J Med Virol, 2001, 65(2): 282-292.
[2] Ning H, Niu Z, Yu R, et al. Identification of genotype 3 hepatitis E virus in fecal samples from a pig farm located in a Shanghai suburb[J]. Vet Microbiol, 2007, 121(1-2): 125-130. DOI: 10.1016/j.vetmic.2006.11.006
[3] Huang FF, Haqshenas G, Guenette DK, et al. Detection by reverse transcription-PCR and genetic characterization of field isolates of swine hepatitis E virus from pigs in different geographic regios of the United States[J]. J Clin Microbiol,2002, 40(4): 1326-1332. DOI: 10.1128/JCM.40.4.1326-1332.2002
[4] Chen Y, Tian DY, Xia NS. Epidemiology and genotypes of HEV in Wuhan[J]. Chin J Dig Dis, 2005, 6(4): 182. DOI: 10.1111/j.1443-9573.2005.00228.x
[5] Mitsui T, Tsukamoto Y, Suzuki S, et al. Serological and molecular studies on subclinical hepatitis E virus infection using periodic serum samples obtained from healthy individuals[J]. J Med Virol,2005, 76(4): 526-533. DOI: 10.1002/jmv.20393
[6] Mushahwar IK. Hepatitis E virus: molecular virology, clinical features, diagnosis, transmission, epidemiology and prevention[J]. J Med Virol,2008, 80(4): 646-658. DOI: 10.1002/jmv.21116
[7] Schlauder GG, Dawson GJ, Erker JC, et al. The sequence and phylogenetic analysis of a novel hepatitis E virus isolated from a patient with acute hepatitis reported in the United States[J]. J Med Virol,1998, 79 (3): 447-456. DOI: 10.1099/0022-1317-79-3-447
[8] Tokita H, Harada H, Gotanda Y, et al. Molecular and serological characterization of sporadic acute hepatitis E in a Japanese patient infected with a genotype III hepatitis E virus in 1993[J]. J Med Virol,2003, 84(Pt 2): 421. DOI: 10.1099/vir.0.18802-0
[9] Matsuda H, Okada K, Takahashi K, et al. Severe hepatitis E virus infection after ingestion of uncooked liver from a wild boar[J]. J Infect Dis,2003, 188(6): 944. DOI: 10.1086/378074
[10] Tamada Y, Yano K, Yatsuhashi H, et al. Consumption of wild boar linked to cases of hepatitis E[J]. J Hepatol,2004,40(5): 869-870. DOI: 10.1016/j.jhep.2003.12.026
[11] Khuroo MS, Kamili S. Clinical course and duration of viremia in vertically transmitted hepatitis E virus (HEV) infection in babies born to HEV-infected mothers[J]. J Viral Hepat,2009, 16(7): 519. DOI: 10.1111/j.1365-2893.2009.01101.x
[12] Kumar A, Beniwal M, Kar P, et al. Hepatitis E in pregnancy[J]. Intl J Gynaecol Obstetrics,2004, 85(3): 240. DOI: 10.1016/j.ijgo.2003.11.018
[13] Mitsui T, Tsukamoto Y, Yamazaki C, et al. Prevalence of hepatitis E virus infection among hemodialysis patients in Japan: evidence for infection with a genotype 3 HEV by blood transfusion.[J]. J Med Virol,2004, 74(4): 563-572. DOI: 10.1002/jmv.20215
[14] Boxall E, Herborn A, Kochethu G, et al. Transfusion-transmitted hepatitis E in a ‘nonhyperendemic’ country[J]. Transfusion Med,2006, 16(2): 79-83. DOI: 10.1111/j.1365-3148.2006.00652.x
[15] Colson P, Coze C, Gallian P, et al. Transfusion-associated hepatitis E, France.[J]. Emerg Infect Dis,2007, 13(4): 648-649. DOI: 10.3201/eid1304.061387[16] Ma X, Lu CP, Meng JH. Sero epidemiological survey of swine hepatitis E in Xinjiang[J]. Virologica Sinica, 2004, 19(3): 285-287. (in Chinese)
马勋,陆承平,孟继鸿. 新疆地区猪戊型肝炎血清流行病学调查[J]. 中国病毒学,2004, 19(3): 285-287.
[17] Jothikumar N, Cromeans TL, Robertson BH, et al. A broadly reactive one-step real-time RT-PCR assay for rapid and sensitive detection of hepatitis E virus[J]. J Virol Methods,2006, 131(1): 65-71. DOI: 10.1016/j.jviromet.2005.07.004
[18] Yan L. Establishment of real-time PCR for detection of swine hepatitis E virus and epidemiological investigation in Yancheng[D]. Daqing:Heilongjiang Bayi Agricultural University, 2016. (in Chinese)
闫蕾. 猪戊型肝炎病毒荧光定量PCR检测方法的建立及盐城地区流行病学调查[D]. 大庆:黑龙江八一农垦大学, 2016.
[19] Lin H,Guan DW,Deng XL, et al. Detection of hepatitis E virus in liver by TaqMan RT-PCR[J]. South China J Prev Med,2015(2): 171-175. DOI:10.13217/j.scjpm.2015.0171(in Chinese)
林虹,管大伟,邓小玲,等. 应用TaqMan荧光定量RT-PCR检测猪肝中戊型肝炎病毒的研究[J]. 华南预防医学,2015(2): 171-175. DOI:10.13217/j.scjpm.2015.0171
[20] Ge SX, Tian KG, Duo HG,et al. Survey of hepatitis E virus infection among commercial pigs in different regions of China[J]. Chin J Zoonoses,2003, 19(2): 108-109. (in Chinese)
葛胜祥,田克恭,多海刚,等. 中国不同地区商品猪中戊型肝炎病毒感染情况调查[J]. 中国人兽共患病杂志,2003, 19(2): 108-109.
[21] Liu M, Li LJ, Xiao W. Geographical distribution of hepatitis E virus genotypes and their subtypes in China[J]. Chin J Zoonoses, 2016, 32(2): 182-187. DOI:10.369/j.issn.1002-2694.2016.02.017 (in Chinese)
刘敏,李丽娟,肖文,等. 中国戊型肝炎病毒基因型及其亚型的地理分布[J]. 中国人兽共患病学报,2016, 32(2): 182-185. DOI:10.369/j.issn.1002-2694.2016.02.017
DevelopmentandapplicationofaSYBRGreenⅡreal-timeRT-PCRfordetectionofswinehepatitisEvirus
LI You-you1, GONG Shuang-yan1, LI Xiao-jing1, MAO Xi-yu1, DENG Yi-chao1, ZHU Ling1,2, XU Zhi-wen1,2
(1.AnimalMedicalCollege,SichuanAgriculturalUniversity,Chengdu611134,China;2.KeyLaboratoryofAnimalDiseaseandHumanHealthofSichuanProvince,SichuanAgriculturalUniversity,Chengdu611134,China)
In order to establish a real-time RT-PCR based on SYBR Green Ⅱ for detection of hepatitis E virus (HEV), a pair of special primers was designed according to the conserved sequences of ORF2 in GenBank. Result showed that the standard curve of established SYBR Green Ⅱreal-time RT-PCR had a wide dynamic range from 4.10×102-4.10×108copies/μL with a linear correlation(r2) of 0.996. The sensitivity could reach 1.00×102copies/μL. The melting curve analysis using SYBR Green Ⅱ dye showed one specific peak with a melting temperature(Tm) of 84.0 ℃±0.1 ℃. No amplification was detected from the RNA samples of porcine reproductive and respiratory syndrome virus, classial swine fever virus, transmissible gastroenteritis virus, porcine bocavirus, porcine epidemic dearrhoea virus porcine kobuvirus and porcine rotavirus by this PCR, respectively. Excellent reproducibility was obtained for detecting constructed positive plasmid DNA with intra-assay of 0.83%-0.94% and inter-assay of 0.83%-0.94%. Further detection of 61 specimens showed that 9 of them were HEV positive, and the results of the quantitative RT-PCR were the same as that of the conventional RT-PCR. In conclusion, the real-time quantitative RT-PCR for HEV is feasible, the real-time RT-PCR established in this study will be useful for earlier rapid laboratory diagnosis and pathogenesis of HEV.
hepatitis E virus; SYBR Green Ⅱ; real-time RT-PCR
Zhu Ling, Email: abtcxzl72@126.com
10.3969/j.issn.1002-2694.2017.11.010
四川省科技支撑计划(No.2014NZ0043),国家“十二五”科技支撑计划(No.2015BAD12B04-2.3)联合资助
朱 玲,Email:abtcxzl72@126.com
1.四川农业大学动物医学院,成都 611134;
2.四川农业大学动物疫病与人类健康四川省重点实验室,成都 611134
R373.2
A
1002-2694(2017)11-1002-05
Supported by the Sichuan Province Science and Technology Support Program (No.2014NZ0043),and the National Science and Technology Support "The 12th Five-Year" Program(No.2015BAD12B04-2.3)
2017-05-22编辑王晓欢

