重组人促红细胞生成素对高氧脑损伤大鼠脑组织Caspase-3、Bcl-2表达的影响
许春花,王永双,杨磊,胡婉婷,赵寒阳
(1延边大学附属医院,吉林延吉133000;2湖北医药学院附属襄阳市第一人民医院)
重组人促红细胞生成素对高氧脑损伤大鼠脑组织Caspase-3、Bcl-2表达的影响
许春花1,王永双1,杨磊2,胡婉婷1,赵寒阳1
(1延边大学附属医院,吉林延吉133000;2湖北医药学院附属襄阳市第一人民医院)
目的探讨重组人促红细胞生成素(rEPO)对新生大鼠高氧脑损伤的影响及其机制。方法将新生Wistar大鼠90只分成空气组、高氧组、治疗组各30只,高氧组和治疗组置于高氧模型箱中,空气组置于氧气室外呼吸空气。于实验第3、7、14天每组处死10只,取大鼠海马组织行HE染色进行病理检查,采用TUNEL染色法检测海马神经细胞凋亡指数,采用Western blotting法检测脑组织中Caspase-3和Bcl-2的相对表达量。结果病理检查显示,高氧组脑组织有不同程度的水肿、坏死和炎症反应,随着暴露于高浓度氧中时间的延长病理改变明显加重,而治疗组明显抑制了高氧诱导的脑组织炎症反应。TUNEL 染色结果表明,高氧组第3、7、14天海马神经细胞凋亡指数均较对照组增高,而治疗组凋亡指数较高氧组降低(P均<0.05)。高氧组第3、7、14天脑组织Caspase-3相对表达量均较空气组升高(P均<0.05),治疗组第7、14天较高氧组降低(P均<0.05),治疗组与空气组比较差异无统计学意义(P均>0.05)。高氧组第7、14天脑组织Bcl-2相对表达量较空气组降低(P均<0.05),治疗组第7、14天较高氧组升高(P均<0.05),治疗组与空气组比较差异无统计学意义(P均>0.05)。结论rEPO能减轻高氧所致的脑损伤,可能与其下调脑组织中Caspase-3及上调抗凋亡蛋白Bcl-2表达有关。
高氧脑损伤;重组人促红细胞生成素;Caspase-3;Bcl-2;大鼠
高浓度氧疗是呼吸窘迫早产儿最常用的治疗方法之一。但高氧可增加脑细胞内致炎细胞因子、神经细胞、血管内皮细胞凋亡,导致细胞凋亡、坏死、炎症反应,通过诱导促炎因子和抑制生长因子信号级联反应来诱发广泛的神经退行性病变[1],从而引起脑损伤。促红细胞生成素(EPO)是一类肽类激素,是由166个氨基酸残基构成的唾液酸糖蛋白。EPO通过抑制细胞凋亡、减轻炎症反应、促进血管再生等途径减轻高氧脑损伤。重组人促红细胞生成素(rEPO)可通过抗神经细胞凋亡、抗氧化、抗炎性反应来维持脑血管正常结构和功能,保护脑组织。2016年7~12月,我们通过制备新生大鼠高氧脑损伤模型,观察大鼠海马组织病理学变化和海马神经细胞凋亡情况,并检测凋亡相关蛋白Caspase-3和Bcl-2的表达,探讨rEPO治疗高氧脑损伤的作用机制,为临床治疗提供理论依据。
1 材料与方法
1.1 材料 普通级Wistar新生大鼠90只,体质量10~15 g,雌雄不限。适应性喂养1周,自由饮水、进食。rEPO购自哈药集团生物工程有限公司,Caspase-3抗体和Bcl-2抗体购自Santa Cruz公司。
1.2 动物分组与处理 将大鼠随机分为空气组、高氧组、治疗组各30只。空气组置于空气中饲养,高氧组和治疗组置于氧浓度80%±2%的高氧模型箱中,三组均保持温度20~25 ℃、湿度70%左右。在新生鼠出生后第2天开始,对治疗组腹腔内注射rEPO,3 000 U/kg,连续13 d,空气组注射相同剂量的生理盐水。于实验第3、7、14天每组各处死10只新生鼠,取出大脑。
1.3 海马组织病理学检查 将新生鼠大脑放入4%中性甲醛中固定,经过脱水、石蜡包埋、5 μm厚切片。行HE染色,光镜下观察海马组织病理学变化。
1.4 海马神经细胞凋亡情况观察 将脑组织包埋切片,运用核染色结合TUNEL染色技术,在荧光显微镜下观察神经细胞凋亡情况。 每张切片记录 500 个脑细胞,计算每 100 个细胞内阳性细胞数,以百分数表示神经细胞凋亡指数。
1.5 脑组织Caspase-3、Bcl-2蛋白检测 采用Western blotting法。将脑组织充分剪碎、匀浆,加入细胞裂解液提取组织蛋白,BCA法测定蛋白浓度。凝胶电泳分离蛋白,湿转法将蛋白转移到硝酸纤维素膜,300 mA恒流40 min。封闭液封闭后PVDF膜过夜,TBS-T缓冲液中充分振荡清洗,分别滴加一、二抗,一、二抗终浓度稀释比例为1∶2 000,ECM显色。X线曝光后显影、定影、晾干。使用凝胶成像系统扫描,图像分析软件对吸光度进行分析,以目标蛋白与β-actin吸光度的比值表示目标蛋白的相对表达量。
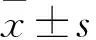
2 结果
2.1 三组海马组织病理变化比较 空气组海马组织细胞形态正常,排列紧密整齐,形态完整,细胞核圆而大,核仁清晰,神经纤维密集,排列整齐。高氧组第3天海马组织部分细胞出现水肿及破裂,部分细胞核溶解、固缩,炎症细胞略增多,海马组织结构破坏;第7天海马组织水肿及破裂的细胞较第3天明显增加,核溶解、固缩的细胞增加,炎症细胞明显增加;第14天以上变化较前加重,海马结构紊乱。治疗组第3、7、14天海马组织的病理变化均较高氧组有所减轻。
2.2 三组海马神经细胞凋亡指数比较 高氧组第 3 、7 、14 天与空气组比较海马神经细胞凋亡指数增高(P均<0.05);治疗组第3、7、14天与高氧组比较细胞凋亡指数降低(P均<0.05)。治疗组与空气组比较差异无统计学意义(P均>0.05)。见表1。

表1 三组各时间点海马神经细胞凋亡指数比较
注:与高氧组比较,*P<0.05。
2.3 三组脑组织Caspase-3相对表达量比较 高氧组第3、7、14天脑组织Caspase-3相对表达量均较空气组升高(P均<0.05);治疗组第7、14天较高氧组降低(P均<0.05),治疗组与空气组比较差异无统计学意义(P均>0.05)。见表2。
2.4 三组脑组织Bcl-2相对表达量比较 高氧组第7、14天脑组织Bcl-2相对表达量较空气组降低(P均<0.05);治疗组第7、14天较高氧组升高(P均<0.05),治疗组与空气组比较差异无统计学意义(P均>0.05)。见表3。

表2 三组各时间点脑组织Caspase-3相对表达量比较
注:与高氧组比较,*P<0.05。

表3 三组各时间点脑组织Bcl-2相对表达量比较
注:与高氧组比较,*P<0.05。
3 讨论
氧疗是重症监护室最常用的治疗方法之一,对呼吸窘迫的治疗效果尤为突出。高压氧治疗能有效改善微循环及缺氧,减轻脑水肿,但易引起氧疗并发症,其中最易受损的器官为脑、肺和视器。随着极低出生体重儿存活率的提高,高氧所致的脑损伤也随之上升。细胞凋亡是神经细胞死亡的重要形式,其病理改变是选择性神经细胞损伤,启动细胞内凋亡相关基因,导致神经细胞凋亡。有研究[2]显示,在高氧引起海马氧化应激时,不论氧化途径、内质网应激还是炎症途径,均可诱发广泛的神经细胞凋亡,引起高氧脑损伤后发生细胞凋亡及其凋亡相关基因的表达。本研究显示,脑组织暴露于高浓度氧时海马神经细胞出现凋亡,随着高氧时间延长,凋亡指数增高。
Bcl-2和Caspase是与细胞凋亡密切相关的基因,在细胞凋亡不同阶段起不同的调控作用[3]。Caspase-3是Caspase家族中最重要的细胞凋亡效应蛋白,是凋亡的执行者[4]。细胞外的环境中尚存在其作用底物,可促进细胞凋亡,故认为抑制Caspase-3信号通路可能是治疗脑损伤的途径之一[5]。细胞凋亡胞内信号途径是使细胞色素C从线粒体释放到胞质引起凋亡,这一过程受Bcl-2蛋白调控。Bcl-2是抗凋亡基因,Bcl-2家族可控制激活或抑制凋亡[6,7],从而决定一个细胞生存或启动细胞凋亡途径来回应细胞内的破坏。缺氧缺血脑损伤后大鼠脑组织中Caspase-3的表达量与神经细胞凋亡数量均明显增加[8],脑创伤后神经细胞会发生凋亡,而凋亡的发生与Caspase-3、Bcl-2等蛋白的调节有关[9]。本研究显示,高氧组比空气组Caspase-3表达量增加,Bcl-2表达量减少,与文献报道一致。
对啮齿类动物实验模型的研究显示,EPO显著影响缺氧缺血、中毒的多个信号通路,EPO可通过抗神经细胞凋亡及活化、阻断兴奋性氨基酸神经毒性、阻止一氧化氮生成及减轻炎症反应等,发挥对脑组织的神经保护效应[10,11]。EPO是神经生存的有效促进剂,它通过降低神经系统的新陈代谢、神经毒性以及兴奋性毒性应激来抵抗神经细胞损伤[12]。保护神经免受谷氨酸毒性和自由基损伤,可能是EPO在高氧脑损伤治疗中的两种可能的治疗机制[13]。EPO的深入研究发现,在高氧脑损伤中,通过外源性地增加EPO的浓度,也可以增加大脑中EPO的浓度,从而携带走氧气,使大脑中的氧浓度降低到生理范围之内,抑制氧化酶的激活,切断ROS的原料供给,致使其浓度下降,从而抑制氧化应激反应的持续发生,减轻大脑损伤。rEPO是一种通过基因重组技术合成的糖蛋白,与天然EPO有着相同氨基酸序列,生物学活性也相似,rEPO已经被证实是预防早产儿贫血的一种有效药物。杨晓等[14]报道,EPO能减少新生鼠坏死性小肠结肠炎(NEC)发生率,使NEC新生大鼠Bcl-2表达增加、Caspase-3表达减少,抑制细胞凋亡,对肠道起保护作用。rEPO在高氧诱导的脑损伤的神经保护效应与伴随而来的各种急性蛋白质的改变这一过程有明显关系[15]。本研究通过检测Caspase-3以及抑制凋亡的主要抗凋亡因子Bcl-2蛋白表达水平来明确高氧脑损伤是否与细胞凋亡有关。结果显示,rEPO治疗能降低新生大鼠高氧脑组织Caspase-3表达,抑制Bcl-2降低。
综上所述,rEPO具有保护脑组织免受高氧损伤的作用,其机制与下调Caspase-3、上调Bcl-2表达有关。
[1] Benderro GF, La Manna JC.Kidney EPO expression during chronic hypoxia in aged mice[J]. Adv Exp Med Biol, 2013,765:9-14.
[2] Ardalan MR, Estakhri R, Hajipour B, et al. Erythropoietin ameliorates oxidative stress and tissue injury following renal ischemia/reperfusion in rat kidney and lung[J]. Med Prine Pract, 2013,22(1):70-74.
[3] 王永霞,马娜,钟兴明,等.Caspase-3、TNF-α、bcl-2、bax在人胎儿卵巢的表达[J].中国医药导报,2015,12(31):21-24.
[4] 曹朝晖,覃剑,董世访,等.IFN-γ和TNF-α联合对MIN6细胞Caspase-3活化的影响[J].免疫学杂志,2014,30(1):17-20.
[5] Nandra KK, Collino M, Rogazzo M, et al. Pharmacological preconditioning with erythropoietin attenuate the organ injury and dysfunction induced in a rat model of hemorrhagic shock[J]. Dis Model Mech, 2013,6(3):701-709.
[6] Watson AJ, Gao L, Sun L, et al. Enhanced preservation of the rat heart after prolonged hypothermic ischemia with erythropoietin-supplemented Celsior solution[J]. J Heart Lung Transplant, 2013,32(6):633-640.
[7] Roubille F, Micheau A, Combes SA, et al. Intracoronary administration of darbepoetin alpha at onset of reperfusion in acute myocardial infarction:results of the randomized Intra-Co-Epo MI trial[J]. Arch Cardiovasc Dis, 2013,982:265-302.
[8] 闫昆明,刘英,张芮,等.新生大鼠缺氧缺血性脑损伤Caspase-3 表达与自由基损伤机制的研究[J].中国免疫学杂志,2015,21(31):1094-1097.
[9] 顾奕,于明琨,吕立权,等.p53、BCL-2、Caspase-3等凋亡相关蛋白在大鼠脑损伤中的表达及意义[J].现代生物医学杂志,2011,11(39):2030-2033.
[10] Jun JH, Shin EJ, Kim JH, et al. Erythropoietin prevents Hypoxia-Indu ced GATA-4 ubiquitination via phosphorylation of serine 105 of G ATA-4[J]. Biol Pharm Bull, 2013,36(7):1126-1133.
[11] 廖飞龙,杨仲璠,刘煜,等.促红细胞生成素的研究进展[J].中国新药杂志,2016,25(1):64-70.
[12] Mastromarino V, Musumeci MB, Conti E, et al. Erythropoietin in cardiac disease: effective or harmful[J]. J Cardiovasc Med (Hagerstown), 2013,14(12):870-878.
[13] Matejkova S, Scheuerle A, Wagner F, et al. Carbamylated erythropoieti n-FC fusion protein and recombinant human erythropoietin during porcine kidney ischemia/reperfusion injury[J]. Intensive Care Med, 2013,39(3):497-510.
[14] 杨晓,梁琨.促红细胞生成素对坏死性小肠结肠炎新生大鼠肠道Bcl-2及Caspase-3蛋白表达的影响[J].临床儿科杂志,2015,33(2):179-183.
[15] 李宜培,牛朝霞,勒力,等.促红细胞生成素对阿尔兹海默病样大鼠记忆能力及凋亡相关蛋白的影响[J].新乡医学院学报,2014,31(8):599-602.
10.3969/j.issn.1002-266X.2017.42.009
R742
A
1002-266X(2017)42-0034-03
吉林省教育厅“十二五”科学技术研究项目(吉教科合字(2015)第20号)。
2017-02-10)

