PI3K/Akt和MAPK信号通路平衡在运动调控高血压血管平滑肌表型转换中的作用
张 琳,吴 迎,曾凡星,石丽君
PI3K/Akt和MAPK信号通路平衡在运动调控高血压血管平滑肌表型转换中的作用
张 琳,吴 迎,曾凡星,石丽君
目的:探究PI3K/Akt(磷脂酰肌醇3激酶/蛋白激酶B)和MAPK(丝裂原活化蛋白激酶)信号通路间平衡在有氧运动调控高血压平滑肌表型转换中的作用。方法:选取3月龄雄性Wistar-Kyoto大鼠(WKY)和自发性高血压大鼠(SHR),随机分为安静组[WKY-SED(正常血压)、SHR-SED(高血压)]、有氧运动组[WKY-EX(正常血压)、SHR-EX(高血压)]。运动组进行8周55%~65% V.O2max强度的跑台运动,观察有氧运动对高血压大鼠胸主动脉管壁厚度、平滑肌标志蛋白和信号蛋白表达的影响。结果:1)与WKY-SED组相比,SHRSED组SBP显著升高(P<0.01),WKY-EX组SBP显著下降(P<0.05)。与SHR-SED组相比,SHR-EX组SBP显著下调(P<0.01)。2)与WKY-SED组相比,SHR-SED组胸主动脉管壁厚度明显增加(P<0.01),WKY-EX组无显著性差异;与SHR-SED组相比,SHR-EX组胸主动脉管壁厚度显著降低(P<0.05)。3)与WKY-SED组相比,SHR-SED组平滑肌收缩表型标志蛋白(α-SM-actin、calponin)蛋白表达显著下调,而合成表型标志蛋白(OPN)显著上调 (P<0.01),WKY-EX组无显著性差异。与SHR-SED组相比,SHR-EX组α-SM-actin、calponin的蛋白表达显著上调,而OPN的蛋白表达显著下调(P<0.05)。与WKY-SED组相比,SHR-SED组p-Akt、eNOS的蛋白表达显著下调(P<0.01),p-ERK、p-p38的蛋白表达显著上调(P<0.01),WKY-EX组p-Akt(P<0.05)、eNOS(P<0.01)的蛋白表达呈上调趋势。与SHR-SED组相比,SHR-EX组p-Akt(P<0.05)、eNOS(P<0.01)的蛋白表达显著上调,p-ERK和p-p38(P<0.05)的蛋白表达显著下调。结论:有氧运动可抑制高血压大鼠VSMC由收缩表型向合成表型转换,且VSMC的表型可能是通过PI3K/Akt和MAPK通路之间的平衡作用进行调控的。
有氧运动;高血压;表型转换;PI3K/Akt;MAPK
高血压作为威胁人类健康的杀手,如不及时发现和治疗将会导致心肌梗塞、中风、肾衰竭,甚至造成死亡。2014年成人高血压的管理指南中指出,60岁及以上高血压患者的治疗目标是血压低于150/90 mmHg,而对于30~59岁的高血压人群来说,要求血压低于140/90 mmHg[14]。血压升高与血管功能密切相关,血管的舒缩活动主要取决于血管平滑肌细胞(vascular smooth muscle cell,VSMC)[11]。VSMC位于动脉管壁的中层,通过舒缩来调节血流阻力和流向外周的血流量。成年个体中,VSMC呈收缩表型,在众多细胞因子和生长因子的调控下,可从处于静息状态的收缩表型转换为具有增殖迁移功能的合成表型。收缩表型的标志蛋白有α平滑肌肌动蛋白(α-SM-actin)、调宁蛋白(calponin)、平滑肌肌球蛋白重链蛋白(SM-MHC),转凝蛋白(SM22α)等,合成表型的标志蛋白有骨桥蛋白osteopontin(OPN),表皮调节素(Epiregulin)[2]。同时,VSMC的这种变化受磷脂酰肌醇激酶信号通路(PI3K/Akt)和丝裂原活化蛋白激酶级联反应(mitogen-activated protein kinase,MAPK)等多种通路的调控[26]。
静坐少动的生活方式导致肥胖、II型糖尿病和心血管疾病等慢性病的发病率大大增加。规律性的有氧运动可以激活体内相关信号通路,从而延缓慢性病的发展进程[20]。运动作为非药物治疗手段,已经被越来越多的高血压患者所接受,坚持长期规律性的有氧运动可以有效降低血压,改善血管舒缩功能,积极地预防心血管疾病。运动改善VMSC的舒缩功能可能是通过调控VSMC的表型来实现的,表型转换在VSMC的功能调控方面起着重要作用。
本实验采用自发性高血压大鼠(spontaneously hypertensive rat,SHR)和正常血压大鼠(Wistar Kyoto rats,WKY),探讨有氧运动对正常血压和高血压大鼠VSMC表型转换的影响及相关信号通路(PI3K/Akt和MAPK)的平衡在VSMC表型转换中的调控。
1 实验材料与方法
1.1 实验动物与分组
选取3月龄雄性SPF级的WKY和SHR各24只。全部大鼠采用国家标准啮齿类动物饲料进行饲养,自由饮食和进水,动物饲养完全符合动物伦理委员会的相关规定。
全部大鼠先进行为期1周的跑台适应性训练,1周后对大鼠进行分组。分组情况如下:正常血压安静对照组(WKY-SED)、正常血压有氧运动组(WKY-EX)、高血压安静对照组(SHR-SED)、高血压有氧运动组(SHR-EX)。WKY-EX和SHR-EX进行8周的跑台运动干预。运动干预方案为:以55%~65%O2max进行训练,20 m/min,60 min/天,5 天/周。
1.3 大鼠尾动脉无创血压测定
测试要求在安静、温暖的环境下,大鼠需保持清醒,用智能无创血压测试仪BP-2010A(软隆生物公司,北京)测量大鼠安静时的尾动脉血压和心率HR。
1.4 H&E染色
选取各组大鼠的胸主动脉进行固定,梯度酒精二甲苯脱水透明后,浸蜡包埋。石蜡块固定于病理切片机上,设置4 μm的蜡片厚度,将胸主动脉切片放于60 ℃烤箱烤2 h。二甲苯脱蜡及梯度浓度酒精水化后,分别用苏木素伊红对细胞核和细胞质进行着色,酒精二甲苯处理后封片。
1.5 免疫组化
检测了各组大鼠胸主动脉α-SM-actin、calponin、OPN的表达。对抗原修复后的各组胸主动脉切片使用0.3%TritonX-100进行打孔处理,BSA封闭20 min后进行免疫反应,滴加一抗于切片上,4 ℃过夜。第2天取出切片,室温下复温1 h后,用0.01 mol/L的PBS缓冲液洗3×5 min(一抗不同要分开洗)。滴加辣根过氧化物酶标记的二抗,室温孵育1h,DAB显色,苏木素复染,梯度酒精和二甲苯处理后,中性树胶封片。
1.6 蛋白免疫印迹分析
采用蛋白免疫印迹技术检测了各组大鼠胸主动脉平滑肌表型标志蛋白α-SM-actin、Calponin、OPN及信号蛋白p-Akt、Akt、eNOS、p-42/44 ERK、42/44ERK、p-p38 MAPK、p38 MAPK、的蛋白表达量。具体操作如下:动物麻醉取大鼠的胸主动脉,剥离干净后投入液氮中暂存。研磨组织至粉状,迅速加入裂解液(PIPA裂解液中已经预先加入了一定比例的蛋白酶抑制剂和磷酸酶抑制剂)。振荡摇匀后离心后取上清液。用BCA试剂盒测定蛋白浓度,样品制备,聚丙烯酰胺凝胶(SDS-PAGE)电泳后,恒流转膜。5%的BSA封闭2 h后加入一抗溶液过夜。第2天加入二抗孵育,ECL发光液滴于PVDF膜上,孵育1 min左右后放入ChemiDoc XRS+ 系统成像。Image Lab™ Software软件根据光密度进行目标蛋白质条带的半定量分析。
1.7 数据统计
统计方法采用平均数±标准差来表示。组间比较采用SPSS 19.0进行单因素方差分析(one way-ANOVA),P<0.05为具有显著性差异,P<0.01为具有非常显著性差异。蛋白印迹法用Image-Lab进行分析,免疫组化用IPP进行分析,统计图表用GraphPad Prism 5制作。
2 实验结果
2.1 各组大鼠的心脏重量指数
表1和图1所示,实验前(initial),SHR-SED组与SHREX组相比,WKY-SED组与WKY-EX组相比,体重无显著差异。8周实验后(fi nal),高血压运动组和正常血压运动组分别与其安静组相比,体重显著下调(P<0.05)。大鼠的心脏重量指数(Heart Weight Index,Heart weight/Body weight),SHR-SED组显著高于WKY-SED组(P<0.01),SHR-EX组显著低于SHR-SED组(P<0.05),WKY-EX组显著高于WKYSED组(P<0.05)。
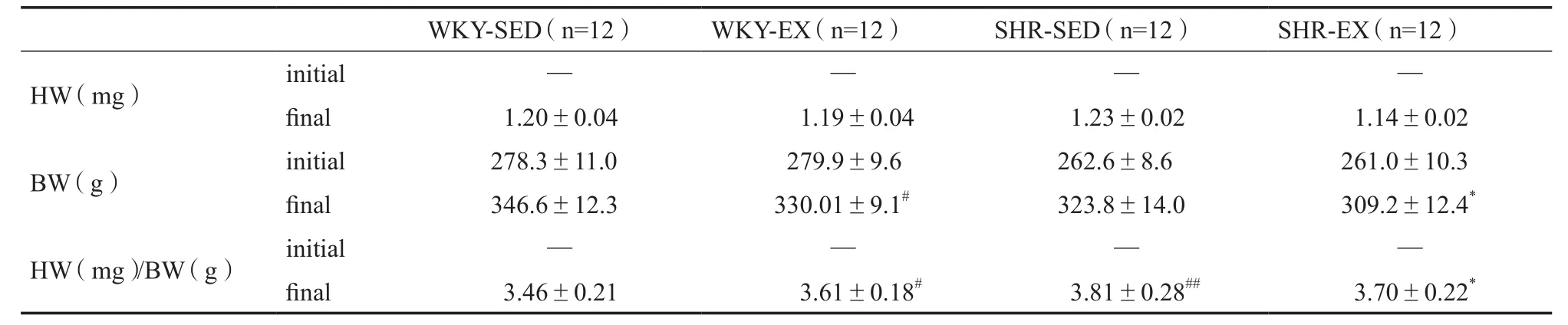
表1 各组大鼠心脏重量指数Table 1 The Heart Weight/Body Weight of Rats

图1 有氧运动对大鼠心脏重量/体重的影响Figure 1. E ff ects of Aerobic Exercise on HW/BW of Rats
2.2 运动对WKY和SHR血压及心率的影响
对WKY和SHR实验前、后的收缩压(SBP)、舒张压(DBP)、平均动脉压(MAP)、HR进行测量后发现:1)实验前:与WKY-SED组相比,SHR-SED组的SBP、DBP、MAP、HR出现显著性上调(P<0.01)。2)8周运动后:与WKY-SED组相比,WKY-EX组的SBP、DBP、MAP、HR虽有所下调,但并未出现显著性的差异。与SHR-SED组相比,SHR-EX组的SBP、MAP、HR均出现显著下调,其中以SBP的下调尤为显著(P<0.01,图2)。
2.3 有氧运动对WKY和SHR胸主动脉管壁厚度的影响
取各组胸主动脉进行H&E染色,比较管壁厚度。与WKY-SED组相比,SHR-SED组胸主动脉管壁厚度显著增加(P<0.01),但与WKY-EX组相比管壁厚度无显著差异。与SHR-SED组相比,SHR-EX组胸主动脉管壁厚度显著下降(P<0.05,图3)。
2.4 有氧运动对WKY和SHR胸主动脉平滑肌表型标志蛋白的分布和表达的影响
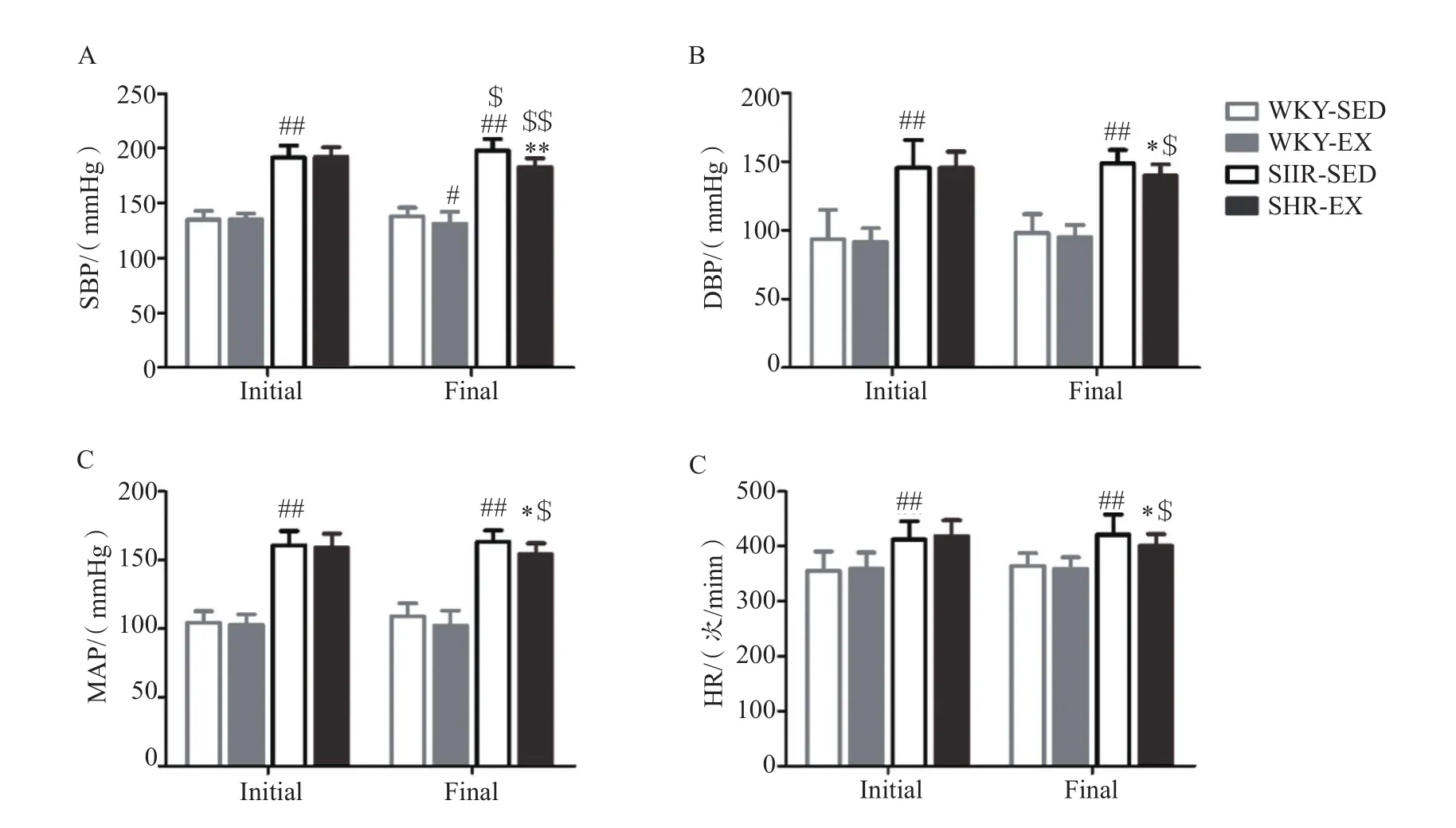
图2 有氧运动对大鼠血压及心率的影响Figure 2. E ff ects of Aerobic Exercise on BP and HR of Rats
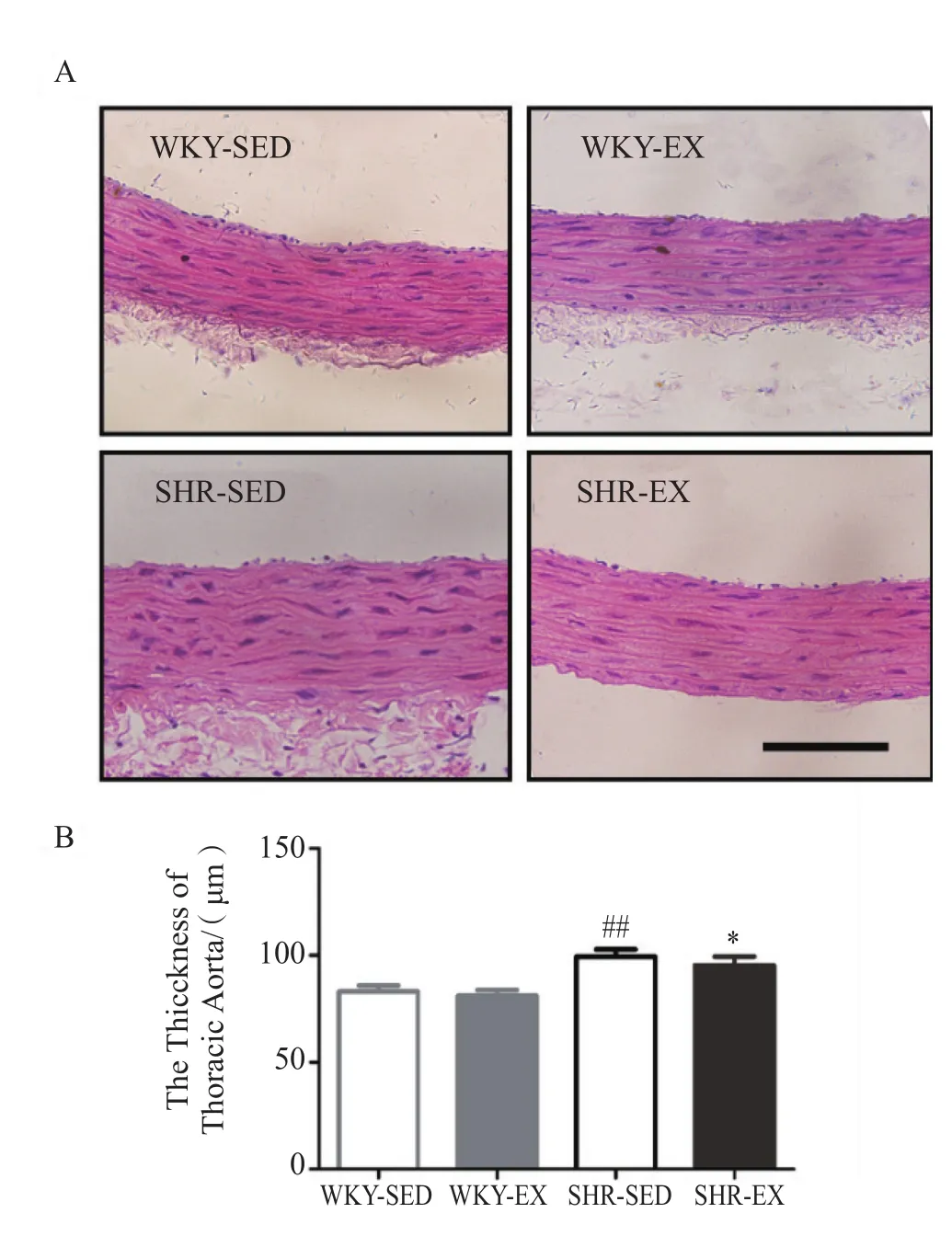
图3 有氧运动对大鼠胸主动脉管壁厚度的影响Figure 3. E ff ects of Aerobic Exercise on the Thickness of Thoracic Aortic Aorta of Rats
免疫组化实验检测了各组大鼠胸主动脉平滑肌表型标志蛋白α-SM-actin、calponin及OPN的蛋白分布及表达。结果表明,与WKY-SED组相比,SHR-SED组中胸主动脉的α-SM-actin、calponin的表达显著下调(P<0.01),而OPN的表达显著上调(P<0.01);与WKY-EX组无明显差异;与SHR-SED组相比,SHR-EX组α-SM-actin、calponin的表达显著上调(P<0.05),而OPN显著下调(P<0.05)。组化染色及统计,结果如图4所示。
2.5 有氧运动对WKY和SHR胸主动脉平滑肌表型标志蛋白表达量的影响
由图5可知,与WKY-SED组相比,SHR-SED组α-SM-actin和calponin的蛋白表达量呈显著性下调(P<0.01),而与SHR-SED组相比,SHR-EX组的α-SM-actin的蛋白表达量显著上调(P<0.05)。WKY-SED组合WKY-EX组无显著性差异。与WKY-SED组相比,SHR-SED组的OPN的蛋白表达显著性上调(P<0.01),而与SHR-SED组相比,SHR-EX组OPN的蛋白表达量出现显著性下调(P<0.05)。WKY-SED组与WKY-EX组之间无显著性差异。
2.6 有氧运动对WKY和SHR胸主动脉平滑肌信号蛋白表达量的影响
本实验有氧运动部分同样对PI3K/Akt/eNOS和MAPK信号通路进行检测。MAPK信号通路中选取了两个与平滑肌表型转化相关的信号,分别是42/44 ERK和p38 MAPK,观察有氧运动对3个通路的磷酸化水平的影响。
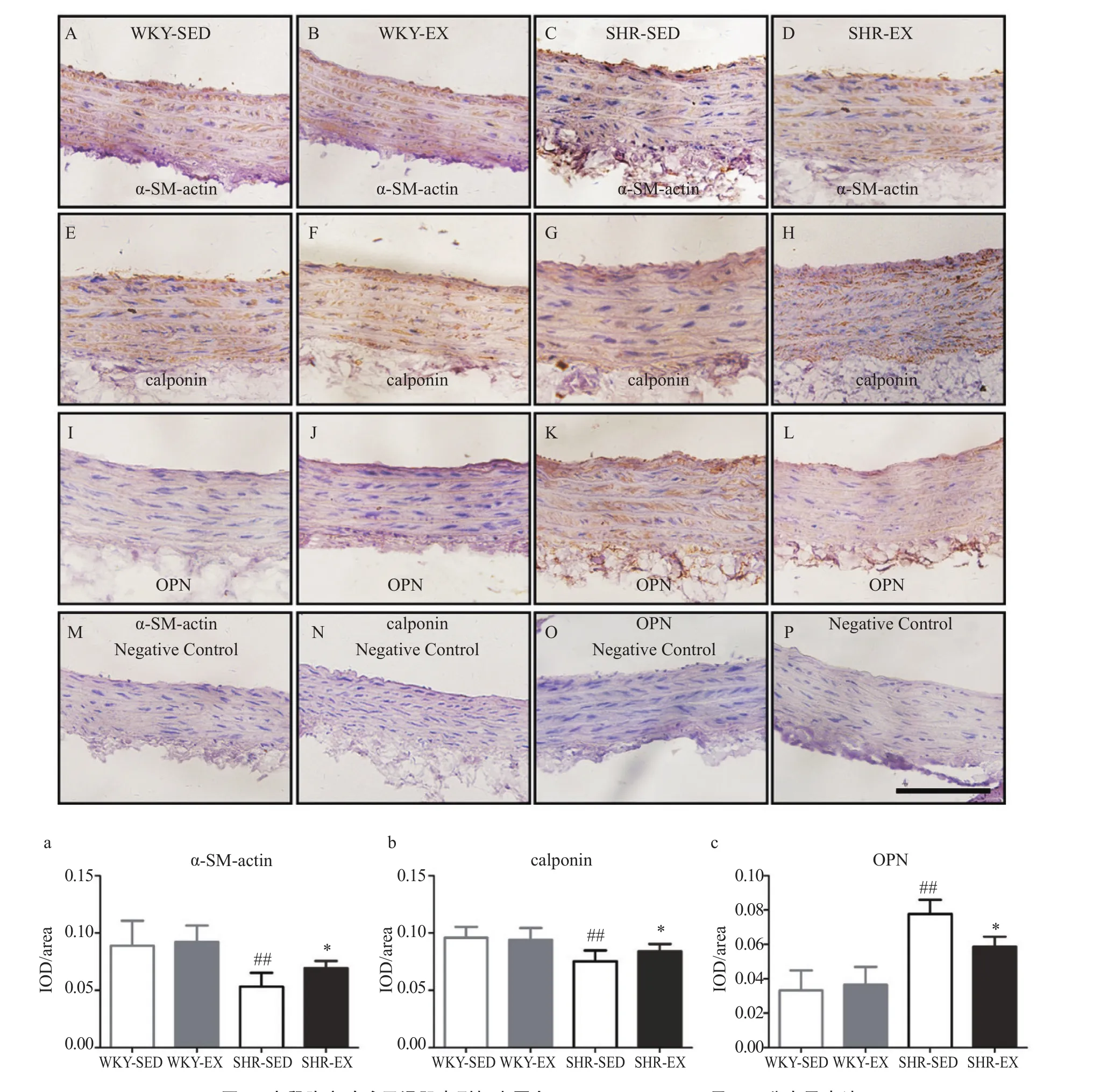
图4 大鼠胸主动脉平滑肌表型标志蛋白α-SM-actin、calponin及OPN分布及表达Figure 4. Protein Expression and Distribution of α-SM-actin,Calponin and OPN in Thoracic Aortic Smooth Muscle Cells
由图6可知,与WKY-SED组相比,WKY-EX组p-Akt的蛋白表达显著性升高(P<0.05),SHR-SED组p-Akt的蛋白表达水平显著性下调(P<0.01)。与SHR-SED组相比,SHR-EX组p-Akt的蛋白表达水平显著性上调(P<0.05)。与WKY-SED相比,WKY-EX组eNOS的蛋白表达量显著性升高(P<0.01),SHR-SED组eNOS的蛋白表达量显著性下调(P<0.01);与SHR-SED组相比,SHR-EX组eNOS的蛋白表达量显著性上调(P<0.05)。
由图7可知,与WKY-SED组相比,SHR-SED组p-42/44 ERK和p-p38 MAPK的蛋白表达量显著上调(P<0.01),而WKY-EX组无显著性差异;与SHR-SED相比,SHR-EX组p-42/44 ERK的蛋白表达量显著下调(P<0.01),SHR-EX组p-p38 MAPK的蛋白表达量也显著下降(P<0.05)。
3 讨论
平滑肌的表型调控在高血压、动脉粥样硬化、肺动脉高压等心血管疾病中发挥重要作用。目前对VSMC表型的研究已经有了一定的进展。VSMC在胚胎时期和血管形成过程中呈合成表型,具有较强的增殖和迁移能力。在成熟个体中,VSMC呈高度分化型,通过舒缩来调控管腔大小、血压以及血流的分布[23]。分化型的VSMC表现出较低的增殖和合成能力,通过表达特殊的收缩蛋白、离子通道及信号分子来完成细胞的收缩功能[24,30]。然而,已有研究表明,VSMC 在成年个体中具有高度的可塑性,当血管发生损伤时,其表型会发生可逆性转变,此过程称之为表型转换(phenotypic switching)[3,4,13]。已有流行病学数据显示,身体活动能够改善血管疾病,降低心血管的发病率和死亡[6,7,28],但鲜见有氧运动对高血压血管平滑肌表型的调控研究。有氧运动调控血压的机制可能是通过逆转VSMC的表型来实现的。
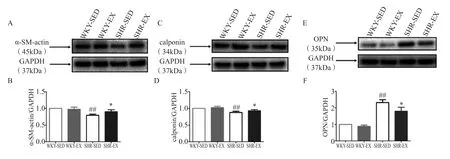
图5 有氧运动对大鼠胸主动脉α-SM-actin蛋白表达量的影响Figure 5. E ff ects of Aerobic Exercise on the Makers Protein Expression of α-SM-actin,Calponin and OPN in Thoracic Aortic Smooth Muscle Cells

图6 有氧运动对大鼠胸主动脉eNOS蛋白表达量的影响Figure 6. E ff ects of Aerobic Exercise on the Protein Expression of p-Akt and eNOS in Thoracic Aortic Smooth Muscle Cells
常用心脏重量指数(Heart Weight Index)来评价心脏肥大的程度。本实验中,有氧运动可以增加正常大鼠的心脏重量指数,降低安静时的HR和收缩压;高血压运动组和安静组对比发现,有氧运动可以减轻因病理原因导致的心脏病理性肥大,降低因高血压引起的HR和心脏重量指数的增加,同时还可以有效降低收缩压和平均动脉压。有氧运动对于正常血压大鼠仍有良好效应,促进其心脏产生运动适应,形成生理性肥大。有氧运动能显著增强正常大鼠的心脏功能,血压降低可能涉及到各种调节机制,从神经系统分析,可能是因为有氧运动有效调节植物神经系统,降低了交感神经的兴奋性,同时增强了迷走神经的调节作用,从而缓解了小动脉的痉挛[21]。
高血压导致血管的结构和功能发生改变,这种改变也体现了机体在高血压症状下的自我防御[22]。在健康个体中,有氧运动可以引起血管结构的适应性变化,这种变化包括冠状动脉阻力的变化[17]。有氧运动可以维持动脉管壁的弹性,延缓动脉管壁增厚的速度,维持动脉管壁原有的结构和功能特点。实验结果显示,SHR安静对照组胸主动脉的管壁厚度要明显大于WKY安静对照组,而有氧运动可以改善高血压大鼠血管壁增厚的现象,与正常血压的安静组相比,经过8周的规律性有氧运动的正常血压有氧运动组胸主动脉的管壁厚度出现一定程度的下降;与高血压安静组相比,高血压有氧运动组胸主动脉的管壁厚度明显减少,猜想血管的弹性和功能都得到了积极性改善。无论是对于高血压大鼠还是正常血压大鼠来说,血管弹性的增强,使得对抗心脏泵出血液的缓冲能力增强,可以贮备更多的势能,即使在血管舒张期也能将血液继续泵向外周。
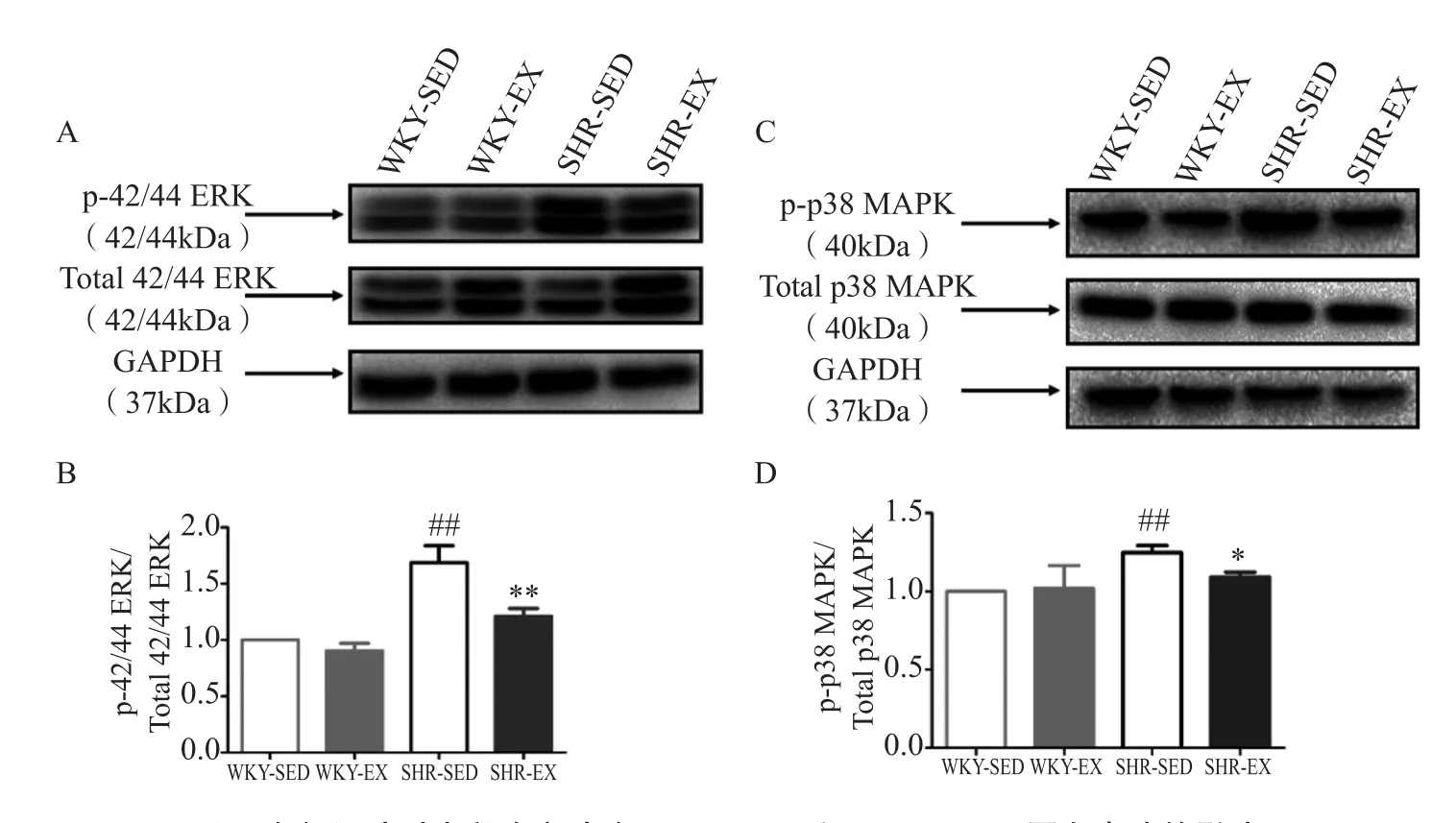
图7 有氧运动对大鼠胸主动脉p-42/44 ERK和p-p38 MAPK蛋白表达的影响Figure 7. E ff ects of Aerobic Exercise on the Protein Expression of p-42/44ERK and p-p38 MAPK in Thoracic Aortic Smooth Muscle Cells
在健康成熟个体中,VSMC以高度分化,无增殖和迁移能力的收缩表型为主,即以α-SM-actin、h1-calponin、SMMHC的蛋白表达为主,而OPN和Epiregulin等合成表型标志蛋白表达较少[29]。一旦血管发生病变,VSMC的收缩表型蛋白表达下调,合成表型蛋白表达上调。高血压的发生可导致VSMC的结构异常和功能紊乱。VSMC在血管损伤过程中的表型调控是一种适应性的表现,然而,这些适应性的变化也导致了动脉硬化或高血压的发生[1,25]。本实验对VSMC收缩表型标志蛋白α-SM-actin、h1-calponin和合成表型标志蛋白OPN的表达量进行了检测。结果表明,SHR安静对照组胸主动脉的收缩表型标志蛋白α-SM-actin和h1-calponin的表达量明显少于WKY安静对照组,相反,SHR安静对照组合成表型标志蛋白OPN的表达量明显多于WKY安静对照组。但经过8周跑台运动干预后,这种现象得到明显逆转。表明,有氧运动可以有效逆转高血压诱导的VSMC的表型转换,使收缩表型标志蛋白呈优势表达,合成表型标志蛋白表达量下调,改变血管的结构,从而恢复血管的舒缩功能。
VSMC的表型转化受多条信号通路的共同调控,蛋白磷酸化往往是信号传递信息改变基因表达的直接方式,转录因子或与其相互作用的蛋白质常常是磷酸化作用的靶点。研究表明,VSMC的表型转换是由细胞Ca2+进行调控的,Ca2+介导细胞内兴奋转录耦联过程,Ca2+通过激活相关信号通路,引起胞内蛋白的异常表达[16]。与VSMC表型转换相关的两条主要信号通路分别为磷脂酰肌醇激酶信号通路(PI3K/Akt/eNOS)和丝裂原活化蛋白激酶信号通路(mitogen-activated protein kinase,MAPK)[12,21]。研究发现,PI3K/Akt信号通路参与到VSMC的表型转换,但对于其作用是维持VSMC的收缩表型还是合成表型还存在争议[8,10,15]。MAPK通路具有三级激酶模式,ERK和p38MAPK是MAPK的亚族,参与到VSMC的表型转换过程中[5,9,19],激活MAPK通路可促进VSMC的增殖和迁移。本实验中,高血压大鼠和正常血压大鼠相比,高血压大鼠分化表型标志蛋白α-SM-actin、h1-calponin表达减少,合成表型标志蛋白OPN增多时,相应的具有活性的p-Akt与eNOS的表达减少,而具有活性的p-ERK和p-p38MAPK作用增强。说明PI3K/Akt/eNOS信号通路对VSMC的表型具有调控作用,维持VSMC的收缩表型。相反,ERK和p38MAPK信号通路主要维持VSMC的合成表型,使其具有增殖和迁移的能力。
有氧运动可以调控SHR的Ras元件,从而改善促炎反应和抗炎反应之间的平衡作用。Roque FR[27]等人用3月龄的SHR的冠状动脉和肠系膜动脉作为研究对象,12周的运动干预后发现,有氧运动可以明显降低高血压大鼠肠系膜动脉的氧化应激现象,同时使得 eNOS的蛋白表达量明显增加,从而进一步改善高血压大鼠VSMC的功能[31]。本实验对调控平滑肌表型转换的信号蛋白检测发现,有氧运动使高血压大鼠p-Akt和eNOS的蛋白表达量均显著上调,同时p-ERK和p-p38水平显著性下调,有氧运动也可使正常血压大鼠的p-Akt和eNOS的蛋白表达量显著上调。说明有氧运动介导的VSMC表型转换是通过促进PI3K/Akt信号通路作用增强,同时抑制MAPK信号通路的作用,从而使得高血压大鼠平滑肌向收缩表型方向转化,抑制其向合成表型方向转化。有氧运动对于正常血压的大鼠血管机能方面也有良好的促进作用。对于正常血压大鼠来说,有氧运动也可以促进PI3K/Akt信号通路的作用增强,从而维持VSMC的收缩表型标志蛋白优势表达。这也印证了VSMC主要以何种表型存在是由PI3K/PKB(Akt)和MAPK两条信号之间的平衡作用决定的。
4 结论
有氧运动可抑制高血压大鼠VSMC由收缩表型向合成表型转换,对VSMC的表型可能是通过PI3K和MAPK通路之间的平衡进行调控的,且使促分化的PI3K/Akt作用增强,促合成的MAPK作用减弱。
[1] AOSHIMA D,MURATA T,HORI M,et al. Time-dependent phenotypic and contractile changes of pulmonary artery in chronic hypoxia-induced pulmonary hypertension.[J]. J Pharmacol Sci,2009,110(2):182-190.
[2] BEAMISH J A,HE P,KOTTKE-MARCHANT K,et al. Molecular regulation of contractile smooth muscle cell phenotype:implications for vascular tissue engineering[J]. Tissue Eng Part B Rev,2010,16(5):467-491.
[3] BENTON J F,SONDERGAARD C S,KASSEM M,et al.Smooth muscle cells healing atherosclerotic plaque disruptions are of local,not blood,origin in apolipoprotein E knockout mice[J].Circulation,2007,116(18):2053-2061.
[4] BENTZON J F,WEILE C,SONDERGAARD C S,et al. Smooth muscle cells in atherosclerosis originate from the local vessel wall and not circulating progenitor cells in ApoE knockout mice[J].ArteriosclerThromb Vasc Biol,2006,26(12):2696-2702.
[5] BRENAN L,ANDREEV A,COHEN O,et al. Phenotypic characterization of a comprehensive set of MAPK1/ERK2 missense mutants[J]. Cell Rep,2016,17(4):1171-1183.
[6] BRIONES A M,TOUYZ R M. Moderate exercise decreases infl ammation and oxidative stress in hypertension:but what are the mechanisms[J]. Hypertension,2009,54(6):1206-1208.
[7] CAMPNELL N R,KHAN N A,HILL M D,et al. 2009 Canadian hypertension education program recommendations:the scienti fi c summary--an annual update[J]. Can J Cardiol,2009,25(5):271-277.
[8] CHOI K H,KIM J E,SONG N R,et al. Phosphoinositide 3-kinase is a novel target of piceatannol for inhibiting PDGF-BB-induced proliferation and migration in human aortic smooth muscle cells[J]. Cardiovasc Res,2010,85(4):836-844.
[9] CUENDA A,ROUSSEAU S. p38 MAP-kinases pathway regulation,function and role in human diseases[J]. Biochim Biophys Acta,2007,1773(8):1358-1375.
[10] FAN Z,LI C,QIN C,et al. Role of the PI3K/AKT pathway in modulating cytoskeleton rearrangements and phenotype switching in rat pulmonary arterial vascular smooth muscle cells[J]. DNA Cell Biol,2014,33(1):12-19.
[11] GERTHOFFER W T. Mechanisms of vascular smooth muscle cell migration[J]. Cir Res,2007,100(5):607-621.
[12] HAYASHI K,TAKAHASHI M,KIMURA K,et al. Changes in the balance of phosphoinositide 3-kinase/protein kinase B (Akt)and the mitogen-activated protein kinases (ERK/p38MAPK) determine a phenotype of visceral and vascular smooth muscle cells[J].J Cell Biol,1999,145(4):727-740.
[13] HOOFNAGLE M H,THOMAS J A,WAMHOFF B R,et al.Origin of neointimal smooth muscle we’ve come full circle[J].Arterioscler Thromb Vasc Biol,2006,26(12):2579-2581.
[14] JAMES P A,OPARIL S,CARTER B L,et al. 2014 evidence-based guideline for the management of high blood pressure in adults:report from the panel members appointed to the eighth Joint National Committee (JNC 8)[J]. JAMA,2014,311(5):507-520.
[15] KAWAHARA S,UMEMOTO S,TANAKA M,et al. Up-regulation of Akt and eNOS induces vascular smooth muscle cell di ff erentiation in hypertension in vivo[J]. J Cardiovasc Pharmacol,2005,45(4):367-374.
[16] KUDRYAVTSEVA O,AALKJAER C,MATCHKOV V V. Vascular smooth muscle cell phenotype is de fi ned by Ca2+-dependent transcription factors.[J]. FFBS J,2013,280(21):5488-5499.
[17] LAUGHLIN M H,BOWLES D K,DUNCKER D J. The coronary circulation in exercise training[J]. Am J Physiol,2012,302(1):H10-H23.
[18] LEANDRO C G,LEVADA A C,HIRABARA S M,et al. A program of moderate physical training for Wistar rats based on maximal oxygen consumption[J]. J Strength Cond Res,2007,21(3):751-756.
[19] LI H,WANG Y P,ZHANG L N,et al. Perivascular adipose tissue-derived leptin promotes vascular smooth muscle cell phenotypic switching via p38 mitogen-activated protein kinase in metabolic syndrome rats[J]. Exp Biol Med(Maywood),2014,239(8):954-965.
[20] LI S,LAHER I. Exercise pills:At the starting line[J]. Trends Pharmacol Sci,2015,36(12):906-917.
[21] MIMURA J,YUASA F,YUYAMA R,et al. The e ff ect of residential exercise training on barore fl ex control of heart rate and sympathetic nerve activity in patients with acute myocardial infarction[J].Chest,2005,127(4):1108-1115.
[22] MULVANY M J. Small artery remodelling in hypertension:causes,consequences and therapeutic implications[J]. Med Biol Eng Comput,2008,46(5):461-467.
[23] OWENS G K,KUMAR M S,WAMHOFF B R. Molecular regulation of vascular smooth muscle cell di ff erentiation in development and disease[J]. Physiol Rev,2004,84(3):767-801.
[24] OWENS G K. Regulation of differentiation of vascular smooth muscle cells[J]. Physiol Rev,1995,75(3):487-517.
[25] ORR A W,HASTINGS N E,BLACKMAN B R,et al. Complex regulation and function of the in fl ammatory smooth muscle cell phenotype in atherosclerosis[J]. J Vasc Res,2010,47(2):168-180.
[26] RENSEN S S,DOEVENDANS P A,VAN EYS G J. Regulation and characteristics of vascular smooth muscle cell phenotypic diversity[J]. Neth Heart J,2007,15(3):100-108.
[27] ROQUE F R,BRIONES A M,GARCIA-REDONDO A B,et al.Aerobic exercise reduces oxidative stress and improves vascular changes of small mesenteric and coronary arteries in hypertension.[J].Br J Pharmacol,2013,168(3):686-703.
[28] RUIVO J A,ALCANTARA P. Hypertension and exercise[J].Rev Port Cardiol,2012,31(2):151-158.
[29] SARTORE S,SCATENA M,CHIAVEGATO A,et al. Myosin isoform expression in smooth muscle cells during physiological and pathological vascular remodeling[J]. J Vasc Res,1994,31(2):61-81.
[30] SOMLYO A P,SOMLYO A V. Ca2+sensitivity of smooth muscle and nonmuscle myosin II:modulated by G proteins,kinases,and myosin phosphatase[J]. Physiol Rev,2003,83(4):1325-1358.
[31] WANG X,CADE R,SUN Z. Human eNOS gene delivery attenuates cold-induced elevation of blood pressure in rats[J]. Am J Physiol Heart Cir Physiol,2005,289(3):H1161-1168.
Role of the Balance of PI3K/Akt and MAPK Pathways in the Aerobic Exercise-induced Regulation of the Phenotypic Switching of VSMC from Spontaneously Hypertensive Rats
ZHANG Lin,WU Ying,ZENG Fan-xing,SHI Li-jun
Objective:This study aimed to explore aerobic exercise-induced the balance of PI3K/Akt and MAPK pathways on the phenotypic switching in the vascular smooth muscle cells from spontaneously hypertensive rats (SHR). Methods:12-week-old male SHR and WKY rats were randomly assigned to sedentary groups (SHR-SED,WKY-SED) and aerobic exercise training groups (SHR-EX,WKY-EX ). Exercise groups were performed an 8-week moderate-intensity treadmill running (55%~65%VO2max). After 8 weeks,thoracic aortic morphological and structural were evaluated. Results:1) Compared with WKY-SED,SBP was signi fi cantly higher than SHR-SED (P<0.01),however,SBP was signi fi cantly lower in WKY-EX ones (P<0.05). Compared with SHR-SED,SBP became signi fi cantly lower than in SHR-EX (P<0.01). 2) Compared with WKY-SED,thoracic aortic wall thickness was increased signi fi cantly in SHR-SED (P<0.01). There was no signi fi cant di ff erences in WKY-EX;Compared with SHR-SED,thoracic aortic wall thickness was signi fi cantly lower in SHR-EX ones (P<0.05). 3) Compared with WKY-SED,α-SM-actin,calponin protein expression level were signi fi cantly lower,and OPN was signi fi cantly higherin SHR-SED (P<0.01),there was no signi fi cant di ff erence between WKY-EX and WKY-SED. Compared with SHR-SED,α-SM-actin,calponin protein expression level were signi fi cantly increased,OPN was signi fi cantly lower in SHR-EX(P<0.05). Compared with WKY-SED,p-Akt (P <0.01) and eNOS (P<0.01) were signi fi cantly lowered,however,p-ERK (P< 0.01) and p-p38 MAPK(P<0.01) were signi fi cant increasing in SHR-SED. In WKY- EX group,the p-Akt (P<0.05),and eNOS (P<0.01) showeda trend of increasing. Compared with SHR-SED,p-Akt (P<0.05) and eNOS (P<0.01) were signi fi cant increasing,p-ERK (P<0.05) and p-p38 MAPK (P<0.05) were signi fi cantly lower in SHR-EX ones. Conclusions:Aerobic exercise can inhibit the phenotypic switching from contractile phenotype to synthetic phenotype,and VSMC phenotype is decided by the balance of PI3K/Akt and MAPK signal pathways.
aerobic exercise;hypertension;phenotypic switching;PI3K/Akt;MAPK
1002-9826(2017)06-0108-09
10. 16470/j. csst. 201706014
G804.7
A
2017-04-12;
2017-08-12
北京市自然科学基金资助项目(5172023);中央高校基本科研业务费专项资金资助项目(2017ZD004)。
张琳,女,在读博士研究生,主要研究方向为运动和心血管生理学,E-mail:zhanglinbsu@126.com。
北京体育大学 运动与体质健康教育部重点实验室,北京100084 Beijing Sport University,Beijing 100084,China.

