有氧运动通过抑制肝脏IKKβ/ NF-κB信号通路改善胰岛素抵抗小鼠炎症反应
杜 杰
有氧运动通过抑制肝脏IKKβ/ NF-κB信号通路改善胰岛素抵抗小鼠炎症反应
杜 杰
目的:探讨连续和间歇有氧运动对胰岛素抵抗小鼠炎症反应的改善作用及IKKβ/NF-κB炎症通路的调控机制。方法:以高脂高果糖饲料喂养小鼠,建立胰岛素抵抗模型。将雄性C57BL/6小鼠随机分为4组:正常对照组(NC)、高脂高果糖喂养对照组(HC)、高脂高果糖喂养连续有氧运动组(HE)和高脂高果糖喂养间歇有氧运动组(HI),每组10只。HE组和HI组小鼠根据运动方案分别进行连续和间歇有氧运动训练,每周5天,共8周。实验结束后,禁食10 h后处死小鼠,采样。采用葡萄糖试剂盒检测血清FBG含量;ELISA法检测血清FINS、TNF-α、FFA、IL-6、IL-10、CRP和APN含量;Western blotting法检测肝脏IKKβ与NF-κB蛋白及其磷酸化表达。结果:经连续和间歇有氧运动干预后,1)胰岛素抵抗小鼠的体质量、FBG含量及FINS含量显著降低(P<0.05),葡萄糖耐量受损情况(AUC值,P<0.05)得到显著改善,胰岛素抵抗指数(HOMA-IR值,P<0.05)显著降低,胰岛素敏感性(QUICKI值,P<0.05)显著增加;2)胰岛素抵抗小鼠血清中促炎因子的含量(TNF-α、FFA、IL-6、CRP,P<0.05)显著降低,血清抗炎因子的含量(IL-10、APN,P<0.05)显著增加;3)胰岛素抵抗小鼠肝脏IKKβ和NF-κB的蛋白磷酸化水平显著降低(P<0.05);4)对于胰岛素抵抗小鼠炎症反应的改善作用,间歇有氧运动优于连续有氧运动。结论:连续和间歇有氧运动均能显著改善由高脂高果糖饮食诱导的胰岛素抵抗及炎症反应,且间歇有氧运动干预效果更佳,其作用机制可能是通过抑制IKKβ/NF-κB炎症通路,减少促炎因子及增加抗炎因子的分泌,从而改善胰岛素抵抗小鼠的炎症反应。
连续有氧运动;间歇有氧运动;胰岛素抵抗;炎症反应;IKKβ/ NF-κB
近年来,由于饮食不当及缺乏运动致使肥胖、高血糖、高血脂、冠心病等代谢综合征的患病率逐年上升,而代谢综合征大多表现出明显的胰岛素抵抗[32,33],研究表明,胰岛素抵抗的发生与炎症反应密切相关[2]。机体组织在发生炎症的情况下会分泌大量的炎性因子,如瘤坏死因子-α(TNF-α)、C反应蛋白(CRP)、白介素-6(IL-6)、瘦素等[27,38,40]。同时,炎症因子与胰岛素相关信号通路相互作用,干扰胰岛素分泌相关基因转录与表达,从而诱发IR。体内核因子-κB(NF-κB)通路被认为是细胞炎症反应信号转导过程中的关键通路[5]。有研究认为,IKKβ/ NF-κB通路在高脂饮食诱导胰岛素抵抗过程中发挥着重要作用[20,21,36]。
研究发现,长期有规律的运动能够有效改善胰岛素抵抗引起的炎症反应,其中,有氧运动能够有效降低肥胖患者血清中的炎症因子TNF-α和IL-6,对机体的炎症反应具有一定的改善作用[12,15]。也有研究表明,不同强度有氧运动均能够降低糖尿病大鼠血清TNF-α含量,改善炎症反应,其中,中等强度有氧运动具有最佳的改善效果[3]。对有氧运动降低机体炎症反应改善胰岛素抵抗的作用机制研究较少。因此,本研究通过对高脂高果糖诱导胰岛素抵抗小鼠进行为期8周的运动训练干预,从IKKβ/ NF-κB炎症通路探讨连续和间歇有氧运动改善胰岛素抵抗小鼠炎症反应的作用机制。
1 材料与方法
1.1 主要仪器与试剂
主要仪器:ZS-PT动物实验跑台(北京众实迪)、低温离心机(美国Beckman)、电泳仪(北京六一)、荧光酶标仪(美国 Bio-Tek)、Real-Time PCR扩增仪(美国Stratagene)、UV-2550紫外可见分光光度计(上海元析)、Universal HoodⅡ凝胶成像系统(美国 Bio-Rad)等。
主要试剂:葡萄糖测定试剂盒,胰岛素测定试剂盒(长春汇力),游离脂肪酸(FFA)、TNF-α、IL-6、CRP、IL-10和脂联素(APN)酶联免疫(ELISA)检测试剂盒(美国R&D公司),BCA蛋白测定试剂盒,蛋白质ECL试剂盒(碧云天生),兔抗鼠β-actin单克隆抗体(北京博奥森),兔抗鼠p-NF-κB p65、NF-κB p65单克隆抗体(Cell Signaling公司),兔抗鼠p-IKKβ、IKKβ单克隆抗体(Bioworld Technology公司)等。
1.2 实验动物及运动方案
实验采用6周龄、雄性C57BL/6小鼠,体质量大约为20~22 g,购于北京维通利华实验动物技术有限公司,许可证号:SCXK(京)2012-0001。动物适应性喂养1周,分笼饲养,自由饮水摄食,给以12 h光照,12 h黑暗,室温为20~25 ℃,相对湿度为40%~50%。
1周喂养后,称量体重,并随机分组。将实验动物分为正常对照组(NC)、高脂高果糖喂养对照组(HC)、高脂高果糖喂养连续有氧运动组(HE)和高脂高果糖喂养间歇有氧运动组(HI),每组10只(表1)。连续和间歇有氧运动方案参考田振军等人运动方案[7],略有改动。HE和HI组小鼠进行跑台运动,1周适应训练,每天以12 m/min训练30 min,训练5天,之后HE组小鼠每天以16 m/min运动60 min,HI组小鼠每天以10 m/min运动12 min、20 m/min运动5 min和15 m/min运动3 min交替进行60 min;每周运动5天,共进行8周。期间各组小鼠每6 天称1次体重,每3 天记录1次进食量。最后1次喂养结束后,禁食不禁水10 h,采用2%浓度的戊巴比妥钠溶液将小鼠麻醉,眼眶取血,将血清分离后置于-20 ℃保存备用。摘取小鼠肝脏组织,液氮速冻,并置于-80 ℃保存备用。
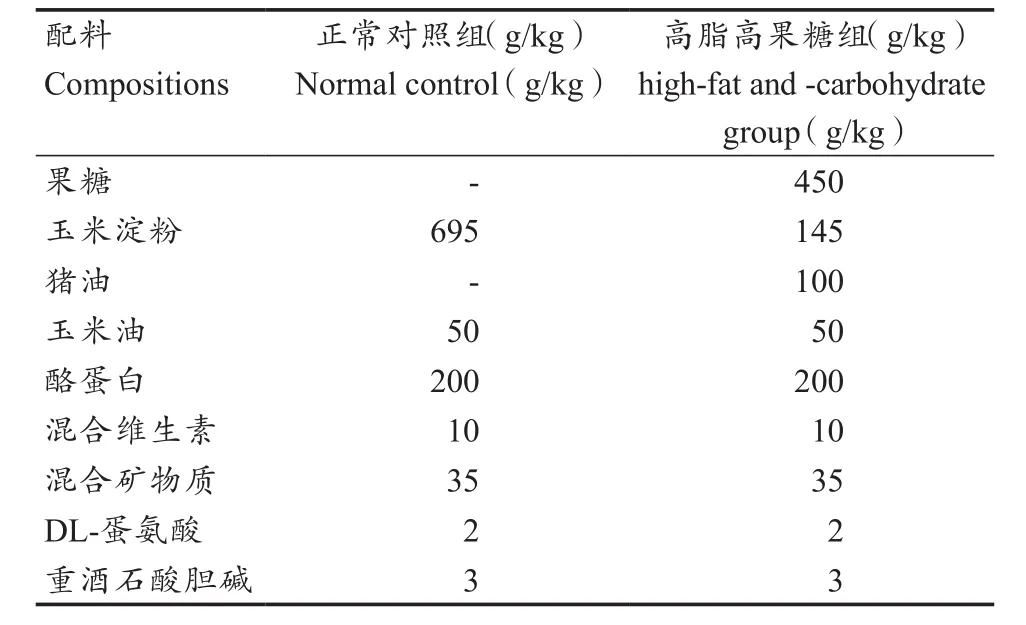
表1 本研究动物饲料配方 [5,16]Table 1 Compositions of Animal Experimental Diets
1.3 空腹血糖(FBG)及口服葡萄糖耐量测定
最后1次喂养结束后,各组小鼠禁食不禁水5 h,尾静脉取血,按照葡萄糖试剂盒方法测定FBG含量。之后进行口服葡萄糖耐量测定,具体步骤为:小鼠灌喂2 g/kg葡萄糖溶液后,分别在0、30、60 和120 min时测定血糖值,绘制口服葡萄糖耐量曲线,AUC值按照公式(1)计算得出。
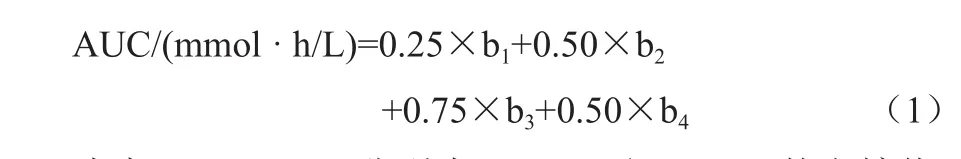
式中:b1、b2、b3、b4分别为0、30、60和120 min的血糖值,mmol/L。
1.4 血清胰岛素(FINS)测定
取各组小鼠备用血清依据ELISA试剂盒的说明测定各组小鼠血清中的FINS水平。胰岛素抵抗指数(HOMA-IR)和胰岛素敏感性指数(QUICKI)按照公式(2)和公式(3)计算得出。

1.5 血清炎症因子的测定
各组小鼠血清TNF-α、FFA、IL-6、IL-10、CRP和APN水平按照ELISA试剂盒方法测定。
1.6 Western blotting法检测肝脏IKKβ和NF-κB蛋白磷酸化水平
取小鼠肝脏0.1 g加入0.5 mL裂解液处理30 min,4 ℃下低温离心(12 000 rpm,20 min),上清液用BCA法分析蛋白。取样蛋白50μL加入电泳孔道,恒压分离蛋白,PVDF转印后置于5%脱脂奶粉的TBST溶液中4 ℃过夜,之后加入稀释后的一抗4 ℃过夜孵育,再移至相对应的二抗稀释液(1:2 000)中37 ℃孵育 1 h,最后滴加ECL Plus化学发光试剂进行显影、定影处理,采用凝胶成像采集系统分析目标条带蛋白信号强度。
1.7 统计学分析
2 结果与分析
2.1 有氧运动对小鼠进食量及体质量的影响
从表2所示的结果中可以看出, HC组、HE组和HI组小鼠的摄食量与NC组相比均显著下降(P<0.05)。根据阿特活特通用数系对小鼠的摄食量能量进行换算后,HC组、HE组和HI组小鼠的能量摄入量与NC组相比较均没有显著性差异(P>0.05)。
肥胖是引起高血糖及胰岛素抵抗的重要原因之一。由图1所示结果可以看出,喂养期间,各组小鼠体重逐渐上升,喂养3周后,与NC组相比,HC组、HE组和HI组小鼠体重显著升高(P<0.05); 与HC组相比,HE组和HI组从第5周开始小鼠体重显著下降(P<0.05); HE组和HI组小鼠的体重增加没有显著性差异(P>0.05)。如表2所示,与NC相比,HC、HE和HI组体重增量分别增加了84%、24.6%和33.3%。与HC组相比,HE和HI组体重增量分别下降了32.3%和27.6%。说明,连续和间歇有氧运动均能显著抑制由高热量饮食引起的体重增加,同时,二者对于体重的影响没有显著性差异(P>0.05)。
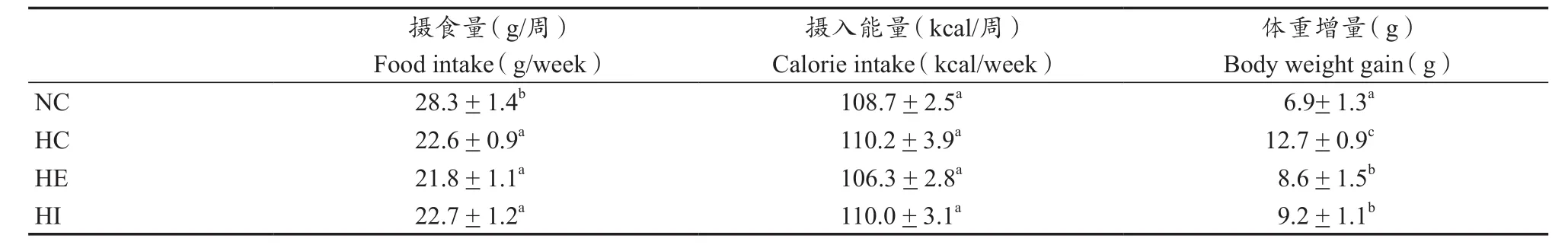
表2 各组小鼠摄食量、能量摄入与体重增加Table 2 The Levels of Food Intake,Calorie Intake and Body Weight Gain in Each Group
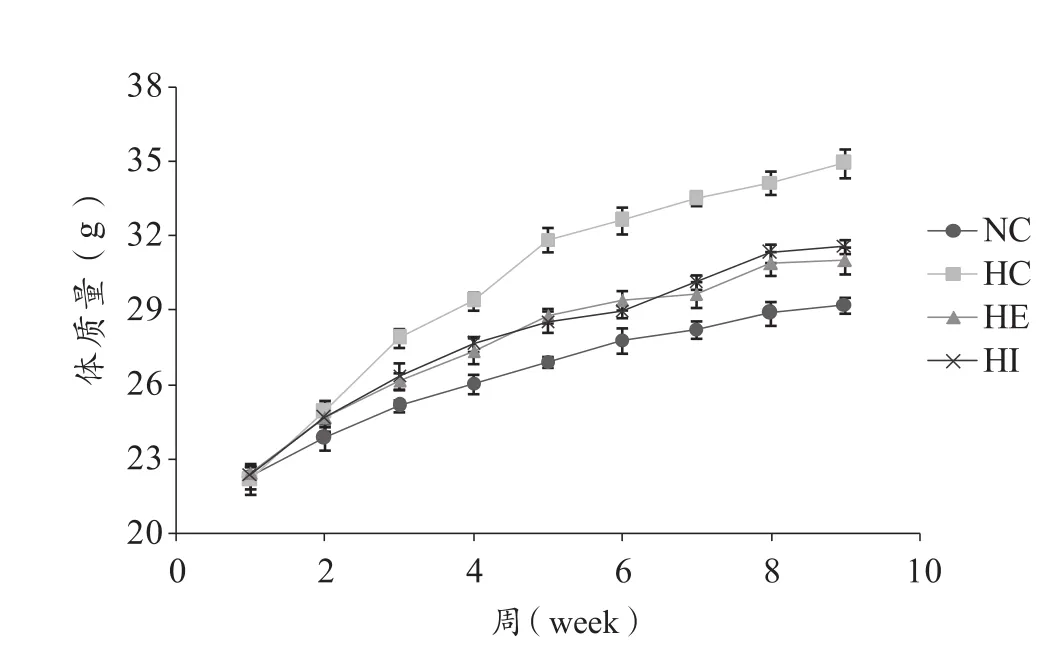
图1 各组小鼠体重增加曲线图Figure 1. Change Curve of Rats` Body Weight
2.2 有氧运动对胰岛素抵抗小鼠FBG和AUC水平的影响
空腹血糖和口服葡萄糖耐量是判断胰岛素抵抗和2型糖尿病重要的指标,其中,AUC值与葡萄糖耐受性呈反比。从表3结果可以看出,经高脂高果糖饲料喂养的HC组FBG和AUC水平较正常饮食的NC组显著升高(P<0.05),表明HC组小鼠出现了高血糖症状。与HC组相比,HE和HI组均能显著降低FBG和AUC(P<0.05),分别下降了12.4%、11.9%和 18.5%、17.1%,结果说明二者均可改善高脂高果糖喂养小鼠引起的高血糖症状,间歇有氧运动干预效果要优于连续有氧运动干预。
2.3 有氧运动对胰岛素抵抗小鼠FINS、HOMA-IR和QUICKI水平的影响
胰岛素抵抗的典型标志是出现高胰岛素血症。胰岛素的抵抗程度一般用HOMA-IR值来表示,胰岛素敏感水平一般用QUICKI值来表示。从表3所示结果可以看出,与正常饲料喂养的NC组相比,经过高脂高果糖饮食,HC组HOMA-IR值显著升高(P<0.05),QUICKI值显著降低(P<0.05),说明成功建立小鼠胰岛素抵抗模型。与HC组相比,HE和HI组小鼠FINS和HOMA-IR值显著降低(P<0.05),QUICKI值显著升高(P<0.05),说明连续与间歇有氧运动有利于改善胰岛素抵抗程度,增加胰岛素敏感性,并且间歇有氧运动效果更佳。
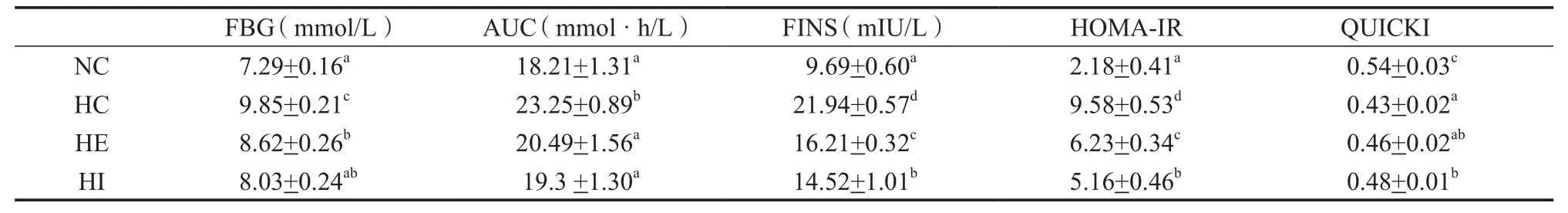
表3 各组小鼠血清FBG、AUC、FINS、HOMA-IR和QUICKI水平的变化表Table 3 The Levels of BloodFBG,AUC,FINS,HOMA-IR and QUICKI in Each Group
2.4 有氧运动对胰岛素抵抗小鼠血清炎症因子的影响
TNF-α、FFA、IL-6和CRP是血清促炎因子。由表4可以看出,喂食高脂高果糖饲料小鼠HC组血清中TNF-α、FFA、IL-6和CRP含量较喂食正常饲料NC组小鼠显著升高(P<0.05),说明HC组小鼠出现炎症反应。与HC组相比,HE组和HI组小鼠血清中TNF-α、FFA、IL-6和CRP含量显著降低(P<0.05),分别降低了15.9%、11.8%、26.5%、13.4%和 24.5%、24.2%、37.2%、26.1%。IL-10和APN是机体分泌的抗炎因子。由表4可以看出,HC组小鼠血清IL-10和APN含量较NC组显著降低(P<0.05),说明高脂高果糖喂养后小鼠抵抗炎症反应能力下降。当连续和间歇有氧运动干预后,HE组和HI组血清中IL-10和APN含量较HC组显著升高(P<0.05),分别增加了16.6%、17.4%和21.6%、34.4%。结果说明,有氧运动能够改善高脂高果糖喂养小鼠慢性炎症反应,并且间歇有氧运动效果优于连续有氧运动干预。

表4 各组小鼠血清TNF-α、FFA、IL-6、CRP、IL-10和APN含量的变化表Table 4 The Levels of BloodTNF-α,FFA,IL-6,CRP,IL-10 and APN in Each Group
2.5 有氧运动对胰岛素抵抗小鼠肝脏IKKβ/ NF-κB炎症通路的影响
为了进一步探究有氧运动对胰岛素抵抗小鼠炎症反应改善的作用机制,对肝脏的关键信号通路IKKβ/NF-κB磷酸化激活水平进行测定。从图2所示结果可以看出,相比正常饲料喂养的NC组,高热量饮食的HC组肝脏IKKβ和NF-κB的磷酸化水平显著增加(P<0.05),说明高糖高脂饮食能够激活小鼠肝脏的IKKβ/ NF-κB炎症通路。与HC组相比,HE组和HI组肝脏IKKβ和NF-κB的磷酸化水平显著下降(P<0.05),分别降低13.9%,17.2%和32.9%,51.7%,说明连续和间歇有氧运动干预能够有效抑制IKKβ/ NF-κB炎症通路,降低胰岛素抵抗小鼠炎症反应,且间歇有氧运动效果更佳。
3 分析与讨论
随着国民经济的发展,人们的饮食结构发生了很大的变化,高脂高果糖饮食的增加引起机体代谢紊乱,尤其是高果糖摄入与胰岛素抵抗的发生密切相关,例如,可乐、果汁等高果糖软饮料的摄入,以及玉米果糖或果葡糖浆作为高价蔗糖甜味剂的替代品,被大量应用于面包、糖果及饮料中。鉴于此,本实验对C57BL/6小鼠喂食高脂高果糖饲料建立了胰岛素抵抗模型,并探讨了连续和间歇有氧运动对该模型小鼠炎症反应的影响,结果表明,连续和间歇有氧运动具有一定改善胰岛素抵抗,降低机体炎症反应及抑制IKKβ/ NF-κB炎症通路的作用。
目前,全世界范围内肥胖人群已达到10亿人口,肥胖人群数呈逐年递增趋势。研究发现,80%以上的肥胖人群表现出慢性炎症及胰岛素抵抗症状[31]。本实验采用以高脂高果糖饲料喂养小鼠,结果发现,喂养8周后,高脂高果糖饮食组小鼠的体重、FBG水平、FINS水平较正常饮食组小鼠显著增加,并且HC组小鼠糖耐量异常状况显著,产生明显的IR症状。对HC组小鼠连续和间歇有氧运动进行8周干预后,小鼠的体质量、FBG水平及AUC值显著降低,FINS水平和胰岛素抵抗指数(HOMA-IR)显著下降,胰岛素敏感程度(QUICK)显著升高,且HI组作用效果更为明显。结果说明,这两种形式的有氧运动均可显著改善高热量饮食诱发的胰岛素抵抗情况,并且间歇有氧运动的效果优于连续有氧运动。
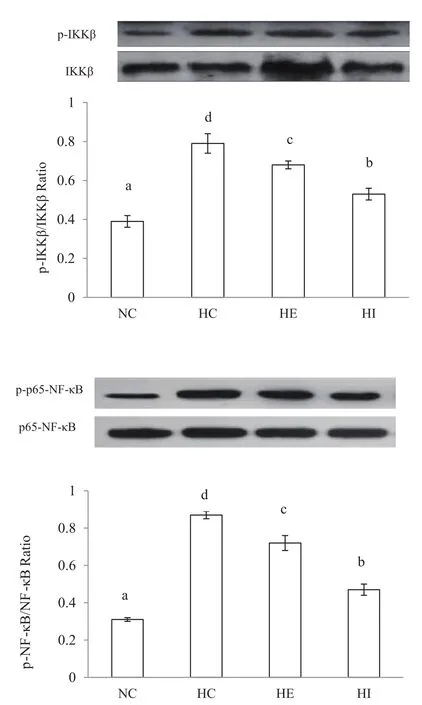
图2 有氧运动对肝脏IKKβ/ NF-κB信号通路的影响图Figure 2. The E ff ect of Aerobic Exercise on IKKβ/ NF-κBChannel of Liver
当机体发生胰岛素抵抗时,炎症因子分泌会发生变化,从而影响葡萄糖的耐受和胰岛素抵抗[25]。研究发现,运动可以减少机体对炎症因子的分泌,从而使机体胰岛素抵抗和炎症反应得以改善。TNF-α和IL-6是两个与运动抗炎症反应关系紧密的炎症因子。TNF-α是机体组织分泌的一种典型的促炎因子,可以促进机体各组织胰岛素抵抗的发生[17,26]。TNF-α使葡萄糖转运蛋白(GLUT4)表达降低,IRS-1的丝氨酸磷酸化水平增加,从而扰乱机体组织对葡萄糖的摄取;TNF-α也能通过影响胰岛素信号通路的转导降低胰岛素的敏感性[28,34]。TNF-α还可诱导脂肪组织产生和释放FFA,激活NF-κB通路产生炎症反应[14]。研究发现,由于机体脂肪组织大量累积会导致血浆中FFA的升高,影响葡萄糖代谢,导致机体组织的胰岛素抵抗[30]。 IL-6是由脂肪组织产生的促炎因子,与TNF-α有一定的协同作用,主要作用于肝脏,能够通过增加肝糖原输出调节葡萄糖转运;IL-6还可使机体脂肪组织大量分解,FFA浓度显著升高,并诱导胰岛β细胞功能受损,致使胰岛素敏感性降低,导致胰岛素抵抗和炎症的发生[11,37]。邹华刚等人研究发现,耐力运动可以降低高脂饮食小鼠的血清TNF-α、IL-6水平,使机体炎症得到改善[18];吴明方研究发现,肥胖患者经过16周有氧运动后,血清TNF-α、IL-6水平有所下降,同时胰岛素抵抗状态得到有效缓解[8,9]。马涛等人研究发现,对高脂喂养大鼠进行有氧运动和补充茶多酚后,胰岛素抵抗作用得到明显的改善,这与炎症因子IL-6和TNF-α的表达和分泌具有一定的联系[6]。林文弢等人实验发现,6周不同强度有氧运动对大鼠肝脏TNF-α的含量具有不同程度的降低,其中以中等强度作用最佳[3]。CRP是由肝脏产生的一种反应全身炎症敏感性的标志物,CRP的表达受到IL-6及TNF-α等炎症因子的调控,可通过介导IL-6与TNF-α的分泌,阻断胰岛素信号通路的转导,致使胰岛素敏感性下降,发生胰岛素抵抗[12]。刘敏等人发现,低肥胖青少年经过4周有氧运动后,机体胰岛素抵抗程度及相关的炎症因子水平(IL-6、TNF-α及CRP)显著下降[4]。张琛琛等人对单纯性肥胖儿童采用运动干预,发现能够降低机体的炎症因子水平(IL-6、TNF-α及CRP)[19]。本实验中,连续和间歇有氧运动均能显著降低胰岛素抵抗小鼠血清促炎因子的含量(TNF-α、FFA、IL-6、CRP)。提示,这两种运动均能显著改善胰岛素小鼠的慢性炎症,其中,间歇有氧运动效果优于连续有氧运动。
除分泌促炎因子外,机体组织还会分泌抗炎因子,其中IL-10和APN是两个具有代表性的抗炎因子。IL-10是机体组织分泌的一种重要的抗炎因子,它可通过阻断NF-κB炎症通路的转导,抑制TNF-α、IL-6等促炎因子的分泌与表达[41]。APN是由脂肪组织产生的一种抗炎因子,被认为是一种胰岛增敏激素。APN可通过增加机体组织对葡萄糖的利用以及促进体内脂肪酸的氧化,改善糖脂代谢紊乱;APN还可阻断NF-κB炎症通路的转导,抑制促炎因子的产生,增加IL-10的分泌,从而有效抑制胰岛素抵抗[17,35]。夏书宇研究发现,对高脂喂养大鼠实行中等强度跑台运动可显著提高脂肪组织APN的浓度[13]。魏姗姗等人研究发现,对高脂饮食大鼠进行8周游泳运动干预,血清TNF-α、IL-6浓度显著下降,APN水平显著升高,糖脂代谢和胰岛素抵抗程度得到明显改善[10]。本实验研究显示,连续和间歇有氧运动均能显著增加抗炎因子的含量(IL-10、APN),提示,两种运动均可通过促进抗炎因子的分泌改善胰岛素小鼠的慢性炎症,且间歇有氧运动作用效果更显著。
NF-κB通路是炎症信号转导的主要途径,参与多种炎症因子基因的表达和调控[1]。正常情况下,NF-κB与IκB蛋白结合,存在于细胞质中,无活性[40],但在外界刺激作用下(如促炎因子),IκB 激酶(IKKβ)发生磷酸化,致使IκB磷酸化,与NF-κB解离,进入细胞核调控炎症因子的分泌与表达[33]。肝脏是机体进行各种代谢的主要器官,也是胰岛素发挥作用的靶组织,因此,肝脏代谢异常是导致机体代谢紊乱,诱发各组织发生胰岛素抵抗的重要原因[22]。研究发现,肥胖和高脂饮食可导致肝脏脂肪堆积,从而激活IKKβ/NF-κB通路,诱导机体发生胰岛素抵抗[20,23,42]。同时,该通路还可抑制FAT/CD36、PPARs、APN及脂肪细胞蛋白的表达,增加促炎因子TNF-α和IL-6的分泌,产生炎症反应。分泌的TNF-α和IL-6进一步激活JNK信号通路加重机体胰岛素抵抗程度[24,29]。因此,抑制肝脏中IKKβ/ NF-κB通路有利于降低炎症反应,改善胰岛素抵抗。本研究中,连续和间歇有氧运动均可不同程度抑制IKKβ和NF-κB的磷酸化蛋白的表达,表明这两种形式的有氧运动可以抑制肝脏IKKβ/NF-κB炎症通路,并且间歇有氧运动抑制效果更为显著。
综上所述,高脂高果糖饮食可导致实验小鼠体重增加、血糖升高、胰岛素水平升高,出现明显的胰岛素抵抗。同时,肝脏IKKβ/ NF-κB炎症通路被激活,体内促炎因子分泌显著增加,抗炎症因子分泌显著下降 ,引起机体的炎症反应。通过连续和间歇有氧运动干预,可在一定程度上抑制IKKβ/ NF-κB炎症通路的转导,调节炎症因子分泌,从而改善机体胰岛素抵抗及炎症反应,并且间歇有氧运动干预效果比连续有氧运动更显著。
[1] 何淋铮. 抑制Kup ff er细胞NF-κB介导的炎症通路改善C57/BL6小鼠追赶生长和高脂饮食所致胰岛素抵抗[D]. 武汉:华中科技大学,2014.
[2] 胡世伟,王静凤,徐慧,等. 刺参岩藻聚糖硫酸酯对胰岛素抵抗小鼠炎症改善作用的研究[J]. 中国海洋药物,2015,34(6):49-56.
[3] 林文强,李品芳,翁锡全. 不同强度有氧运动对糖尿病大鼠肝脏炎症状态的影响[J]. 体育学刊,2011,18(3):136-139.
[4] 刘敏,冯连世,王晓慧. 4周有氧运动对肥胖青少年胰岛素抵抗及炎症因子的影响[J]. 上海体育学院学报,2015,39(3):87-89.
[5] 毛磊,王静凤,陈鹏,等. 梅花参岩藻聚糖硫酸酯对胰岛素抵抗小鼠慢性炎症的改善作用及其机制研究[J]. 中国海洋药物,2016,35(2):51-58.
[6] 马涛,王法涛,单小忠. 有氧运动与补充茶多酚对高脂膳食大鼠糖脂代谢及炎症因子TNF-α和IL-6的影响[J]. 北京体育大学学报,20l1,34(6):63-67.
[7] 田振军,贺志雄,刘智炜,等. 连续和间歇有氧运动对心梗大鼠心肌Myostatin及其受体表达的影响[J]. 体育科学,2013,33(11):66-74.
[8] 唐晖,谢敏豪. 肥胖与运动研究进展-慢性炎症反应学说[J].体育科学,2008, 28(8):54-59.
[9] 吴明方. 肥胖者有氧运动抗炎效应的实验研究[J]. 中国体育科技,2010,46(3):106-108.
[10] 魏珊珊,梁丹丹. 运动对高脂饮食大鼠TNF-α、IL-6及脂联素的影响[J]. 中国应用生理学杂志,2013,29(3):280-282.
[11] 王学娟. 虾青素酯对胰岛素抵抗模型小鼠慢性炎症的影响及作用机制研究[D]. 青岛:中国海洋大学,2015.
[12] 徐建方,张漓,冯连世,等. 不同运动方式对肥胖青年身体慢性炎症状态的影响[J]. 体育科学,2015,35(10):30-36.
[13] 夏书宇. 不同强度跑台运动对高脂饮食大鼠脂肪组织PPARs/脂联素/TNF-αmRNA的影响[J]. 成都体育学院学报,2015,41(3):98-102.
[14] 杨姗姗,胡秀芬,温宇. 脂毒性一炎症反应与胰岛素抵抗的关系研究进展[J].生理科学进展,2011,42(2):112-117.
[15] 于爱平. 肥胖者有氧运动抗炎效应的实验研究[D]. 苏州:苏州大学,2010.
[16] 张昕,赵延蕾,陈睿曦,等. 海参岩藻聚糖硫酸酯对小鼠胰岛素抵抗及炎症因子的影响[J]. 食品科学,2014,35(21):201-206.
[17] 张豫文,洪洁. 炎症因子与胰岛素抵抗[J]. 诊断学理论与实践,2010,9(1):90-94.
[18] 邹华刚,陈香仙. 耐力运动通过抑制HIF-1α/iNOS预防高脂饮食小鼠脂肪组织炎症[J]. 中国体育科技,2016,52(2):85-89.
[19] 张琛琛,司虎克. 营养和运动综合治疗对单纯性肥胖儿童血脂水平、瘦素抵抗以及炎症反应的影响[J]. 海南医学院学报,2014,20(12):1696-1698.
[20] ALKALAY I,YARON A,HATZUBAI A,et al. Stimulation-dependent I kappa B alpha phosphorylation marks the NF-kappa B inhibitor for degradation via the ubiquitin-proteasome pathway[J].Proc Natl Acad Sci U S A,1995,92:10599-10603.
[21] BAKER R G,HAYDEN M S,GHOSH S. NF-kappaB,in fl ammation,and metabolic disease[J]. Cell Metab,2011,13(1):11-22.
[22] BOONLOH K,KUKONGVIRIYAPAN U,PANNANGPETCH P,et al. Rice bran protein hydrolysates prevented interleukin-6 and high glocuse-induced insulin resistance in Hep G2 cells [J].Food Funct,2015,(6):566-573.
[23] CAI D,YUAN M,FRANTZ D F,et al. Local and systemic insulin resistance resulting from hepatic activation of IKK- and NF-B[J]. Nat Med,2005,11(2):183-190.
[24] DASGUPTA S,BHATTACHARYA S,BISWAS A,et al. NF-kappaB mediates lipid-induced fetuin-A expression in hepatocytes that impairs adipocyte function e ff ecting insulin resistance[J].Biochem J,2010,429(3):451-462.
[25] FRANCZAK A,ZMIJEWSKA A,KUROWICKA B,et al. The e ff ect of tumor necrosis factor Q (TNF-Q),interleukin I B(IL·I B)and Interleu·kin 6(IL-6)on endometrial PGF2 a synthesis,metabolism and release in early-pregnant pigs[J]. Theriogen,2012,77(1):155-165.
[26] HAWLA A,NGUYEN K D,GOH Y P. Macrophagem ediated in- fl ammationin metabolic disease[ J]. Nat Rev Immunol,2011,11(11):738-749.
[27] HOTAMISLIGIL G S,ARNER P,CARO J F,et al. Increased adipose tissue expression of tumor necrosis factor-alpha in human obesity and insulin resistance[J]. J Clin Invest,1995,95(5):2409-2415.
[28] HOTAMISLIGIL G S,SHARGILL N S,SPIEGELMAN B M.Adipose expression of tumor necrosis factor-alpha:direct role in obesity—linked insulin resistance[J]. Sci,1993,259(5091):87-91.
[29] JADHAV A,TIWARI S,LEE P,et al. The heme oxygenase system selectively enhances the anti-in fl ammatory macrophage-M2 phenotype,reduces pericardial adiposity,and ameliorated cardiac injury in diabetic cardiomyopathy in Zucker diabetic fatty rats[J].J Pharmacol Exp Ther,2013,345(2):239-249.
[30] JIAO K,LIU H,CHEN J,et al. Roles of plasma interleukin-6 and tumor necrosis factor-α and FFA and TG in the development of insulin resistance induced by high-fat diet[J]. Cytokine,2008,42(2):161-169.
[31] KAHN S E,HULL R L,UTZSELMEIDERK M. Mechanisms linking obesity to insulin resistance and type 2 diabetes[J]. Nature,2006,444(7121):840-846.
[32] KALUPAHANA N S,MOUSTAID N,CLAYCOMBE K J. Immunity as a link between obesity and insulin resistance[J]. Mol Aspects Med,2012,33(1):26-34.
[33] KARIN M. How NF-kappaB is activated:the role of the IkappaB kinase (IKK) complex[J]. Oncogene,1999,18(49):6867-6874.
[34] KONGCHI R,ZHANG L,WANG N,et al. Effects of paeoniflorin on tumor necrosis fsctor-a induced insulin resistance and changes of adipolines in 3T3-LI adipocytes [J]. Fitoterapia,2013,91:44-50.
[35] KIM J,AHN J. E ff ect of zinc supplementation on in fl ammatory markers and adipokines in young obse women[J]. Biol Trace Elem Res,2014,157(2):101-106.
[36] KIM J,LEE M H,NAM D H,et al. Celastrol,an NF-kappaB inhibitor,improves insulin resistance and attenuates renal injury in db/db mice[J]. PLoS One,2013,8(4):e62068.
[37] NDISANG J F,JADHAV A. Hemin therapy suppresses in fl ammation and retroperitoneal adipocyte hypertrophy to improve glucose metabolism in obese rats co-morbid with insulin-resistant type-2 diabetes[J]. Diabetes Obes Metab,2013,15(11):1029-1039.
[38] ROYTBLAT L,RACHINSKY M,FISHER A,et al. Raised interleukin-6 levels in obese patients[J]. Obesity,2000,8(9):673-675.
[39] SARTIPY P,LOSKUTOFF D J. Monocyte chemoattractant protein 1 in obesity and insulin resistance[J]. Proc Natl Acad Sci U S A,2003,100(12):7265-7270.
[40] SCHEIDEREIT C. IkappaB kinase complexes:gateways to NF-kappaB activation and transcription[J]. Oncogene,2006,25(51):6685-6705.
[41] SHARMA A K,RAIKWAR S K,KURMIURMI M K,et al.Gem fi brozil and its combination with metformin on pleiotropic e ff ect on IL-10 and adiponectin and anti-atherogenic treatment in insulin resistant type 2 diabetes mellitus rats[J]. In fl ammopharma,2013,21(2):137-145.
[42] YAMAMOTO Y,GAYNOR R B. Therapeutic potential of inhibition of the NF-kappaB pathway in the treatment of in fl ammation and cancer[J]. J Clin Invest,2001,107(2):135-142.
Aerobic Exercise Improving In fl ammatory by Inhibiting Hepatic IKKβ/NF-κB Signaling Pathway in Insulin Resistance Mice
DU Jie
Objective:The aim of this study was to investigate the anti-in fl ammatory e ff ects of continuous and interval aerobic exercise and the corresponding hepatic signaling pathways IKKβ/ NF-κB in insulin resistant mice. Methods:The insulin resistant mice model was established by feeding with high-fat and -fructose diet. Male C57BL/6 mice were randomly divided into four groups with 10 mice each:normal control group (NC),high-fat and –fructose diet (HC),high-fat and–fructose diet/continuous aerobic exercise (HE) and high-fat and–fructose diet/interval aerobic exercise (HI).HE and HI group were subjected to 8-weeks continuous and intermittent aerobic exercise training,5 days per week. After experiments,the mice were sacri fi ced after 10 h fasting. The ELISA kits were used to measure the contents of serum glucose,FINS,TNF-α,FFA,IL-6,IL-10,CRP and APN.Western blotting was performed to detect the expression of IKKβ and NF-κB. Results:1) After the continuous and interval aerobic exercise training,the body weight and the levels of FBG and FINS signi fi cantly reduced (P<0.05),in the meantime,impaired glucose tolerance (AUC,P<0.05) was signi fi cantly improved as well as insulin resistance (HOMA-IR,P<0.05),which is accompanied with the enhanced sensitivity to insulin (QUICKI,P<0.05);2) The serum proin fl ammatory factors TNF-α,FFA,IL-6,CRP levels were significantly decreased (P<0.05),and serum anti-flammatory factors IL-10,APN levels were significantly increased (P<0.05);3) The phosphorylation of IKKβ and NF-κB in the liver of insulin-resistant mice were significantly reduced (P<0.05);4) The interval aerobic exercise group had a better e ff ect on the improvement of insulin resistance and in fl ammation than continuous aerobic exercise group. Conclusion:Both continuous and interval aerobic exercise can significantly improve the hyperglycemia and insulin resistance,inhibit thesecretion of pro-inflammatory cytokines,and increase the secretion of anti-inflammatory factors by inhibiting hepatic IKKβ/NF-κB signaling pathway in insulin resistant mice. Moreover,interval aerobic exercise has a better e ff ect.
continuous aerobic exercise;interval aerobic exercise;insulin resistance;in fl ammatory;IKKβ/NF-κB
1002-9826(2017)06-0101-07
10. 16470/j. csst. 201706013
G804.7
A
2016-12-09;
2017-09-06
教育部人文社会科学基金资助项目(16YJC890006)。
杜杰,男,讲师,博士,主要研究方向为运动生化与营养、民族传统体育学,E-mail:sdwushu@sxu.edu.cn。
山西大学 体育学院,山西 太原 030006 Shanxi University, Taiyuan 030006,China.

