5周间歇性亚极限强度运动中大鼠睾丸组织StAR及其调控因子的时序性变化
汤 昆,张 漓
5周间歇性亚极限强度运动中大鼠睾丸组织StAR及其调控因子的时序性变化
汤 昆1,2,张 漓1
目的:探讨5周间歇性亚极限强度运动引起大鼠睾酮水平下降的可能机制。方法:8周龄SD大鼠分为运动干预组和安静对照组,运动组大鼠以尾部负重的方式(6%体重)进行4 min×5次游泳训练,间隔90 s,上、下午各进行1次训练,每周6天,分别持续1、2、3、4、5周。各组大鼠末次训练结束48 h后取材,测定StAR、PKA、pCREB、SF-1等相关蛋白及基因mRNA变化情况。结果:1)运动干预组血睾酮水平后2周下降幅度较大,第5周血睾酮水平与安静对照组相比下降了70%(P<0.01)。2)运动干预组大鼠StAR mRNA在第5周出现了显著性下降(P<0.05)。3)大鼠睾丸组织PKA、pCREB、SF-1蛋白表达以及SF-1 mRNA表达在后2周出现了显著下降(P<0.05)。结论:5周间歇性亚极限强度运动引起大鼠睾丸间质细胞内StAR及其相关调控因子PKA、pCREB、SF-1等表达下降,进而引起胆固醇转运受限,这可能是导致睾酮合成和血液睾酮水平下降的原因之一。
运动性低睾酮;亚极限强度运动;StAR;时序性变化;大鼠
血清睾酮是常用的机能评定指标,越来越多被用于评定运动员的训练负荷,运动负荷强度和负荷量都会对血睾酮产生影响[12],测定运动员机体血睾酮水平不仅有助于教练员合理地安排运动员运动强度、运动量,而且在消除疲劳过程中都起到重要作用。有研究表明,睾酮合成的主要限速步骤是胆固醇由线粒体外膜向线粒体内膜转运的过程,在这过程中StAR蛋白起到了关键性的作用。有研究证实,长时间大强度运动会导致StAR mRNA下降,这也被认为是睾酮水平显著降低的重要诱因,然而,StAR mRNA下降的原因却鲜见报道。本研究拟利用低睾酮动物模型,以StAR调控通路为研究内容,重点探讨长期间歇性无氧训练导致StAR mRNA下降的过程及原因。
1 材料与方法
1.1 实验动物与饲养条件
成年SPF/VAF级雄性SD大鼠95只,体重300±16.16 g,购自北京维通利华实验动物技术有限公司,许可证号SCXK(京)2012-0001。大鼠分笼饲养,每笼5只,以标准啮齿类动物饲料饲养,大鼠自由饮食饮水,定期更换饲料垫料。室温22±2 ℃,空气湿度为45%~55%,每天光照12 h。
1.2 动物分组与运动方案
适应性饲养3天后,所有大鼠进行适应性游泳训练(每天无负重游泳30 min,共6天)。适应性游泳之后,随机分为7组:安静饲养0周和5周对照组(C0、C5组),各10只;训练1周、2周、3周、4周、5周组(T1、T2、T3、T4、T5组),各15只。运动组大鼠以尾部负重的方式进行4 min×5次游泳训练,根据预实验结果将负重定为6%体重。每次间隔90 s,上、下午各进行1次训练,每周6天,持续5周。每桶5只,水深35 cm,水温30±2 ℃。训练在每天上午8:00~12:00和下午2:00~6:00完成。每周一上午训练之前记录大鼠体重。对照组安静饲养。
1.3 动物处死与取材
在训练过程中,有个别大鼠溺亡。各组末次训练结束时剩余:T1组15只,T2组14只,T3组15只,T4组14只,T5组13只。各组末次训练结束后第3分,剪尾取10 μL尾血,检测血乳酸情况。各组大鼠末次训练结束安静饲养48 h后处死。处死前禁食12 h。称量体重后,按照1 mL/100g体重的剂量腹腔注射10%水合氯醛麻醉大鼠,迅速剖开腹腔,分离出腹主动脉,用一次性采血针和采血管取血,迅速3 000 r/min离心10 min,分离血清,-20 ℃冰箱保存。摘取右侧睾丸,称重,-80 ℃保存。
1.4 实验仪器和试剂
主要仪器有免疫测定仪(Beckham Counter,Access2),乳酸盐分析仪(ECK,C-line sport),全自动生化分析仪(Hitachi,7020),低温离心机(ThermoFisher,Biofuge 28RS),电泳仪(Bio-RAD,Power PacTMBasic),化学发光成像系统(Bio-RAD,ChemiDoc Touch),酶标仪(Labsystems Dragon,Wellscan MK3)。主要试剂包括:CK测定试剂盒购自上海科华生物工程股份有限公司,BU测定试剂盒购自上海荣盛生物药业有限公司,睾酮测定试剂盒购自贝克曼库尔特商贸(中国)有限公司,LH 酶联免疫测定试剂盒自北京赛驰生物科技有限公司,SOD、MDA测定试剂盒购自南京建成生物工程研究所,StAR、 pCREB、SF-1、GAPDH一抗、HRP标记的二抗均购自美国Abcam公司,RT-PCR反转录及反应试剂盒购自TaKaRa公司。
1.5 测试指标与主要方法
1.5.1 血液指标测定
血乳酸采用ECK C-line乳酸盐分析仪进行检测,睾酮采用BeckhamCounter Access2免疫测定系统进行测试,SOD采用羟胺法,MDA采用TBA法,LH采用酶联免疫吸附测定法(Elisa)进行测试。上述测试均严格按照仪器及试剂说明书进行。
1.5.2 Western Blot法检测睾丸组织蛋白表达
取大鼠睾丸组织50 mg剪碎于EP管中,加入1 mL预冷组织裂解液(由RIPA蛋白裂解液、蛋白酶抑制剂、磷酸酶抑制剂按100:1:1的比例配制而成),10 000 g离心15 min后取上清,采用BCA法测定并调整蛋白浓度,加入上样缓冲液后沸水浴10 min。随后即可进行SDS-PAGE凝胶电泳实验,本实验电泳主要参数为:上层胶80 V,30 min;下层胶110 V,60 min,电泳完成后采用半干转方式转移至PVDF膜上。5%脱脂奶粉封闭2 h,加入一抗4 ℃过夜,次日TBST洗涤3次后加二抗(1:5 000),室温摇床孵育1 h。然后TBST洗膜3次,滴加ECL发光液,放入化学发光成像系统曝光显影,条带用Image J软件进行图像分析,计算目的蛋白与内参蛋白条带积分光密度(IOD)的相对值。
1.5.3 RT-PCR法检测StAR和SF-1转录变化
采用Trizol法提取总RNA,随后应用反转录试剂盒将RNA反转录为cDNA(反应条件为:37 ℃,15 min;85 ℃ 5 s;4 ℃保持)。以合成的cDNA为模板,以GAPDH为内参,RTPCR扩增(反应条件为:预变性95 ℃,30 s;PCR反应95 ℃,5 s;60 ℃,31 s;40个循环)。根据收集的数据通过荧光定量PCR所得数据用2-△△Ct法进行相对定量。所有基因引物均参照GeneBank数据库,由上海生工生物有限公司设计并合成。
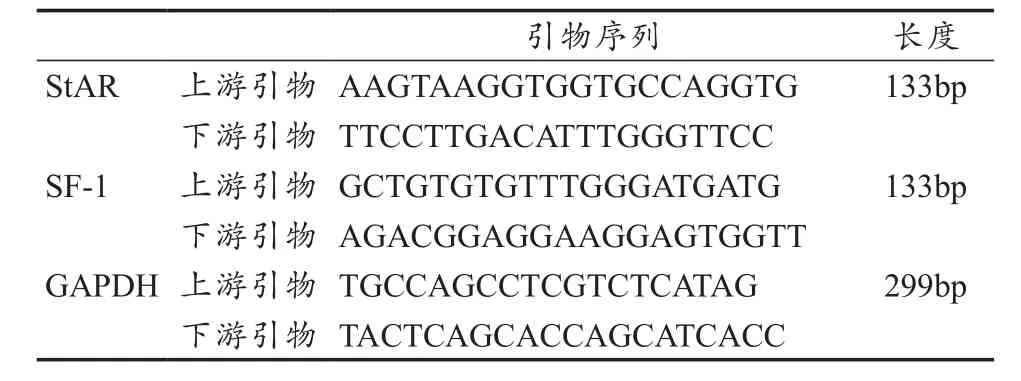
表1 本研究RT-PCR反应引物序列一览表Table 1 Primer Sequence of RT-PCR Reaction
1.6 数据统计与处理
2 实验结果
2.1 大鼠一般情况
在整个实验期间,对照组大鼠神态安静,活泼好动,反应灵敏,皮毛紧密光滑。运动干预组大鼠随着运动训练的进行,逐渐出现了萎靡倦怠,眯眼少动,反应迟钝,毛散而无光泽,偶有大便稀软不成形等现象。
2.2 大鼠血清睾酮、LH变化情况
表2显示,运动干预组睾酮水平随着训练时间的延长逐步下降,前3周下降较缓慢,与C0组相比下降了27%(P<0.01),但第4周之后睾酮下降幅度有所加大,与C0组相比下降了60%(P<0.01),最后一周仍有小幅下降,与C0组相比下降了70%(P<0.01)。另外,运动干预组大鼠血清LH水平在5周训练中,出现曲折下降,第3、4周LH水平与C0组相比下降了26%,第5周LH水平下降更显著,与C0相比下降了41%,差异均有显著性(P<0.01),与C5组相比差异亦有显著性(P<0.01)。C5与C0组间差异没有统计学意义。
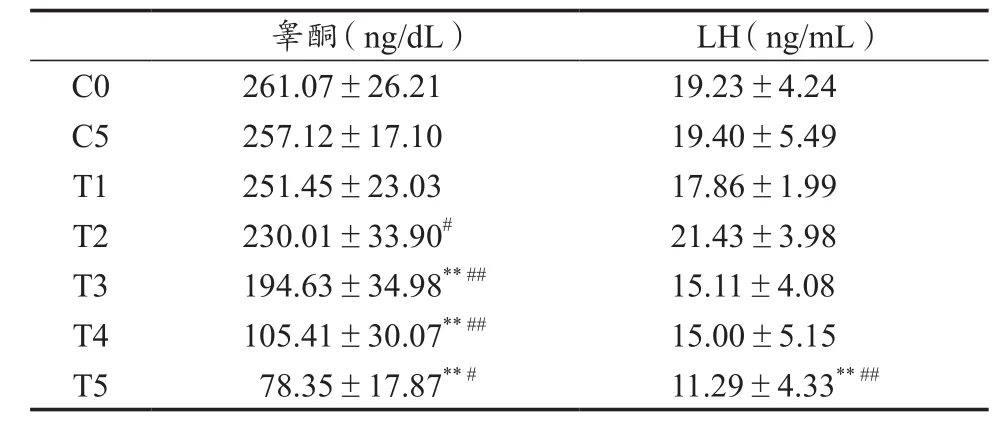
表2 各组大鼠血清睾酮和LH测试结果Table 2 The Results of Serum Testosterone and LH
2.3 大鼠血液乳酸及睾丸组织SOD、MDA变化情况
如表3所示,5周间歇性负重游泳训练之后,运动干预组训练后3 min乳酸水平显著上升。其变化趋势为:前3周上升幅度较大,后2周则维持在较高水平且略有上升(P>0.05),C5与C0组间差异没有统计学意义。表3还显示,游泳训练使运动干预组SOD活性显著不断下降。前4周下降水平相对平缓,第5周则下降至C0组SOD活性的77%。无论与C0组或者前1周相比差异非常显著(P<0.01)。与C0组相比,运动干预组MDA含量前3周略有波动,第4周出现显著上升(P<0.05),随后第5周MDA水平仍略有上升,较C0组相比,MDA变化差异非常显著(P<0.01)。C5与C0组间差异没有统计学意义。
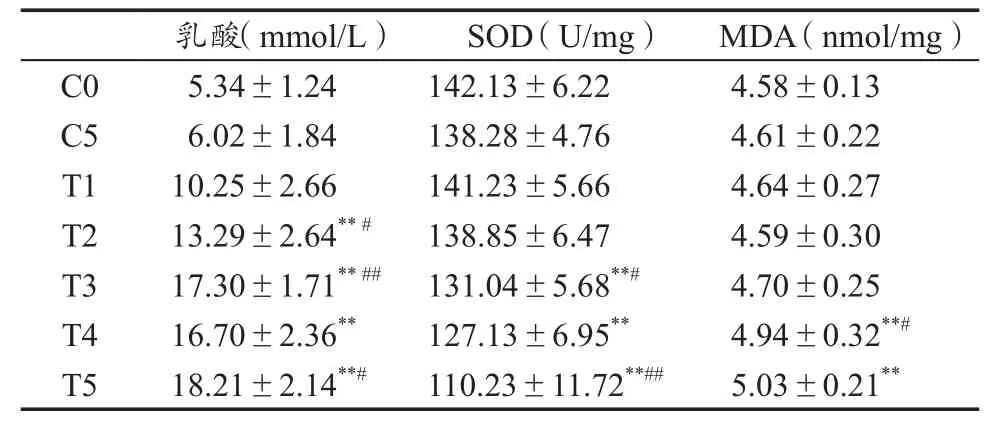
表3 各组大鼠乳酸、SOD和MDA测试结果Table 3 The Results of Blood Lactate,Serum SOD and MDA
2.4 大鼠睾丸组织PKA、p-CREB、SF-1蛋白表达变化情况
图1(A)显示,大鼠睾丸组织PKA蛋白表达水平在前3周保持稳定,与运动前相比未见显著差异,后2周持续下降。与C0组相比,T4组PKA表达水平下降了50%(P<0.01),与C5组相比亦有显著差异(P<0.01)。随后T5组略有上升(P>0.05)。C5与C0组间差异没有统计学意义。如图1(B)所示,经过5周游泳训练之后,运动干预组大鼠第2周pCREB表达相较于第1周略有下降,随后回升至训练前水平。第4周则出现显著下降,与C0组相比,P<0.05。第5周持续下降,与C0组相比,P<0.05。C5组与C0组相比,略有升高,但组间差异没有统计学意义。如图1(C)所示,大鼠睾丸组织SF-1蛋白表达水平在前3周略有波动(P>0.05),在第4周SF-1表达水平下降了36%(P<0.05),至第5周下降了43%(与C0相比,P<0.01),与C5组相比亦有显著差异(P<0.01)。C5与C0组间差异没有统计学意义。
2.5 大鼠睾丸组织StAR和SF-1 mRNA变化情况
如图2(A)所示,运动干预组StAR mRNA表达在第3周之后呈现出下降的态势,但是与安静组、前1周相比没有显著性。第5周mRNA表达与安静组C0相比差异出现了显著性(P<0.05)。图2(B)显示,1周运动干预组SF-1 mRNA较C0组略有上升,差异没有显著性。随后SF-1 mRNA表达逐渐下降,至第5周SF-1 mRNA表达出现极显著下降(P<0.01)。
3 分析与讨论
3.1 5周间歇性亚极限强度运动对血清睾酮的影响及其可能机制
大鼠游泳模型是最常见的构建疲劳模型的方式之一,为保证运动强度,通常采用负重的方式来增加大鼠运动量[1]。本实验发现,大鼠血清睾酮在5周间歇性亚极限强度运动中出现如下时序性变化:在整个运动训练过程中持续下降,并且在第4周降幅增加,到第5周降至对照组的30%左右。
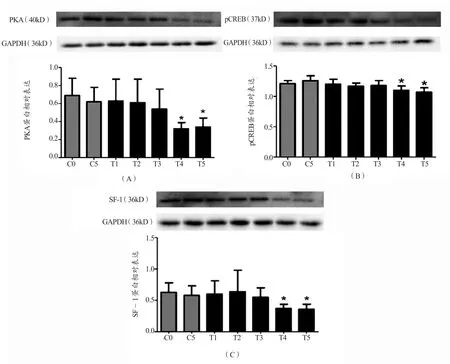
图1 各组大鼠PKA、pCREB和SF-1蛋白的相对表达Figure 1. Protein Expression Changes of PKA pCREB and SF-1 in Various Group
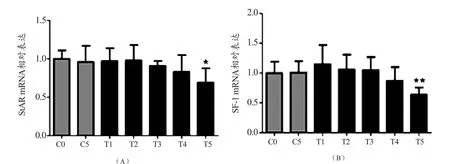
图2 各组大鼠StAR和SF-1 mRNA相对表达Figure 2. Relative Expression Changes of StAR and SF-1 mRNA in Various Group
3.1.1 运动对StAR的影响
胆固醇是睾酮合成的重要前体物质,合成睾酮必须要有充足的胆固醇做物质基础以满足合成需要。胆固醇通过线粒体内、外膜之间的水性环境转运至线粒体,最终是通过睾丸间质细胞内以StAR为代表的一系列转运蛋白实现的。本实验结果与以往结果[7]相似,长期大强度运动可以导致StAR mRNA表达下降。说明随着运动疲劳的逐步积累,StAR蛋白在转录层面受到抑制,进而导致睾酮水平下降。
然而,结合睾酮变化特点可以发现,在睾酮下降初期,StAR mRNA表达并未发生显著变化。这说明StAR mRNA这一指标反映机体胆固醇转运情况有明显滞后性。有研究者[15]指出,睾酮水平与StAR mRNA在某些情况下并非完全正相关关系。除此之外,研究发现,StAR蛋白在转录后存在磷酸化修饰。2012年的一项研究指出,14-3-3γ蛋白会结合在StAR的脂质结合域上,除了导致StAR无法正常变构以结合胆固醇外,也会抑制StAR蛋白194号位上丝氨酸残基磷酸化程度,导致StAR蛋白无法发挥其最大活力[17]。Duarte等研究者[20]通过细胞培养的方式证实,StAR携带胆固醇的能力与其磷酸化程度有关,在线粒体外膜磷酸化StAR可以使StAR在很短时间内携带大量胆固醇。
尽管单一利用StAR mRNA来判断机体胆固醇转运有一定的滞后性,但StAR mRNA仍是一项判断胆固醇转运状态的重要指标,在本实验中, StAR mRNA下降说明持续性高强度运动导致了胆固醇转运发生了较为深刻的抑制。
3.1.2 运动对HPG轴的影响
睾丸间质细胞合成分泌睾酮主要受LH的调节,LH通过活化腺苷酸环化酶,使胞内cAMP水平升高,激活PKA,触发胞内级联反应,从而调节睾酮合成和分泌。由于运动干预方案不同,不同运动强度、运动量对HPG轴不同环节神经递质、信号通路和细胞因子的影响不同,导致了研究结果不一致。尽管具体研究结果各不相同,但是,综合文献可以得到以下结论,中等强度运动可以维持GnRH、LH、FSH等调节激素的合成和释放,而大强度运动则会导致HPG轴负反馈调节机制失衡[14,23]。这也与本研究结果一致,实验发现,前4周LH水平出现了曲折下降的变化趋势,直至第5周出现显著下降,降幅高达41%。这或由于两方面原因造成的:1)大强度训练可以引起GnRH受体自身调节发生紊乱[10],造成LH反馈机制对GnRH应答受抑制,这就导致了睾酮下降时,LH无法出现反馈性增加[28]。2)长期大强度运动会导致大鼠下丘脑内质网狭窄,不扩张,神经分泌颗粒数明显减少[8]。另外,运动会导致下丘脑多巴胺、5羟色胺等单胺类物质更新率及释放改变,从而抑制GnRH合成分泌。
3.1.3 运动对氧化应激的影响
SOD是细胞内一个重要抗氧化酶,具有清除细胞内氧自由基,保护细胞的目的[3]。MDA是自由基攻击生物膜形成脂质过氧化物的产物,其含量可反映脂质过氧化及细胞损伤程度。研究发现,长期大强度运动会引起机体各部位SOD和MDA水平产生显著变化[6,11]。本研究发现,与安静对照组相比,各运动干预组SOD值降低,MDA值升高,这种变化趋势与其他研究者的研究结果相似[2]。机体内大部分睾酮由睾丸间质细胞合成和分泌,间质细胞结构的完整性对睾酮合成过程有着重要的影响,SOD和MDA这一组指标综合反映了睾丸间质细胞氧化损伤程度。近来Korytowski等研究者[22]通过设计精妙的实验,证实在氧化应激情况下,StAR蛋白会介导有害的脂质过氧化物进入线粒体内部,对正常胆固醇转运造成了竞争性抑制。因此,结合本研究中的SOD和MDA变化情况可以判定:经过长期大强度运动,大鼠睾丸间质细胞产生氧化应激,引起间质细胞活力下降,细胞膜结构完整性受破坏,胆固醇转运受限,这也是抑制睾酮合成和分泌的原因之一。
3.2 5周间歇性负重游泳训练导致StAR mRNA下降的可能机制
3.2.1 运动对PKA、p-CREB的影响
cAMP是细胞内重要的第二信使之一,cAMP主要通过激活PKA来实现其生理功能。在睾酮合成调节方面,PKA被激活后变构,释放催化亚基,催化CREB磷酸化为p-CREB,在其他转录因子的协助下与StAR基因启动子相结合,对睾酮合成进行调控。以往的研究主要集中在PKA、CREB转导因子对突触的可塑性及学习记忆功能的作用,近些年,也有研究者[4]开始研究PKA、CREB等调控因子在心肌等其他组织中所起的作用。本研究则发现,大鼠睾丸组织中的PKA、pCREB蛋白表达水平在前3周较为稳定,变化差异不大,然而,随着大强度运动时间的持续,后2周出现了显著下降。Mayr等研究者[25]就指出,cAMP长期激活会降低细胞对cAMP的敏感性,提高激活PKA的阈值,抑制PKA催化亚基的释放能力,从而进一步降低了CREB的磷酸化水平。除此之外,p-CREB除了受到PKA等蛋白的正向调节作用,还受到PP1和PP2A等蛋白磷酸酶的负向调控,这2种酶可以或直接或间接调节CREB的去磷酸化程度,抑制CREB的转录调节活性[18]。许绍哲等研究者[13]就发现,经过8周递增负荷跑台训练后,大鼠骨骼肌内PP1水平显著上升。由此,可以推测StAR mRNA表达下降与其上游调控因子磷酸化水平有关。
3.2.2 运动对SF-1的影响
SF-1是一个调控生长生殖过程的关键调控因子,尤其是在调控StAR等蛋白方面有着其独特的作用。早在1997年,就有研究人员通过实验证实,只有在SF-1参与下才能使StAR启动子达到最大活力[27]。随后,Clavia等研究者[24]发现,SF-1对于维持StAR基因基本功能而言也非常重要,并且SF-1与StAR结合后会影响其他蛋白与StAR启动子CAN区的结合。同样的,Mizutani等研究者[26]也发现,SF-1是StAR上游的一个关键调控因子,SF-1与StAR结合之后,驱逐组蛋白,引起染色质变构,并且以SF-1依赖的方式诱导StAR开始转录。本实验研究了SF-1在5周间歇性负重游泳中的变化特点,结果发现,与PKA、pCREB等调控因子变化特点一致,通过Western Blot检测发现,SF-1前3周表达并无显著变化,而后2周则出现了显著降低。通过RT-PCR检测发现,SF-1 mRNA直到第5周才出现显著下降。以往就运动对SF-1的影响这方面的研究较少,然而,不乏研究者对SF-1在睾酮合成过程中的作用进行了有益探索。任毅等研究者[9]发现,电针治疗可以提高中老年雄激素缺乏症大鼠睾酮水平,改善间质细胞病理表现,推测SF-1表达提高,是促进睾酮分泌的机制之一。Hu等研究者[21]发现,在邻苯二甲酸二丁酯所导致的类固醇合成受抑制的环境中,SF-1可以调控StAR以促进睾酮合成。探索SF-1在运动干预后期所出现下降的原因,一方面固然与其信号通路上游因子下降有关,另一方面,SF-1自身也会受到其他蛋白的影响。李德锋等研究者[5]构建了大鼠4周跑台模型(20 m/min,10°),结果发现,4周跑台运动引起了大鼠睾丸组织TGF-β1表达显著增加。Derebecka-Holysz等学者[19]则提出,TGF-β1可以降低SF-1表达水平,从而降低其转录活性。由此我们的推论是,在5周间歇性负重游泳后期,由于运动量的积累和机体代谢产物增加等多种因素,导致睾丸组织间质细胞TGF-β1表达增加,进而引起SF-1表达下降。除此之外,Aesoy等研究人员[16]发现,PKA可以通过增强SF-1蛋白稳定性以提高SF-1表达水平。这也从另一方面解释SF-1在蛋白和基因水平出现差异的原因,即由于长时间运动导致PKA表达下降,进而增加了SF-1蛋白的降解速率。因此,通过WB技术检测出SF-1蛋白在第4周就出现下降,但mRNA表达则在最后1周才出现显著下降。
4 结论
5周亚极限强度运动引起大鼠睾丸间质细胞内StAR及其相关调控因子PKA、pCREB、SF-1等表达下降,进而引起胆固醇转运受限,这可能是导致睾酮合成和血液睾酮水平下降的原因之一。
[1] 蔡浩刚. 大鼠运动性疲劳模型建立方法的比较研究[J]. 商丘职业技术学院学报,2008,7(5):111-113.
[2] 陈奕姗,郝思佳,薛莲,等. 运动对小鼠睾丸超氧化物歧化酶的影响[J]. 四川解剖学杂志,2013,21(2):1-4.
[3] 董亮,何永志,王远亮,等. 超氧化物歧化酶(SOD)的应用研究进展[J]. 中国农业科技导报,2013,15(5):53-58.
[4] 侯伊玲,薄海,刘子泉,等. 运动训练对急性心肌梗死后心室重构中受磷蛋白和肌浆网钙泵表达的影响[J]. 中国现代医学杂志,2010,20(21):3257-3262.
[5] 李德锋. 模拟高原训练对睾丸、肾上腺和胸腺组织的影响及其可能机制[D].西安:陕西师范大学,2009:10-63.
[6] 李敏华,唐健,王春亮. 甘草黄酮对长期大强度运动小鼠心肌损伤的保护作用[J]. 基因组学与应用生物学,2015,34(2):290-295.
[7] 罗齐军,鲁顺保,李红,等. 牡蛎多肽对长期大负荷训练大鼠血睾酮、LH和StAR mRNA表达的影响[J]. 江西师范大学学报(自然科学版),2013,37(6):611-616.
[8] 钱风雷,曾繁辉,冯炜权. 补肾中药对运动大鼠下丘脑—垂体—性腺轴功能的调节作用[J]. 中国运动医学杂志,2005,24(5):571-575.
[9] 任毅,杨晓光,李学智,等. 电针对部分雄激素缺乏综合征大鼠睾丸P450scc/SF-1表达的影响[J]. 中国老年学杂志,2015,5(35):2620-2623.
[10] 王人卫,陆爱云,郭仕达,等. GnRH-R在大鼠递增负荷训练中的表达及与性激素的关系[J]. 上海体育学院学报,2001,25(2):26-30.
[11] 武胜奇,张琳,熊正英,等. 补充白藜芦醇对大强度运动大鼠脑组织抗氧化能力、NO、NOS、ATP酶的影响[J]. 武汉体育学院学报,2011,45(12):78-81.
[12] 谢敏豪,冯炜权,杨天乐,等. 血睾酮与运动[J]. 体育科学,1999,19(2):80-83.
[13] 许绍哲,朱荣. 长期运动训练诱导SD大鼠骨骼肌糖原含量上调的分子机制[J]. 中国运动医学杂志,2015,34(1):42-49.
[14] 闫慧娟. 不同负荷运动对大鼠睾酮合成的影响及机制研究[D]. 扬州:扬州大学,2015:16-23.
[15] 郑王龙,刘青,王亚军,等. 玉米赤霉烯酮对小鼠睾丸间质细胞内StAR蛋白及类固醇合成关键酶表达的影响[J]. 畜牧兽医学报,2014,45(7):1091-1096.
[16] AESOY R,MELLGREN G,MOROHASHI K,et al. Activation of cAMP-dependent protein kinase increases the protein level of steroidogenic factor-1[J]. Endocrinol,2002,143(1):295-303.
[17] AGHAZADEH Y,RONE M B,BLONDER J,et al. Hormone-induced 14-3-3gamma adaptor protein regulates steroidogenic acute regulatory protein activity and steroid biosynthesis in MA-10 Leydig cells[J]. J Biol Chem,2012,287(19):15380-15394.
[18] CHRIVIA J C,KWOK R P,LAMB N,et al. Phosphorylated CREB binds specifically to the nuclear protein CBP[J]. Nat,1993,365(6449):855-859.
[19] DEREBECKA-HOLYSZ N,LEHMANN T P,HOLYSZ M,et al.SMAD3 inhibits SF-1-dependent activation of the CYP17 promoter in H295R cells[J]. Mol Cell Biochem,2008,307(1-2):65-71.
[20] DUARTE A,CASTILLO A F,PODESTA E J,et al. Mitochondrial fusion and ERK activity regulate steroidogenic acute regulatory protein localization in mitochondria[J]. PLoS One,2014,9(6):e100387.
[21] HU Y,DONG C,CHEN M,et al. E ff ects of monobutyl phthalate on steroidogenesis through steroidogenic acute regulatory protein regulated by transcription factors in mouse Leydig tumor cells[J].J Endocrinol Invest,2015,38(8):875-884.
[22] KORYTOWSKI W,PILAT A,SCHMITT J C,et al. Deleterious cholesterol hydroperoxide trafficking in steroidogenic acute regulatory (StAR) protein-expressing MA-10 Leydig cells:implications for oxidative stress-impaired steroidogenesis[J]. J Biol Chem,2013,288(16):11509-11519.
[23] LI X,HUANG W X,LU J M,et al. Experimental study on neuroendocrinological and immunological characteristics of the military-trained artillerymen[J]. Chin Med J (Engl),2012,125(7):1292-1296.
[24] LIN H,WANG S W,WANG R Y,et al. Stimulatory effect of lactate on testosterone production by rat Leydig cells[J]. J Cell Biochem,2001,83(1):147-154.
[25] MAYR B,MONTMINY M. Transcriptional regulation by the phosphorylation-dependent factor CREB[J]. Nat Rev Mol Cell Biol,2001,2(8):599-609.
[26] MIZUTANI T,YAZAWA T,JU Y,et al. Identi fi cation of a novel distal control region upstream of the human steroidogenic acute regulatory protein (StAR) gene that participates in SF-1-dependent chromatin architecture[J]. J Biol Chem,2010,285(36):28240-28251.
[27] SUGAWARA T,KIRIAKIDOU M,MCALLISTER J M,et al.Multiple steroidogenic factor 1 binding elements in the human steroidogenic acute regulatory protein gene 5’-flanking region are required for maximal promoter activity and cyclic AMP responsiveness[J]. Biochem,1997,36(23):7249-7255.
[28] VASANKARI T J,KUJALA U M,TAIMELA S,et al. Pituitary-gonadal response to gonadotropin-releasing hormone stimulation is enhanced in men after strenuous physical exercise[J].Acta Endocrinol (Copenh),1993,129(1):9-14.
Sequential Changes of StAR Protein and Its Regulatory Factors in Testicular Tissue of Rats during 5-week sub-ultimate Intensity Exercise
TANG Kun1,2,ZHANG Li1
Objective:To explore the possible mechanism of 5-week intermittent sub-ultimate intensity exercise induced low serum testosterone in rats. Methods:The rats in the exercise group
weight bearing training sessions. Each session consisted of fi ve 4-minute weight bearing (6% body weight) swimming separated by 90-second intervals. Training sessions were given twice a day and six days a week. The length of experiment was set to be 1,2,3,4 and 5 weeks. 48 hours after the last training session,rats from each groups were sampled in order to analyze protein and gene mRNA changes of StAR,PKA,pCREB,SF-1. Results:1) The serum testosterone level in intervention group decreased at a signi fi cant rate in the last two weeks,the serum testosterone level in the fi fth group decreased by 70% compared to control group(P<0.01). 2) The expression of StAR mRNA in the fi fth week was signi fi cantly di ff erent than the control group (P<0.05).3) The expression of PKA,pCREB,SF-1 protein and SF-1 mRNA in testis decreased signi fi cantly in the last two weeks.(P<0.05). Conclusion:StAR and its associated regulators PKA,pCREB,SF-1 in testicular leydig cells declined after 5-week intermittent sub-ultimate intensity exercise,thus mitochondrial cholesterol transfer limitation might be one of the mechanisms of decline in testosterone synthesis and serum testosterone.
exercise-induced low serum testosterone;sub-ultimate intensity exercise;StAR;time sequence;rat
G804.7
A
1002-9826(2017)06-0095-06
10. 16470/j. csst. 201706012
2017-02-20;
2017-09-05
国家体育总局体育科学研究所基本科研业务经费资助项目(基本16-28)。
汤昆,男,硕士,主要研究方向为运动生理生化,Tel:(0519)81281290, E-mail:tangkun0103@126.com。
张漓,男,研究员,博士,硕士研究生导师,主要研究方向为生理生化训练监控、减肥机制与运动及营养处方,Tel:(010)87182532 ,E-mail: zhangli@ciss.cn。
1. 国家体育总局体育科学研究所,北京 100061;2. 常州市体育医疗科研所,江苏 常州 213001 1. China Institute of Sport Science,Beijing 100061, China;2. Changzhou Research Institute of Science and Medical Treatment,Changzhou 213001,China.

