虾青素对小鼠肝脏原代细胞氧化应激的影响
张珊珊,吴 旻,张晓音,兰海楠,郑 鑫
(1 吉林农业大学 动物科学技术学院,吉林 长春 130118; 2 吉林农业大学 中药材学院,吉林 长春 130118)
虾青素对小鼠肝脏原代细胞氧化应激的影响
张珊珊1,吴 旻2,张晓音1,兰海楠1,郑 鑫1
(1 吉林农业大学 动物科学技术学院,吉林 长春 130118; 2 吉林农业大学 中药材学院,吉林 长春 130118)
【目的】研究虾青素对过氧化氢(H2O2)诱导小鼠肝脏原代细胞产生氧化应激的影响。【方法】原位二步灌流法提取ICR小鼠的肝脏原代细胞,用丙二醛(Malondialdehyde,MDA)作为指标、采用H2O2处理建立氧化应激模型。采用流式细胞仪测定细胞中活性氧(Reative oxygen species,ROS)含量及凋亡水平变化,生物化学法测定细胞中MDA和谷胱甘肽(Glutathione,GSH)的含量、超氧化物歧化酶(Superoxide dismutase,SOD)和谷胱甘肽过氧化物酶(Glutathione peroxidase,GSH-Px)的活性,用荧光定量PCR检测抗氧化酶SOD、GSH-px mRNA的相对表达量,Western-blot检测细胞核中 Nrf2 蛋白相对表达量。【结果】使用 5 μg·mL–1虾青素预保护细胞 3 h,10 μmol·L–1H2O2刺激3 h的情况下氧化应激模型效果最好。虾青素降低了H2O2诱导后小鼠肝脏原代细胞的细胞凋亡率以及ROS、MDA和GSH含量,提升了SOD、GSH-px的活性以及SOD、GSH-px的mRNA相对表达量,抑制了Nrf2蛋白的核转移。【结论】虾青素对H2O2诱导产生氧化应激的肝脏原代细胞具有保护作用。
小鼠肝脏原代细胞;虾青素;抗氧化酶;Nrf2蛋白;H2O2
肝脏疾病为高发疾病,各种类型的肝脏疾病均会造成不同程度的肝损伤,肝脏疾病的研究也一直是科学界的研究热点。实质性细胞是肝脏中数量最多的功能性细胞,也是多种损伤因素的靶向细胞。虽然不同类型的肝损伤引起的肝细胞破坏程度往往不同,但基本都伴随着不同程度的肝细胞死亡[1]。肝细胞死亡包括细胞凋亡和细胞坏死,研究表明肝细胞的凋亡在肝损伤中占主导地位,并且所有类型的肝损伤都会不同程度地伴随着肝细胞凋亡[2]。线粒体在细胞死亡过程中扮演着重要角色,几乎在所有死亡的肝细胞中,都存在线粒体功能失调这一特征。一般情况下,氧化应激是造成肝细胞线粒体功能失调的重要诱因之一,说明肝损伤通常与氧化应激有关[3-4]。天然和人工抗氧化剂均可以抵抗肝脏产生的氧化应激。在本研究中,我们探索利用天然抗氧化剂虾青素来减轻氧化应激诱导的肝损伤。
虾青素是一种在微藻中普遍存在的酮类类胡萝卜素,是一种较强的天然抗氧化剂,广泛存在于自然界中,大多数甲壳类动物、植物的叶、花果等均含有虾青素[5-7]。Lee等[8]比较了共轭双键数不同的叶黄素、玉米黄质、番茄红素、异玉米黄素和虾青素5种类胡萝卜素及其衍生物在豆油光氧化作用中淬灭活性氧的作用,发现此作用随共轭双键的增加而增加并以虾青素的作用最为明显,说明作为抗氧化剂,虾青素比其他类胡萝卜素有更明显的优势[9]。本试验选择虾青素作为氧化应激模型中的保护剂,通过检测细胞凋亡率、活性氧(Reative oxygen species,ROS)含量、丙二醛 (Malondialdehyde,MDA)含量、谷胱甘肽(Glutathione,GSH)含量、抗氧化酶如超氧化物歧化酶(Superoxide dismutase,SOD)活性、谷胱甘肽过氧化物酶(Glutathione peroxidase,GSH-px)活性以及抗氧化通路中相应蛋白的表达等来研究其在H2O2诱导小鼠肝脏原代细胞氧化应激过程中对细胞的保护作用。
1 材料与方法
1.1 材料
1.1.1 小鼠 8~10周龄的雄性ICR小鼠,购自长春市亿斯实验动物技术有限责任公司,小鼠生活在
合适的温度[(18~22) ℃]和湿度 (50%~60%)下,允许自由采水,并在使用前适应至少1周。
1.1.2 主要试剂 H2O2、胶原酶IV、虾青素、DMSO、台盼蓝(美国Sigma公司),RPMI-1640培养基、胎牛血清 (Fetal bovine serum, FBS)、Willam’E 培养基(美国Gibco公司),细胞核蛋白提取试剂盒(上海碧云天),MDA、SOD、GSH、GSH-px检测试剂盒 (南京建成生物研究所有限公司),引物(上海生工生物),RIPA 裂解液 (北京 Solarbio),Nrf2 抗体、βactin抗体(美国CST),HRP标记的羊抗鼠/兔抗体(天津三箭)。
1.1.3 主要仪器 高速冷冻离心机(德国Sigma),Thermo酶标仪(上海赛默飞世尔),荧光定量PCR仪、凝胶成像仪(美国BIO-RAD)。
1.2 方法
1.2.1 小鼠肝脏原代细胞提取与培养 用原位二步灌流法提取ICR小鼠肝脏原代细胞[10]。提取的细胞用预冷 RPMI-1640 培养基冲洗,800 r·min–1离心3次(3、20、1 min),台盼蓝染色,瞬时成活率为90%~95%。用冷RPMI 1640培养基[含体积分数为15% 的胎牛血清 (FBS)、青霉素 100 U·mL–1,链霉素 100 μg·mL–1]接种到细胞培养瓶中,接种浓度5.5×105mL–1,置于 CO2体积分数为 5%、37 ℃ 培养箱中培养,过夜换Willam’E培养基(含青霉素100 U·mL–1、链霉素 100 μg·mL–1、体积分数为 15% 的FBS),24 h换液1次,培养72 h。根据多次试验,在本试验条件下小鼠肝脏原代细胞能够存活1周,且第3天细胞状态最佳,可以进行下一步试验。
1.2.2 小鼠肝脏原代细胞氧化应激模型的建立 采用H2O2建立氧化应激模型[11]。MDA是检测氧化应激一种可靠的、敏感的生物标志物[10,12],本试验通过检测细胞中MDA的含量来确定虾青素和H2O2的浓度及作用时间。首先将细胞分为6组,即空白组和 H2O2组 (1、5、10、50 和 100 μmol·L–1),分别刺激1、3、6、12和24 h后测定细胞中MDA含量,确定H2O2刺激浓度和时间。再分8组细胞即H2O2组,保护组 (0、5、2.5、1.25、0.625、0.1 和 0.05 μg·mL–1虾青素预保护),每个保护组预保护时长分别采用1、3、6、12和24 h,通过测定细胞中MDA含量进而确定虾青素的预保护时间和质量浓度。
1.2.3 生理指标的测定 细胞提取与培养同“1.2.1”。将细胞分为4组,分别为空白组、虾青素组(最佳质量浓度及最佳时间)、H2O2组(最佳浓度及最佳时间)和保护组(最佳质量浓度和刺激时间的虾青素预保护,最佳浓度和刺激时间的H2O2后刺激),之后根据试剂盒说明书检测4组细胞中MDA、GSH含量以及SOD、GSH-px的活性变化。1个酶活力单位(U)表示每分钟转化1 μmol底物的酶量;用流式细胞仪测定细胞中ROS含量以及细胞凋亡率。
1.2.4 抗氧化酶的mRNA表达 采用荧光定量PCR检测虾青素对H2O2刺激小鼠肝脏原代细胞产生氧化应激的抗氧化酶SOD、GSH-px mRNA相对表达量的影响。细胞培养和分组同“1.2.3”。按照RNA Lyzol说明书提取细胞RNA,样品在–80 ℃保存,并取部分样品检测RNA质量,D260nm/D280nm在1.8~2.0之间,可用于下一步试验。然后按照cDNA逆转录试剂盒的步骤将RNA转录为cDNA。荧光定量 PCR 采用 20 μL 的反应体系,Master Mix 10 μL、上下游引物各 1 μL、cDNA 模板 4 μL、ddH2O 4 μL,反应程序为95 ℃预变性5 min; 95 ℃变性10 s,58 ℃退火60 s,40个循环。以18sRNA作为内参。用2–ΔΔCt[13]法计算抗氧化酶的相对表达量,引物序列如表1所示。
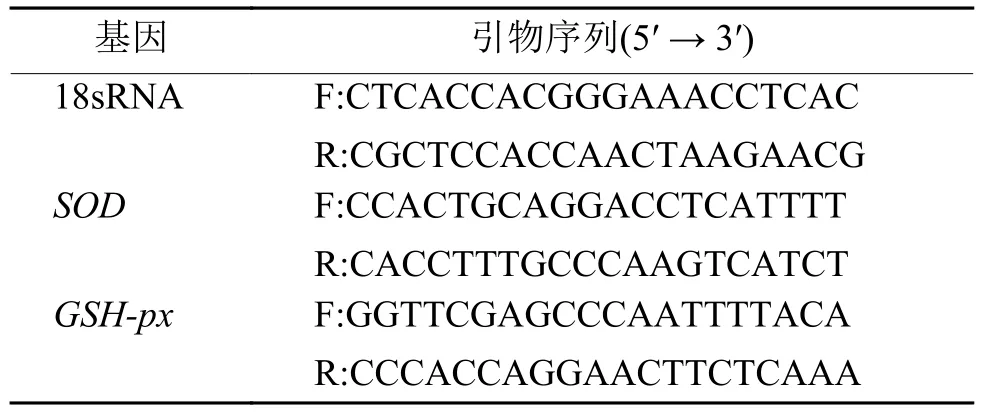
表1 荧光定量PCR引物序列Tab. 1 Sequences of fluorescence quantitative PCR primers
1.2.5 细胞核中Nrf2蛋白表达 采用Westernblot法检测虾青素对H2O2诱导小鼠肝脏原代细胞氧化应激后细胞核中Nrf2蛋白表达的影响。细胞培养和分组同“1.2.3”。细胞用预冷的PBS溶液洗涤2次,根据细胞核蛋白提取试剂盒说明提取细胞核蛋白,用BCA法测蛋白质量浓度。取15 μg核蛋白进行SDS-PAGE电泳,电转印至PVDF膜上,用质量分数为5%的脱脂奶粉封闭1 h,一抗为兔源Nrf2抗体 (按体积比 1∶1 000稀释),鼠源的 βactin抗体 (按体积比 1∶3 000稀释),4 ℃ 孵育过夜。TBST洗膜后分别加入相应的二抗:HRP标记的山羊抗鼠IgG (按体积比1∶2 000稀释)和HRP标记的山羊抗兔IgG(按体积比1∶3 000稀释),37 ℃孵育1 h。TBST洗膜后,ECL显色,目的条带用Image J进行灰度分析,用目的条带灰度值比上内参(β-actin)条带灰度值计算出蛋白相对表达量。
1.3 统计学分析
应用SPSS19.0软件进行统计分析,数据均以“平均值±标准误”形式表示,并采用单因素方差分析数据,采用Duncan’s法进行多重比较。
2 结果与分析
2.1 小鼠肝脏细胞氧化应激模型的建立及生理指标的测定
采用H2O2处理建立了小鼠肝脏原代细胞氧化应激模型,结果表明,在 10 μmol·L–1H2O2作用 3 h的情况下,产生的MDA含量显著高于空白组(p<0.05)(图1、图2),GSH 含量以及 SOD、 GSH-px的活性显著低于空白组(图2),表明肝脏原代细胞产生氧化应激,氧化应激模型成功建立。在本试验条件下,使用 10 μmol·L–1H2O2刺激 3 h 的情况下氧化应激模型效果最好,其他浓度及时间效果均不理想。虾青素最佳预保护时长为3 h,最佳质量浓度为 5 μg·mL–1,在该虾青素作用条件下,与 H2O2组[ρ(虾青素)为0]相比极显著降低了MDA含量(p<0.01),显著提高了GSH含量和SOD、GSH-px的活性(图2)。
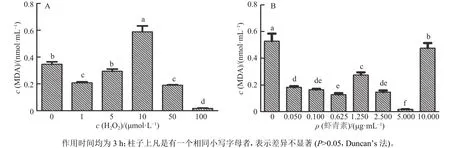
图1 H2O2和虾青素作用浓度的确定Fig. 1 Determination of the concentrations of H2O2 and astaxanthin
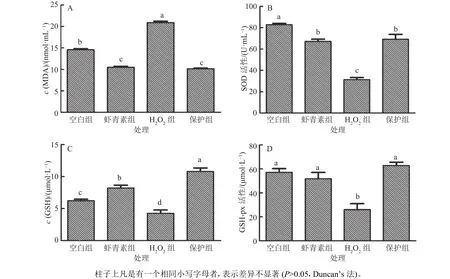
图2 虾青素对小鼠肝脏原代细胞MDA、GSH含量及抗氧化酶活性的影响Fig. 2 The effects of astaxanthin on the contents of MDA and GSH and the activities of antioxidant enzymes in primary mouse hepatocytes
2.2 抗氧化酶SOD、GSH-px的mRNA表达
从mRNA水平上进一步分析了虾青素对H2O2诱导小鼠肝脏原代细胞氧化应激的影响,如图3所示,H2O2组SOD,GSH-px的mRNA的相对表达量与空白组相比显著降低,而保护组的mRNA相对表达量与H2O2组相比显著提升。由此看来虾青素能够通过提升SOD以及GSH-px的mRNA相对表达量进而抑制小鼠肝脏原代细胞产生氧化应激。
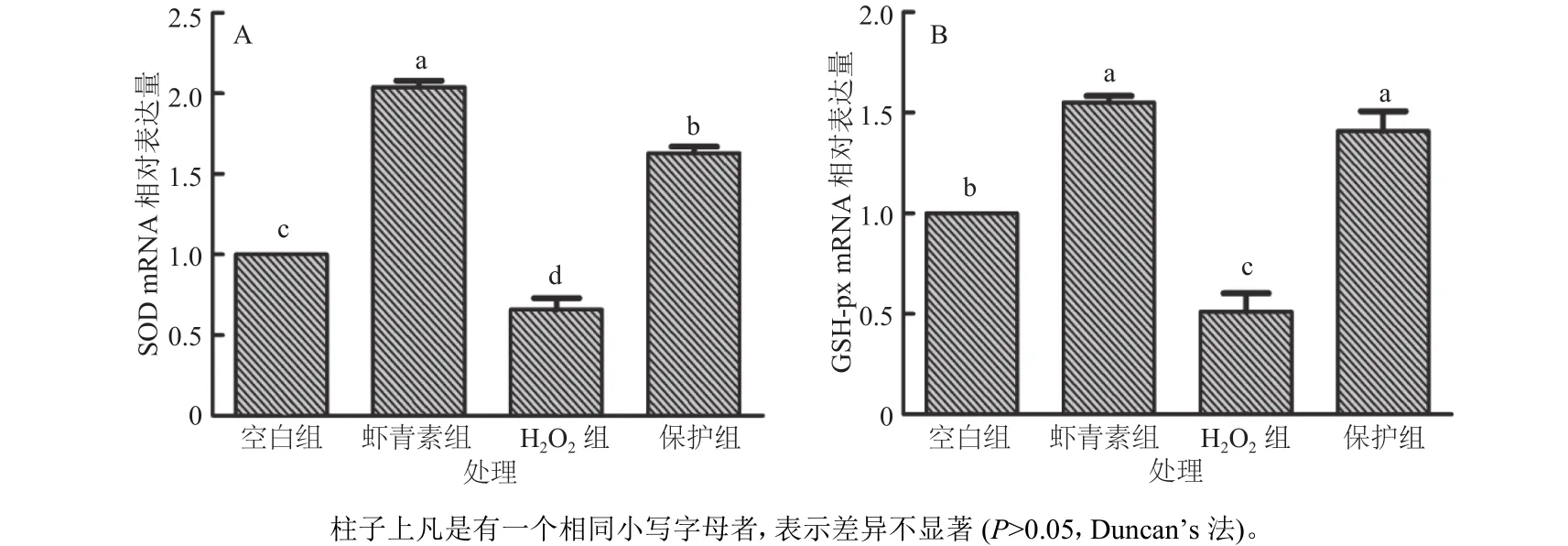
图3 虾青素对小鼠肝脏代细胞抗氧化酶mRNA表达的影响Fig. 3 The effects of astaxanthin on mRNA expressions of antioxidant enzymes in primary mouse hepatocytes
2.3 ROS含量以及细胞凋亡率
为进一步确定虾青素对小鼠肝脏原代细胞氧化应激的影响,本研究分析了虾青素对ROS以及细胞凋亡率的影响。如图4A所示,H2O2组细胞ROS含量显著高于空白组,保护组显著低于H2O2组;如图4B所示,H2O2组细胞凋亡率极显著高于空白组,保护组显著低于H2O2组。
2.4 细胞核中Nrf2的蛋白表达
Nrf2蛋白是参与调节细胞抗氧化功能的核心信号通路分子,本研究分析了小鼠肝脏原代细胞氧化应激过程中虾青素对Nrf2核转移的影响。如图5和图6所示,与空白组相比,H2O2组显著促进Nrf2蛋白的表达,从而使其转移至细胞核诱导细胞产生氧化应激;与H2O2组相比,保护组显著降低了Nrf2蛋白的核转移,从而降低H2O2诱导小鼠肝脏原代细胞产生的氧化应激。
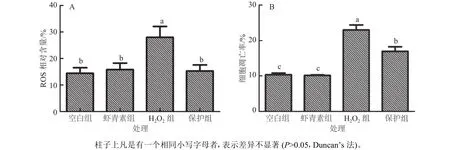
图4 虾青素对小鼠肝脏原代细胞ROS含量和凋亡率的影响Fig. 4 The effects of astaxanthin on ROS content and apoptosis rate in primary mouse hepatocytes
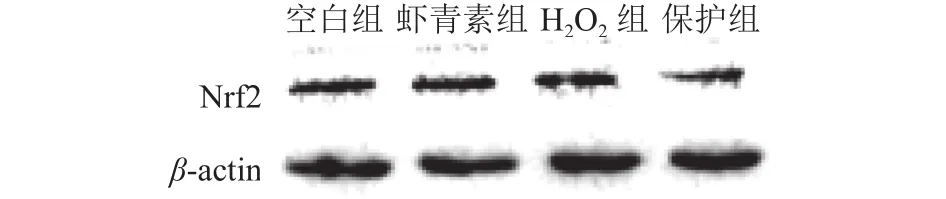
图5 Nrf2蛋白表达条带Fig. 5 Nrf2 protein expression bands
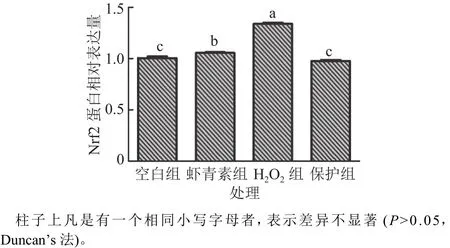
图6 虾青素对小鼠肝脏原代细胞的细胞核中Nrf2蛋白表达的影响Fig. 6 The effects of astaxanthin on Nrf2 protein expression in nucleus of primary mouse hepatocytes
3 讨论与结论
氧化应激主要通过启动膜脂质过氧化改变生物膜功能、与生物大分子共价结合及破坏酶的活性等在细胞因子的共同作用下引起不同程度的肝损伤。氧化应激在脂肪肝、病毒性肝炎、肝纤维化等肝病中可产生不容忽视的作用[14]。近年来,寻求天然抗氧化剂成为新的研究热点。虾青素的抗氧化能力强,是维他命E的550倍、β–胡萝卜素的10倍[15],是天然的强抗氧化剂。小鼠肝脏原代细胞是研究氧化应激的重要体细胞类型。MDA的生成是由于细胞遭受氧化性物质(如H2O2等)刺激产生氧化应激生成ROS,ROS进而与细胞膜上的磷脂、膜受体等发生过氧化反应而形成的。MDA是检测氧化应激一种可靠的、敏感的生物标志物[10,12]。当机体发生氧化应激,ROS产生过多,在这种情况下,动物体内抗氧化防御系统负责清除过多的ROS,以维持机体正常水平,所以机体抗氧化酶系统的相应抗氧化酶的活性也会相应增强,同时ROS含量的增多也会导致细胞凋亡量上升,本试验用 10 μmol·L–1H2O2刺激小鼠肝脏原代细胞后,GSH含量以及SOD和GSH-px的活性显著降低,SOD、GSH-px的mRNA相对表达量明显降低,几乎没有表达,说明细胞已经处于明显氧化应激状态,用 5 μg·mL–1虾青素处理后,GSH含量和抗氧化酶活性显著升高,说明虾青素对H2O2诱导小鼠肝脏原代细胞产生氧化应激具有保护作用。
Keap1-Nrf2-ARE是调节细胞抗氧化作用最重要的信号通路,Nrf2是该通路的中枢调节者,是调节抗氧化应激反应的重要核转录因子,是外源性有毒物质和氧化应激的感受器,可清除自由基,上调多种抗氧化酶及解毒酶,提高GSH及SOD等抗氧化物质的表达水平,维持细胞内氧化还原平衡状态[16]。正常状态下,Nrf2与胞浆蛋白伴侣分子Keapl蛋白在细胞浆内结合,其活性被抑制。当机体处于氧化应激状态时,Nrf2与Keapl解耦联,Nrf2转移至细胞核中,Nrf2蛋白被激活[17]。有研究表明在溃疡性结肠炎患者结肠组织中Nrf2表达与血清总超氧化物歧化酶(T-SOD)活性呈负相关,与MDA含量呈正相关,所以在一定程度上,Nrf2的表达水平可反映疾病的严重程度[16]。本研究中,H2O2组细胞核中Nrf2蛋白的表达量显著高于空白组,说明此时细胞正处于氧化应激状态,且保护组细胞核中Nrf2蛋白显著低于H2O2组,表明虾青素能够抑制H2O2诱导小鼠肝脏原代细胞产生氧化应激反应。
综上所述,虾青素可以抑制H2O2诱导小鼠肝脏原代细胞产生的氧化应激,此抑制作用是通过抑制Nrf2蛋白的核转移进而提升细胞中GSH含量和SOD、GSH-px的活性以及降低MDA的含量来实现的。
[1]MATSUMURA H, SHIMIZU Y, OHSAWA Y, et al.Necrotic death pathway in Fas receptor signaling[J]. J Cell Biol, 2000, 151(6): 1247-1256.
[2]RIBEIRO P S, CORTEZ-PINTO H, SOLA S, et al. Hepatocyte apoptosis, expression of death receptors, and activation of NF-kappaB in the liver of nonalcoholic and alcoholic steatohepatitis patients[J]. Am J Gastroenterol,2004, 99(9): 1708-1717.
[3]PESSAYRE D, MANSOURI A, HAOUZI D, et al. Hepatotoxicity due to mitochondrial dysfunction[J]. Cell Biol Toricol, 1999, 15(6): 367-373.
[4]SUSIN S A, ZAMZAMI N, KROEMER G, et al. Mitochondria as regulators of apoptosis: Doubt nomore[J].Biochim Biophys Acta, 1998, 1336(1/2): 151-165.
[5]GOTO S, KOGURE K, ABE K, et al. Efficient radical trapping at the surface and inside the phospholipid membrane is responsible for highly potent antiperoxidative activity of the carotenoid astaxanthin[J]. Biochim Biophys Acta, 2001, 1512(2): 251-258.
[6]HIGUERA-CIAPARA I, FELIX-VALENZUELA L,GOYCOOLEA F M, et al. Astaxanthin: A review of its chemistry and applications[J]. Crit Rev Food Sci Nutr,2006, 46(2): 185-196.
[7]LIAO K S, WEI C L, CHEN J C, et al. Astaxanthin enhances pemetrexed-induced cytotoxicity by downregulation of thymidylate synthase expression in human lung cancer cells[J]. Regul Toxicol Pharm, 2016, 81: 353-361.
[8]LEE S H, MIN D B. Effects of quenching mechanism and kinetics of carotenoids in chlorophyll-sensitized photo-oxidation of soybean oil[J]. J Agric Food Chem,1990, 38(8): 1630.
[9]HIX L M, LOCKWOOD S F, BERTRAM J S, et al. Bioactive carotenoids: Potent antioxidants and regulators of gene expression[J]. Redox Rep, 2004, 9(4): 181-191.
[10]LIU F P, MA X, LI M M, et al. Hepatoprotective effects of Solanum nigrum against ethanol-induced injury in primary hepatocytes and mice with analysis of glutathione S-transferase A1[J]. J Chin Med Assoc, 2016,79(2): 65-71.
[11]YOUNG I C, CHUANG S T, HSU C H, et al. C-phycocyanin alleviates osteoarthritic injury in chondrocytes stimulated with H2O2and compressive stress[J]. Int J Biol Macromol, 2016, 93(Pt A): 852-859.
[12]SING J, ZHANG H, WANG Z H, et al. Effects of12C6+ion radiation and ferulic acid on the zebrafish (Danio rerio)embryonic oxidative stress response and gene expression[J]. Mutat Res, 2013. doi: 10.1016/j.mrfmmm.2013.03.007.
[13]LIU H, BEIER J I, ARTEEL G E, et al. Transient receptor potential vanilloid 1 gene deficiency meliorates hepatic injury in a mouse model of chronic binge alcohol-induced alcoholic liver disease[J]. Am J Pathol, 2015,185(1): 43-54.
[14]吴娜, 蔡光明, 何群. 氧化应激与肝脏损伤[J]. 世界华人消化杂志, 2008(29): 3310-3315.
[15]ROSENBLAT J D, CHA D S, MANSUR R B, et al. Inflamed moods: A review of the interactions between inflammation and disorders[J]. Prog Neuropsychopharmacol Biol Psychiatry, 2014, 53(1448): 23-24.
[16]SINGH A, RANGASAMY T, THIMMULAPPA R K, et al. Glutathione peroxidase 2, the major cigarette smokeinducible isoform of GPX in lungs, is regulated by Nrf2[J]. Am J Resp Cell Mol, 2006, 35(6): 639-650.
[17]COPPLE I M. The Keap1-Nrf2 cell defense pathway: A promising therapeutic target?[J]. Adv Pharmacol, 2012,63: 43-79.
Effects of astaxanthin on oxidative stress response in primary mouse hepatocytes
ZHANG Shanshan1, WU Min2, ZHANG Xiaoyin1, LAN Hainan1, ZHENG Xin1
(1 College of Animal Science and Technology, Jilin Agricultural University, Changchun 130118, China;2 Chinese Medicinal College, Jilin Agricultural University, Changchun 130118, China)
【Objective】To investigate the effect of astaxanthin on H2O2-induced oxidative stress response in primary mouse hepatocytes.【Method】Primary mouse hepatocytes were isolated by an in situ two-step perfusion technique. The model of oxidative stress response in primary mouse hepatocytes was established using H2O2treatment and malondialdehyde(MDA) as an indicating index. The content of reative oxygen species(ROS) and change in apoptosis rate were measured by flow cytometry. The contents of MDA and glutathione(GSH), and the activities of superoxide dismutase(SOD) and glutathione peroxidase(GSH-px) were measured by biochemical methods. The relative mRNA expression levels of antioxidant enzymes including SOD and GSH-px were measured by fluorescence quantitative PCR. The relative expression of Nrf2 protein was measured by Western-blot.【Result】The model of oxidative stress response performed the best with the primary mouse hepatocytes pre-protected by 5 μg·mL–1astaxanthin for 3 h before being exposed to 10 μmol·L–1H2O2for 3 h. Astaxanthin decreased the apoptosis rate and the contents of ROS, MDA and GSH in primary mouse hepatocytes induced by H2O2. Astaxanthin increased the activities of SOD and GSH-px as well as therelative mRNA expression levels of SOD and GSH-px, and inhibited the nuclear transfer of Nrf2 protein.【Conclusion】Astaxanthin has protective effects on H2O2-induced primary mouse hepatocytes with oxidative stress.
primary mouse hepatocyte; astaxanthin; antioxidant enzyme; Nrf2 protein; H2O2
S828
A
1001-411X(2017)06-0014-06
张珊珊, 吴旻, 张晓音, 等. 虾青素对小鼠肝脏原代细胞氧化应激的影响[J]. 华南农业大学学报, 2017, 38(6): 14-19.
2017-03-30 优先出版时间:2017-11-06
优先出版网址:http://kns.cnki.net/kcms/detail/44.1110.S.20171106.1412.008.html
张珊珊 (1992—),女,硕士研究生,E-mail: 1414600996@qq.com; 通信作者: 郑 鑫 (1965—),女,教授,博士,E-mail: zhengxin@jlau.edu.cn
国家自然科学基金(31672511)
【责任编辑 庄 延】

