I群禽腺病毒血清4型广东株的分离鉴定及分子特性
罗洋洋,招丽婵,李群辉,林瑞庆,翁亚彪
(1 华南农业大学 兽医学院,广东 广州 510642; 2 广东温氏食品集团股份有限公司,广东 云浮 527400)
I群禽腺病毒血清4型广东株的分离鉴定及分子特性
罗洋洋1,招丽婵2,李群辉2,林瑞庆1,翁亚彪1
(1 华南农业大学 兽医学院,广东 广州 510642; 2 广东温氏食品集团股份有限公司,广东 云浮 527400)
【目的】对广东地区疑似心包积液–肝炎综合征患病鸡进行腺病毒分离鉴定并研究其分子特征。【方法】采集的病料样品,通过鸡胚有限稀释法经SPF鸡胚传代分离纯化病毒,进行致病性试验,并对病毒的hexon、fiber-2、ORF19和ORF29基因进行PCR扩增,分析其分子特征。【结果】hexon基因序列分析显示此次分离的毒株为Ⅰ群禽腺病毒血清4型(命名为WM-XC株),SPF鸡接种分离毒株后,致死率达90%,死亡鸡只出现明显的心包积液、肝炎等变化,肝脏病理切片可观察到明显的嗜酸性包涵体,显示分离毒株具有致病性。fiber-2基因序列同经典毒株ON1和KR5相应序列的相似性达96.1%和97.0%,与2015年以来国内分离的毒株序列相似性则达到100%;ORF29序列与2013年国内分离到的毒株JSJ13和JN13的相应序列相比存在33个碱基的缺失;WM-XC分离株与2015年以来国内分离毒株序列相同,但相比经典株ON1和KR-5,缺失ORF19序列。【结论】此次从广东地区分离到的血清4型Ⅰ群腺病毒,和近年国内其他地区分离的流行毒株一样,其fiber-2、ORF19和ORF29基因序列与经典毒株差异明显。
禽腺病毒;分离鉴定;分子特性;hexon基因;fiber-2基因;致病性
禽腺病毒(Fowl adenovirus,FAdV)是一种无囊膜的双链DNA病毒,属于腺病毒科Adenovirudae禽腺病毒属Aviadenovirus,根据其特异性抗原的不同,禽腺病毒可分为Ⅰ、Ⅱ和Ⅲ群[1]。Ⅰ群禽腺病毒分为5种基因型(A~E),12个血清型(FAdV-1~FAdV-12)[2-4]。其中基因C型包括血清4型和10型(FAdV-4、FAdV-10)病毒,其主要临床和病理症候群为心包积水综合征(Hydropericardium syndrome,HPS)、包涵体肝炎 (Inclusion body hepatitis,IBH)等。心包积水–肝炎综合征(Hydropericardium syndrome-inclusion body hepatitis,HHS)于 1987 年在巴基斯坦卡拉奇的安卡拉地区首先报道,故也称为安卡拉病,之后在亚洲的印度、韩国、日本,中东的伊朗、科威特,美洲的墨西哥、厄瓜多尔、秘鲁、智利都发现该病[5-7]。2015年6月开始,中国的中北部许多地区的鸡群暴发了以心包积液、肝炎为主要临床特征的安卡拉病[8-10]。该病主要发生于3周龄以上的肉鸡,包括817、肉杂等品种,自然发病日龄最小的为7日龄,发病后4~8 d为死亡高峰,病程为8~15 d,病死率20%~80%不等[11]。发病日龄越小,病死率越高,鸡死亡前均正常采食,无明显临床表现而突然倒地死亡。
本研究对广东发病鸡场病死鸡的肝脏组织内的病原分离株进行序列测定及分析,并对其进行SPF鸡的感染与致病性评估,确定该疾病的病原,为该病的防控提供理论基础。
1 材料与方法
1.1 材料与试剂
青霉素(031722659,华北制药)和链霉素(030201517,华北制药),核酸抽提试剂盒(Magen),PrimeSTAR Premix、Ex Taq Premix、loading Buffer、RNA-free H2O、电泳仪、T-Vetor PMD19、DH-5α competent cell(大连TaKaRa),质粒抽提试剂盒(OMEGA),胶回收试剂盒 (AXYGEN),PCR 仪、凝胶成像仪(BIO-RAD),离心机(5424EI662969,广州深华),SPF鸡胚(北京梅里亚维通实验动物有限公司)。
1.2 样品采集及处理
2016年初从广东某鸡场采集疑似心包积水–肝炎综合征的病鸡肝脏,加入青霉素和链霉素各2 000 IU进行研磨分装,反复冻融 3 次后,8 000 r·min–1离心5 min取上清液备用。
1.3 病毒分离纯化及DNA抽提
将上清液经卵黄囊接种7日龄鸡胚,每只0.2 mL,弃48 h内死胚,连续观察9 d,收集死胚尿囊液,连续3次传代后采用鸡胚有限稀释法[12-14]纯化病毒。将收集的尿囊液用于DNA抽提,抽提方法参照Magen核酸抽提试剂盒说明书。
1.4 引物设计
根据GenBank公布的FAdV-4的hexon、fiber-2、ORF19和ORF29基因序列,分别设计了hexon的检测引物及各基因的测序引物(表1)。
1.5 基因的PCR扩增
用抽提的DNA作为模板,反应体系为:Ex TaqPremix 12.5 μL,上下游引物各 1 μL,DNA 2 μL,ddH2O 8.5 μL。反应程序:95 ℃ 10 min;95 ℃ 30 s,55 ℃ 30 s,72 ℃ 30 s,30 个循环;72 ℃ 10 min。PCR产物经10 g·L–1的琼脂糖凝胶电泳鉴定。

表1 血清4型禽腺病毒特异基因扩增引物Tab. 1 Amplification primers for specific genes of fowl adenovirus serotype FAdV-4
1.6 病毒对鸡胚致病力的测定
3~7倍稀释的F8代病毒经卵黄囊接种7日龄SPF鸡胚,每枚胚接种0.2 mL,每个梯度5枚,设立PBS对照组。弃48 h内死胚,观察3~10 d各组鸡胚死亡情况,计算其鸡胚半数致死量(ELD50)、鸡胚半数感染量(EID50)和平均死亡时间(MDT)。
1.7 动物回归试验
40只1日龄SPF鸡饲养于隔离器中,21日龄时分为4组,每组10只,1~3组为攻毒组,第4组为空白对照。选择F8代纯化的病毒,攻毒组剂量分别为 105EID50、104EID50、103EID50。观察 10 d,记录其发病率及死亡率,采集具有典型症状鸡只的心脏和肝脏,用质量分数为4%的甲醛溶液固定,HE染色观察心脏和肝脏的病理学病变。再采集典型发病鸡只的肝脏,对病毒进行再分离和PCR鉴定。
1.8 基因克隆与测序
以确定为阳性的病毒DNA为模板,分别扩增hexon、fiber-2、ORF19和ORF29基因。产物经琼脂糖凝胶电泳鉴定,切胶回收后连接至T载体PMD19,16 ℃连接4 h,经蓝白斑筛选,阳性克隆送上海生工测序。
2 结果与分析
2.1 疑似样品PCR鉴定
以hexon基因引物扩增的产物经琼脂糖凝胶电泳可见约480 bp大小的条带,与预期大小相符(图1),初步鉴定此分离毒株为血清4型禽腺病毒,命名为WM-XC毒株。
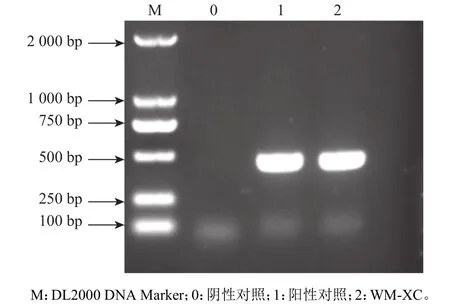
图1 疑似样品PCR扩增产物Fig. 1 PCR product of suspected sample
2.2 病毒对鸡胚的致病力
接种0.2 mLWM-XC毒株鸡胚的EID50为10–5、ELD50为 10–4,MDT 为 206 h。
2.3 动物回归试验
发病死亡曲线显示(图2),攻毒剂量为105EID50时,攻毒后第6天鸡群全部发病,病死率达到90%;攻毒剂量为104EID50时,攻毒后第6天发病率为80%,病死率为40%,攻毒剂量为103EID50时,攻毒后第6天发病率达到60%,病死率降到20%。人工感染3 d后开始发病并可伴随死亡,第5、第6天为发病高峰,7 d后开始逐渐耐过。临床症状可见心脏包心、有积液,肝脏又明显出血、坏死,肾脏出现尿酸盐沉积(图3)。病理组织学结果(图4)显示:心肌纤维较稀疏、可见较多淋巴细胞浸润,肝细胞变性坏死,有炎性细胞浸润,可见嗜酸性小体。攻毒动物进行病毒再分离,PCR鉴定为血清4型I群腺病毒阳性。
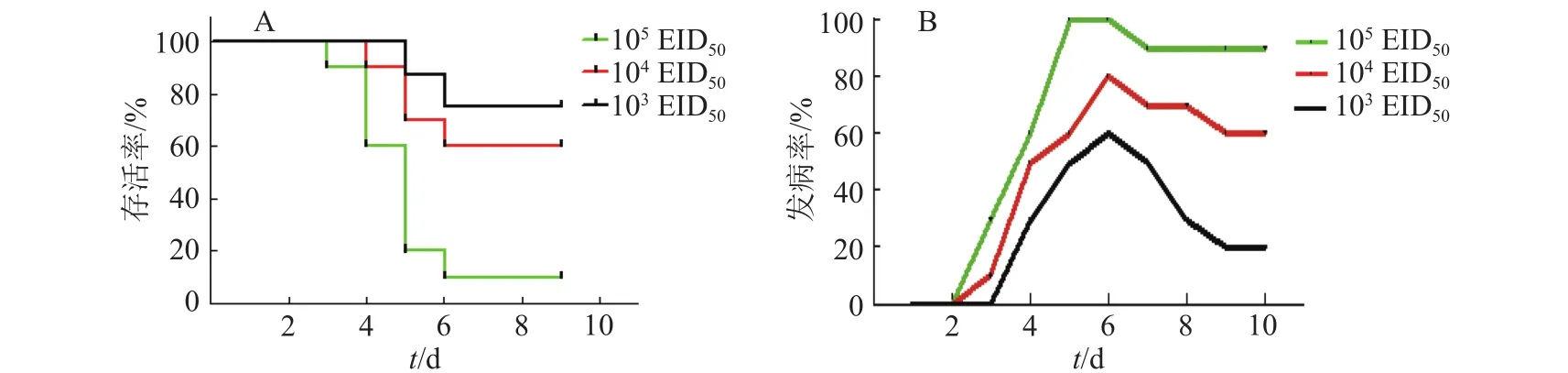
图2 WM-XC毒株不同攻毒剂量的存活率与发病率Fig. 2 Survival and morbidity proportions of chickens inoculated with strain WM-XC at different doses
2.4 基因序列的扩增及分析
2.4.1 hexon基因序列分析 WM-XC分离株的hexon基因同2015年国内分离的CHJSXZ、CHSDDZ、CHSXCZ、CHAHBZ、CHHNJZ 以及2016年印度分离的B1-7毒株的序列相似性达99%以上,同2011年加拿大分离的ON1毒株和2012年澳大利亚分离的KR-5毒株的序列相似性达97.9%和98.1%,显示hexon基因具有很高的保守性。基于hexon基因的系统演化树(图5)显示,分离毒株与禽腺病毒I群血清4型亲缘关系最近,同经典毒株 B1-7、及 CHJSXZ、CHSDDZ、CHSXCZ、CHAHBZ、CHHNJZ处于同一分支。
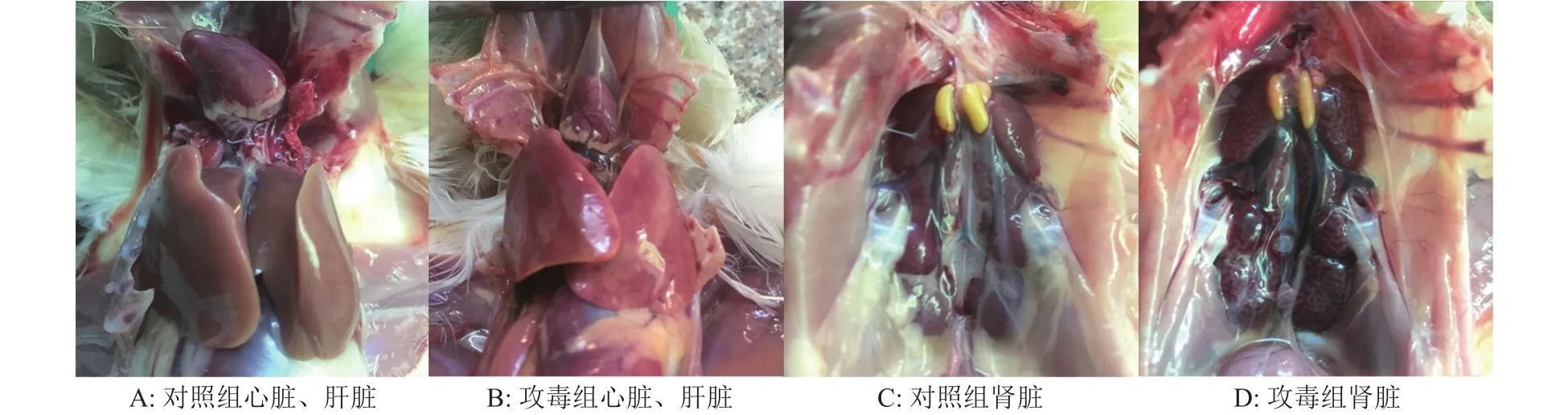
图3 WM-XC毒株感染SPF鸡后心脏、肝脏和肾脏的肉眼病变Fig. 3 Gross lesions in heart, liver and kidney from SPF chicken infected with strain WM-XC
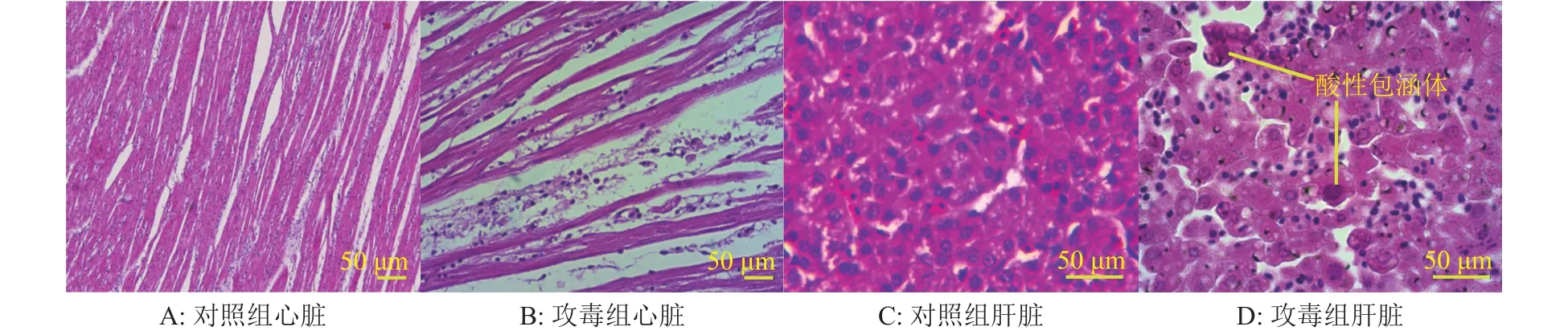
图4 WM-XC毒株感染SPF鸡后心脏和肝脏的病变(HE染色)Fig. 4 HE staining for heart and liver from SPF chicken infected with strain WM-XC
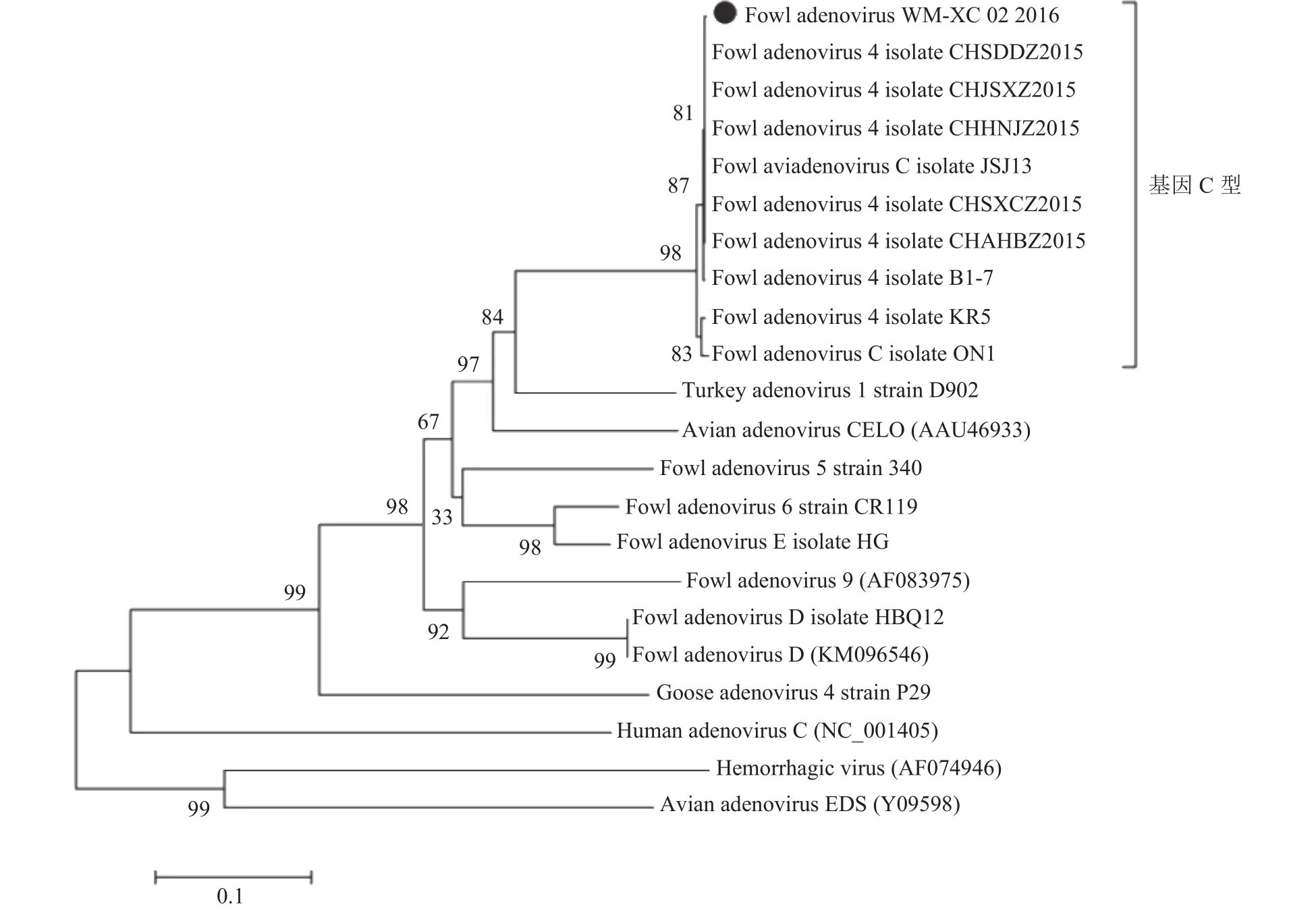
图5 基于hexon基因的禽腺病毒血清4型系统演化树Fig. 5 Phylogenetic tree of FAdV-4 based on hexon gene
2.4.2 fiber-2基因序列分析 WM-XC分离株的fiber-2基因与经典毒株ON1和KR5的序列相似性达96.1%和97.0%,与2015年我国中北部分离的毒株序列相似性达100%。fiber-2基因的遗传进化分析结果(图6)显示,分离毒株与JSJ13、CHJSXZ、CHSDDZ、CHSXCZ、CHAHBZ和CHHNJZ处于同一分支,进一步证明了分离到的腺病毒为FAdV-C血清4型。
2.4.3 ORF29和ORF19基因序列分析 WMXC分离株的ORF29基因同2015年国内分离的毒株 CHSDDZ、CHSXCZ、CHJSXZ、CHAHBZ、CHHNJZ、HLJFAd15以及 2016年分离的HB1510序列相同,但与JSJ13和JN13相比却有33个碱基的缺失,而2011年加拿大分离的经典毒株ON1和美国分离株NC015323.1中该基因碱基缺失却达到66个(图7)。此外,我们还发现WMXC分离株未能扩增出ORF19,与2011年加拿大分离的ON1和NC015323.1、2012年澳大利亚分离的KR-5、以及2016年印度分离的B1-7毒株相比表现为ORF19基因缺失。
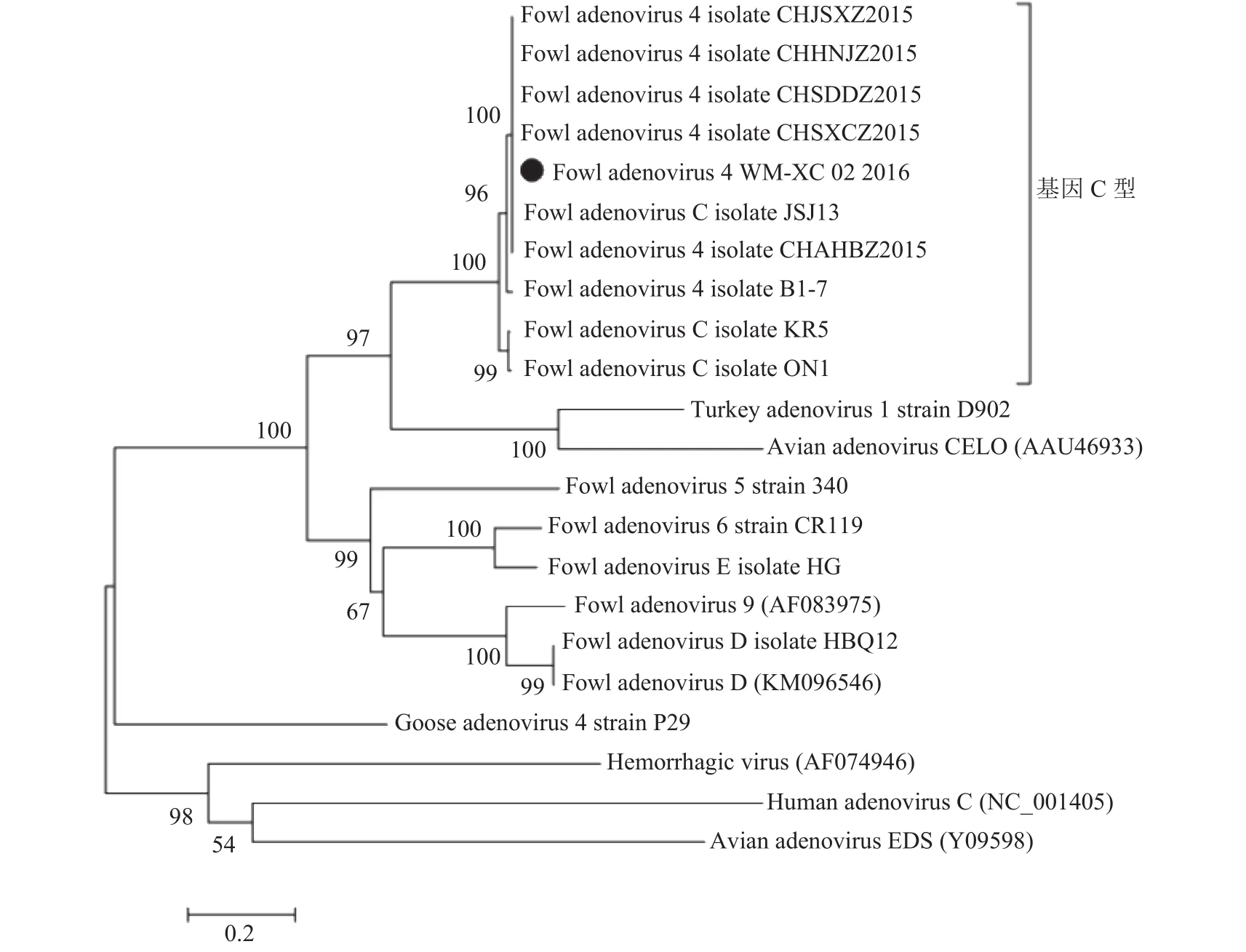
图6 基于fiber-2基因的禽腺病毒血清4型系统演化树Fig. 6 Phylogenetic tree of FAdV-4 based on fiber-2 gene

图7 ORF29基因变异区域Fig. 7 Variable region of ORF29 gene
3 讨论与结论
I亚群的禽腺病毒对禽类的致病性大多还未完全明确[15],引起的主要疾病为包涵体肝炎(IBH)和心包积液综合征(HPS)[16-17]。据有关报道[15,18],I亚群的禽腺病毒所有的12种血清型都可引起包涵体肝炎,然而大部分HPS是由FAdV-4引起的,主要表现是心包腔内积累的透明液体以及肝炎、肾炎。本研究从广东发病鸡场分离到1株引起心包积液–肝炎综合征的病原,经PCR检测及六邻体序列分析确定该病原为禽腺病毒血清4型。动物回归试验可复制出心包积液和包涵体肝炎,肝脏组织病理切片可见炎性细胞浸润和嗜酸性的包涵体,采取发病典型鸡只的肝脏进行病毒再分离和PCR鉴定,验证了此次分离到的血清4型禽腺病毒为引起该疾病的病原。
腺病毒的主要结构蛋白为六邻体和五邻体蛋白。其中六邻体是主要的衣核蛋白,含有型、群、亚群特异性抗原决定簇,用六邻体基因hexon作引物可将病毒的A~E种区分开来,并且定位到种内特定的血清型,此次分离的毒株即通过六邻体鉴定为4型。有研究表明,五邻体上的Fiber蛋白具有受体结合位点,对病毒吸附到宿主细胞具有非常重要的作用[19-20],且FAdV-4的fiber-2重组蛋白能够有效地阻碍鸡心包积液–肝炎综合征的侵害[21]。fiber-2的序列分析表明WM-XC分离株与ON1和KR5具有96.1%和97.0%的序列相似性,而与2015年我国中北部分离的毒株序列相似性却高达100%。
另有研究报道,近期国内分离的毒株存在ORF29和ORF19的变异情况[22-23],2015年以来国内分离的毒株CHSDDZ、CHSXCZ、CHJSXZ、CHAHBZ、CHHNJZ、HLJFAd15和 HB1510相比2013年分离的毒株JSJ13和JN13在ORF29序列上存在33个碱基的缺失[24],而本研究分离到的广东株WM-XC也存在着同样的缺失,但与2011年加拿大分离的经典毒株ON1和NC015323相比却有66个碱基的缺失[24],不过ORF29碱基的缺失是否能够导致FAdV-4毒力、宿主适应性及致病性的改变尚不清楚。值得注意的是,此次广东分离的毒株同近年来国内分离的 CHSDDZ、CHSXCZ、CHAHBZ、CHHNJZ、HLJFAd1、HB1510、JSJ13 均缺失ORF19[22]。动物回归试验结果显示此次分离的毒株具有高致病性(攻毒剂量为105EID50时,病死率可达到90%)。但这种高致病性是否是由于ORF29和ORF19的变异导致的,亦或是其他区域的变异引起的尚需进一步研究。
根据国内有关研究报道[25-27],2015年以来心包积水–肝炎综合征主要流行于我的中北部地区,如河南、河北和山东,而华南地区鲜见此病的报道。本研究的广东分离株WM-XC为华南地区报道的FAdV-4分离株,对其主要的hexon、fiber-2、ORF29和ORF19基因进行分析发现该毒株同2015年以来的国内分离株相似性极高,同经典毒株的变异位置也相同。由此推测,华南地区FAdV-4的流行可能是由北部地区疫情扩散导致的。
国内流行的FAdV-4与以前国外流行的毒株存在一定的变异是确定的,但由于高致病性FAdV-4毒力基因的位置及其在国内大范围流行的因素还未确定,所以对国内FAdV-4进行大范围的流行病学调查以及遗传进化分析显得很有必要,筛选差异毒株对于腺病毒致病性及宿主适应性的研究具有重大意义,将为以后疫苗毒株的筛选及FAdV-4的防控提供理论与技术支撑。
[1]ZSAK L, KISARY J. Grouping of fowl adenoviruses based upon the restriction patterns of DNA generated by BamHI and HindIII[J]. Intervirology, 1984, 22(2): 110-114.
[2]MATCZUK A K, NICZYPORUK J S, KUCZKOWSKI M, et al. Whole genome sequencing of fowl aviadenovirus A: Acausative agent of gizzard erosion and ulceration,in adult laying hens[J]. Infect Genet Evol, 2017, 48: 47-53.
[3]LI C, LI H, WANG D, et al. Characterization of fowl adenoviruses isolated between 2007 and 2014 in China[J].Vet Microbiol, 2016, 197: 62-67.
[4]HOWELL J, MACDONALD D W, CHRISTIAN R G.Inclusion body hepatitis in chickens[J]. Can Vet J, 1970,11(5): 99-101.
[5]KIM J N, BYUN S H, KIM M J, et al. Outbreaks of hydropericardium syndrome and molecular characterization of Korean fowl adenoviral isolates[J]. Avian Dis, 2008,52(3): 526-530.
[6]KIM M S, LIM T H, LEE D H, et al. An inactivated oilemulsion fowl adenovirus serotype 4 vaccine provides broad cross-protection against various serotypes of fowl adenovirus[J]. Vaccine, 2014, 32(28): 3564-3568.
[7]JOUBERT H W, AITCHISON H, MAARTENS L H, et al. Molecular differentiation and pathogenicity of aviadenoviruses isolated during an outbreak of inclusion body hepatitis in South Africa[J]. J S Afr Vet Assoc,2014, 85(1): 1058.
[8]NIU Y J, SUN W, ZHANG G H, et al. Hydropericardium syndrome outbreak caused by fowl adenovirus serotype 4 in China in 2015[J]. J Gen Virol, 2016, 97(10):2684-2690.
[9]ZHANG T, JIN Q, DING P, et al. Molecular epidemiology of hydropericardium syndrome outbreak-associated serotype 4 fowl adenovirus isolates in central China[J]. Virol J, 2016, 13(1): 188.
[10]ZHAO J, ZHONG Q, ZHAO Y, et al. Pathogenicity and complete genome characterization of fowl adenoviruses isolated from chickens associated with inclusion body hepatitis and hydropericardium syndrome in China[J].PLoS One, 2015, 10(7): e133073.
[11]DE HERDT P, DUCATELLE R, LEPOUDRE C, et al.An epidemic of fatal hepatic necrosis of viral origin in racing pigeons (Columba livia)[J]. Avian Pathol, 1995,24(3): 475-483.
[12]智海东, 杨志, 解生亮, 等. 鸡包涵体肝炎病毒CELOV株的鉴定研究[J]. 中国兽药杂志, 2009, 43(1): 6-9.
[13]PURCHASE H G.禽病原分离与鉴定实验手册: 第3版[M].唐桂运, 译.北京: 北京农业大学出版社, 1993: 140-143.
[14]姜北宇, 赵继勋, 张国中, 等. 禽流感H9亚型病毒WD株毒种的纯化研究[J]. 中国兽药杂志, 2006, 40(8): 1-4.
[15]SAIF Y M.禽病学: 第 12 版[M].苏敬良, 译. 北京: 中国农业出版社, 2005: 236-246.
[16]NICZYPORUK J S. Phylogenetic and geographic analysis of fowl adenovirus field strains isolated from poultry in Poland[J]. Arch Virol, 2016, 161(1): 33-42.
[17]MITTAL D, JINDAL N, TIWARI A K, et al. Characterization of fowl adenoviruses associated with hydropericardium syndrome and inclusion body hepatitis in broiler chickens[J]. Virusdisease, 2014, 25(1): 114-119.
[18]OJKIC D, NAGY E. The complete nucleotide sequence of fowl adenovirus type 8[J]. J Gen Virol, 2000, 81(7):1833-1837.
[19]LOUIS N, FENDER P, BARGE A, et al. Cell-binding domain of adenovirus serotype 2 fiber[J]. J Virol, 1994,68(6): 4104-4106.
[20]SCHACHNER A, MAREK A, GRAFL B, et al. Detailed molecular analyses of the hexon loop-1 and fibers of fowl aviadenoviruses reveal new insights into the antigenic relationship and confirm that specific genotypes are involved in field outbreaks of inclusion body hepatitis[J].Vet Microbiol, 2016, 186: 13-20.
[21]SCHACHNER A, MAREK A, JASKULSKA B, et al.Recombinant FAdV-4 fiber-2 protein protects chickens against hepatitis-hydropericardium syndrome (HHS)[J].Vaccine, 2014, 32(9): 1086-1092.
[22]VERA-HERNANDEZ P F, MORALES-GARZON A,CORTES-ESPINOSA D V, et al. Clinicopathological characterization and genomic sequence differences observed in a highly virulent fowl aviadenovirus serotype 4[J]. Avian Pathol, 2016, 45(1): 73-81.
[23]汪凯, 蔡骁垚, 叶建强, 等. 新型鸡心包炎–包涵体肝炎病毒的分离及鉴定[J]. 中国动物传染病学报, 2016, 24(4): 1-6.
[24]YE J, LIANG G, ZHANG J, et al. Outbreaks of serotype 4 fowl adenovirus with novel genotype, China[J]. Emerg Microbes Infect, 2016, 5: e50.
[25]牛登云, 沈元, 王蕊, 等. 2015年我国Ⅰ群禽腺病毒分子流行病学调查[J]. 中国家禽, 2016, 38(9): 65-68.
[26]李晓林, 王相芹, 罗济冠, 等. Ⅰ群禽腺病毒的分离鉴定及其致病性研究[J]. 中国动物检疫, 2016, 33(8): 86-89.
[27]于可响, 黄兵, 凌红丽, 等. 山东省血清4型禽腺病毒的分离鉴定[J]. 中国动物传染病学报, 2016(5): 1-5.
Isolation, identification and molecular characteristics of group I fowl adenovirus serotype 4 from Guangdong, China
LUO Yangyang1, ZHAO Lichan2, LI Qunhui2, LIN Ruiqing1, WENG Yabiao1
(1 College of Veterinary Medicine, South China Agricultural University, Guangzhou 510642, China;2 Guangdong WENS Foodstuff Group Co., Ltd., Yunfu 527400, China)
【Objective】To isolate and identify the pathogen causing the inclusion body hepatitis (IBH) and hydropericardium syndrome (HPS) in chicken in Guangdong Province, and study its molecular characteristics.【Method】A virus was isolated from specific pathogen-free(SPF) chicken embryo inoculated with liver suspension from affected chickens. The virus was purified by limiting dilution method and used for pathogenicity test. Hexon, fiber-2, ORF29 and ORF19 genes were amplified by PCR, and analyzed for molecular characteristics.【Result】Sequence analysis of hexon gene revealed the strain, named as WM-XC,belonged to group I fowl adenovirus serotype 4 (FAdV-4). This isolated strain was pathogenic based on the evidence that the mortality rate of SPF chicken reached 90% after virus inoculation, the hydropericardiumhepatitis syndrome was observed, and acidophilous inclusion body was found in the pathological section ofliver. The fiber-2 gene sequence of WM-XC had 96.1% and 97.0% similarities with the corresponding sequences of ON1 and KR-5, and had 100% similarity with fiber-2 genes of fowl adenovirus isolates collected in China since 2015. There was a 33 bp deletion in ORF29 gene of WM-XC compared with JSJ13 and JN13 strains isolated in 2013 in China. Similar to isolates collected in China since 2015, WM-XC lacked ORF19 compared with classical FAdV-4 strain ON1 and KR-5.【Conclusion】The isolated group I FAdV-4 strain and other isolates collected in China in recent years were distinct from classical FAdV-4 strains in their fiber-2,ORF19 and ORF29 gene sequences.
fowl adenovirus; isolation and identification; molecular characteristic; hexon gene; fiber-2 gene; pathogenicity
罗洋洋, 招丽婵, 李群辉, 等. I群禽腺病毒血清4型广东株的分离鉴定及分子特性[J]. 华南农业大学学报, 2017, 38(6): 27-33.
S852.659.1
A
1001-411X(2017)06-0027-07
2017-01-21 优先出版时间:2017-11-06
优先出版网址:http://kns.cnki.net/kcms/detail/44.1110.S.20171106.1412.010.html
罗洋洋 (1991—),男,硕士研究生,E-mail: qunlongluo@qq.com; 通信作者: 翁亚彪 (1963—),男,副教授,硕士,E-mail: ybweng@scau.edu.cn
国家重点研发计划(2016YFD0501303)
【责任编辑 庄 延】

