糖尿病合并肺结核患者体内抗结核药物血药浓度分析
毛晓辉 吴璇 王勃 薛欣 曹思哲 高新华 马庭喜薛瑜 徐纾 郭凤艳 王清虎
糖尿病合并肺结核患者体内抗结核药物血药浓度分析
毛晓辉 吴璇 王勃 薛欣 曹思哲 高新华 马庭喜薛瑜 徐纾 郭凤艳 王清虎
目的研究糖尿病合并肺结核患者体内异烟肼、利福平的血药浓度与单纯肺结核之间的差别,为临床用药提供理论支持。方法随机选取糖尿病合并肺结核患者30例作为观察组(A组),单纯肺结核组30例为对照组(B组),采用高效液相色谱法(HPLC)测定患者体内异烟肼、利福平的血药浓度,两组间进行比较,采用SPSS18.0软件进行统计学分析。结果(1) A组治疗前的血药浓度较治疗后显著降低[分别为(8.56±4.04)ug/mL和(14.91±4.99)ug/mL,t=-5.41,P=0.00];(2) A组治疗前后异烟肼的血药浓度统计学无显著性差异[分别为(2.89±0.78)ug/mL和(2.92±0.71)ug/mL,t=-0.18,P=0.86];(3) A组与B组比较,A组利福平的血药浓度较B组显著降低[分别为(8.56±4.04)ug/mL和(14.24±3.48)ug/mL,t=-5.77,P=0.00];(4) A组与B组,两组异烟肼的血药浓度统计学无显著性差异[分别为(2.89±0.78)ug/mL和(2.96±0.96)ug/mL,t=-0.29,P=0.77]。结论肺结核患者体内异烟肼的血药浓度高低不受血糖的影响,但普遍偏低,利福平的血药浓度有可能受血糖高低的影响,血糖的控制有可能会提高利福平的血药浓度,因此要注意监测其血药浓度并及时调整给药剂量。
结核,肺/并发症;糖尿病;抗结核药物;血药浓度
我国是世界上22个结核病高负担国家之一,同时我国也是糖尿病大国,糖尿病患者是肺结核的高危人群,我国糖尿病合并肺结核率高达40%[1],肺结核合并糖尿病的临床发病率越来越高[2-3].两病共存时治疗周期长,痰菌阴转时间长,治疗失败率高。抗结核药物血药浓度的检测近年来在临床上越来越受到重视,Heysell 等[4]研究显示抗结核药物的血药浓度与疗效具有直接相关性,血药浓度不足是疗效不佳的原因之一。本研究旨在通过对糖尿病合并肺结核组与单纯肺结核组患者体内抗结核药物的血药浓度进行检测,进一步了解肺结核患者体内抗结核药物的血药浓度高低与血糖水平是否有关。
资料与方法
一、诊断标准
1 肺结核诊断标准参考《肺结核诊断和治疗指南》[5]
2 糖尿病诊断标准参考世界卫生组织(WHO)1999年糖尿病诊断标准[6]
二、病例选取
1 糖尿病组:随机选取我院2015年12月至2017年5月初治肺结核同时合并糖尿病的患者30例,其中男性22例,女性8例,年龄28-68岁,平均年龄(46.58±6.02)岁,体质量为49-70.2kg,平均体质量(57.24±6.0)kg。
2 对照组:随机选取同期单纯初治肺结核患者30例,除外其它基础疾病,其中男性20例,女性10例,年龄23-70岁,平均年龄(44.56±5.89)岁,体质量为44-72.3kg,平均体质量(55.4±6.0)kg。
两组性别、年龄、体质量均无显著性差异(Pgt;0.05)
三、糖尿病组均采用胰岛素降糖治疗。抗结核药物均给予HRZE四联抗结核方案。异烟肼0.3g口服,1次/日(山西云鹏制药有限公司、0.1g×100片)利福平0.45g/0.6g口服,1次/日(体质量lt;50kg者0.45g,≥50kg者0.6g)(四川制药制剂有限公司、0.15g×100片)。
四、血药浓度检测:A组分别在入院时服用异烟肼、利福平2h抽取静脉血3mL送检,采用高效液相色谱仪(HPLC)测定二者的血药浓度,治疗1月后再次检测,同时检测B组入院时的异烟肼、利福平的血药浓度。
五、统计学分析:收集整理病例相关资料及血药浓度值,运用SPSS18软件将A组治疗前后及AB组的两种抗结核药物的血药浓度数值进行比较,通过t检验计算出相应的P值,Plt;0.05为差异有统计学意义。
结 果
一、 A组治疗1月后较治疗初利福平的血药浓度显著升高,差异有统计学意义(Plt;0.05)(见表1)。
二、A组治疗1月后和治疗初相比较,异烟肼的血药浓度差异无统计学意义(Pgt;0.05)(见表1)。
三、A组治疗初利福平的血药浓度较B组显著降低,差异有统计学意义(Plt;0.05)(见表2)。
四、A组治疗初异烟肼的血药浓度较B组比较差异无统计学意义(Pgt;0.05)(见表2)。
五、不同组别异烟肼的血药浓度多低于正常,与血糖高低无关(见表3)。
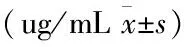
表1 糖尿病合并肺结核组治疗前后抗结核药物血药浓度分析
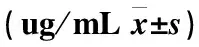
表2 糖尿病合并肺结核组和单纯肺结核组抗结核药物血药浓度分析

表3 糖尿病合并肺结核组和单纯肺结核组异烟肼血药浓度分析
讨 论
我国是结核病高发的国家,结核病例数约占全球 12%[7],结核病的疫情还不容乐观。抗结核药物是结核病化疗的基石,自抗结核药物问世以来,结核病治愈率明显提高,但仍有约13 %患者治疗失败[7]。治疗失败的原因有一部分是耐药的问题。有研究表明,患者体内的治疗药物浓度与耐药的发生相关[8]。药物浓度过低可能诱发耐药,Heysell 等[4]研究显示抗结核药物的血药浓度与疗效具有直接相关性,血药浓度不足是疗效不佳的原因之一。药物浓度过高则会增加药物的毒副作用,可造成药物性肝损伤而影响化疗效果[9]。因此,进行血药浓度监测,才能指导临床用药,更好的达到个体化治疗。因此,抗结核药物血药浓度监测在结核病的治疗中十分重要[10]。
糖尿病患者是结核病的高危人群,且二者共存时往往治疗周期长,疗效差,复发率高。糖尿病患者往往合并肝肾等脏器的损害,而抗结核药物大多是经肝肾代谢。异烟肼和利福平是结核病化疗药物的基石。异烟肼对结核分枝杆菌具有高度选择性,对生长旺盛的活动期结核分枝杆菌有强大的杀灭作用,对静止期结核分枝杆菌无杀灭作用而仅有抑菌作用,其 MIC 为 0.025-0.050 mg/L[11]。 本研究结果显示,A组治疗前后异烟肼的血药浓度差异无统计学意义;且A组和B组异烟肼的血药浓度差异也无统计学意义。A组治疗前和治疗1月后的异烟肼血药浓度值低于正常血药浓度范围(正常范围为3-6ug/mL)的占73.3%,两组无统计学差异;B组异烟肼的血药浓度值低于正常浓度范围的占70%,AB两组相比较差异无统计学意义。与魏香兰等[12]报道的结果一致。原因可能是因为异烟肼主要在肝内由N-乙酰转移酶2(NAT-2)乙酰化为乙酰异烟肼和异烟酸等,最后与少量原形药经肾排出。异烟肼的代谢根据 NAT-2不同的表型分为快代谢型、中间代谢型和慢代谢型[13]。 74.4%的中国人和大部分的亚洲人是快乙酰化型(结核病P510),因此异烟肼的血药浓度普遍偏低可能与此有关,慢代谢型患者异烟肼的暴露量大,可能具有更好的疗效。可以看出,肺结核患者体内异烟肼的血药浓度高低不受血糖的影响,并且其血药浓度值普遍偏低,需监测并及时调整用药剂量。
利福平是目前治疗结核病最有效的药物之一,主要经肝脏代谢,体外试验表明,利福平对结核分枝杆菌的杀菌浓度为 0.005-0.2 mg/L[12]。该药主要经胆汁从肠道排泄,在肾功能减退患者中本品无蓄积。本研究结果提示A组治疗初利福平的血药浓度值低于治疗1月后,同时也低于B组,考虑可能与A组治疗初期的高血糖状态有关,与王建岗等[14]报道结果相符合,分析原因可能与糖尿病患者往往合并有肝肾等脏器的损害有关,糖尿病可造成糖脂代谢紊乱,肝脏作为糖脂代谢重要的靶器官,糖尿病状态下可产生脂肪肝、肝纤维化、肝硬化等肝脏疾病,其机制可能与氧化应激有关[15]。有研究表明[16]:2 型糖尿病患者非酒精性脂肪肝、肝纤维化、肝硬化的风险增加 ,肝脏病变时,肝脏的有效血流量减少,肝细胞对药物的摄取和排泄减少,胆汁淤积,血浆蛋白合成减少,使得药物的血药浓度降低。因此可能导致导致利福平的血药浓度降低。本研究结果与魏明等[17]报道的结果不一致。可能与不同患者应用利福平的血药浓度个体差异较大有关,也有可能是因为有的患者开始对药物吸收不良,但当药物起作用后,血药浓度可能增高有关,本研究的缺陷是样本量少,采血的时间点过少,不能连续动态反应血药浓度的状态,有待于进一步大样本数据和多个时间点检测的研究。
综上,糖尿病合并肺结核时,往往病情疗程长、治愈率低、复发率高,本研究提示糖尿病患者的利福平血药浓度降低可能是导致治疗失败的原因之一。因此,应重视在抗结核治疗过程中抗结核药物特别是利福平的血药浓度监测,以更好的指导临床用药。
[1] 弭凤玲,杜建,姜晓颖,等.我国合并糖尿病初治涂阳肺结核患者治疗效果的系统评价和meta分析[J].医学研究杂志,2011,40(9):51-55.
[2] 闫晓伟.结核病合并糖尿病住院患者的临床分析125例[J].中国社区医师(医学专业),2012,14(9):71.
[3] Stevenson CR,Forouhi NG,Roglic G,et al.Diabetes and tuberculosis: the impact of the diabetes epidemic on tuberculosis incidence[J].BMC Public Health,2007,7:234.
[4] Heysell SK,Moore JL,Keller SJ,et al.Therapeutic drug monitoring for slow response to tuberculosis treatment in a state control program, Virginia, USA[J].Emerg Infect Dis,2010,16(10):1546-1553.
[5] 张培元.肺结核诊断和治疗指南[S].中华结核和呼吸杂志,2001,24(2):70-74.
[6] 钱荣立.关于糖尿病的新诊断标准与分型[S].中国糖尿病杂志,2000,8(1):5-6.
[7] World Health Organization.Global tuberculosis report 2014[EB/OL].[2015-07-01].http://www.who.int/tb/publications/global_report/en/.
[8] Srivastava S,Pasipanodya JG,Meek C,et al.Multidrug-resistant tuberculosis not due to noncompliance but to between-patient pharmacokinetic variability[J].J Infect Dis,2011,204(12):1951-1959.
[9] Marjani M,Baghaei P,Tabarsi P,et al.Drug resistance pattern and outcome of treatment in recurrent episodes of tuberculosis[J].East Mediterr Health J,2012,18(9):957-961.
[10] Sotgiu G,Alffenaar JW,Centis R,et al.Therapeutic drug monitoring:how to improve drug dosage and patient safety in tuberculosis treatment[J].Int J Infect Dis,2015,32:101-104.
[11] 中国防痨协会.耐药结核病化学治疗指南(2015)[S].中国防痨杂志,2015,37(5):421-469.
[12] 魏香兰,方如塘,师延峰,等.抗结核药物的血药浓度监测结果分析[J].中国医院药学杂志,2015,35(21):1918-1921.
[13] Azuma J,Ohno M,Kubota R,et al.NAT2 genotype guided regimen reduces isoniazid-induced liver injury and early treatment failure in the 6-month four-drug standard treatment of tuberculosis: a randomized controlled trialfor pharmacogenetics-based therapy[J].Eur J Clin Pharmacol,2013,69(5):1091-1101.
[14] 王建岗,刘进.利福平、异烟肼在肺结核合并糖尿病患者中的血药浓度分析[J].现代实用医学,2013,25(5):522-523.
[15] 吴悠,丛晓东,张云.糖尿病肝损伤相关机制及中药干预[J].中国民族民间医药,2011,20(21):16-17.
[16] Salas-Flores R,González-Pérez B,Echegollen-Guzmán A.Hepatic steatosis and type 2 diabetes mellitus in health workers[J].Rev Med Inst Mex Seguro Soc,2012,50(1):13-18.
[17] 魏明,朱木新,刘炜,等.糖尿病合并肺结核血糖控制前、后2种抗结核药的药动学对比[J].中国医院药学杂志,2009,29(17):1457-1459.
Analysisofplasmaconcentrationsofisoniazid(INH)andrifampicin(RFP)ofdiabetespatientscomplicatedwithpulmonarytuberculosis
MAOXiao-hui,WUXuan,WANGBo,XUEXin,CAOSi-ze,GAOXin-hua,MATin-xi,XUEYu,XUSu,GUOFen-yan,WANGQing-hu
Xi’anChestHospital,Xi’an,Shaanxi710061,China
ObjectiveTo explore the deviation of plasma concentrations of isoniazid (INH) and rifampicin (RFP) between diabetes mellitus with pulmonary tuberculosis and pulmonary tuberculosis.Methods30 diabetes mellitus patients complicated with pulmonary tuberculosis were taken as the observation group (the group A), and another 30 tuberculosis patients as control group (the group B). It used high performance liquid chromatography (HPLC) to measure the plasma concentrations of isoniazid (INH) and rifampicin (RFP), and the results of the two groups were statistically analyzed by SPSS18.0.Results1. The plasma concentration of RFP in the group A decreased significantly after treatment [(8.56±4.04)ug/mL and (14.91±4.99)ug/mL respectively, (t=-5.41,P=0.00)]. 2. The plasma concentration of INH before and after treatment in the group A had no statistically significant [(2.89±0.78)ug/mL and (2.92±0.71)ug/mL respectively] (t=-0.18,P=0.86). 3. The plasma concentration of RFP decreased more significantly in the group A than in the group B [(8.56±4.04)ug/mL and (14.24±3.48)ug/mL respectively] (t=-5.77,P=0.00). 4. The plasma concentration of INH in the group A and the group B had no statistical significance [(2.89±0.78)ug/mL and (2.96±0.96)ug/mL respectively] (t=-0.29,P=0.77).ConclusionThe plasma concentration of INH in pulmonary tuberculosis patients is influenced by blood sugar but generally low. The plasma concentration of RFP may be influenced by blood sugar. The controlling of blood sugar may increase the plasma concentration of RFP. Therefore, plasma concentration should be monitored and drug dose should be adjusted appropriately.
tuberculosis; pulmonary/complication; diabetes; anti-tuberculosis drugs; plasma concentration
10.3969/j.issn.1009-6663.2017.12.029
710100 陕西 西安,西安市胸科医院 内四科
2017-08-03]

