肺恶性结节18F-FDG显像特征与预后的关系
付立武
肺恶性结节18F-FDG显像特征与预后的关系
付立武
目的:分析肺恶性结节18F-FDG PET双时相显像特征,并探讨其与预后的关系。方法回顾性分析2011年2月-2013年5月经手术或病理确诊的76例肺恶性结节患者临床资料,所有患者行18F-FDG PET双时像检查,并将影像学特征与患者预后进行多因素分析。结果患者早期显像SUV值(4.78±1.13), 延迟显像SUV值为(6.53±1.36), SUV 变化率为(37.47±2.05)%。Cox模型多因素分析显示,与患者生存时间密切相关的临床与病理因素为原发病灶大小、18F-FDG显像阳性、血清CEA。原发病灶≤2cm、18FDG显像阴性、血清CEA正常患者的3年生存率比原发病灶gt;2cm、FDG显像阳性、血清CEA升高患者高(Plt;0.01)。结论原发病灶大小、18FDG显像阳性、血清CEA是肺恶性结节患者预后的独立危险因素。运用18F-FDG PET双时相显像检查在肺恶性结节中的诊断价值比较高,与原发病灶大小、血清CEA等指标联合使用,能够前瞻性地预估患者预后。
肺恶性结节;18F-FDG;显像
随着现代影像学技术的快速发展,18F-脱氧葡萄糖(FDG)PET显像被广泛应用于肿瘤诊断和分期。此种显像技术诊断肿瘤灵敏度比较高,但特异性较低,易受到生理性摄取、炎症反应与结节病等因素的干扰,进而会出现假阳性[1-2]。多数肺癌患者预后评价因素是在通过手术后获得的,难以对术前治疗给予科学指导。而精确的预后判断有益于规范化的综合性治疗。目前,关于18F-FDG PET双时相显像在肺恶性结节患者预后评价中的作用的研究报道尚少。本文旨在分析肺恶性结节的18F-FDG PET双时相显像体现的与预后相关的因素/特征,探讨18F-FDG PET双时相显像检查与肺恶性结节患者预后的关系,现总结报道如下。
资料与方法
一、一般资料
回顾性分析2011年2月-2013年5月经手术或病理确诊的76例肺恶性结节患者临床资料,其中男42例,女34例,年龄36-71岁,平均年龄(63.5±2.7)岁;部位:右上肺 20例,右中下肺 22例,左上肺 24例,左下肺 10例;病理类型:腺癌45例,鳞癌26例,腺鳞癌5例;血清CEA正常52例,升高24例。排除18F-FDG PET双时像检查图像无法满足测量需求者、围手术期(术后1个月内)死亡者,合并存在心、脑、肝等其他重要器官疾病者。所有患者行18F-FDG PET双时像检查,最后由手术病理或临床随访确诊。入选的患者均签署知情同意接受本研究。
二、PET-CT检查方
患者检查前禁食4 h以上, 对患者末梢血糖控制于3.1-6.7 mmol/L范围内, 对其静脉进行注射剂量为3.70-5.55 MBq/kg的18F-FDG,药品由南京江原安迪科正电子研究发展有限公司提供。早期显像于患者静脉注射FDG后40-65 min进行, 延迟显像则在注药后2 h进行。使用飞利浦公司Gemini TF Nano 128成像仪实施 PET-CT检查,患者取仰卧位,双上臂置于头上,以降低胸部伪影;首先实施CT透射扫描操作,将扫描电流设定为80 mA, 电压设定为120 kV;然后实施PET采集, 每个床位2.5 min。符合探测轴向视野40 cm。滤波反投影重建, 4 mm层厚。CT透射扫描进行衰减校正后将CT图像和核医学图像PET自行图像融合, 获得横断面、矢状面、冠状面三维断层图像[3-4]。
三、结果判断
由3名资深的核医学科医生进行独立阅片,观察是否有异常的FDG摄取情况发生, 运用计算机软件在横断面、矢状面、冠状面3个断面观察异常FDG摄取的病灶位置。与CT扫描对照,判断肺部病灶勾画感兴趣区(ROI), 同时结合患者的体质量、注射剂量及时间、ROI内放射性计数, 通过计算机自动算出SUV。最后把同样大小的ROI置于延迟显像之相应层面, 算出SUV的变化率。计算公式:SUV变化率=(SUV延迟-SUV早期)/SUV早期×100%[5]。FDG显像阳性判定标准: SUVmaxgt;2.5[6]。患者经治疗后进行随访3年,评价患者的3年生存率。
四、统计学处理
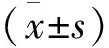
结 果
一、患者早期与延迟显像SUV值及SUV 变化率结果
患者早期显像SUV值(4.78±1.13), 延迟显像SUV值为(6.53±1.36), SUV 变化率为(37.47±2.05)%。
二、18FDG显像病灶大小及阳性情况
结合目测法和半定量法结果进行诊断[7],76例病例中原发病灶为(2.6±0.8)cm,其中病灶gt;2cm 40例, 病灶≤2cm 36例。18FDG显像显示阳性70例,阴性6例。
三、患者生存曲线分析
以视觉定性判断作为预后分析的标准[8],18F-FDG PET双时相显像阳性患者3年生存率明显低于阴性患者,Plt;0.01,(见图1)。

图1 患者生存曲线图
四、单因素分析结果
单因素分析显示,原发病灶大小、病变部位、病理类型、18F-FDG显像阳性、血清CRA水平均是肺恶性结节预后评价因素。其中,原发病灶≤2cm、FDG显像阴性、血清CEA正常患者的3年生存率比原发病灶gt;2cm、FDG显像阳性、血清CEA升高患者高,Plt;0.01,(见表1)。

表1 单因素分析结果
五、多因素分析结果
通过Cox模型多因素分析,得出与患者生存时间密切相关的临床与病理因素为: 原发病灶大小、18FDG显像阳性、血清CEA,(见表2)。

表2 Cox模型多因素分析结果
六、典型病例分析
对比(图2,图3)的典型病例,可以看出18FDG显像阳性的生存时间更短。

图2 左肺上叶恶性结节
患者男,55岁,患有左肺上叶恶性结节,病理类型为腺癌,CT图像示左肺上叶尖后段实性结节(箭),边缘毛糙,有分叶,细短毛刺(见图2-a);PET图像示左肺病灶 FDG摄取异常增高(箭)(见图2-b),FDG显像阳性,患者生存时间为23个月。

图3 左肺上叶恶性结节
患者男,57岁,患有左肺上叶恶性结节,病理类型为腺癌,CT图像示左肺上叶尖后段亚实性结节(箭),有细短毛刺,密度不均匀(见图3-a) ;PET图像示左肺病灶 FDG摄取稍增高(箭)(见图3-b),FDG显像阴性,患者生存时间为37个月。
讨 论
有研究显示[9],大概50%的孤立性肺结节患者术后病理证实是良性结节。所以积极寻找准确度高的检查方法,降低治疗决策中的失误,具有十分重要的意义。近年来将两种及以上影像学手段进行联合检查、综合判断。18F-FDG PET/CT是运用恶性肿瘤细胞的糖酵解增强的原理来诊断原发性恶性病灶及其转移灶,而同机多层的螺旋CT可以比较清晰地检查出解剖结构。18F-FDG PET/CT可以把PET图像与CT图像进行融合, 能够清晰地显示出PET图像、CT图像与PET-CT的融合图像,也可以看见横断面、矢状面、冠状面3个断面图像, 根据SUV(标准摄取值)则能够实施定量分析, 进而对孤立性肺结节实施精确定位与准确的定性诊断[10-11]。相关研究显示[12],18F-FDG PET/CT可以对CT与PET进行优势互补,一方面可弥补CT的定性困难,另可以弥补PET定位不够精确等局限, 进而大幅度提高了孤立性肺结节中的临床诊断的准确度。目前,关于18F-FDG PET/CT在孤立性肺结节中得到了比较广泛的应用。但是许多学者[13-14]仅是将18F-FDG PET/CT运用孤立性肺结节的诊断研究,而关于18F-FDG PET/CT运用于肺恶性结节中的预后判断的研究尚少。
本研究显示,肺恶性结节患者早期显像SUV值(4.78±1.13), 延迟显像SUV值为(6.53±1.36), SUV 变化率为(37.47±2.05)%,说明肺恶性结节的SUV延迟与SUV早期存在差异,可以通过显像SUV值的变化来判断肺恶性结节病变,这与国外文献[15]的研究报道一致。
经Cox模型多因素分析显示,与患者生存时间密切相关的临床与病理因素为原发病灶大小、18FDG显像阳性、血清CEA。且原发病灶≤2cm、18FDG显像阴性、血清CEA正常患者的3年生存率比原发病灶gt;2cm、18FDG显像阳性、血清CEA升高患者高(Plt;0.01)。说明,在临床上可以通过18F-FDG PET/CT检查(FDG显像是否呈阳性)、原发病灶大小、血清CEA等指标进行联合判断肺恶性结节患者的预后评估。此外, 本研究单因素和多因素分析均显示, 病变部位、病理类型等因素与肺恶性结节患者的预后无关, 值得进一步探讨。
综上所述,原发病灶大小、18FDG显像阳性、血清CEA是肺恶性结节患者预后的独立危险因素。运用18F-FDG PET双时相显像检查在肺恶性结节中的诊断价值比较高,与原发病灶大小、血清CEA等指标联合使用,能够前瞻性地预估患者预后。
[1] 郑昊,樊树峰.不同影像检查技术对孤立性肺结节的研究进展[J].医学研究杂志,2016,45(5):183-186.
[2] Nakashima T,Takayama Y,Nishie A,et al.Hepatocellular adenoma showing high uptake of18F-fluorodeoxyglucose (FDG) via an increased expression of glucose transporter 2 (GLUT-2)[J].Clin Imaging,2014,38(6):888-891.
[3] 郑凯,叶慧,莫逸,等.40岁以下肺内孤立性结节18F-FDG PET-CT分析[J].影像诊断与介入放射学,2017,26(1):62-65.
[4] 潘博,汪世存,方雷,等.18-氟-脱氧葡萄糖PET/CT双时相显像在孤立肺结节中的诊断价值[J].中国临床保健杂志,2009,12(1):23-24.
[5] 李文婵,姚稚明,屈婉莹,等.SUV小于2.5的孤立性肺结节18F-FDG PET/CT诊断价值初探[J].医学研究杂志,2011,40(9):47-51.
[6] 徐荣,邵明岩,陈小华,等.18F-FDG PET/CT双时相显像对不同大小的孤立性肺结节的诊断价值[J].南昌大学学报(医学版), 2016,56(6):28-32.
[7] 葛全序,朱仁娟,刘庆伟,等.18F-FDG PET/CT结合高分辨率CT对孤立性肺结节的诊断价值[J].中华核医学杂志,2005,25(5):264-266.
[8] 李鹤虹,郑长煌,罗良平,等.孤立性肺结节CT影像的计算机视觉分析[J].暨南大学学报(医学版),2011,32(4):415-418.
[9] 郭洪生,杨德宏,李媛媛,等.孤立性肺结节诊断和处理策略研究进展[J].天津医药,2016,44(5):653-656.
[10] Karunanithi S,Sharma P,Kumar A,et al.18F-FDOPA PET/CT for detection of recurrence in patients with glioma: prospective comparison with18F-FDG PET/CT[J].Eur J Nucl Med Mol Imaging,2013,40(7):1025-1035.
[11] Fagman E,van Essen M,Fredén Lindqvist J,et al.18F-FDG PET/CT in the diagnosis of prosthetic valve endocarditis[J].Int J Cardiovasc Imaging,2016,32(4):679-686.
[12] Caobelli F,Alongi P,Evangelista L,et al.Predictive value of 18 F-FDG PET/CT in restaging patients affected by ovarian carcinoma: a multicentre study[J].Eur J Nucl Med Mol Imaging,2016,43(3):404-413.
[13] Lin P,Min M,Lee M,et al.Prognostic utility of18F-FDG PET-CT performed prior to and during primary radiotherapy for nasopharyngeal carcinoma: Index node is a useful prognostic imaging biomarker site[J].Radiother Oncol,2016, 120(1):87-91.
[14] 齐景伟,李冬.PET/CT在孤立性肺结节的早期定性诊断及鉴别诊断方面的应用价值[J].中国实验诊断学,2011,15(5):905-906.
[15] Taniguchi Y,Takahashi M,Matsudaira K,et al.Potential use of18F-FDG-PET/CT to visualize hypermetabolism associated with muscle pain in patients with adult spinal deformity: a case report[J].Skeletal Radiol,2016,45(11):1577-1581.
Relationshipbetween18F-FDGimagingfeaturesandprognosisofmalignantpulmonarynodules
FULi-wu
LuoyangCentralHospitalAffiliatedtoZhengzhouUniversity,Luoyang,Henan471000,China
ObjectiveTo analyze the characteristics of PET dual phase imaging of pulmonary malignant nodules (18F-FDG) and its relationship with prognosis.MethodsThe clinical data of 76 cases of malignant pulmonary nodules patients from February 2011 to May 2013 were retrospectively analyzed. All patients underwent18F-FDG PET double check, and the imaging features and prognosis of patients were given multi-factor analysis.ResultsThe value of SUV (4.78±1.13) in the early stage of the imaging was SUV (6.53±1.36), and the change rate of SUV was (37.47±2.05)%. Multivariate analysis of Cox model showed that the clinical and pathological factors were closely related to the survival time of patients, the size of primary lesions, FDG positive, and serum CEA. While the patients with primary lesion less than or equal to 2cm, negative FDG imaging and normal serum CEA, their 3 year survival rate was higher than patients with primary lesions ≤2cm, positive FDG imaging, and high serum CEA (Plt;0.01).ConclusionThe size of primary lesion, positive FDG imaging and serum CEA are independent risk factors for prognosis of patients with malignant pulmonary nodules. The use of18F-FDG PET dual phase imaging examination in the diagnosis of pulmonary malignant nodules is relatively high, and the size of primary lesions, serum CEA and other indicators can predict the prognosis of patients.
pulmonary malignant nodules;18F-FD; imaging
10.3969/j.issn.1009-6663.2017.12.042
471000 河南 洛阳,郑州大学附属洛阳中心医院 核医学科
2017-04-25]

