可溶性甘露聚糖受体sMR在脓毒症中的表达水平及差异性研究
张文彬 常晓悦
可溶性甘露聚糖受体sMR在脓毒症中的表达水平及差异性研究
张文彬1常晓悦2
目的探讨可溶性甘露糖受体(Soluble Mannose Receptor,sMR)在脓毒症(Sepsis)患者血清的表达水平,分析其在sepsis的诊断及病情严重程度判断的价值。方法收集脓毒症患者66例(脓毒症40例,脓毒症休克26例)及对照组18例,采集所有入组患者24小时内的静脉血,离心后保存上层血清于-80℃冰箱待测,采用ELISA法检测血清中的sMR的水平。同时收集化验室的检测结果,入院的SOFA评分和APACHE II评分。所有数据和图表均用统计分析软件SPSS 17.0计算及处理。结果对照组、脓毒症组、脓毒症休克组血清sMR水平在三组的表达比较差异有显著统计学意义(Plt;0.05)。脓毒症组的PCT、sMR水平均高于对照组,差异均有统计学意义(Plt;0.05),感染指标经受试者工作特征曲线(The Receiver Operating Characteristic Curve,ROC)分析,ROC曲线下面积分别为:0.881/0.954。Sepsis、septic shock间比较,PCT在两组间表达水平均没有统计学意义(Pgt;0.05),而sMR的表达水平在两组间具有显著统计学意义(Plt;0.05)。SOFA评分和APACHE II评分在sepsis和sepsis shock间差异均具有显著统计学意义,绘制诊断septic shock的ROC曲线,ROC曲线下面积分别为:0.910/0.972。Spearman秩相关分析显示,在脓毒症患者中sMR同PCT呈弱正相关性(0.2lt;rlt;0.4,Plt;0.05),与APACHE II评分呈中等强度正相关性(0.4lt;rlt;0.6,Plt;0.05),与SOFA评分呈强正相关性(0.6lt;rlt;0.8,Plt;0.05)。结论血清sMR水平在脓毒症患者有应用价值,可早期诊断脓毒症,诊断效能优于PCT,可鉴别脓毒症的严重程度。
可溶性甘露糖受体;脓毒症;降钙素原;序贯器官衰竭估计评分;急性生理与慢性健康评分
脓毒症(sepsis)是宿主对感染的反应失调,并产生危及生命的器官功能损害[1]。是危害公众健康的重大问题,也是国际医疗界的公认难题。是危重病人的首要死亡原因,占医院报告死亡率的30%-50%[2]。
由于其进展快,早期诊断和早期治疗变得尤为重要。但脓毒症缺乏特异的临床表现,血培养是检测血液感染的当前黄金标准。然而由于培养周期长,只有大约30%的患者血培养阳性,血培养在脓毒症早期诊断的实际应用价值有限[3]。
生物标记物(Biomarkers)近年来是国内外学者的研究热点[4],临床应用较成熟的两个感染指标,C-反应蛋白(C-Reactive protein,CRP)和降钙素原(PCT),两者均被用于2001年和2012年脓毒症定义的炎症感染指标。其中PCT在2012年被纳入国际脓毒症和脓毒性休克治疗指南用于脓毒症的早期诊断[5],然而其灵敏度和特异性低,临床仍急需一个灵敏度和特异性均高的生物标记物[6]。
甘露糖受体(MR)是先天免疫系统中重要的模式识别受体和内吞受体,在维持内稳态、识别病原、诱导细胞因子、抗原递呈等过程中发挥重要作用[7]。MR可识别细胞或病原体表面多种糖分子和可溶性糖蛋白,可特异性识别以甘露糖、N-乙酞葡糖胺或岩藻糖为末端的配体[8]。这些糖类经常出现于微生物的表面,通过识别、结合这些糖类以介导吞噬病原微生物。可溶形式的MR(sMR),由内源性细胞金属蛋白酶对膜结合形式的蛋白水解切割释放,sMR保留了MR的结合特性,且在外周血清中也有表达[9],然而其释放过程仍待研究。
来自于Sidsel Rodgaard-Hansen[10]等研究结果显示血清sMR在脓毒症患者的表达水平显著升高,且其表达水平与感染指标指标正相关,是很有前景的生物标记物。本研究通过对sMR在脓毒症的表达水平及其差异的分析,探讨其在脓毒症患者的诊断、脓毒症严重程度的鉴别和预后评估临床应用的价值。
资料与方法
一、研究对象
收集所有2015.12至2016.11包头市中心医院呼吸重症监护病房(RICU)、及重症监护病房(ICU)满足脓毒症诊断的病例。根据疾病的严重程度不同分为sepsis、septic shock,并选取感染非脓毒症组患者18例作为对照组。所有入组患者严格按照入选的标准选取,剔除符合排除标准的病例。脓毒症纳入标准依据2016年国际脓毒症定义Sepsis3.0,对照组为感染+SOFAlt;2分。排除符合以下任一条件者:①年龄lt;18岁;②怀孕或哺乳期女性;③一年内放、化疗患者;④HCTlt;0.25;⑤大剂量糖皮质激素应用患者;⑥严重肝脏基础疾病患者;⑦不同意参加本研究者。
二、研究方法
抽取患者入院24小时内外周血3mL,置于EDTA管中,室温静置1-2小时,然后置于离心机内 以3000rpm离心20分钟,取上清液转移至EP管中并作好标记,置于-80℃冰箱中保存待测。患者的一般临床资料,记录患者入组24小时内的体温、心率、血压、呼吸频率、吸氧浓度、动脉血气、尿素氮、血清肌酐、总胆红素、白细胞计数、红细胞压积、凝血功能、血小板计数、降钙素原、序贯器官衰竭估计(Sequential Organ Failure Assessment,SOFA)评分和急性生理与慢性健康评分(Acute Physiology and Chronic Health Evaluation II,APACHEII)。
应用ELISA法测定标本中人可溶性甘露糖受体(sMR)水平,用纯化的人可溶性甘露糖受体(sMR)抗体包被微孔板,制成固相抗体,往包被单抗的微孔中依次加入可溶性甘露糖受体(sMR),再与 HRP 标记的可溶性甘露糖受体(sMR)抗体结合,形成抗体-抗原-酶标抗体复合物,经过彻底洗涤后加底物 TMB 显色。TMB 在 HRP 酶的催化下转化成蓝色,并在酸的作用下转化成最终的黄色。颜色的深浅和样品中的可溶性甘露糖受体(sMR)呈正相关。用酶标仪在 450nm 波长下测定吸光度(OD 值),以标准物的浓度为横坐标,OD 值为纵坐标,在坐标纸上绘出标准曲线,根据样品的 OD 值由标准曲线查出相应的浓度;再乘以稀释倍数,通过标准曲线计算样品中人可溶性甘露糖受体(sMR)浓度。
三、统计学方法
统计资料应用SPSS 17.0进行统计学分析和图的绘制,对正态分布的变量,采用“平均值±标准差(Mean+SD)quot;的表示方式;非正态分布的变量采用“中位数+四分位数区间(Median,IQR)quot;表示。正态分布变量两组数值差异性比较采用t检验,多组数值差异比较采用单因素方差分析(ANOVA)。非正态分布的两组数值变量差异性比较采用非参数的Mann-Whitney检验;非正态分布多组数值变量差异性比较采用非参数的Kruskal-Wallis检验;分类变量组间比较采用卡方检验(Chi-square test,χ2test);绘制ROC曲线来作为候选指标在脓毒症、脓毒症休克的诊断和患者预后判断效能指标。指标之间相关性分析采用Spearman秩相关分析(Spearman’s rank correlation)。以Plt;0.05为统计学显著性水准。
结 果
一、本研究共收录66例脓毒症患者和18例非脓毒症患者作为对照组,入组患者的一般资料和检测指标结果及其统计学差异(见表1)。对照组、sepsis、septic shock间年龄比较采用非参数的Kruskal-Wallis检验,H值为0.006,P值0.997gt;0.05,差异无统计学意义。sepsis、septic shock间年龄差异比较非参数的Mann-Whitney检验,Z值为-0.059,P值0.953gt;0.05,差异无统计学意义。对照组和脓毒症组间年龄差异性比较采用Mann-Whitney检验,Z值为-1.489,P值0.136gt;0.05,差异无统计学意义。对照组、sepsis、septic shock三组间性别差异χ2值为1.328,P值为0.515gt;0.05,差异无统计学意义,sepsis、septic shock两组间性别差异无统计学意义(Pgt;0.05),对照组和脓毒症组间性别差异性比较采用卡方检验方差分析,其结果为χ2值为0.329,P值为0.556gt;0.05,差异无统计学意义。PCT在三组间有统计学意义,但在sepsis、septic shock间无统计学意义。而sMR在三组间和sepsis、septic shock间均有统计学意义;SOFA评分和APACHE II 评分在sepsis、septic shock间均有统计学意义,具体分析如下。
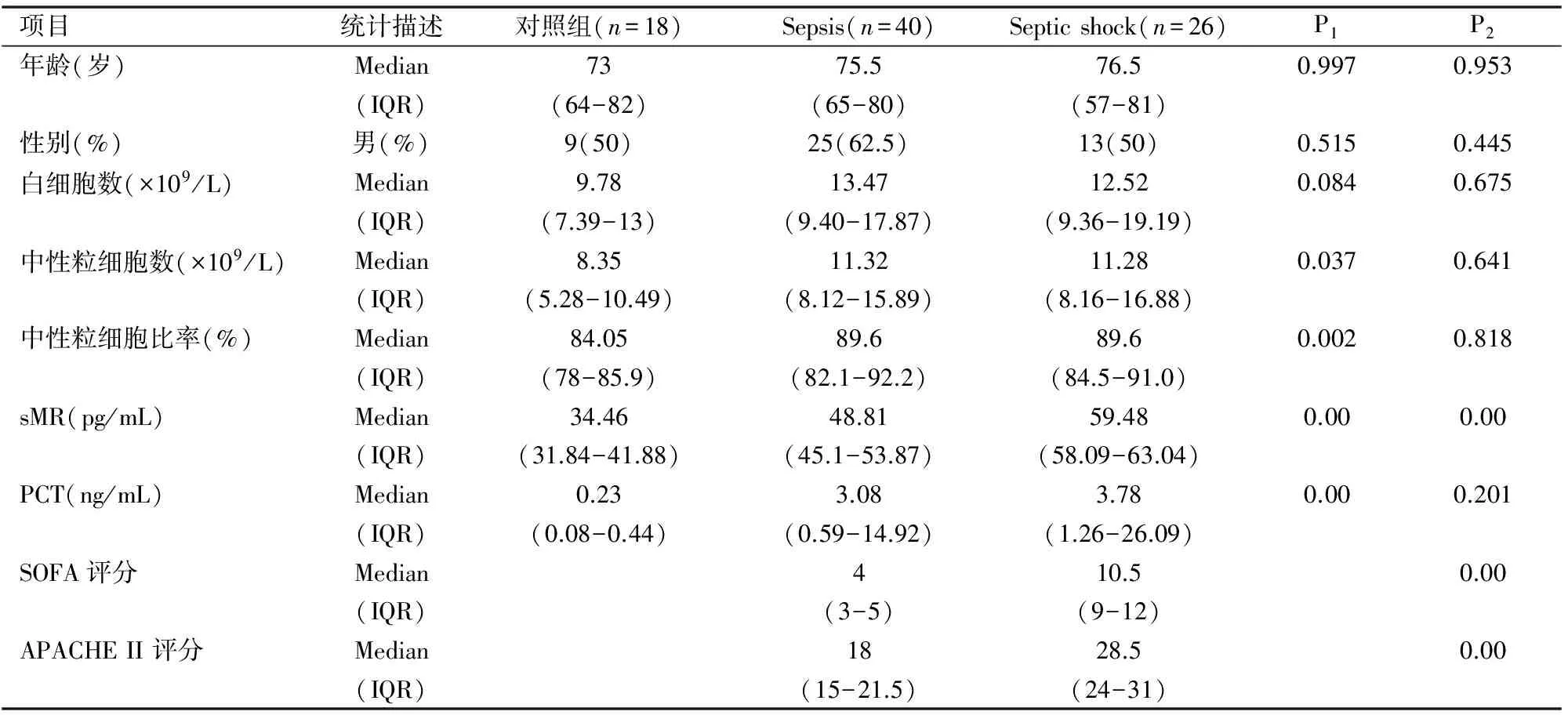
表1 入组患者的分布和部分检验指标
注:Plt;0.05差异有统计学意义;p1为三组差异性比较;p2为sepsis、septic shock差异性比较。
二、感染指标在三组间比较
入组患者入院时均收集临床常用感染指标白细胞数、中性粒细胞数、中性粒细胞比率、降钙素原,再加上本课题研究的血液标记物可溶性甘露糖受体(sMR)。分别记录其在各组的表达水平,探讨其差异的统计学意义。sMR、PCT、中性粒细胞数、中性粒细胞比率在三组间有统计学意义(Plt;0.05),而白细胞数在三组间比较无统计学意义(Pgt;0.05)(见表1、图1)。
三、感染指标在对照组和脓毒症组的比较
对照组和脓毒症组间年龄和性别比较均没有统计学意义(Pgt;0.05),两组间年龄和性别对统计学没有影响。白细胞、中性粒细胞、中性粒细胞比率、降钙素原PCT和sMR在对照组和脓毒症组间差异均有统计学意义(Plt;0.05),(见表2)。

表2 对照组与脓毒症患者的比较

图1 PCT、sMR在三组间的表达水平分布
四、感染指标在脓毒症的诊断价值
根据前面的统计分析结果,脓毒症组的白细胞(WBC)、中性粒细胞数、中性粒细胞比率、PCT、sMR水平均高于对照组,差异均有统计学意义(Plt;0.05),各感染指标ROC曲线下面积分别为:0.669(95%置信区间[confidence interval,cI],0.542-0.796)、0.696(95%CI,0.575-0.817),0.769(95%CI,0.659-0.879),0.881(95%CI,0.799-0.963),0.954(95%CI,0.903-1.000),sMR的AUC高于其他感染指标,选择灵敏度和特异度之和最大的截断点43.02pg/mL为介值时,其灵敏度为0.909,特异度为0.833,Youden指数为0.742,具有较高的诊断价值。sMR较PCT显示出较好的早期诊断脓毒症的效能。
五、sMR、SOFA、APACHE II在septic shock的诊断价值
sMR、SOFA和APACHE II在sepsis和septic shock间有统计学意义(Plt;0.05),绘制septic shock的ROC曲线。sMR、APACHE II和SOFA的AUC分别为0.883、0.910、0.972,SOFA的诊断准确度高于APACHE II。(见表1、图3)。

图2 sepsis的ROC曲线

图3 septic shock的ROC曲线
六、血清sMR与PCT、SOFA、APACHEII评分、WBC的相关性分析
脓毒症患者的sMR与PCT、SOFA评分、APACHE II评分、WBC进行Spearman相关性分析发现,sMR同SOFA评分具有强正相关性(0.6lt;rslt;0.8,Plt;0.05),同APACHE II评分具有中等强度正相关性(0.4lt;rslt;0.6,Plt;0.05),同PCT具有弱正相关性(0.2lt;rslt;0.4,P=0.056),同WBC基本不具备相关性(rslt;0,P=0.461)。(见表3)。
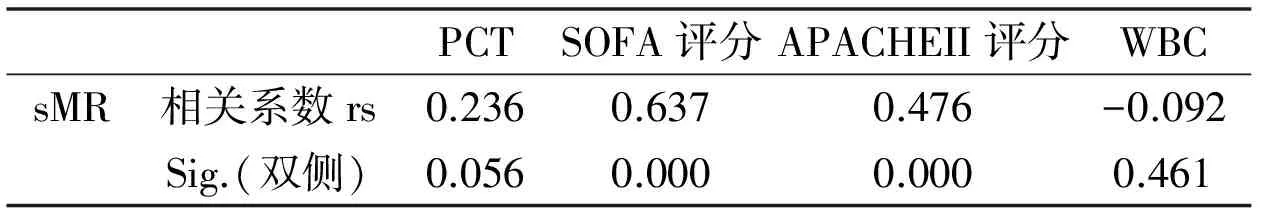
表3 sMR与PCT、SOFA、APACHEII评分、WBC的相关性分析
讨 论
脓毒症治疗花费高,医疗资源消耗大,严重影响人类的生活质量,并可能随着人口老龄化[11]大幅增加,已经对人类健康造成巨大威胁。因此,2001年欧洲重症学会、美国重症学会和国际脓毒症论坛发起“拯救脓毒症运动”(surviving sepsis campain,SSC)[12],SSC指南于2003年第一次制定,后于2008、2012年再次修订。尽管应用新的指南指导治疗更加规范、及时,sepsis的发病率和死亡率仍居高不下。
MR介导了病原体的识别、吞噬与清除,参与了机体的先天与后天免疫。巨噬细胞在先天免疫系统中有重要地位,不仅是效应细胞,也参与对病原体的免疫应答,其表面受体标记物在sepsis患者有研究价值。且其在血清中存放稳定,在-20℃即可存放12个月,sMR的检测应用ELISA方法,检测方便,具有良好的临床研究及临床应用价值。
作为同位于单核巨噬细胞和树突状细胞表面的受体CD163,其可溶性形式sCD163作为感染的生物标记物研究已显示出其优越性,然而sMR的具体分子生物学及生物学功能还未知,sCD163与sMR在巨噬细胞激活后有相似表达过程,具有相关性[13]。多项研究表明,sMR的水平升高与巨噬细胞活化、吞噬活动增强相关[13-14]。林冯[15]及其团队研究结果表面血清sCDl63水平可早期诊断脓毒症及鉴别严重脓毒症,其诊断价值优于PCT、CRP。Anders G.等人[16]通过初步研究发现sMR对脓毒症的诊断价值高于sCD163、CRP,Rødgaard-Hansen S[17]等人研究表明sMR在肺炎球菌导致的sepsis患者预后有意义,且其AUC高于sCD163、CRP,是一种新的很有前景的脓毒症标记物。
sMR与PCT同为感染性疾病生物标记物,PCT已经相对应用成熟,且在临床广泛应用。但其在脓毒症的预后方面无应用价值,动态监测降钙素原水平对患者的早期抗生素治疗或生存率无明显改善[18]。其在鉴别细菌感染中有临床应用价值,然而其不能区分病毒、真菌等其他感染。本研究PCT、sMR水平在脓毒症组均高于对照组,差异均有统计学意义(Plt;0.05),PCT的AUC为:0.881,灵敏度为0.833,特异度为0.833,sMR的AUC为0.954,其灵敏度为0.909,特异度为0.833。与Anders G等人研究结果相符,sMR可应用于脓毒症的诊断,且诊断效能优于PCT,有临床应用价值。
此外危重评分系统由于应用简便、无创,在sepsis的评估及预后判断显示出良好的应用价值。APACHE II评分和SOFA评分是ICU应用广泛、操作简单,临床应用价值高的评分系统。SOFA评分更是被纳入在Sepsis3.0的定义,SOFA评分的升高与死亡率正相关。sMR与APACHE II评分、SOFA评分在sepsis、septic shock组间和存活、死亡组间均有有统计学意义(Plt;0.05),且sMR同SOFA评分具有强正相关性(0.6lt;rslt;0.8,Plt;0.05),同APACHE II评分具有中等强度正相关性(0.4lt;rslt;0.6,Plt;0.05),可联合用于脓毒症的诊断、预后的评估。
综上所述血清sMR水平的检测在脓毒症患者的诊断有研究价值,具有较高的敏感度和特异度,值得深入研究。然而本课题为单中心研究,病例组没有动态监测sMR、PCT的水平变化。且样本量偏少,需扩大样本量进一步验证。
[1] Singer M,Deutschman CS,Seymour CW,et al.The Third International Consensus Definitions for Sepsis and Septic Shock(Sepsis-3)[J].JAMA,2016,315(8):801-810.
[2] Levy MM,Dellinger RP,Townsend SR,et al.The Surviving Sepsis Campaign: results of an international guideline-based performance improvement program targeting severe sepsis[J].Intensive Care Med,2010,36(2):222-231.
[3] Calandra T,Cohen J. The international sepsis forum consensus conference on definitions of infection in the intensive care unit[J].Crit Care Med,2005,33(7):1538-1548.
[4] Cho SY,Choi JH.Biomarkers of sepsis[J].Infect Chemother,2014,46(1):1-12.
[5] Dellinger RP,Levy MM,Rhodes A,et al.Surviving sepsis campaign: international guidelines for management of severe sepsis and septic shock:2012[J].Crit Care Med,2013,41(2):580-637.
[6] Tang BM,Eslick GD,Craig JC,et al.Accuracy of procalcitonin for sepsis diagnosis in critically ill patients: systematic review and meta-analysis[J].Lancet Infect Dis,2007,7(3):210-217.
[7] Martinez-Pomares L.The mannose receptor[J].J Leukoc Biol,2012,92(6):1177-1186.
[8] Drickamer K.Ca2+-dependent sugar recognition by animal lectins[J].Biochem Soc Trans,1996,24(1):146-150.
[9] Jordens R,Thompson A,Amons R,et al.Human dendritic cells shed a functional, soluble form of the mannose receptor[J].Int Immunol,1999,11(11):1775-1780.
[10] Rodgaard-Hansen S,Rafique A,Christensen PA,et al.A soluble form of the macrophage-related mannose receptor (MR/CD206) is present in human serum and elevated in critical illness[J].Clin Chem Lab Med,2014,52(3):453-461.
[11] Hall MJ,Williams SN,DeFrances CJ,et al.Inpatient care for septicemia or sepsis: a challenge for patients and hospitals[J].NCHS data brief,2011,62:1-8.
[12] Angus DC,Linde-Zwirble WT,Lidicker J,et al.Epidemiology of severe sepsis in the United States: analysis of incidence, outcome, and associated costs of care[J].Crit Care Med,2001,29(7):1303-1310.
[13] Andersen MN,Andersen NF,R dgaard-Hansen S,et al.The novel biomarker of alternative macrophage activation, soluble mannose receptor (sMR/sCD206):Implications in multiple myeloma[J].Leuk Res,2015,39(9):971-975.
[14] Laursen TL,Rodgaard-Hansen S,Moller HJ,et al.The soluble mannose receptor is released from the liver in cirrhotic patients, but is not associated with bacterial translocation[J].Liver Int,2017,37(4):569-575.
[15] Feng L,Zhou X,Su LX,et al.Clinical significance of soluble hemoglobin scavenger receptor CD163 (sCD163) in sepsis, a prospective study[J].PLoS One,2012,7(7):e38400.
[17] Rodgaard-Hansen S,Rafique A,Weis N,et al.Increased concentrations of the soluble mannose receptor in serum from patients with pneumococcal bacteraemia,and prediction of survival[J].Infect Dis (Lond),2015,47(4):203-208.
[18] Jensen JU,Hein L,Lundgren B,et al.Procalcitonin-guided interventions against infections to increase early appropriate antibiotics and improve survival in the intensive care unit: a randomized trial[J].Crit Care Med,2011,39(9):2048-2058.
Researchontheexpressionlevelanddifferenceofsolublemannosereceptor(sMR)insepsispatients
ZHANGWen-bin,CHANGXiao-yue
BaotouMedicalCollege,Baotou014000,China
ObjectiveTo estimate the value of soluble scavenger receptor (sMR) on diagnosing sepsis and evaluating the severity of sepsis, and to compare the sensitivity/specificity between sMR and other infection index on the values of evaluating sepsis which are commonly used in clinics.MethodsThe study selected 66 sepsis patients (40 sepsis cases and 26 septic shock cases) and 18 control cases. Their serum were collected on the first days. The level of sMR in serum was detected by ELISA, and they were given Sequential Organ Failure Assessment (SOFA) score and Acute Physiology and Chronic Health Evaluation II (APACHEII) score. Data calculation and processing were carried out by SPSS 17.0.ResultsThe concentration of sMR in serum among the control group, the sepsis and septic shock group was statistically significant (Plt;0.05). The levels of PCT and sMR in the sepsis group were higher than those in the control group. The area under the receiver operating characteristic curve (AUROC) for the prediction of sepsis were 0.881/0.954 for PCT and sMR respectively. The level of PCT showed no difference in the septic shock group and the sepsis group (Pgt;0.05), but it showed significant differences in sMR, APACHE II and SOFA between the two groups (Plt;0.05). The AUC for detection of septic shock were 0.883/0.910/0.972 for sMR, APACHEII and SOFA. sMR could distinguish septic shock from sepsis (Plt;0.05). Spearman rank correlation analysis showed sMR had a weak positive correlation with PCT (0.2lt;rlt;0.4,Plt;0.05), a middle positive correlation with APACHE II score (0.4lt;rlt;0.6,Plt;0.05), and a strong positive correlation with SOFA (0.6lt;rlt;0.8,Plt;0.05).ConclusionsMR may be a useful serum marker on early diagnosing sepsis, evaluating the severity, prognosis of sepsis and it is better than PCT.
sMR; sepsis; PCT; SOFA; APACHE II
10.3969/j.issn.1009-6663.2017.12.006
1.014000 内蒙古 包头,包头医学院 2.014000 内蒙古 包头,包头市中心医院
常晓悦,Email:btchangxiaoyue@163.com
2017-03-10]

